文献解读|Nature(64.8):耐力运动训练的多组学反应的时间动态
✦ +
+
论文ID
原名:Temporal dynamics of the multi-omic response to endurance exercise training
译名:耐力运动训练的多组学反应的时间动态
期刊:Nature
影响因子:64.8
发表时间:2024.05.01
DOI号:10.1038/s41586-023-06877-w
背 景
定期锻炼可以促进全身健康并预防疾病,但其潜在的分子机制尚不完全清楚。
实验设计
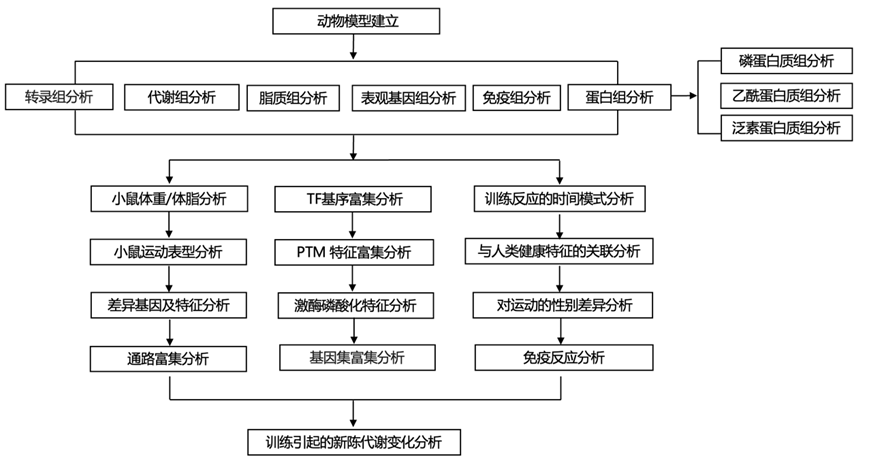
结 果
01
运动训练的多组学分析
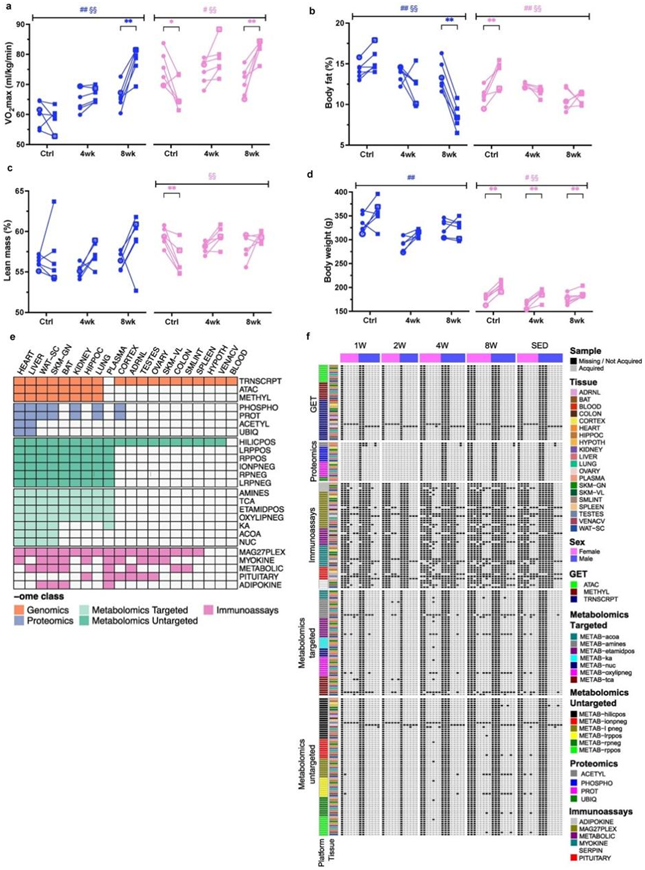
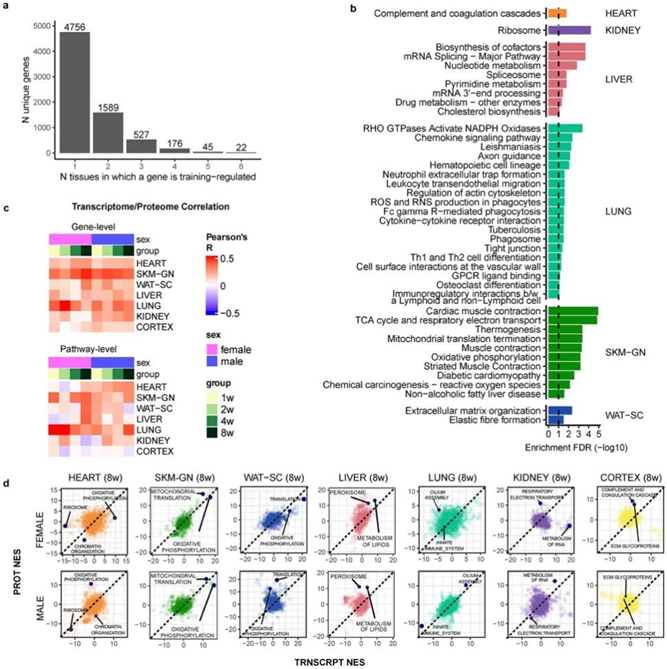
在本项研究中,6月龄雄性和雌性Fischer 344大鼠分别进行1、2、4、8周的渐进式跑步机耐力训练(以下简称耐力训练)(图1a)。以性别匹配的不运动、未接受训练的大鼠作为对照组。训练产生了稳健的表型变化,包括8周时雄性和雌性的有氧能力(最大摄氧量VO2)分别提高了18%和16%(图S1a-d)。8周时,雄性体脂百分比下降了5%,瘦体重(lean mass)无显著变化(图S1b-c)。在雌性小鼠中,经过4周或8周的训练后,体脂率没有变化,而久坐不动的对照组则增加了4%(图S1b)。在所有干预组中,雌性的体重都有所增加,而雄性没有变化(图S1d)。
研究团队利用基因组学、蛋白质组学、代谢组学和蛋白质免疫分析技术分析了全血、血浆和18个实体组织(图1b,图S1e-f)。根据可用组织数量和生物学相关性对分子测定进行优先排序,腓肠肌、心脏、肝脏和白色脂肪组织进行了最多样化的分子测定,其次是肾脏、肺、棕色脂肪组织和海马体(图S1e)。
他们计算了每个特征的训练响应的总体显著性,表示为训练P值,其中35439 个特征构成了训练调节的差异特征(图1c)。时间汇总统计量化了每个性别和时间点的运动训练效果。在本研究的绝大多数组织中都观察到了训练调节分子,包括相对较大比例的转录组学、蛋白质组学、代谢组学和免疫分析特征(图1c)。下丘脑、皮质、睾丸和腔静脉的训练调节基因比例最小,而血液、棕色和白色脂肪组织、肾上腺和结肠则显示出更广泛的影响(图1c)。腓肠肌、心脏和肝脏在蛋白质丰度和翻译后修饰 (PTM) 方面显示出显著的差异调节,而白色脂肪组织、肺和肾蛋白质丰度的结果更有限。在所有组织中一致观察到很大一部分差异代谢物(图S1e-f)。在训练过程中,跨组织和基因组的大量差异特征凸显了耐力训练分子适应的多方面、全有机体性质。
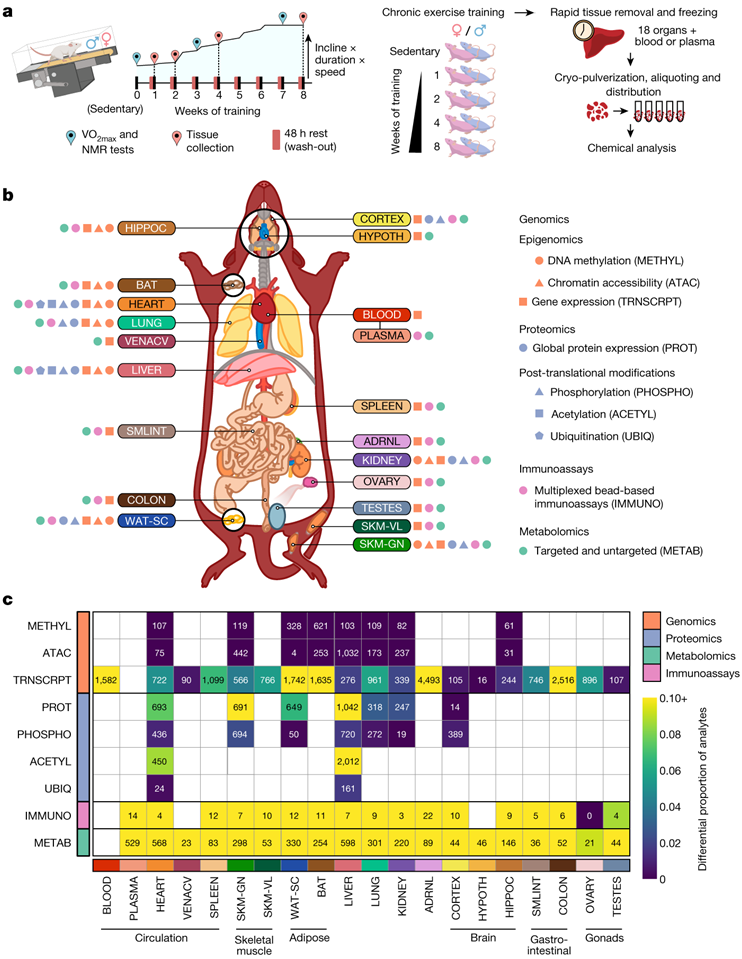
图1. 研究设计和多组学分析流程。
(a) 实验设计和组织样本处理。(b) 本研究中包含的分子数据集摘要。(c) 训练调节的特征数量。
图S1. 动物表型和数据可用性。
(a-d) 未经训练的对照大鼠 (SED)、训练 4 周(4w)的大鼠和训练 8 周(8w)的大鼠的训练干预前后的临床测量。(e)可用数据集的描述。(f) 跨检测的样本数据的详细可用性。
02
多组织对训练的反应
为了确定组织特异性和多组织训练响应基因表达,他们分析了具有最深入分子分析的六种组织:腓肠肌、心脏、肝脏、白色脂肪组织、肺和肾脏。总之,他们将这些数据集中的 11407 个差异特征映射到其同源基因,整个组织总共有 7115 个独特基因(图2a,图S4a)。
大多数具有至少一种训练响应特征的基因是组织特异性的(67%),其中数量最多的基因出现在白色脂肪组织中(图2a)。他们确定了这些组织特异性训练响应基因富集的通路。他们还观察到多组学(ome)特异性反应,在基因和通路水平上具有独特的转录本和蛋白质反应(图S4c-d)。
2359 个基因在至少两个组织中具有差异特征(图2a)。肺和白色脂肪组织具有最大的一组独特共有基因,主要富集免疫相关通路(图2b);表达模式表明肺部炎症减少,白色脂肪组织中免疫细胞募集增加。心脏和腓肠肌拥有第二大的独特共有基因,线粒体代谢通路富集,包括线粒体融合基因Opa1和Mfn1。
在所有6个组织中,有22个基因受训练调节,特别是在热休克反应通路中富集(图2c)。运动可诱导各种啮齿类动物和人体组织中热休克蛋白(HSP)的表达。
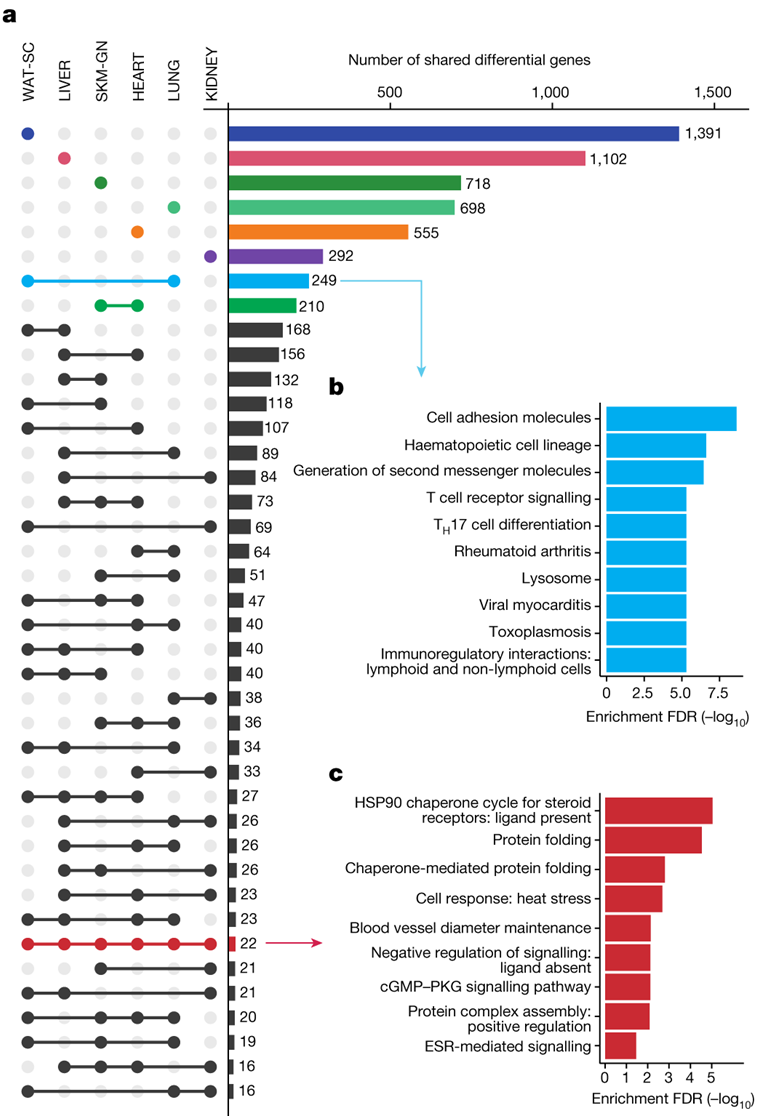
图2. 多组织分子耐力训练反应。
(a) 与每个组织相关的训练调节基因集的 UpSet 图。(b-c) 显著富集的通路。
图S4. 整个耐力训练过程中蛋白质和转录本之间的相关性。
(a) 每个基因(包括映射到所有组的基因的特征)受训练调节的组织数量。(b)通路富集分析。(c)热图显示TRNSCRPT 和 PROT 时间汇总统计数据(分别为 z 和 t 分数)和通路富集结果。(d)获取这些数据的七个组织中 TRNSCRPT 和 PROT 数据集的 GSEA NES 通路散点图。
03
转录因子和磷酸信号传导
接下来,他们比较了跨组织最显著富集的转录因子(TF)(图3a,图S6a)。在血液中,他们观察到造血相关转录因子 GABPA、ETS1、KLF3 和 ZNF143 的富集;造血祖细胞是运动对健康益处的传递者。在心脏和骨骼肌中,他们观察到了一组富集的Mef2家族转录因子基序(图3a)。 MEF2C 是一种与骨骼肌、心肌细胞和平滑肌细胞分化相关的肌肉相关转录因子,并且与血管发育、心环形成和神经元分化有关。
许多组织中关键激酶的磷酸化特征发生了改变,这包括跨心脏、肾脏和肺的 AKT1,跨心脏、肾脏和白色脂肪组织的 mTOR,以及跨心脏和肾脏的 MAPK(图3b)。肝脏显示出与肝再生调节因子相关的磷酸信号增加,包括 EGFR1、IGF 和 HGF(图S6b)。STAT3 和 PXN(参与细胞增殖的 HGF 靶标)的磷酸化增加,提示了运动响应肝脏再生的机制(图6c)。在心脏中,激酶在响应耐力训练时显示出其预测的基础活性的双向变化(图S6d)。多种 AGC 蛋白激酶(包括 AKT1)显示出预测活性下降,而酪氨酸激酶(包括 SRC 和 mTOR)预计活性增加。已知的SRC靶磷酸化位点GJA1 pY265和CDH2 pY820显示响应于训练的磷酸化显著增加(图S6e)。值得注意的是,GJA1 Y265 的磷酸化已证明会破坏间隙连接,而间隙连接是心脏电导率的关键传感器。这表明 SRC 信号传导可能调节心脏的细胞外结构重塑,以促进生理上有益的适应。与这一假设一致,细胞外基质蛋白的基因集富集分析(GSEA)揭示了耐力训练的负富集,显示基底膜蛋白等蛋白质丰度下降(图S6f-h)。
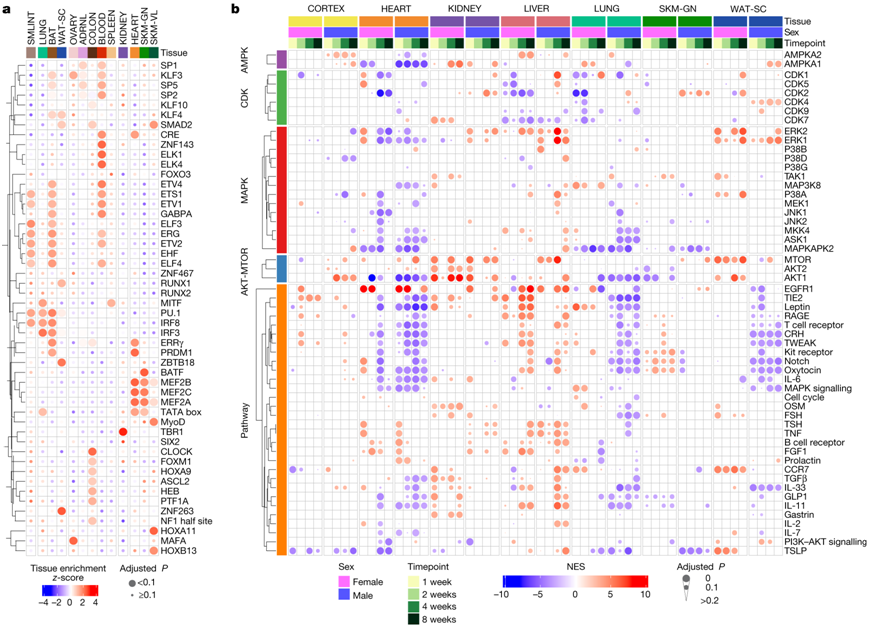
图3. 耐力训练调节的调节信号通路。
(a) 每个组织中训练调节转录本的转录因子基序富集分析。(b) 使用磷酸蛋白质组学数据的 PTM 特征富集分析来估计选定激酶和信号传导通路的活性变化。
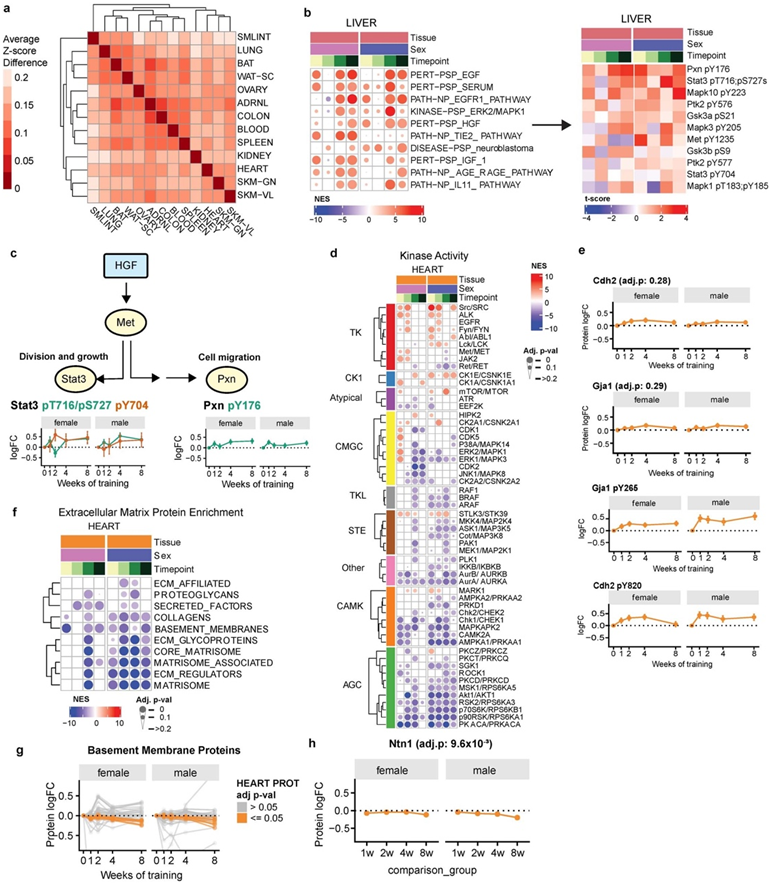
图S6. 耐力训练调节的调节信号通路。(a) 跨组织训练调节基因中 TF 基序富集差异的热图。(b)(左)肝脏的过滤 PTM-SEA 结果显示激酶和信号通路活性增加。(右)热图显示 HGF 信号通路内磷酸位点的 t 分数。(c) 运动训练期间 HGF 信号传导效应的模型图。(d) 过滤后的心脏 PTM-SEA 结果显示所选激酶在至少一个时间点具有显著富集。(e) 心脏中 GJA1 和 CDH2 蛋白丰度和Src 激酶磷酸位点靶标 GJA1 pY265 和 CDH2 pY820 丰度变化。(f) 使用基质体基因集数据库从心脏全局蛋白质组数据集进行基因集富集分析 (GSEA) 结果。(g) 记录心脏中基底膜蛋白丰度变化。(h) 心脏中 NTN1 蛋白丰度变化。
04
运动适应的分子中心
接下来,他们重点关注三个横纹肌(腓肠肌、股外侧肌和心脏)中共有的分子反应。在每种肌肉组织中,三条最大的图形聚类路径在第8周时趋于性别一致的响应(图4a)。由于在第 8 周时两性都有大量肌肉特征上调,因此他们进一步检测了相应的多组学分析数据集(图4b)。与这些差异特征相关的基因的通路富集分析表明,性别和肌肉一致的耐力训练反应反映了线粒体代谢、生物发生和翻译以及细胞对热应激反应的上调(图4c)。
他们使用网络连通性分析来研究第8周腓肠肌的上调特征(图S9a-b)。基因的定位特征揭示了转录组学、染色质可及性和蛋白质组学分析之间的重叠,但与甲基化没有重叠。比较3个分子相互作用网络,并采用BioGRID进行进一步聚类分析,共识别出3个聚类(图S9c)。最大的基因聚类显著富集于多个肌肉适应过程(图4d)。该分析说明了通路和假定的中枢调节因子之间的直接联系,强调了多组学数据在识别相互连接的网络和理解骨骼肌重塑方面的重要性。
他们将股外侧肌转录组学结果与人类骨骼肌组织中长期训练基因表达变化的Meta分析进行了比较,证明了显著且方向一致的重叠(图S9d-g)。他们还在一项针对久坐和运动训练的雌性大鼠的研究中发现,经过 8 周训练的雌性大鼠腓肠肌中的差异转录本与比目鱼肌中鉴定出的差异表达基因之间存在显著重叠,这些雌性大鼠选择性地培育为高或低运动能力(图S9h)。类似地,人类高强度间歇训练的适应与大鼠的蛋白质组反应显著重叠(图S9i),特别是对于训练8周的雌性大鼠(图S9i)。来自白色脂肪组织、肾脏和肝脏的下调基因在多种疾病相关通路中富集,表明运动反应与 2 型糖尿病、心血管疾病、肥胖和肾脏疾病之间存在联系(图S9K)。
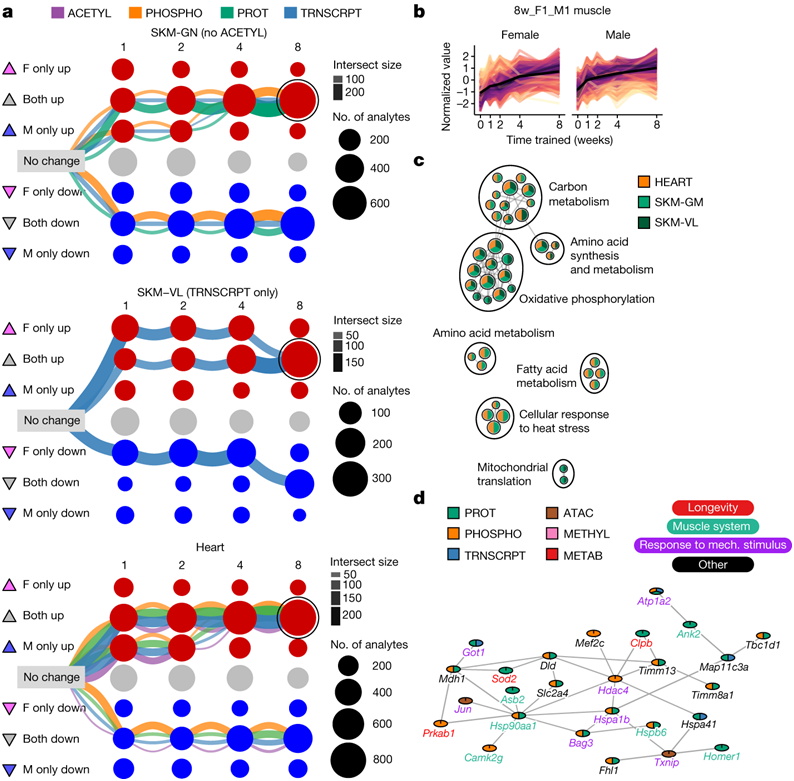
图4. 分子训练反应的时间模式。
(a) 三种肌肉组织训练差异特征的图形表示:腓肠肌(SKM-GN)、股外侧肌(SKM-VL)和心脏。(b) 所有 8w_F1_M1 肌肉特征的标准化丰度的线图。(c)通路富集结果的网络视图。(d) 通过网络聚类 SKM-GN 的 8w_F1_M1 特征识别的较大聚类的子网络。
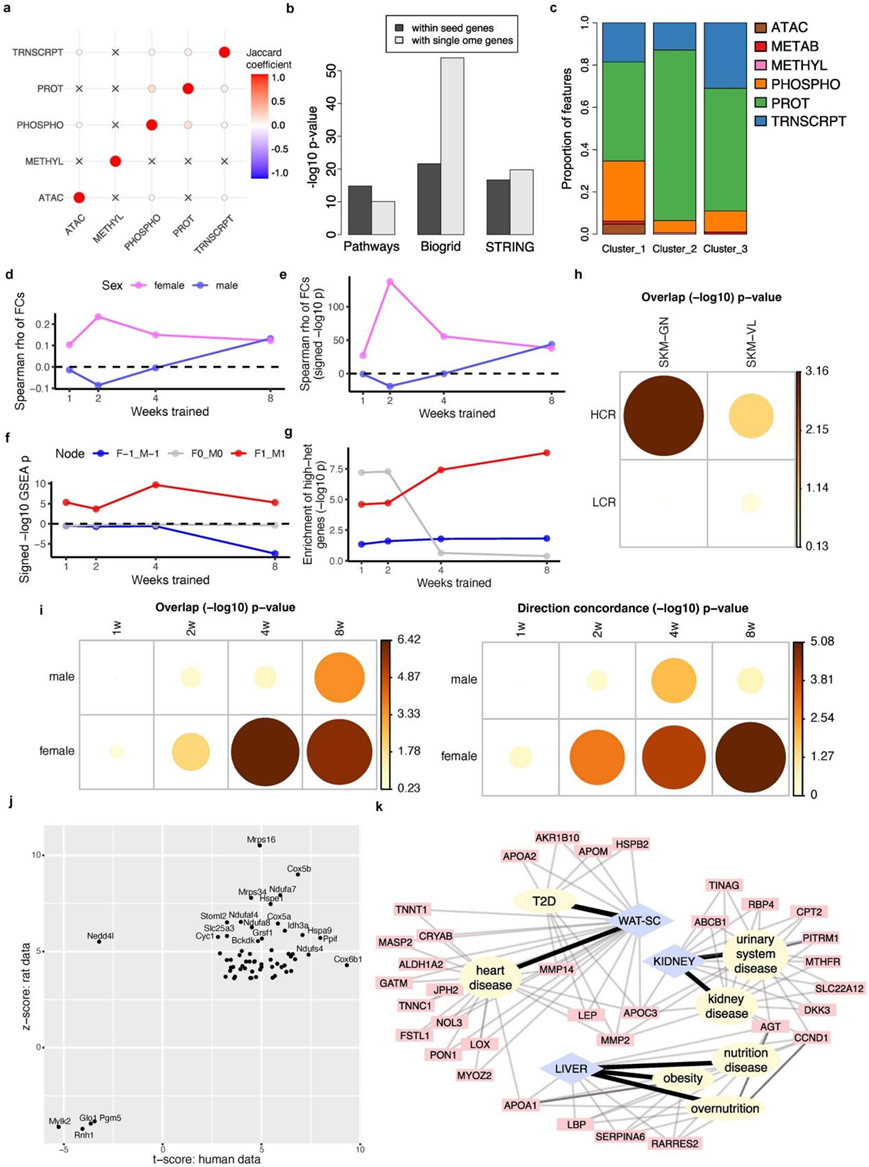
图S9. 与人类健康特征和复杂特征的关联。
(a) 8周腓肠肌上调特征中不同基因组识别的基因集之间的杰卡德系数。(b) 腓肠肌第 8 周多组学基因和单组学基因之间的网络连接 p 值。(c) 通过网络聚类分析确定的腓肠肌反应聚类中代表的每个基因组的特征比例。(d-g) 大鼠股外侧肌差异表达结果与人类长期运动研究的Meta分析结果重叠。(h) 比较本研究第 8 周的大鼠雌性腓肠肌和股外侧肌差异转录本以及大鼠雌性比目鱼肌数据的差异基因。 (i) 本研究中大鼠腓肠肌差异蛋白与人类耐力训练蛋白质组学结果的比较。(j) 重叠蛋白质统计。(k) 白色脂肪、肾脏和肝脏基因组的疾病通路富集结果。
05
不同性别对运动的反应
许多组织在训练反应中表现出性别差异,58% 的 8 周训练调节特征表现出性别差异反应。在肾上腺转录本、肺磷酸位点和染色质可及性特征、白色脂肪组织转录本和肝脏乙酰位点中观察到性别之间相反的反应。此外,促炎细胞因子在组织中表现出与性别相关的变化(图S11a-b)。大多数雌性特异性细胞因子在训练的第1周和第2周之间受到差异性调节,而大多数雄性特异性细胞因子在训练第4周和第8周之间受到差异性调节(图S11c)。
他们观察到肾上腺的广泛转录重塑,有超过 4000 个差异基因。值得注意的是,训练调节特征的最大图形路径在雄性和雌性之间呈负相关(图S11d)。
此外,对该路径中转录本的转录因子基序富集分析显示,14种TF富集,包括代谢调节因子PPARγ、PPARα和雌激素相关受体γ(ERRγ)。几个显著富集的TF的基因表达水平遵循与此路径相同的轨迹(图S11e)。
在大鼠肺部,他们观察到主要在雄性大鼠中进行训练后磷酸信号传导活性降低(图3b)。其中,PRKACA 磷酸化特征在 1 周和 2 周时显示出最大的性别差异(图S11f-h)。PRKACA 是一种参与多种细胞通路内信号传导的激酶。然而,四种 PRKACA 底物遵循这种模式,并与细胞结构(例如细胞骨架和细胞-细胞连接)相关:DSP、MYLK、STMN1 和 SYNE1(图S11i)。这些蛋白质的磷酸化表明 PRKACA 在介导训练时肺结构或机械功能变化方面具有性别依赖性作用。
8周时训练调节转录本的免疫通路富集分析显示,肌肉(心脏、腓肠肌和股外侧肌)和大脑(皮质、海马、下丘脑)的富集有限,肺和小肠的下调,以及强烈的上调仅存在于雄性的棕色和白色脂肪组织中(图5a)。脂肪组织中雄性特异性上调特征的转录本表达谱与外部细胞分型分析的免疫细胞标记物之间的相关性显示,许多免疫细胞类型(包括B细胞、T细胞和自然杀伤细胞)具有很强的正相关性,而与血小板、红细胞和淋巴组织的相关性较低(图5b-c)。小肠是免疫相关通路富集程度最高的组织之一,8周时转录本下调,并且雌性的应答较强(图5b)。该转录集与肠道炎症相关的通路相关。他们观察到这些转录本与几种免疫细胞类型(包括 B、T、自然杀伤细胞和树突细胞)的标记物之间呈正相关,表明丰度下降(图5c)。耐力训练还降低了炎症性肠病(IBD)遗传风险位点转录本的表达,包括主要组织相容性复合物 II 类。总之,这些数据表明耐力训练可以改善肠道稳态,可能具有全身抗炎作用。
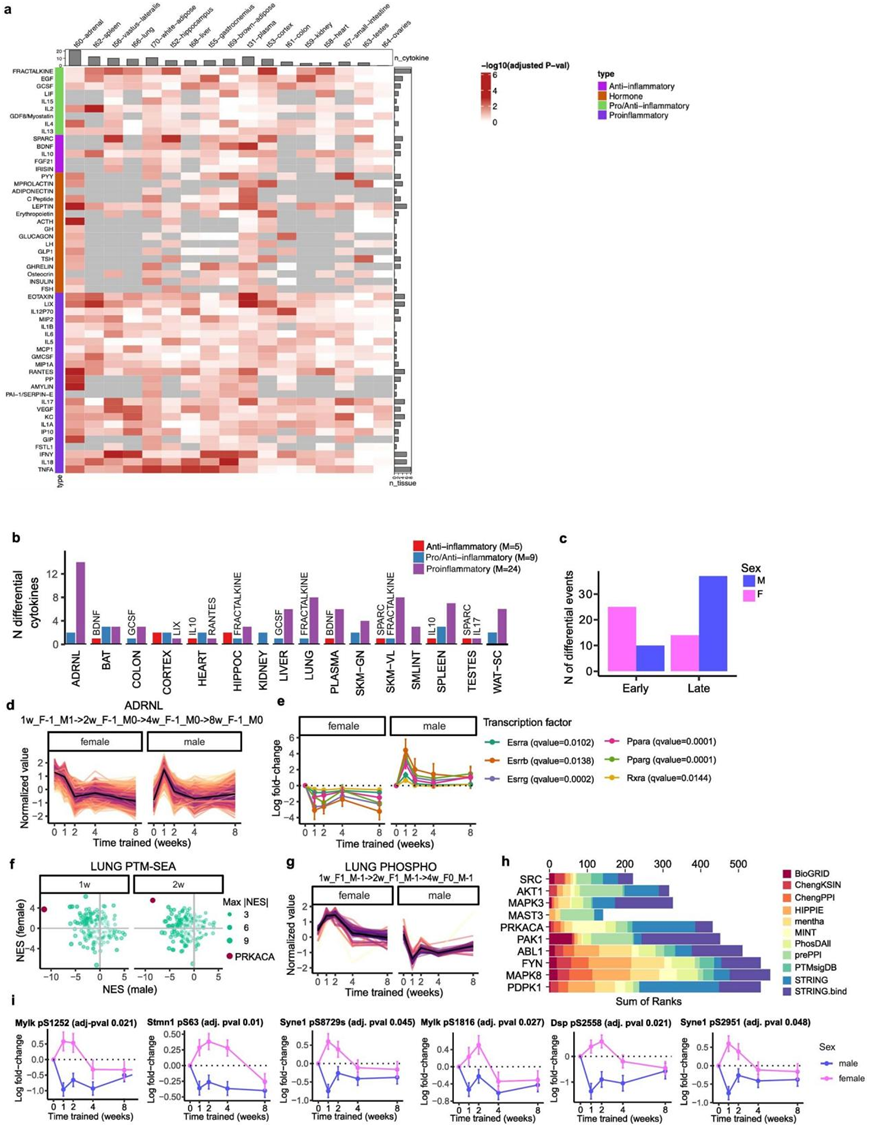
图S11. 耐力训练反应的性别差异。
(a) 跨组织免疫分析物训练响应的热图。(b) 跨组织训练差异细胞因子。(c) 根据图形分析指定的状态,包括所有组织,对早期、(1 或 2 周)与晚期(4 或 8 周)差异细胞因子进行计数。(d) 差异特征丰度的线图。(e) 对应于六个转录因子(TF)的转录本水平分析。(f) 来自肺部翻译后修饰 (PTM) -SEA 的雄性与雌性的标准化富集分数 (NES)。(g) 训练差异磷酸位点标准化丰度的线图。(h) 训练差异磷酸位点的底物(蛋白质)过度表达最多的前十种激酶。(i) 线图显示 PRKACA 磷酸盐底物的磷酸盐水平。
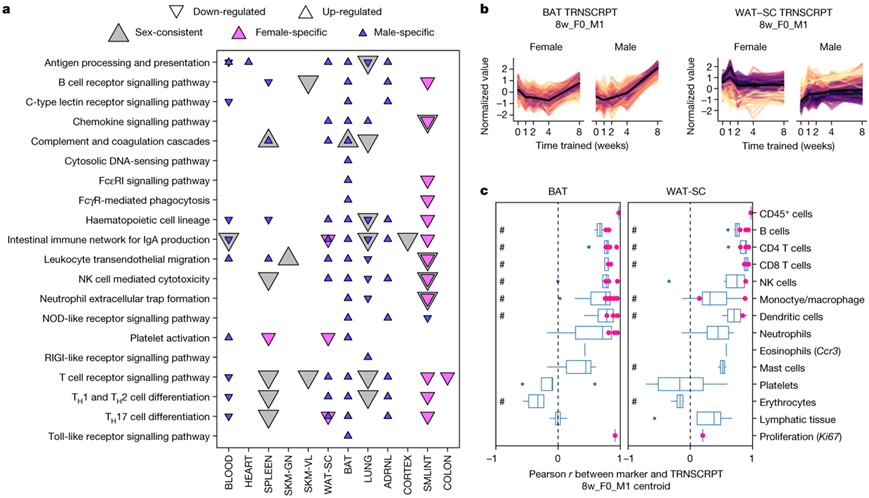
图5. 训练引起的免疫反应。
(a) 差异转录本的富集分析结果。(b) 所选训练差异转录本的标准化丰度的线图。(c) 样本水平Pearson相关性的箱形图。
06
线粒体和脂质的多组织变化
他们总结了使用 RefMet 代谢物类别的代谢组数据集(图6a)。肝脏中显著富集的代谢物种类最多,其次是心脏、肺和海马体。单个代谢物和酰基肉碱组揭示了与训练反应的功能改变相关的变化。特别有趣的是,三甲胺-N-氧化物与心血管疾病有关。他们观察到1-甲基组氨酸(肌肉蛋白转换的标志)在1、2和4周时在肾脏中上调,这可能表明在早期训练时间点肌肉分解和通过肾脏清除。皮质醇水平增加,正如预期的训练生理压力,他们观察到肾脏的显著增加,再次可能是由于肾脏清除所致。第 8 周时,肝脏显示 1-甲基烟酰胺上调,这可能在炎症中发挥作用。氧化磷酸化在大多数组织中富集,并且与肌肉组织的联合分析一致(图4c),表明线粒体生物发生的潜在变化。他们使用线粒体RNA测序(RNA-seq)分析耐力训练中线粒体基因的变化比例,并通过GSEA使用基因表达、蛋白质丰度和蛋白质PTM来估计线粒体功能的变化(图6b)。观察到骨骼肌、心脏和肝脏中的线粒体生物发生增加。此外,如前文所述,他们在肾上腺以及结肠、肺和肾中观察到性别特异性线粒体变化。这些结果突出了耐力训练中高度适应性和无处不在的线粒体反应。在肝脏中,他们观察到蛋白质组、乙酰组和脂质组代谢通路的实质性调节(图6a-b)。例如,属于“脂质和脂质相关化合物”的12个代谢物类别显著富集(图6a)。随着时间的推移,两性都增加了大量特征(图6c)。这些肝脏特征大多与线粒体、氨基酸和脂质代谢通路中的蛋白质丰度和蛋白质乙酰化变化相关(图6d)。他们还观察到磷脂酰胆碱的增加和甘油三酯的减少(图6e)。
总之,这些分子适应可能构成运动介导的肝脏健康改善机制的一部分,特别是防止肝内脂质过度储存和脂肪变性。
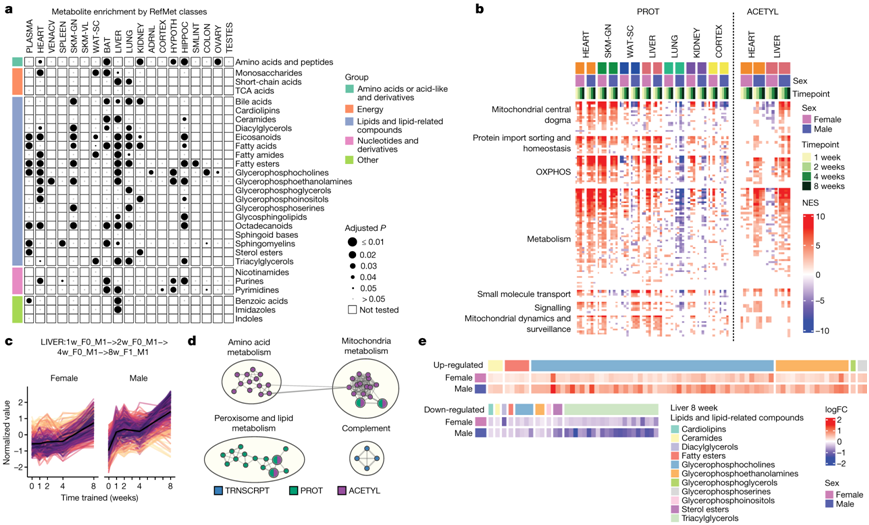
图6. 训练引起的新陈代谢变化。
(a) 使用 GSEA 计算的 RefMet 代谢物类别富集。(b) 使用 MitoCarta MitoPathways 基因集数据库和蛋白质组学 (PROT) 或乙酰组学 (ACETYL) 时间汇总统计进行训练的 GSEA 结果。(c) 所有数据类型中肝脏训练差异特征标准化丰度的线图。(d) 与(c)中的特征相对应的通路富集结果的网络视图。(e) 8周肝脏中“脂质和脂质相关化合物”类别内的代谢物变化分析。
+ + + + + + + + + + +
结 论
本项研究分析了雄性和雌性小鼠在八周的耐力过程中全血、血浆和 18 个实体组织中的时间转录组、蛋白质组、代谢组、脂质组、磷酸蛋白质组、乙酰蛋白质组、泛素蛋白质组、表观基因组和免疫组数。由此产生的数据概要包含 19 个组织、25 个分子平台和 4 个训练时间点的 9466 项检测结果。鉴定出数以千计的共有和组织特异性分子改变,并在多个组织中发现了性别差异。时间多组学和多组织分析揭示了对耐力训练适应性反应的广泛生物学见解,包括免疫、代谢、应激反应和线粒体通路的广泛调节。许多变化与人类健康相关,包括非酒精性脂肪肝、炎症性肠病、心血管健康以及组织损伤和恢复。本研究中提供的数据和分析将作为理解和探索耐力训练的多组织分子效应的宝贵资源。
+ + + + +



 English
English


