文献解读|Sci Adv(13.6):多组学分析表明,亚油酸代谢与不同 BCG 菌株诱导的训练后免疫力的变化有关
✦ +
+
论文ID
原名:Multi-omics analysis reveals that linoleic acid metabolism is associated with variations of trained immunity induced by distinct BCG strains
译名:多组学分析表明,亚油酸代谢与不同 BCG 菌株诱导的训练后免疫力的变化有关
期刊:Science Advances
影响因子:13.6
发表时间:2024.04.05
DOI号:10.1126/sciadv.adk8093
背 景
训练免疫(Trained immunity)是卡介苗(BCG)接种提供持久的非特异性保护作用的机制之一,可以防范多种疾病。使用的不同卡介苗疫苗株之间的基因组差异可能导致针对结核病的保护作用和对膀胱癌的治疗作用存在差异。
实验设计

结 果
01
四种卡介苗菌株在体内诱导了不同水平的训练免疫
研究团队用不同的卡介苗[I 类(BCG-俄罗斯)、II 级(BCG-瑞典)、III 级(BCG-中国)和 IV 级(BCG-巴斯德)]进行静脉注射以进行训练免疫,然后对小鼠实施安乐死,收集骨髓细胞(BMC)用于流式细胞分析(图1A)。BCG静脉接种后,BMC中HSC祖细胞谱系-Sca-1+c-Kit+ (LSK+) 群体明显扩增(图1B-F)。短期造血干细胞(HSC)(ST-HSC;LKS+CD150+CD48+)和多能祖细胞(MPP;LKS+CD150−CD48+)在所有BCG训练的小鼠中增加,但长期HSC (LT-HSC; LKS+CD150+CD48−)并未增加(图1C-I)。BCG-中国和BCG-巴斯德比BCG-俄罗斯和BCG-瑞典诱导了更多的MPP(图1G)。进一步分析显示,卡介苗免疫使造血偏向MPP3(MPP+ CD34 + Flt3-),特别是在卡介苗-中国组中(图1D-K),表明接种卡介苗后骨髓细胞发育得到增强。

图1. BCG 疫苗接种诱导 HSC 扩增。
(A) 用于骨髓细胞 (BMC) 分析的体内训练免疫实验的示意图。(B-D)代表性荧光激活细胞分选 (FACS) 图。(E) t分布随机邻域嵌入 (t -SNE) 分析。(F) Lin−细胞中LSK细胞的比例。(G)LSK细胞中MPP细胞的比例。(H) LSK 细胞中 ST-HSC 的比例。(I)LSK细胞中LT-HSC的比例。(J) MPP3细胞在MPP细胞中所占的比例。(K) MPP4细胞在MPP细胞中所占的比例。
02
四种卡介苗菌株在体内诱导不同水平的细胞因子和非特异性保护
他们进行了非特异性保护实验,1个月后用脂多糖(LPS)(图2A)或鼠伤寒沙门菌(图2H)腹腔注射BCG免疫小鼠。血清细胞因子分析表明,与BCG-俄罗斯训练组和未训练对照组相比,BCG-瑞典、BCG-中国和BCG-巴斯德训练组小鼠对LPS刺激产生了更多的炎性细胞因子(图2B-D)。BCG训练小鼠BMC的转录组谱与对照组不同(图2E)。根据基因本体生物学过程(GOBP)分析的基因集变异分析(GSVA),BCG训练激活了骨髓中淋巴细胞和髓系细胞的发育增殖和免疫功能,这与流式细胞分析一致。与卡介苗-俄罗斯组相比,卡介苗-中国组和卡介苗-巴斯德组的活化水平较高(图2F)。此外,对BMC进行KEGG分析表明,与对照组和BCG-俄罗斯组相比,BCG-瑞典和BCG-中国组具有更强的代谢和信号转导激活(图2G)。最重要的是,与对照组相比,BCG训练的小鼠在感染鼠伤寒沙门氏菌后,体重下降减少,生存期延长。卡介菌-中国组和卡介菌-巴斯德组的治疗效果显著优于卡介菌-俄罗斯组(图2I-J)。因此,这四株卡介苗在体内引起了不同程度的骨髓修饰和对鼠伤寒沙门氏菌感染的非特异性保护。
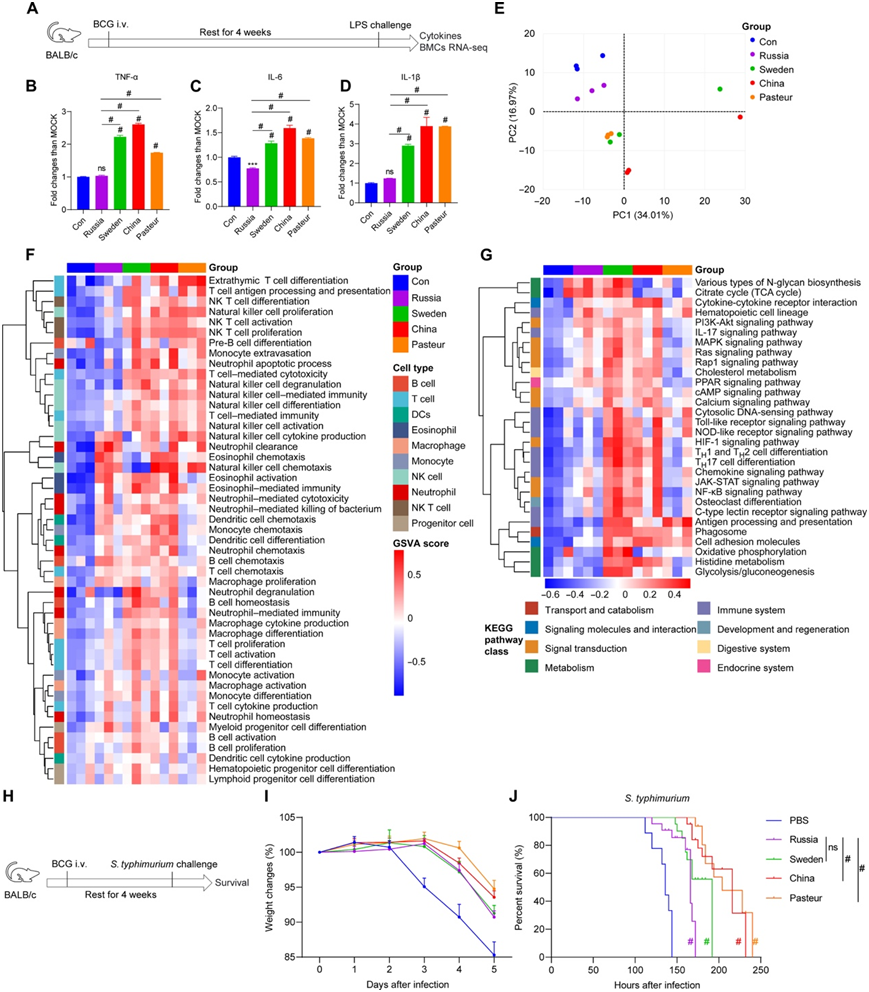
图2. 四种卡介苗菌株在体内诱导不同水平的细胞因子和非特异性保护。
(A) 体内训练免疫实验的示意图。 (B-D) 脂多糖 (LPS) 再刺激后受训小鼠血清中的细胞因子水平。 (E) BMC 中全局基因的主成分分析 (PCA)。 (f)与免疫细胞发育和功能相关的基因本体生物过程(GOBP)的基因集变异分析(GSVA)。(G) KEGG通路的GSVA与免疫细胞代谢和功能相关。 (H)鼠伤寒沙门氏菌攻击感染的示意图。 (I)鼠伤寒沙门氏菌感染小鼠5天内体重变化。(J) 感染小鼠的生存曲线。
03
四种 BCG 菌株在 BMDM 中诱导不同程度的非特异性保护
接下来他们建立了基于巨噬细胞的体外模型,以比较不同卡介苗菌株诱导的训练免疫。简而言之,巨噬细胞[骨髓来源的巨噬细胞(BMDM)和东北医院儿科-1(THP1)细胞分化的巨噬细胞]用BCG[感染复数(MOI)= 1]训练24小时;然后,在第5天(BMDM)或第3天(THP1细胞分化的巨噬细胞),再用LPS刺激(图3A-E)。
4株BCG菌株可在感染后24小时激活巨噬细胞的细胞因子分泌。在LPS再次刺激下,BCG-中国和BCG-巴斯德组培养的巨噬细胞显示出高于对照组和BCG- 俄罗斯组的炎性细胞因子[肿瘤坏死因子-α (TNF-α)、白细胞介素-6 (IL-6)和IL-1β]水平(图3B-H)。BCG训练的BMDM增加了葡萄糖消耗和乳酸生成(图3I-J)。此外,与对照组相比,训练后的BMDM在受到白色念珠菌攻击后的真菌载量降低,其中卡介菌中国组的真菌载量低于卡介菌-俄罗斯组(图3K-L)。与BCG-俄罗斯组和对照组相比,由BCG-中国、BCG-巴斯德和BCG-瑞典训练的BMDM对鼠伤寒沙门氏菌表现出更强的杀菌活性(图3M)。当与小鼠膀胱癌细胞系小鼠膀胱肿瘤细胞系2(MBT2)-绿色荧光蛋白(GFP)共培养时,卡介苗-中国和卡介苗-瑞典组训练的BMDM对肿瘤细胞的增殖抑制作用强于对照和卡介苗-俄罗斯组训练的小组(图 3N)。因此,四种卡介苗菌株在不同程度地增强炎症细胞因子分泌和防止非特异性感染/肿瘤细胞增殖方面的训练免疫力方面存在差异。

图3. 四种卡介苗菌株在体外诱导不同程度的细胞因子和非特异性保护。
(A) THP1 分化的巨噬细胞中经过训练的免疫示意图。 (B-D) LPS 再刺激后对照和训练的 THP1 巨噬细胞的细胞因子谱。 (E) BMDM 中经过训练的免疫力示意图。 (F-H) LPS 再刺激后对照和训练过的 BMDM 中的细胞因子谱。 (I) LPS 刺激后 BCG 训练的 BMDM 的葡萄糖消耗。(J) LPS 刺激后,BCG 训练的 BMDM 产生乳酸。 (K) BMDM 中针对感染的非特异性保护的示意图。 (L)感染 4 小时后对白色念珠菌的总菌落形成单位 (CFU)进行定量。 (M)BMDM 吞噬后 2 小时对鼠伤寒沙门氏菌进行细胞内杀伤。 (N) MBT2-GFP 细胞与 BCG 训练的 BMDM 共培养的比例。
04
由不同 BCG 菌株训练的巨噬细胞具有不同的转录谱
他们利用RNA测序(RNA-seq)用于比较训练后BMDM的转录特征。 BCG 训练的 BMDM 表现出与对照显著不同的转录模式(图 4A-B)。与对照组相比,BCG-俄罗斯组有1644个差异表达基因(DEG),其中827个上调,817个下调;BCG-瑞典组为3030个DEG(1474个上调,1556个下调);用BCG-中国组时,有2452个DEG(1100个上调,1352个下调);使用BCG-巴斯德时,有2826个DEG(1234个上调,1592个下调)(图4C)。GOBP富集分析显示,四组共有的1338个交叉基因主要富集在先天免疫应答、防御应答和炎症应答中(图4D)。BCG训练后,巨噬细胞的识别受体(Tlr1-3、Nod2、Cd14等)和吞噬受体(Marco、Scarf1、Nlrp3等)显著增加,但巨噬细胞甘露糖受体显著下调(图4E)。此外,除Ccl24和Il4外,炎性因子(Tnf、Il1b、Il10等)和趋化因子(Ccl3-5、Cxcl1-3等)均升高(图4F)。与抗原加工和呈递相关的基因在BCG训练后也显著上调(图4G)。
采用基因集富集分析(GSEA)和GSVA对RNA-seq数据进行全基因组表达分析,结果显示BCG训练激活了免疫系统相关的KEGG通路[如toll样受体(TLR)信号通路、nod样受体信号通路、趋化因子信号通路、抗原处理和呈递]。BCG-中国和BCG-巴斯德组的水平高于BCG-俄罗斯组(图4H-L)。已经报道的抑制炎症的通路(Hedgehog信号通路、Wnt信号通路、转化生长因子-β信号通路)在训练后发生抑制(图4H)。在BCG训练组中,Akt/mTOR/ HIF1-α依赖的有氧糖酵解(介导β-葡聚糖诱导的训练性免疫)的诱导上调(图4M)。经过训练的BMDM的脂质代谢(甘油磷脂代谢、甘油脂代谢、醚脂代谢、亚油酸代谢等)增强,且BCG-中国组和BCG-巴斯德组高于BCG-俄罗斯组(图4M-P)。综上所述,这些结果证实了BCG训练的BMDM中先天免疫反应和脂质代谢的激活,并且在BCG-中国和BCG-巴斯德训练的细胞中效果最为明显。
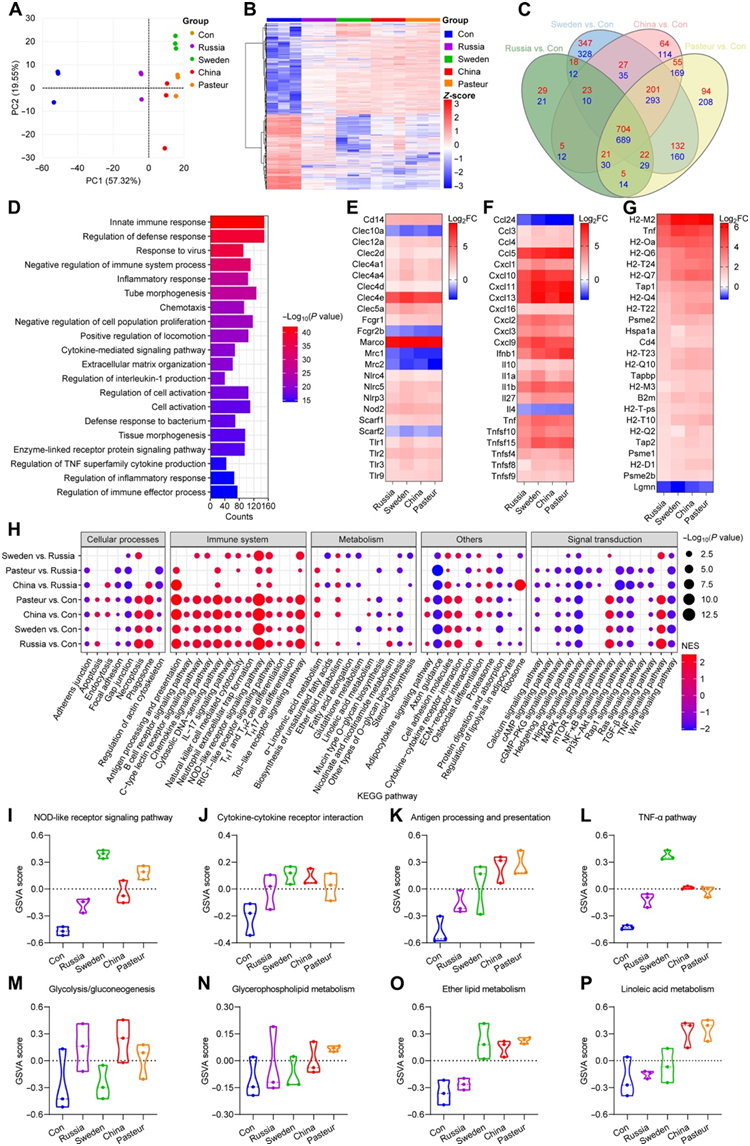
图4. BCG 训练后 BMDM 的转录组特征。
(A)整体基因变化的PCA。 (B) BCG 训练组和 Con 组之间汇集的差异表达基因 (DEG) 的热图。(C) 不同组之间DEG 的维恩图。(D) 1393个共有DEG的前20个GOBP路径。 (E) 参与吞噬作用和细胞激活的基因热图。 (F) 细胞因子和趋化因子基因的热图。 (G) 参与抗原加工和呈递的基因热图。 (H) BCG 训练组之间基因集富集分析 (GSEA) 结果的热图比较。(I-L) 涉及细胞活化和炎症的因子 GSVA 的小提琴图。 (M-P) 细胞代谢相关通路的 GSVA 小提琴图。
05
由不同 BCG 菌株训练的巨噬细胞具有不同的表观遗传景观
接下来,他们通过转座酶可及染色质(ATAC)测序(ATAC-seq)评估BCG训练后BMDM染色体结构的改变。在对照组、卡介菌-俄罗斯组、卡介菌-瑞典组、卡介菌-中国组和卡介菌-巴斯德组的三个生物重复样本中,分别鉴定出26207、38139、41897、49520和46541个高可信的开放染色质区(或峰)。与对照组相比,BCG训练后染色体可及性一般增加(图5A)。他们观察到在BCG训练的BMDM基因的转录起始位点(TSS)上有较高的ATAC信号,在BCG-中国组中最高(图5B)。与对照组相比,BCG-俄罗斯组、BCG-瑞典组、BCG-中国组和BCG-巴斯德组分别有6044、5451、7105和7902个显著差异峰,这些差异峰主要分布在基因的内含子区、基因间区和TSS区(图5C)。卡介苗-俄罗斯组、卡介苗-瑞典组、卡介苗-中国组和卡介苗-巴斯德组的差异峰分别注释为4609、4221、5217和5682基因,这些基因有2146个基因的交集(图5D),主要富集在细胞激活和对外部刺激的反应。BCG训练后炎症信号受体(Tlr2、Tlr4、Tlr9、Nod2等)、趋化因子(Ccl2-4、Cxcl1、Cxcl10、Cxcl12)和细胞因子(Tnf、Il1b、Il6、Il10、Il16等)基因中ATAC信号较高(图5F)。与转录组结果相似,具有差异ATAC峰的基因(GAP)主要富集在免疫系统通路(图5E)。参与Akt-mTOR-HIF轴、糖酵解和NOD样受体信号通路的基因在BCG训练后染色质可及性增加。这一情况在BCG-中国组和BCG-巴斯德组中更为明显(图5G-H)。

图5. BCG 训练后 BMDM 细胞的表观遗传景观。
(A) 经过训练的 BMDM 的全基因组染色质可及性。 (B)转录起始位点 (TSS) 区域转座酶可及染色质 (ATAC) 峰密度差异测定的热图。(C) 基因位点上的差异 ATAC 峰值分布。(D) 具有差异 ATAC 峰的基因维恩图。 (E) BCG 训练组之间的热图比较,具有差异 ATAC 峰的基因的 KEGG 富集结果。(F) Il1b、Il6和Tnf基因的 ATAC 信号。(G) 参与 HIF-1 信号通路的基因的 ATAC 信号。(H)涉及糖酵解的基因的ATAC信号。
06
不同BCG菌株训练的巨噬细胞具有不同的代谢特征
采用基于非靶向液相色谱-串联质谱 (LC-MS/MS) 的代谢组学检测来表征 BCG 训练的 BMDM 的代谢特征。 235 种混合差异代谢物 (DM) 的定性代谢物和热图数据的主成分分析 (PCA)显示,BCG 训练的 BMDM 与对照相比具有不同的代谢特征(图6A-B)。DM主要包括脂质和类脂分子(53.6%)、有机酸及其衍生物(18.3%)、有机杂环化合物(8.9%)和核苷/核苷酸/类似物(7.2%)(图6C)。KEGG富集分析显示,大多数DM在钙信号通路、糖酵解、淀粉和蔗糖代谢、甘油磷脂代谢、嘌呤代谢和嘧啶代谢中上调(图6D)。BCG-瑞典组、BCG-中国组和BCG-巴斯德组甘油磷脂的表达显著高于对照组和俄罗斯组(图6E)。LC-MS/MS结果显示,亚油酸及其衍生物coriolic acid [13(S)-HODE]在BCG-瑞典组、BCG-中国组和BCG-巴斯德组中升高(图6F-G)。

图6. BCG 训练后 BMDM 的代谢特征。
( A ) 代谢物定性变化的 PCA 图。 (B) BCG 训练组和对照组之间汇总 DM 的热图。(C) DM 分类圆环图。(D) DM 的 KEGG 富集结果。 (E) 差异表达甘油磷脂的热图。(F) 通过液相色谱-串联质谱 (LC-MS/MS) 鉴定亚油酸的相对丰度。(G) 通过 LC-MS/MS 鉴定coriolic acid的相对丰度。
07
甘油磷脂-亚油酸代谢参与介导中国卡介苗和俄罗斯卡介苗诱导的训练免疫差异
上调的基因和代谢物在甘油磷脂和亚油酸代谢中显著富集(图7A-B)。GSEA分析显示,与卡介菌俄罗斯组相比,卡介菌中国组甘油磷脂和亚油酸代谢均发生激活(图7C)。卡介菌-中国组中甘油磷脂代谢和亚油酸代谢相关基因(图7D)和代谢产物(图7E)的表达水平高于卡介菌-俄罗斯组;在BCG-中国组的BMDM中,涉及甘油磷脂代谢和亚油酸代谢的基因的ATAC峰升高更多(图7F),并且BCG-中国和BCG-巴斯德组的巨噬细胞的亚油酸升高幅度显著大于BCG-俄罗斯组。
胆固醇代谢与巨噬细胞的免疫训练有关。磷脂酶A2 (PLA2)裂解甘油磷脂代谢中的重要代谢物卵磷脂,生成亚油酸。与联合多组学分析的结果一致,BCG-中国组的巨噬细胞的PLA2酶活性显著高于对照组和BCG-俄罗斯组(图7G-I)。

图7.的免疫群体的比较多组学分析。
(A) BCG-中国组和BCG-俄罗斯组之间mRNA表达比和代谢物表达比的九象限图。 (B)代谢物和基因的综合分析。 (C) BCG 的甘油磷脂和亚油酸代谢通路的 GSEA 富集图。 (D) 参与甘油磷脂和亚油酸代谢的基因热图。 (E) 甘油磷脂和亚油酸代谢通路以及标准化数据的热图。(F)参与甘油磷脂代谢和亚油酸代谢的基因的ATAC信号。(G) BCG 训练的 BMDM 中 PLA2 酶活性测定的示意图。 (H) PLA2 酶活性显示为随时间变化的相对荧光单位。(I) 该表显示(H) 中每个时间点的P值。
Pearson相关分析显示PLA2基因(Pla2g2d、Pla2g7、Plaat3等)与炎症因子(Tnf、Il1b、Ccl3等)表达呈正相关,与Il4表达呈负相关(图8A)。此外,培养的巨噬细胞产生的TNF-α、IL-6和IL-1β与亚油酸和13(S)-HODE的浓度呈正相关(图8B-G)。为探讨甘油磷脂-亚油酸代谢是否参与BCG诱导的免疫反应,在BCG诱导的BMDM免疫反应中添加亚油酸(图8H-I)。正如预期的那样,亚油酸可以诱导训练免疫和增强BCG诱导的训练免疫(图J-L)。作为PLA2的激活剂,蜂毒肽也能增强BCG诱导的训练免疫(图8J-L)。相比之下,PLA2抑制剂ONO-RS-082 (ONO)和1-萘乙酸(NAA)显著减弱了BCG诱导的训练后免疫(图8M-O)。因此,与BCG-俄罗斯组相比,BCG-中国组BMDM具有更高的亚油酸代谢,并且补充亚油酸可增强BCG诱导的训练免疫。

图8. 亚油酸代谢增强了 BCG 诱导的免疫力。
(A)细胞因子基因与PLA2基因之间的相关性。 (B) TNF-α 差异倍数与亚油酸倍数变化之间的相关性。 (C) IL-6 差异倍数与亚油酸差异倍数之间的相关性。 (D) IL-1β差异倍数与亚油酸差异倍数之间的相关性。 (E) TNF-α 差异倍数与 13(S)-HODE 差异倍数之间的相关性。 (F) IL-6差异倍数与13(S)-HODE差异倍数之间的相关性; (G) IL-1β 差异倍数与 13(S)-HODE 差异倍数之间的相关性。(H)用亚油酸(LA)和蜂毒肽进行训练的免疫补充的示意图。 (I)甘油磷脂-亚油酸代谢示意图。 (J-L) LPS 再刺激后补充亚油酸 (10 μM) 和蜂毒肽 (0.25 μg/ml) 的 BCG 训练的 BMDM 的细胞因子。 (M-O) LPS 再刺激后补充 ONO-RS-082 (ONO; 50 μM) 和 1-萘乙酸 (NAA; 50 μM) 的 BCG 训练的 BMDM 的细胞因子。
+ + + + + + + + + + +
结 论
本项研究发现涵盖所有四个基因聚类的四个代表性卡介苗菌株在诱导训练性免疫和非特异性保护的能力方面存在差异。 BCG 诱导的免疫训练与 Akt-mTOR-HIF1α 轴、糖酵解和 NOD 样受体信号通路相关。多组学分析表明,亚油酸代谢与不同 BCG 菌株训练后的免疫诱导能力相关。亚油酸参与训练免疫的诱导,并且可以作为佐剂增强卡介苗诱导的训练免疫,揭示了可用于佐剂开发的训练免疫诱导信号通路。
+ + + + +



 English
English


