文献解读|Cell Rep Med(14.3):多组学分析揭示皮肤 T 细胞淋巴瘤免疫治疗的内源性和肿瘤性反应
✦ +
+
论文ID
原名:Multi-omic profiling reveals the endogenous and neoplastic responses to immunotherapies in cutaneous T cell lymphoma
译名:多组学分析揭示皮肤 T 细胞淋巴瘤免疫治疗的内源性和肿瘤性反应
期刊:Cell Reports Medicine
影响因子:14.3
发表时间:2024.04.25
DOI号:10.1016/j.xcrm.2024.101527
背 景
皮肤 T 细胞淋巴瘤 (CTCL) 是一种生存率较低且治疗方法有限的皮肤癌。蕈样肉芽肿 (MF) 和塞扎里综合征 (SS) 是CTCL的两种最常见亚型。这些恶性肿瘤源自皮肤归巢 CD4+记忆 T 细胞,可表现为皮肤斑块、肿瘤和炎症。虽然免疫疗法已显示出一定的疗效,但对 CTCL 患者进行免疫治疗的后果尚未得到系统表征。
实验设计
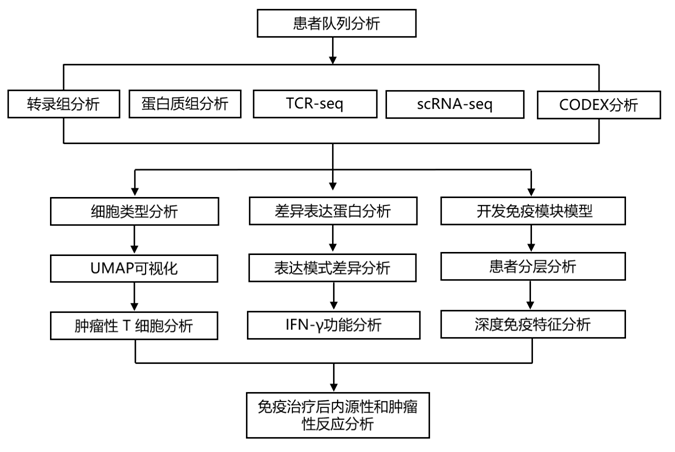
结 果
01
多组学分析描绘 CTCL 患者的疾病状态
为了表征接受免疫治疗的CTCL患者的免疫状态和体内反应,研究团队纳入了39名晚期MF或SS患者,他们参加了癌症免疫治疗试验网络 10 (CITN-10),测试抗pd -1(Pembrolizumab)单药治疗的疗效,或CITN-13,测试IFN-γ和抗pd -1(Pembrolizumab)联合治疗的疗效。他们将分析重点放在基线(BL)和周期1、2和6 (C1、C2、C6)采集的样本上,这些样本反映了治疗开始后的1、3-4和15-16周的患者状态(图1A)。为了探究局部肿瘤效应,他们应用了NanoString进行靶向转录组学分析,并重新分析了福尔马林固定石蜡包埋肿瘤活检样本收集的高维蛋白质组学成像数据(CODEX)(图1A)。为了量化系统效应,他们进行了大量血清蛋白质组学研究,并通过TCR测序(TCR-seq)跟踪克隆动力学。他们开发了一种大规模细胞仪来分析外周血单个核细胞(pbmc),重点关注肿瘤和反应性T细胞。
通过单细胞转录组分析(scRNA-seq)筛选了 6323900 个细胞,并将其聚类为八种主要细胞类型(图 1 B)。正如预期的那样,肿瘤T细胞表现出不同的表型特征,并且在SS患者中富集,而在健康对照(hc)中缺失(图1B)。在SS患者中,肿瘤T细胞占PBMC的很大比例,在一些MF患者中也可检测到(图1C)。克隆性肿瘤T细胞的存在表现为SS患者TCR多样性和均匀性明显降低(图1D)。SS患者CD8+ T细胞较少,骨髓细胞较多,CTCL患者CD4-CD8-T细胞较少(图1E)。
总之,来自两项抗PD-1临床试验的CTCL患者的多组学分析揭示了疾病状态在免疫细胞丰度和TCR克隆性方面的差异。
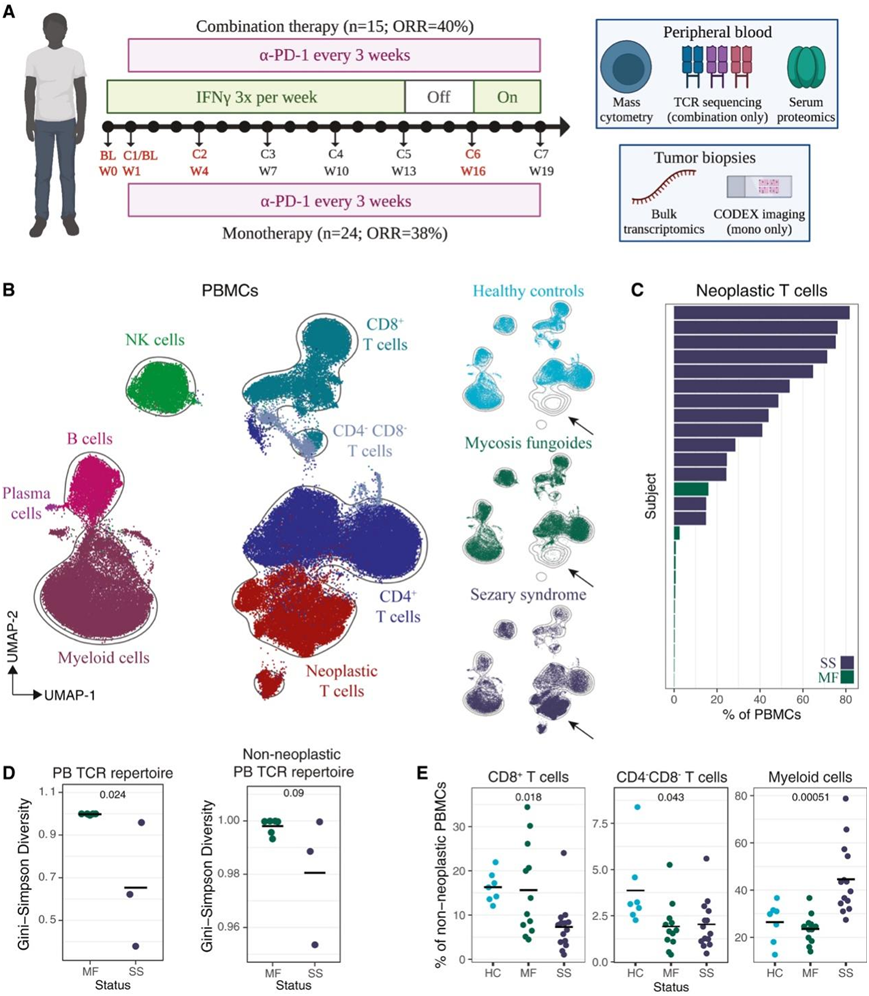
图1. 多组学分析描绘了 CTCL 患者的疾病状态。
(A) 临床试验时间进程和实验方法图。(B) 从 HC、MF 和 SS 受试者的 BL 样本中等量采样 PBMC 的 UMAP。(B) 从 HC、MF 和 SS 受试者的 BL 样本中等量采样 PBMC 的 UMAP。(D) BL 处血液 TCR 库的Gini-Simpson多样性,按疾病状态划分。(D) BL 处血液 TCR 库的Gini-Simpson多样性,按疾病状态划分。
02
肿瘤性 T 细胞没有显示出激活抗 PD-1 疗法的证据
为了评估肿瘤性 T 细胞表型,他们将来自白血病受试者(肿瘤性 T 细胞 >0.9% 的肿瘤性 T 细胞)的等量肿瘤性 T 细胞样本投影到 UMAP 上(图2A)。细胞大部分由受试者共定位,表明受试者间异质性大于受试者内异质性。虽然大多数肿瘤性 T 细胞表现出亲皮肤记忆表型 (CLA + CD45RO + ),但他们还观察到 CD45RO -和 CLA -细胞。肿瘤性 T 细胞表现出检查点分子以及其他人注意到的其他标记物的大量表达,包括 CD39、CCR4 和 KIR3DL2。
为了将肿瘤性 T 细胞表型与正常、非幼稚CD4 + T 细胞进行比较,他们对其中值蛋白质表达谱进行了差异表达分析(图 2 B)。大多数蛋白质均存在显著差异表达,主要富集于肿瘤性 T 细胞。肿瘤T细胞通过临床流式细胞分析定量为CD4+CD26 -,但许多正常的CD4+ T细胞是CD26 -(图2C),他们观察到一个患者有CD26+肿瘤T细胞(图2A)。
为了生成改进的分选策略,他们应用了具有混合子集选择的线性判别分析(HSS-LDA)区分白血病 CTCL 患者和 HC 中的肿瘤性和正常 CD4 + T 细胞。HSS-LDA 将 CD39、CD95 和 KIR3DL2 确定为三个最具区分性的标记,分类准确度 >90%。他们将此分类器转换为分选方案,其中将 CD4+ 肿瘤性 T 细胞分选为 CD95−(CD39+ 或 KIR3DL2+),并将此分选的纯度和准确性与临床上的 CD26− 分选进行了比较(图 2 C)。FOXP3是一种可由调节性T细胞(Treg)和活化的非调节性CD4+ T细胞表达的转录因子,在肿瘤T细胞中表达较高(图2B)。为了检测FOXP3hi肿瘤T细胞是否具有Treg表型,他们对这些细胞进行了分选,并将其典型Treg标志物的表达与非幼稚CD4+ T细胞、Tregs和FOXP3lo/−肿瘤T细胞进行了比较(图2D)。FOXP3hi肿瘤T细胞ICOS表达增加,但不采用与Treg相关的原型表达模式(例如CD25+CD127−)。
癌症的一个特征是细胞代谢的重新编程,以支持细胞的生长和增殖。他们观察到,在质量细胞仪面板中量化的所有五种代谢调节因子(ATP5A, CD98, CPT1A, HK2和VDAC1),代表五种不同的代谢途径(三羧酸循环,氨基酸代谢,脂肪酸代谢,糖酵解和线粒体动力学),在肿瘤T细胞中显著上调(图2B)。为了研究它们的高维代谢谱,他们对肿瘤T细胞和正常、非幼稚CD4+ T细胞的介质进行了主成分分析(PCA)(图2E)。肿瘤T细胞比正常T细胞具有更大的置信区间(CI)椭圆,表明受试者之间代谢表达值的差异更大。较低的PC1值表明较高的代谢表达值,并且在每个受试者中,肿瘤细胞的PC1值总是低于正常细胞的PC1值,然而来自同一受试者的肿瘤细胞和正常T细胞之间的调节因子的中位数代谢表达高度相关。
与非幼稚CD4+ T细胞相比,检查点分子CTLA-4、PD-1和PD-L1在肿瘤T细胞中均显著上调(图2B)。在患者血液中,他们观察到PD-1在肿瘤T细胞上的表达明显高于正常T细胞(图2F-G)。然而,正如之前报道的那样,由于肿瘤中正常T细胞上调PD-1,两种人群在肿瘤中的表达没有差异(图2H)。
抗pd -1治疗后,肿瘤T细胞的频率虽小但显著下降。虽然PD-1大量表达,但Ki-67的表达没有变化(图2I)。事实上,他们观察到整体细胞表型没有明显的变化,正如治疗前和治疗后UMAP空间中细胞的共同定位所证明的那样(图2J)。治疗后,应答者和无应答者的PD-1+肿瘤T细胞比例都较低(图2K),但是应答者的差异幅度明显更大(图2L)。然后,他们发现只有PD-L1的表达在治疗前和治疗后的应答者中显著更高(图2M-N)。
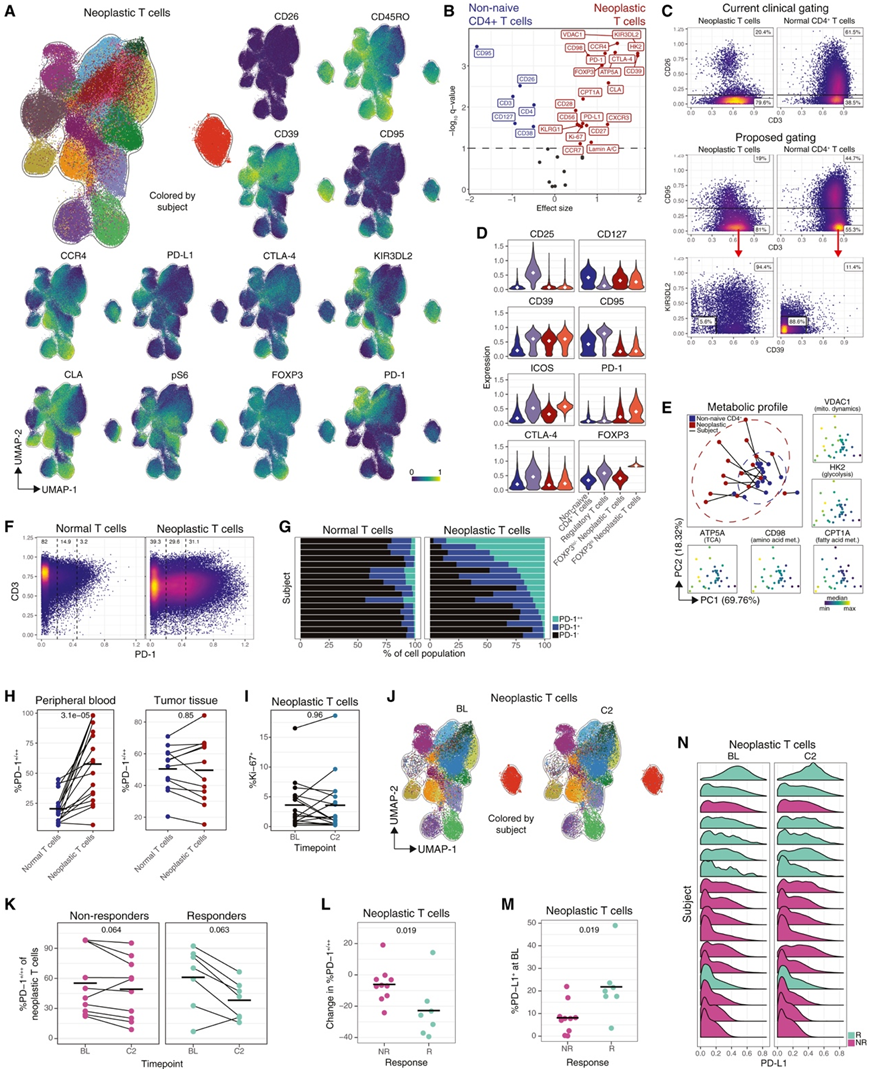
图2. 肿瘤性T细胞没有显示出激活抗PD-1疗法的证据。
(A) 来自白血病受试者的肿瘤性 T 细胞的等量样本的 UMAP。(B)基于中值表达的肿瘤性和正常非幼稚 CD4 + T 细胞之间差异表达的标记物。(C) 肿瘤和正常的CD4 T细胞从相同的HC和白血病受试者的细胞取样,按密度着色。(D) 指定 T 细胞群的等量样本的表达水平。(E) PCA 源自肿瘤和正常非幼稚 CD4 + T 细胞中代谢标志物的中值表达。(E) PCA 源自肿瘤和正常非幼稚CD4+T 细胞中代谢标志物的中值表达。(G) 受试者正常或肿瘤性 T 细胞的 PD-1 表达百分比。(H) 正常或肿瘤性 T 细胞。(I) %Ki-67 +肿瘤性 T 细胞。(J) 等量肿瘤 T 细胞样本的 UMAP。(K)按时间点和反应划分的%PD-1 + / ++肿瘤性 T 细胞。(L) C2 时%PD-1 + / ++肿瘤性 T 细胞的变化。(L) C2 时%PD-1 + / ++肿瘤性 T 细胞的变化。(N) 按时间点划分的肿瘤性 T 细胞中的 PD-L1 表达。
03
IFN-γ诱导免疫激活
据推测,IFN-γ 治疗将激活先天免疫系统,而抗 PD-1 治疗将克服 IFN-γ 诱导的、PD-L1 介导的免疫抑制,从而实现 T 细胞介导的肿瘤清除。然而,与单一疗法相比,联合疗法的反应几乎没有改善。为了了解治疗药物之间缺乏协同作用并研究IFN-γ 单一疗法的体内效果,他们检测了 C1 时间点引起的变化。无论反应和疾病状态如何,任何细胞群中都没有显著诱导 PD-L1,并且没有个体表现出 PD-L1 的显著上调(图 3A)。
他们还发现肿瘤活检样本中主要组织相容性复合物 (MHC) 或 IFN-γ 反应基因没有显著上调,并且在对 IFN-γ 反应基因 log 2变化值进行层次聚类后,没有出现按反应或疾病状态出现的新兴组织(图 3 B)。
他们观察到 NK 和浆细胞的细胞周期显著增加(图 3 C),但 PBMC 子集丰度没有显著变化。他们将 IFN-γ 治疗前后的 LPS 前时间点与当前研究进行了比较。虽然来自 HC 和 CTCL 患者的单核细胞在 IFN-γ 处理后 HLA-DR 显著上调,但 HC 中上调的幅度显著更大(图 3D)。
最后,他们分析了 IFN-γ 是否改变了 TCR 库。不同时间点之间丰度显著差异的 TCR 克隆数量在患者之间差异很大(图 3 E)。在一名 SS 应答者中,治疗后 825 个克隆的丰度显著增加,这与 CD4 + CLA + CD39 + 效应记忆细胞(EM) 和 CD4 + CLA + CD39 + Trcm 细胞比例的急剧增加相一致。
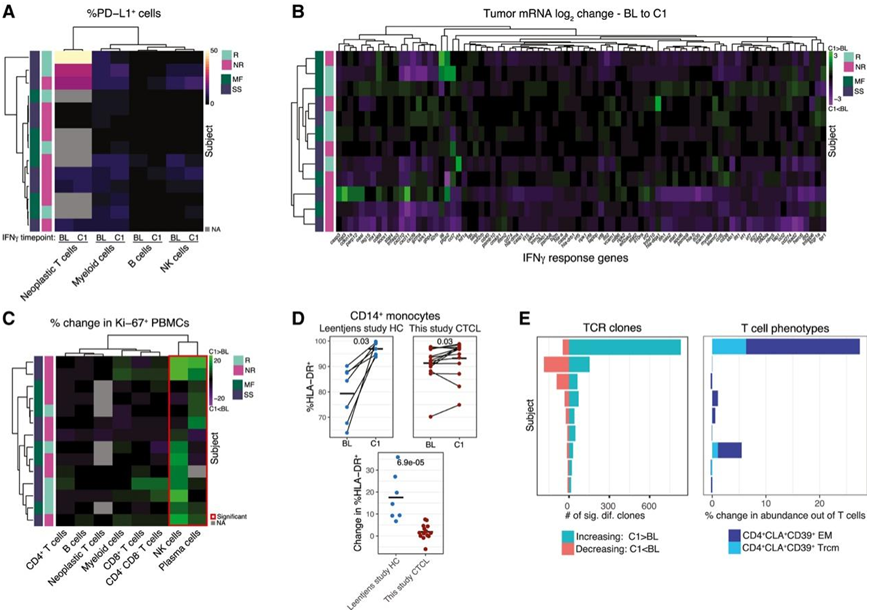
图3. IFN-γ 诱导弱免疫激活。
(A)按受试者、细胞类型和时间点划分的%PD-L1 +细胞。(B)受试者 BL 和 C1 之间肿瘤 mRNA 中 IFN-γ 反应基因表达。(C) C1 处按细胞类型划分的%Ki-67 +细胞的变化。(D)%HLA-DR + CD14 +单核细胞变化。(E) 时间点(左)之间丰度显著差异的 TCR 克隆计数以及时间点(右)之间非肿瘤性 T 细胞的 T 细胞子集频率变化。
04
CLA+CD39+ T细胞与TIL相似,抗pd -1治疗后循环增加
然后,他们分析了抗pd -1治疗如何改变两项试验中患者的免疫状态,观察到肿瘤和正常T细胞在抗PD-1治疗后PD-1的显著下调(图4A)。抗pd -1治疗没有显著改变主要PBMC群体的组成。4个CLA+CD39+ T细胞群,代表CD4+和CD8+ EM和中心记忆(CM) T细胞,在抗pd -1治疗后显著增加(图4B)。他们将非肿瘤性T细胞投射到UMAP上,发现四个CLA+CD39+群体表达高水平的CCR4(一种皮肤归巢趋化因子受体),以及几种激活和检查点分子(图4C)。他们使用了肽-MHC (pMHC) 四聚体来鉴定旁观者、巨细胞病毒 (CMV) 特异性 T 细胞。尽管 CMV 特异性 T 细胞富集了 EM 表型,但它们与 CLA+CD39+ T 细胞没有在 UMAP 上共定位(图 4C),并且不表达 CLA 或 CD39。cmv特异性CD8+ EM T细胞在BL中只有适度的激活水平,治疗对这种激活谱几乎没有影响(图4D)。相比之下,CLA+CD39+CD8+ EM T细胞表现出相当水平的激活,在ifn -γ治疗后减少,在抗pd -1治疗后反弹。在BL和C2的CD4+和CD8+亚群中,CLA+CD39+ T细胞与CLA-CD39-T细胞相比,CD38、HLA-DR、Ki-67和PD-1的表达明显更高(图4E)。CD4+和CD8+ 肿瘤浸润淋巴细胞(til)在血液中表达的HLA-DR和PD-1明显高于CLA-CD39- T细胞(图4F)。
CD4+ TIL在血液中表达的HLA-DR和PD-1水平与CLA+CD39+相似,而CD8+ TIL的PD-1水平明显高于CD8+CLA+CD39+外周血T细胞,HLA-DR水平明显低于CD8+CLA+CD39+外周血T细胞。
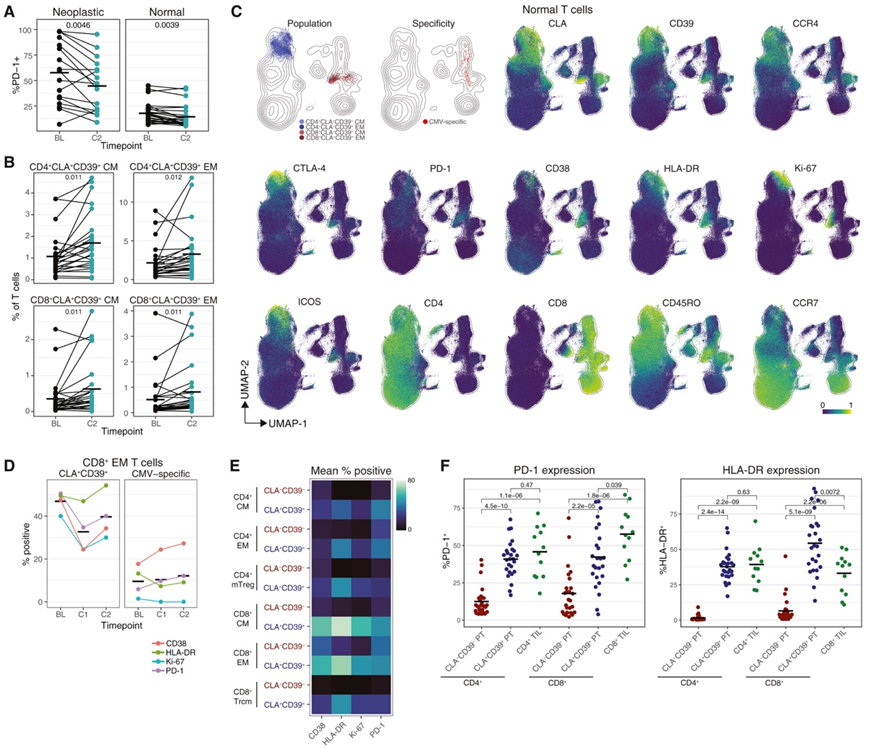
图4. CLA + CD39 + T 细胞类似于 TIL,并且抗 PD-1 治疗后循环增加。
(A)CLA + CD39 + T 细胞类似于 TIL,并且抗 PD-1 治疗后循环增加。(B) 按时间点划分的非肿瘤性 T 细胞中 T 细胞群的频率。(C) 来自抗 PD-1 治疗前后受试者等量样本的非肿瘤性 T 细胞的 UMAP。(D)来自一名受试者跨时间点的CLA + CD39 +或 CMV 特异性 CD8 + EM T 细胞的 % +激活标记。(E) CLA + CD39 +和 CLA - CD39 - T 细胞亚群的平均% +激活标记。(F) BL 处按细胞类型划分的% + T 细胞。
05
多组学免疫模块识别与治疗反应相关的特征
为了发现区分应答者和非应答者的特征,他们开发了一个计算框架,能够集成本研究的高维、多组学数据集并识别特征性免疫模块(图5A-B)。他们将两项试验的血清蛋白值、肿瘤转录组值和单细胞统计汇总为一个统一的特征集。对于每个时间点参数,他们计算了所有多组特征的配对相关性,并根据其加权相关系数向量将这些特征聚类到免疫模块中。
该模型确定了由16个特征组成的9个免疫模块,以区分C2的应答者和非应答者(图5C)。应答者血清中细胞毒性分子GZMA、GZMB和GZMH水平较高,CD8+CLA+ EM T细胞上活化分子表达较高。应答者血清中趋化因子CCL2、CXCL1和CXCL6的丰度也较高,这些趋化因子与骨髓运输和活化有关。无应答者在总Treg和CLA+CD39+ EM Treg亚群中细胞循环的比例更高,在CD4+CLA+CD39+ CM T细胞中HLA-DR表达更高,在CLA+CD39+ Tfr细胞中PD-1表达更高。这两个特征聚集在同一个免疫模块中,因为它们是高度相关的,这表明存在一些生物协同调节,如对共同刺激的反应或亚群之间的表型可塑性(图5D)。
免疫模块还捕获了高度相关的组织间/组间特征,如肿瘤活检样本中的颗粒蛋白(gnly) mRNA表达和血清CCL2蛋白,这些在应答者中较高。尽管同一免疫模块内的特征高度相关,但来自不同免疫模块的特征提供了增强的患者组分离,因为模型选择了将患者分层的免疫模块组合。例如,在CLA+CD39+ Tfr细胞上PD-1高表达的患者均无应答,而在CLA+CD39+ Tfr细胞上PD-1低表达或中等表达的患者只有在血清CCL2水平较低的情况下才无应答(图5D)。
激活标记物的表达在应答者和无应答者之间的T细胞亚群中有所不同(图5C)。他们进一步探索了治疗后的T细胞活化谱,发现应答者的CD8+ EM T细胞中CD38和PD-1表达比例最高,而无应答者的Treg中HLA-DR和Ki-67表达比例最高(图5E)。有趣的是,他们发现CLA+CD39+ Treg EM细胞在BL中的PD-1表达明显增加,在给予抗PD-1治疗后增强了活化(图5F)。他们将差异特征的Z分数可视化(图5G)。无监督的层次聚类导致反应者和无反应者近乎完美的分层,突出了成功治疗反应的局部、细胞和全身免疫特征。
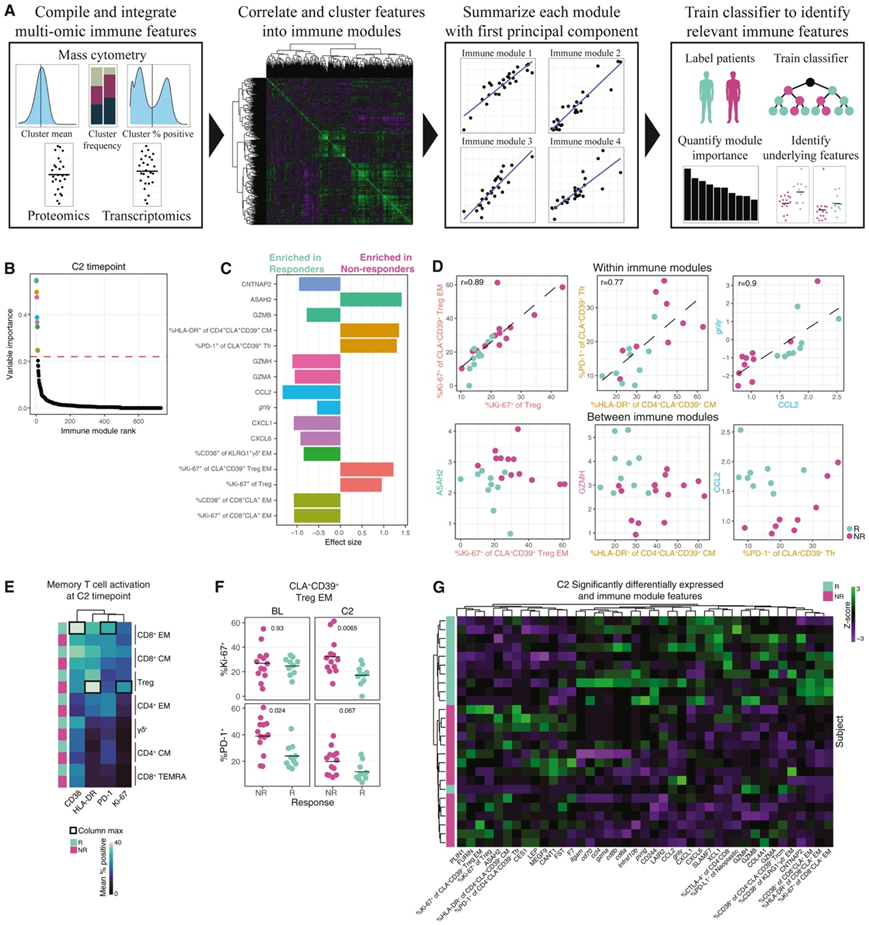
图5. 多组学免疫模块识别与治疗反应相关的特征。
(A) 免疫模块方法图。(B) 在 C2 处区分响应和无响应的预测变量的Gini指数。(C) 包含 (B) 中选择的免疫模块的特征的效应大小。(D)免疫模块中的差异免疫特征。 (E)按反应计算的 T 细胞群的平均百分比激活标记。(F)按反应和时间点划分的 CLA + CD39 + Treg EM 的 % +。(G)由模型选择的特征和/或在 C2 处显著差异表达的特征的Z分数。
06
在抗pd -1治疗前后,MF和SS患者的全身和局部免疫特征是不同的
MF和SS患者都是CTCL的亚型,但其临床表现存在差异,最明显的是SS患者循环肿瘤T细胞频率高,这是SS诊断的决定性标准(图1C)。应用该免疫模块模型方法在BL中区分MF和SS患者,发现了由25个特征组成的11个差异模块(图6A)。正如预期的那样,肿瘤T细胞的丰度是疾病状态的一个强有力的预测因子。在SS患者的非肿瘤性PBMC中,骨髓细胞也有明显的富集(图1E),但没有观察到MF和SS患者肿瘤中巨噬细胞的丰度差异。然而,MF患者肿瘤中的免疫细胞明显更多,这在肿瘤细胞图中很明显(图6B)。根据肿瘤浸润免疫细胞的丰度对患者进行排序,将MF和SS患者完美分层(图6C)。该模型发现,SS患者在多种T细胞群中PD-1表达更高,包括CD8+CLA+CD39+ CM和EM细胞(图6C)。
该模型发现,SS患者在多种T细胞群中PD-1表达更高,包括CD8+CLA+CD39+ CM和EM细胞(图6A)。在肿瘤中,他们还发现SS肿瘤中CD4+、CD8+、肿瘤和treg中PD-1的表达更高。基于肿瘤存在的T细胞PD-1表达的无监督聚类可以完美地对SS和MF患者进行分层(图6D),但基于HLA-DR表达的聚类无法对SS和MF患者进行分层。CLA+CD39+ Treg EM细胞的PD-1+比例在无应答者和SS患者中明显更高(图6A)。他们在BL中可视化CLA+CD39+ Treg EM细胞的%PD-1+和CD8+CLA+CD39+ EM细胞的%HLA-DR+,并根据反应和疾病状态对图进行着色(图6E)。将这些特征相加,完美地对MF和SS患者进行分层,而这些特征的比例显著地区分了应答者和无应答者(图6F),突出了这些细胞群的相关性。
利用公开的scRNA-seq数据集,他们观察到在SS患者的肿瘤T细胞中大量表达了cxcl13,但在其他CTCL亚型患者的肿瘤T细胞中却没有表达(图6G)。同样,尽管在MF患者中观察到更大的免疫浸润,但在BL处的SS肿瘤中,cxcl13也显著增加(图6H)。这一趋势在C2时继续存在,但没有达到统计学意义,而在BL和C2时,SS患者血清CXCL13仍显著升高。有趣的是,一名表现出大量循环肿瘤T细胞的MF患者(图1C),也出现了血清CXCL13水平的升高,但没有发生肿瘤CXCL13水平的升高(图6H)。该患者的 CD4 + CLA + CD39 + Trcm 细胞比例升高,这是 SS 患者的特征(图 S1 M),并且在两项研究中 CD8 + CLA + CD39 + Trcm 细胞比例最高。他们利用这名白血病 MF 患者来识别区分 MF 和 SS 的特征,这些特征可能是由于白血病表现而不是疾病的其他方面,计算了白血病 MF 患者与 MF 和 SS 分布之间的Mahalanobis距离,并可视化了白血病 MF 患者更接近 SS 患者的特征(图 6 I)。正如预期的那样,在 SS 患者中观察到的较高水平的血清 CXCL13 和 PD-1 也同样存在于该白血病 MF 患者中,因此可能是由于循环肿瘤性 T 细胞的存在。他们发现血清 CCL13 水平升高,CCL13 是一种富含慢性炎症性疾病的化学引诱剂,血清IL-10(一种免疫调节细胞因子)和血清IL-16(一种CD4 + T细胞趋化剂和生长因子)与白血病表现相关。
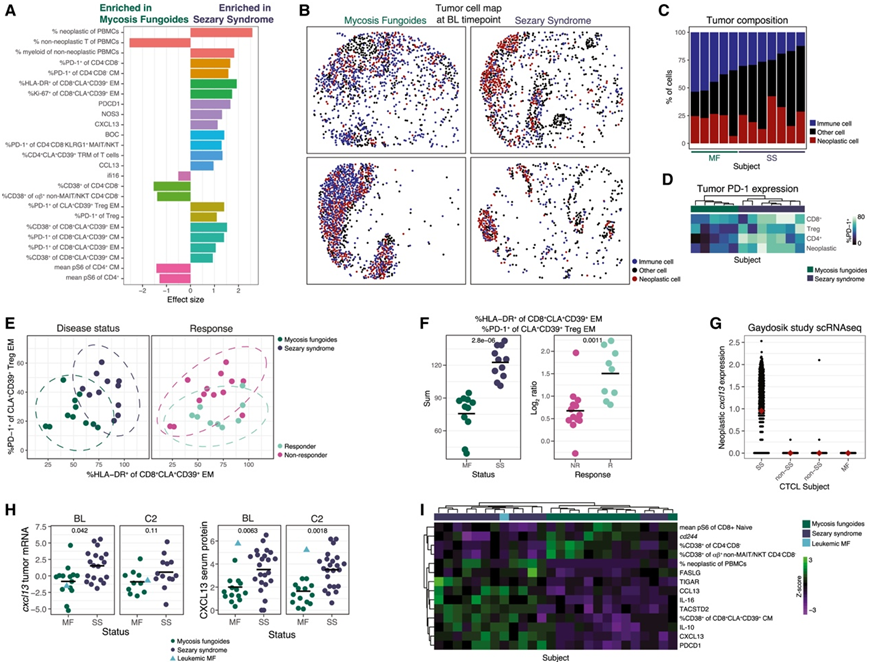
图6. 抗 PD-1 治疗前后的全身和局部免疫特征区分 MF 和 SS 患者。
(A) 包含在 BL 时区分 MF 和 SS 患者的免疫模块的特征的效应大小,按免疫模块着色,行按Gini指数排序。(B) 肿瘤细胞图显示 BL 处代表性 MF 和 SS 肿瘤细胞的坐标,按细胞类型着色。(C) BL 中肿瘤细胞类型百分比,按免疫细胞百分比排序。(D) BL 时肿瘤存在的 T 细胞群的%PD-1+ 。(E-F) BL 的不同免疫特征按疾病状态或反应着色。(G)来自 CTCL 受试者的肿瘤存在的肿瘤性 T 细胞的cxcl13表达。(H)按时间点和疾病状态划分的cxcl13肿瘤 mRNA 和 CXCL13 血清蛋白的大量表达。(I) BL 差异特征的Z分数。
+ + + + + + + + + + +
结 论
本项研究应用一套高维技术来研究接受单一或联合抗 PD-1 加IFN-γ 治疗的 CTCL 患者的局部、细胞和全身反应。肿瘤性 T 细胞在免疫治疗后没有显示出激活的证据。 IFN-γ 会诱导减弱的内源性免疫反应,而抗 PD-1 会引发更广泛的变化,包括 CLA + CD39 + T 细胞丰度增加。本项研究开发了一种公正的多组学分析方法,能够发现对患者进行分层的免疫模块。在无反应者中发现了激活的调节性 CLA + CD39 + T 细胞的富集,在白血病患者中发现了激活的细胞毒性 CLA + CD39 + T 细胞的富集。本项研究结果提供了关于 CTCL 患者免疫治疗效果的见解,以及临床试验多组学分析的通用框架。
+ + + + +



 English
English


