文献解读|Cell Rep Med(14.3):肿瘤内微生物组衍生的丁酸盐促进肺癌转移
✦ +
+
论文ID
原名:Intratumor microbiome-derived butyrate promotes lung cancer metastasis
译名:肿瘤内微生物组衍生的丁酸盐促进肺癌转移
期刊:Cell Reports Medicine
影响因子:14.3
发表时间:2024.04.01
DOI号:10.1016/j.xcrm.2024.101488
背 景
肺癌(LC)是全球癌症相关死亡率最高的癌症,大多数LC复发发生在术后3年内,但其潜在机制仍不清楚。
实验设计
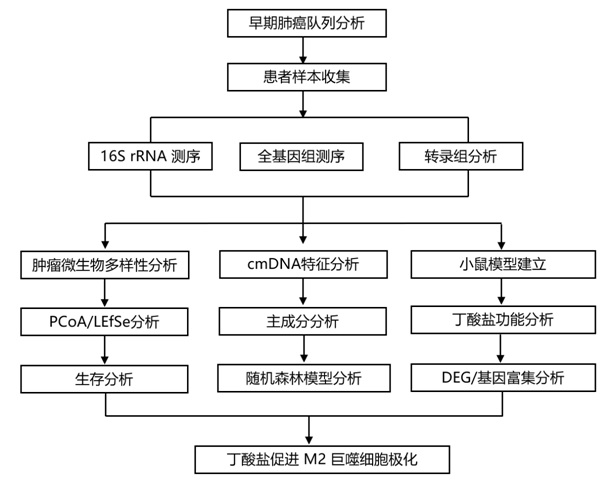
结 果
01
肿瘤微生物多样性与肺癌切除患者的复发相关
为了探讨肿瘤内肺肿瘤微生物组组成与肺癌复发的关系,研究团队首先建立了一个早期肺癌队列,包括手术后3年内复发的患者(复发[R]组,中位无复发生存期(RFS)为1.3年)和临床分期匹配的3年以上无复发的长期幸存者(非复发[NR]组,中位RFS为4.9年)(图S1A)。R组和NR组患者在年龄、性别、身体质量指数(BMI)、吸烟史、临床分期、肿瘤直径和病理方面进行匹配。此外,R组患者的TNM分期比NR组更早,这与肿瘤复发的特点是一致的。从58例手术切除的肺癌肿瘤和邻近正常肺组织(29例R和29例NR)中提取细菌DNA,并通过16S rRNA基因测序进行分类分析(图S1B)。他们首先使用不同的方法(Shannon和Simpson指数)检测肿瘤微生物多样性,发现肿瘤微生物组的α多样性(定义为每个肿瘤样本中存在的物种的丰度和多样性)在NR患者中明显高于R患者(图1A)。同样,与R患者相比,NR患者正常肺微生物组的α多样性更高(图S1C)。然后,他们根据Shannon指数得到的中位数多样性对两组患者进行分层,探讨肺癌肿瘤微生物多样性与RFS的关系。正如预期的那样,他们发现低α多样性的患者与高α多样性的患者相比,RFS显著降低(图1B)。这些研究结果表明,肿瘤α多样性可以作为切除肺癌患者RFS的预测因子,提示肿瘤内微生物组可能参与肺癌复发。
为了进一步了解微生物组多样性的作用及其与复发的关系,他们使用微生物β多样性比较了R组和NR组肿瘤中总体微生物组组成。基于Bray-Curtis距离的主坐标分析(PCoA)显示R组和NR组之间存在明显的聚类差异(图1C)。采用相似性分析(ANOSIM)来评估微生物组组成之间的统计学差异,发现R组和NR组的总体肿瘤微生物组组成有显著差异(图1C)。此外,在正常肺组织中,R组和NR组之间的总体微生物组组成也存在类似的差异(图S1D)。
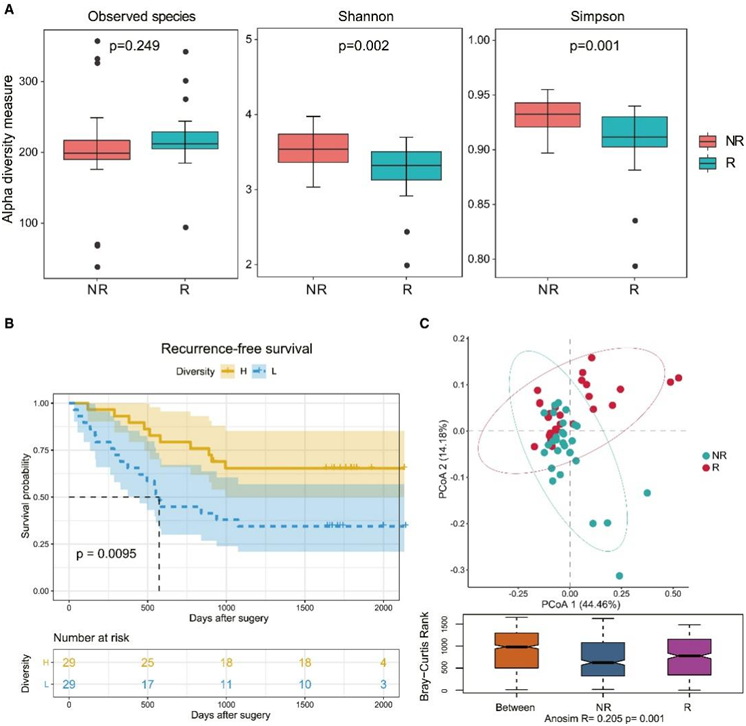
图1. 瘤内微生物多样性与肺癌患者复发的相关性。
(A) R 和 NR 组中的α多样性(观察到的物种、香农指数和辛普森指数)。(B) 由 α 多样性定义的肺癌患者的 Kaplan-Meier 图。(C) 使用 Beta 多样性的 Bray-Curtis 度量距离的 PCoA。
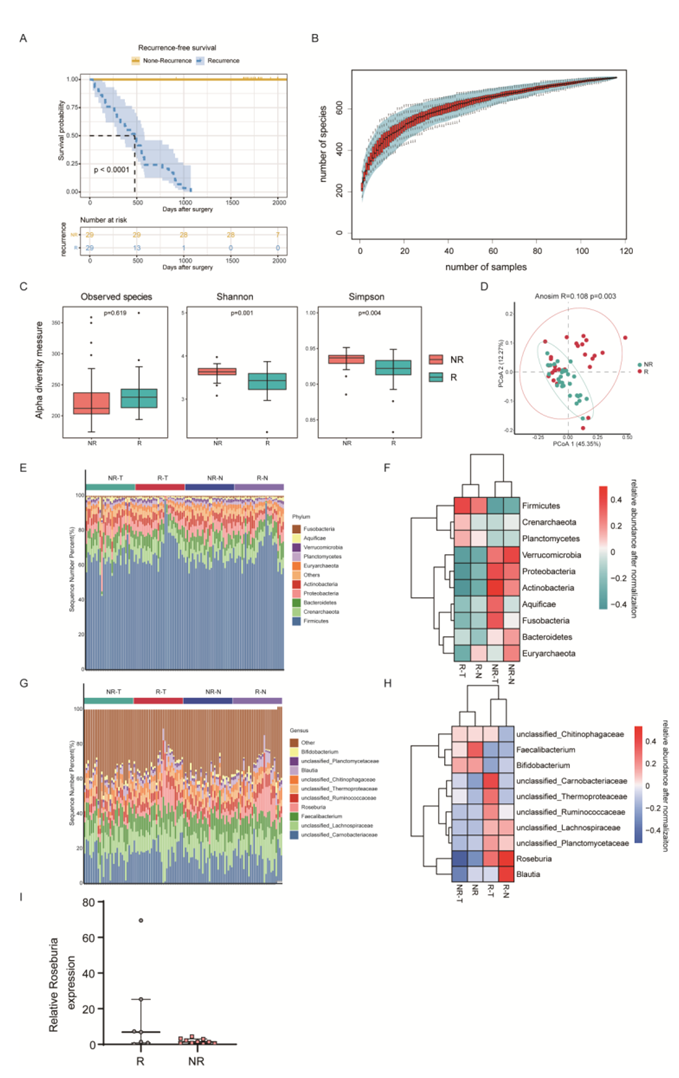
图S1. 肺癌和NR患者肺癌组织和正常肺组织微生物组组成。
(A) 16S队列肺癌患者Kaplan-Meier图。(B)各样品物种积累曲线。(C) R和NR患者正常肺微生物组α多样性。(D)使用β多样性的布雷-柯蒂斯度量距离测量R和NR患者正常肺微生物组的PCoA。(E) R和NR患者肺癌组织和正常肺组织的门分类水平微生物组。(F)分组肺癌患者差异表达门分类水平热图。(G) R和NR患者肺癌组织和正常肺组织的菌群属分类水平。(H)分组肺癌患者差异表达属分类水平热图。(I) RT-PCR检测证实,在另一个队列中,R组Roseburia更丰富。
02
R 和 NR 患者之间的肿瘤微生物群落存在显著差异
鉴于肺癌患者多样性与 RFS 之间的关系,他们接下来试图确定 R 和 NR 患者之间微生物群落的差异。在门水平上,无论是肿瘤组织还是正常肺组织,R组和NR组的主要组成为厚壁菌门、拟杆菌门、变形菌门和放线菌门(图2A,图S1E)。此外,与NR患者相比,R患者的肿瘤和正常组织中厚壁菌门的比例增加,但变形菌门和放线菌门的比例减少(图2B,图S1F)。在属水平上,Faecalibacter、Roseburia、Blautia和Bifidobacteria在两组中都显示出相对较高的丰度(图 2 A ,图S1 G)。与NR组相比,R组中Roseburia和Blautia的比例增加,而Faecalibacter和Bifidobacteria的比例减少(图2A,图S1H)。
为了进一步识别R组和NR组之间的差异微生物群并找到潜在的微生物生物标志物,他们在属水平上进行了效应大小(LEfSe)的线性判别分析。在肿瘤组织中,LEfSe 揭示了可区分 R 组和 NR 组的 22 个特征(图 2 C)。Roseburia是R组最明显的生物标志物。RT-PCR检测证实,R组Roseburia含量更高(图S1L)。双歧杆菌、幽门螺杆菌和Akkermansia是NR组的生物标志物。使用Lasso回归模型进行进一步选择,他们发现6个属(Roseburia, Helicobacter、Gardnerella、Flavonifractor、Coprococcus和Anaerostipes)可能作为区分R和NR组的潜在生物标志物,这6个属与RFS呈显著相关(图2D)。这6个属的相对丰度在R组和NR组之间存在显著差异(图2E)。根据中位预测评分将患者分为高危组和低危组。Kaplan-Meier生存曲线显示,高危组RFS明显缩短(图2F)。重要的是,在调整TNM分期后,属预测评分仍然是多变量Cox回归模型中RFS的独立预测因子。属预测评分的曲线下面积(AUC)值为0.887(图2G)。
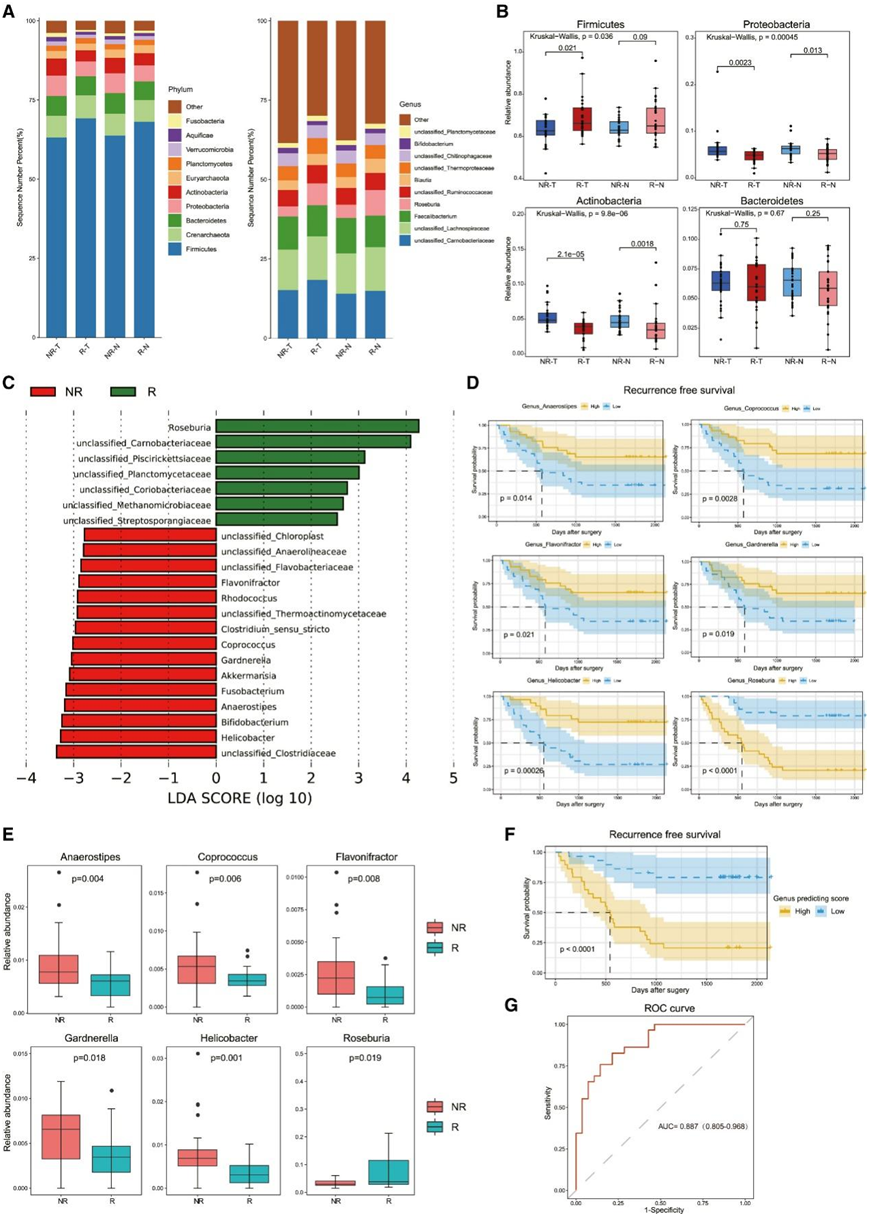
图2. R和NR患者瘤内微生物群落存在显著差异。
(A) R 和 NR 肺癌患者的门(左)和属(右)分类水平的条形图。(B) R 和 NR 患者之间的门差异。(C) R 组和 NR 组之间具有不同丰度的特征的 LDA 评分。(D) Kaplan-Meier 对肿瘤内微生物丰度不同的患者的 RFS 概率进行估计。(E) 属预测得分中六个差异丰富的属。(F) 由属预测评分定义的肺癌患者的 Kaplan-Meier 图。(G) 属预测评分的 ROC 分析作为 RFS 的预测。
03
cmDNA标记是肺癌复发的有潜力的生物标志物
近年来,循环微生物组 DNA(cmDNA)作为一种很有前景的生物标志物出现在癌症诊断中。因此,他们招募了另一个队列来探讨cmDNA与肺癌复发的关系(图3A)。共招募了63名肺癌患者,并通过全基因组测序对其血浆进行了测序。R组和NR组患者在年龄、性别、BMI、吸烟史和病理方面没有差异。在属水平上,两组中不动杆菌、Cutibacterium、丛毛单胞菌和葡萄球菌的丰度相对较高(图S3A)。正如预期的那样,他们在R和NR患者的血浆和肿瘤组织中发现了22个共有属,其中包括幽门螺杆菌和加德纳菌,它们是肿瘤组织中的生物标志物(图3B)。在一定程度上与肿瘤组织一致,NR患者的cmDNA α多样性高于R患者,但无统计学差异(图3C)。此外,使用Bray-Curtis距离的PCoA显示R组和NR组之间的cmDNA存在差异(图3D)。
然后将患者随机分为发现组(70%)和验证组(30%),用于模型校准和验证(图3A)。使用MaAslin2发现7个具有预测概率的属。R组富集了克雷伯氏菌(Klebsiella)、马氏菌(Massilia)和微球菌(Microbulbifer), NR组富集了Cutibacterium、丛毛单胞菌、葡萄球菌和ophilus(图S3B-C)。主成分分析(PCA)表明,这7个属在R组和NR组之间存在明显的聚类差异(图3E,图S3D)。基于这7个属构建随机森林模型,发现集的AUC达到0.857(图3F)。他们使用验证集进一步评估模型并达到可接受的预测能力(AUC = 0.717)(图3F)。此外,他们还发现包括葡萄球菌(Staphylococcus)、Massilia和克雷伯菌(Klebsiella)在内的属与RFS显著相关(图3G)。这些结果表明,cmDNA标记是在手术前预测早期肺癌复发的有希望的非侵入性生物标志物。
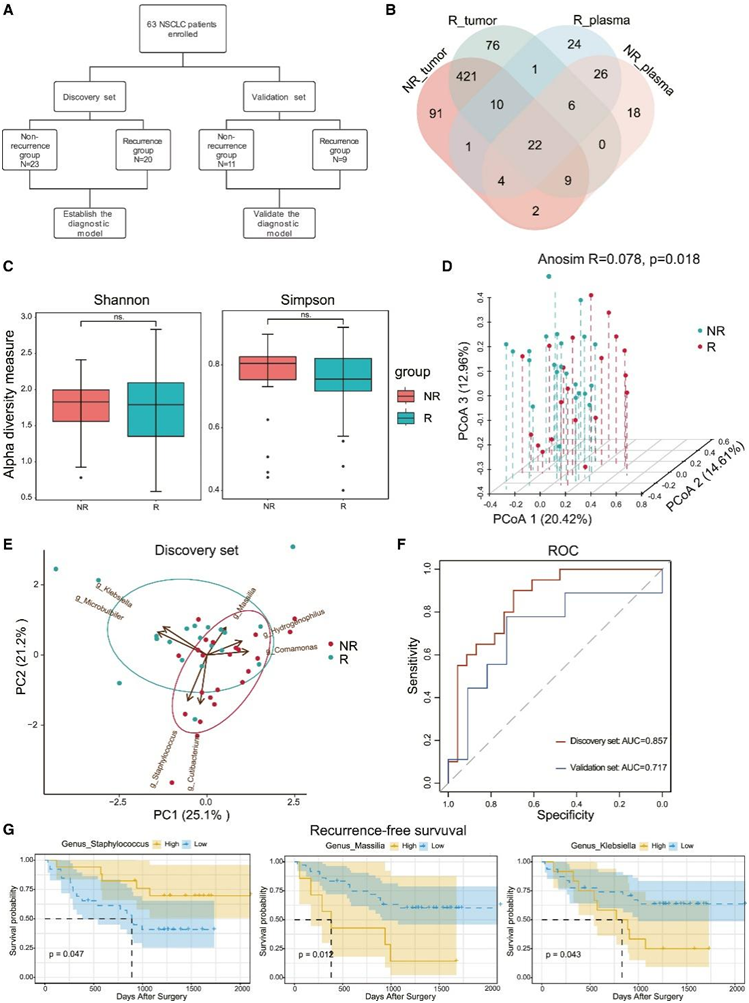
图3. 循环微生物组DNA可以区分R和NR患者。
(A) 循环微生物组 DNA 分析流程图。(B) 肿瘤和血浆中共有属的维恩图。(C) R 和 NR 患者循环微生物组 DNA 的 Alpha 多样性(香农指数和辛普森指数)。(D) 使用 Beta 多样性的 Bray-Curtis 度量距离对 R 和 NR 患者的循环微生物组 DNA 进行 PCoA。(E) PCA 使用发现集中的循环微生物组 DNA 生物标志物。(F) 循环微生物组 DNA 特征的 ROC 分析作为发现和验证集中 R 患者的预测。(G) Kaplan-Meier 根据血浆中微生物的丰度水平估计 RFS 概率。
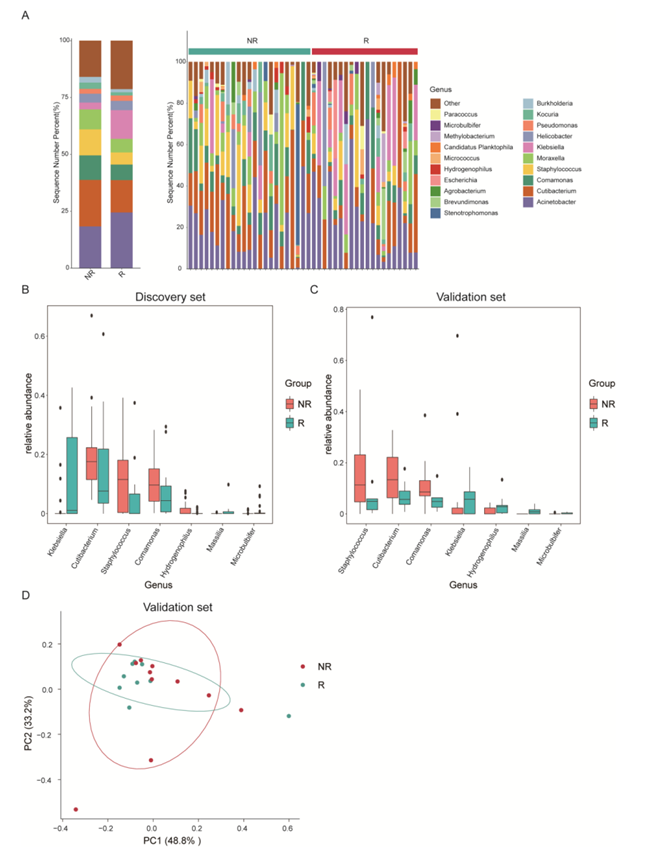
图S3. R和NR患者的循环微生物群落存在差异。
(A) R和NR患者循环微生物群属分类水平。(B)箱线图显示了发现集中7个属的相对丰度。(C) 箱线图显示验证集中7个属的相对丰度。(D)在验证集中使用循环微生物组DNA生物标志物进行主成分分析(PCA)。
04
微生物群衍生的丁酸盐在低浓度下可促进肺癌的进展
鉴于R组中肿瘤和正常组织中产生丁酸的细菌,尤其是Roseburia ,均富集,他们进一步探讨了Roseburia是否可以促进肺癌进展。利用BLAST分析,他们发现Roseburia的序列与Roseburia testinalis的序列最接近,并选择该序列进行进一步的实验。皮下移植肺癌小鼠瘤内每3天注射一次R. intestinalis(Roseburia组)或PBS,在小鼠皮下异种移植物中引入R. intestinalis可使肿瘤体积增大(图4A)。
R组多种产丁酸菌如Roseburia和Butyricicoccus受到干扰,提示丁酸盐可能在肿瘤复发和转移中起作用。以往的研究表明,丁酸盐可能在肠道中发挥不同的作用。丁酸盐在其他器官中的浓度相对较低,可能促进前列腺癌的肿瘤细胞增殖。探讨丁酸盐浓度对肺癌细胞增殖的影响。CCK8实验和集落形成实验显示,低浓度(1 mM)丁酸盐可促进肺癌细胞增殖,高浓度(5 mM)丁酸盐可抑制肺癌细胞增殖(图4B-C)。因此,他们重点研究了低浓度丁酸盐对肺癌细胞迁移和侵袭的影响,发现丁酸盐能促进肺癌细胞的迁移和侵袭能力(图4D-E)。利用肺腺癌患者源性类器官(PDO),他们发现添加丁酸盐可以促进类器官中侵袭性链(invasive strands)的产生,表明丁酸盐可以促进肺癌类器官的侵袭能力(图4F)。
为了进一步评估丁酸盐在体内的功能,他们通过注射加丁酸盐(1 mM)或不加丁酸盐(1 mM)预处理的Lewis肺癌(LLC)细胞,建立C57BL/6J小鼠原位肺癌模型。与阴性对照组相比,丁酸组肺原位肿瘤体积明显增加(图4G)。他们建立了C57BL/6小鼠LLC尾静脉转移模型。小鼠用雾化的万古霉素(10 mg/mL)和新霉素(20 mg/mL)处理一周,以减少共生肺微生物群的干扰。然后,小鼠经尾静脉注射LLC细胞,并雾化生理盐水或丁酸盐(40或200 mM)。低浓度丁酸组(40 mM)肺转移灶数高于生理盐水组,但差异无统计学意义(图4H)。
这些结果提示低浓度丁酸盐可促进肺癌细胞的迁移、侵袭和转移。
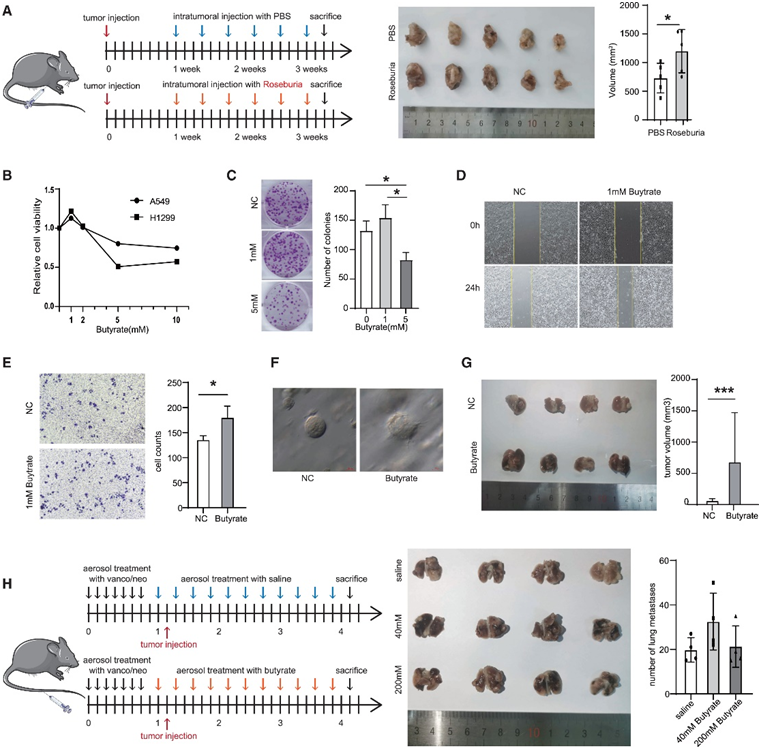
图4. 低浓度丁酸盐促进肺癌进展。
(A) 肿瘤内注射Roseburia可促进皮下异种移植模型中的肺癌生长。(B) 用不同浓度丁酸盐处理的肺癌细胞的 CCK8 测定。(C) A549 细胞中不同浓度丁酸盐的克隆形成测定。(D) 用丁酸盐 (1 mM) 处理的肺癌 A549 细胞的伤口愈合测定。(E) 用丁酸盐 (1 mM) 处理的肺癌 A549 细胞的 Transwell 测定。(F) 丁酸盐处理诱导肺腺癌衍生类器官的侵袭性形态。(G) 通过注射用或不用丁酸盐 (1 mM) 预处理的 LLC 细胞,在 C57BL/6J 小鼠中建立原位肺癌模型。(H) C57BL/6 小鼠的 LLC 尾静脉转移模型。
05
丁酸盐通过上调 H19 促进肺癌进展
为了进一步探讨丁酸盐在肺癌进展中的潜在机制,他们对用或不用丁酸盐 (1 mM) 处理的 A549 细胞进行转录组分析(RNA-seq)。差异表达基因(DEG)分析显示丁酸盐组中有 2680 个上调基因和 656 个下调基因(图 5 A)。然后,他们使用丁酸盐处理后上调的基因生成基因特征,并根据无病生存率(DFS;<或>3年)在TCGA数据集中对肺癌癌症患者进行分类。进行基因集富集分析,丁酸上调的基因特征在DFS<3年的患者中显著富集(图5B)。他们进一步根据细胞内表达情况筛选上调基因,最终得到438个上调基因,其中H19上调最为显著(图5A)。在A549和H1299细胞系中,他们发现丁酸盐能显著提高H19的表达(图5C)。H19是一种长链非编码RNA,在包括肺癌在内的多种肿瘤的进展和转移中发挥重要作用。
既往研究报道组蛋白去乙酰化酶2 (histone deacetylase 2, HDAC2)可通过H3K27去乙酰化抑制H19的表达,抑制肿瘤转移,丁酸盐可抑制HDAC2。因此,他们推测丁酸盐可能通过调节HDAC2和H3K27乙酰化而增加H19的表达。在A549细胞中,他们发现丁酸盐可以在mRNA和蛋白水平上抑制HDAC2的表达(图5D-E)。通过丁酸抑制HDAC2可促进组蛋白H3K27乙酰化(图5E)。染色质免疫沉淀实验证实HDAC2可以结合H19启动子,丁酸盐处理可以抑制这种结合(图5F)。通过丁酸盐抑制HDAC2可增加H19启动子上H3K27乙酰化水平(图5G)。
由于H19是一种没有蛋白产物的非编码RNA,因此我他们进一步探索了H19的下游靶点。大量证据表明,H19可以促进多种基质金属蛋白酶(MMP)的表达。RNA-seq数据显示,MMP15在丁酸盐组中显著上调(图5A)。此外,患者来源类器官(PDO)实验也证实丁酸盐处理诱导了更多的MMP15分泌(图5H)。据报道,MMP15参与肝癌、非小细胞肺癌等肿瘤的转移。免疫组化结果显示,R组肿瘤组织中MMP15的表达明显升高(图5I)。他们还发现,通过TCGA数据集,MMP15的高表达与非小细胞肺癌TNM晚期和短RFS相关。在A549或H1299细胞中,丁酸盐可以在mRNA和蛋白水平上显著提高MMP15的表达。相反,沉默H19可抑制A549和H1299细胞中MMP15的表达。
他们设计了功能挽救实验,用低浓度丁酸盐处理A549或H1299细胞,然后沉默细胞中的H19(图5L)。伤口愈合实验表明,低浓度丁酸盐促进了肺癌细胞的迁移,并且丁酸盐处理所带来的迁移优势由H19沉默部分逆转。这些结果提示,低浓度丁酸盐可能抑制HDAC2及其与H19启动子区域的结合,从而提高H19启动子区域H3K27乙酰化水平,进一步提高H19的表达,促进肺癌细胞的进展。
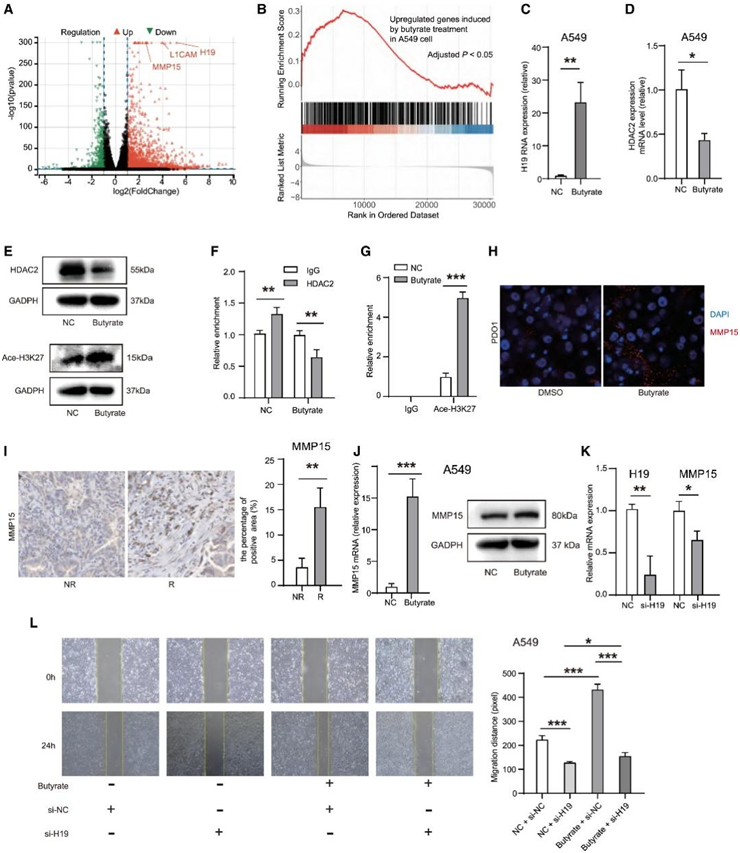
图5. 丁酸盐通过增加H19表达促进肺癌进展。
(A) 用丁酸盐 (1 mM) 处理的 A549 细胞中差异表达基因的火山图。(B) TCGA 肺癌患者中丁酸盐诱导的上调基因的基因集富集分析。(C) 用丁酸盐 (1 mM) 处理的肺癌细胞中 H19 的表达。(D) 用丁酸盐 (1 mM) 处理的 A549 细胞中 HDAC2 的表达。(E) 通过蛋白质印迹检测 HDAC2(上)和 H3K27 乙酰化(下)。(F) 在用或不用丁酸盐 (1 mM) 处理的 A549 细胞中,对 H19 基因启动子处的 HDAC2 富集进行染色质免疫沉淀 (ChIP) 分析。(G) 在用或不用丁酸盐 (1 mM) 处理的 A549 细胞中,对 H19 基因启动子处的 H3K27 乙酰化进行 ChIP 分析。(H) 丁酸盐处理诱导肺癌类器官中更多的 MMP15 分泌。(I)免疫组化实验发现R患者中MMP15表达较高。(J) 用丁酸盐 (1 mM) 处理的肺癌细胞中 MMP15 的表达。(K)转染si-H19后H19和MMP15 mRNA的表达。(L) A549 细胞的挽救实验。
06
丁酸盐促进 M2 巨噬细胞极化
丁酸盐可以调节免疫细胞的分化,例如调节性T细胞和巨噬细胞。而肿瘤微环境中的M2巨噬细胞可以促进肿瘤细胞的侵袭和转移,他们推测低浓度丁酸可能促进巨噬细胞从M0极化到M2,从而促进肿瘤转移。骨髓源性巨噬细胞(BMDM)或RAW264.7细胞经白细胞介素-4 (IL-4)处理后极化为M2表型(M2组为后续实验中经IL-4处理的巨噬细胞),然后用不同浓度的丁酸盐处理M2(图6A)。IL-4成功诱导M2极化,在BMDM或RAW264.7细胞中,Arg1、Ym1和Fizz1的表达增加(图6A)。在BMDM细胞中,暴露于0.5 mM丁酸盐24 h的m2 -BMDM细胞中,Arg1、Fizz1和Ym1的相对表达量显著升高(图6A)。在BMDM和RAW264.7细胞中,对Arg1的影响最为显著。Western blot分析证实,丁酸盐处理后Arg1蛋白表达增强(图6B)。在尾静脉转移模型中,免疫组化显示低浓度丁酸组肺转移灶中Arg1的表达明显高于其他两组(图6C)。此外,ARG1和CD206共染色也显示R患者肿瘤组织中存在更多的M2巨噬细胞(图6D)。综上所述,这些数据表明丁酸盐促进M2巨噬细胞极化。
研究表明,M2巨噬细胞通过分泌多种细胞因子,如IL-10和IL-13,促进肿瘤细胞的迁移和侵袭。收集经丁酸处理和未经丁酸处理的M2巨噬细胞培养基(CM)上清,用Quantibody小鼠细胞因子阵列进行分析。结果显示,经丁酸处理的M2巨噬细胞的CM含有更多的IL-10、IL-13和MIP3a,这些物质与肿瘤转移有关(图6E)。因此,丁酸盐处理M2-BMDM后,M2-BMDM中CM的迁移和侵袭促进作用显著增强(图6F-G)。为了进一步证实巨噬细胞是否参与体内丁酸盐诱导的转移,他们建立了LLC尾静脉转移模型,并通过氯膦酸脂质体消耗巨噬细胞(图6H)。与对照脂质体相比,氯膦酸盐脂质体处理显著减少了外周血和肝脏中的巨噬细胞(图6I),去除巨噬细胞减弱了丁酸盐的促转移功能(图6J)。综上所述,这些数据表明巨噬细胞参与了丁酸盐促进转移的功能。
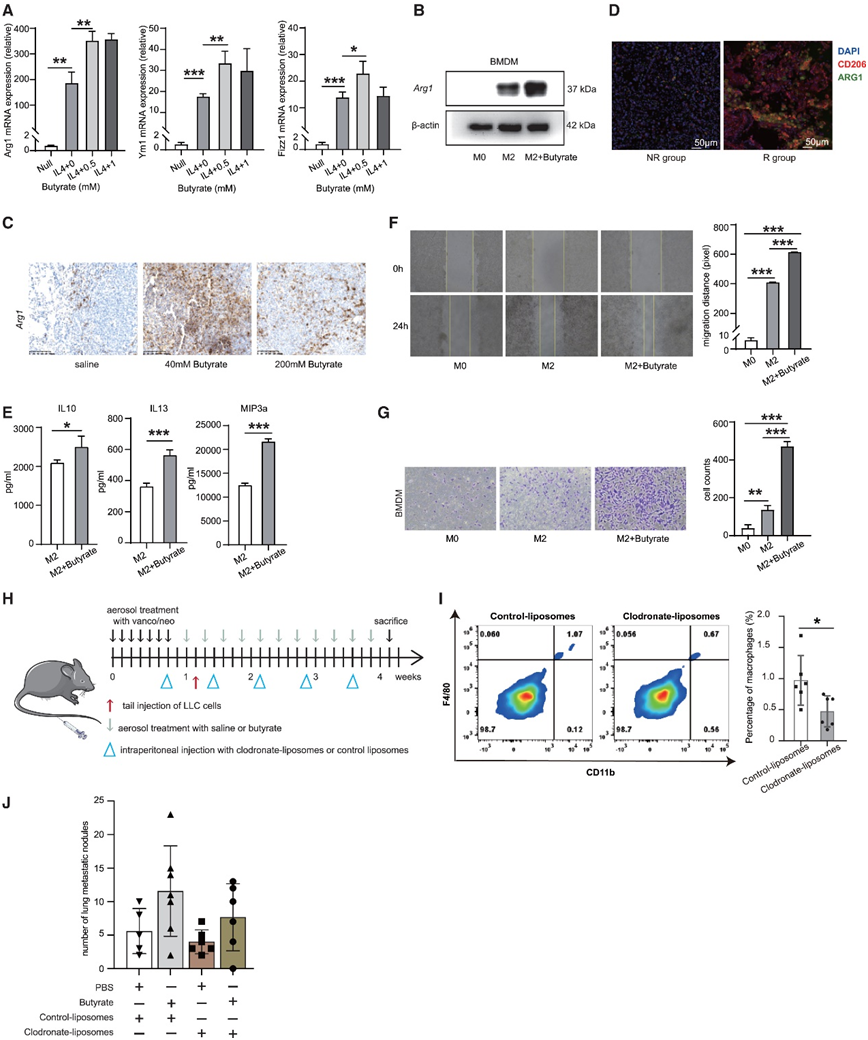
图6. 丁酸盐促进M2巨噬细胞极化和促侵袭功能。
(A) BMDM用不同浓度的丁酸盐处理 24 小时。(B) 免疫印迹分析。(C)用盐水或丁酸盐(40 或 200 mM)雾化的小鼠肺转移中Arg1的表达。(D) NR组和R组肿瘤组织中ARG1和CD206的共染色。(E) 在用丁酸盐处理的 M2 巨噬细胞的培养基中发现 IL-10、IL-13 和 MIP3a 升高。(F) 用来自用或不用丁酸盐 (0.5 mM) 处理的 BMDM 的培养基处理的 LLC 细胞的迁移能力。(G) 用来自用或不用丁酸盐 (0.5 mM) 处理的巨噬细胞的培养基处理的 LLC 细胞的侵袭能力。(H) C57BL/6 小鼠中的 LLC 尾静脉转移模型,通过氯膦酸盐脂质体去除巨噬细胞。(I)氯膦酸盐脂质体或对照脂质体处理小鼠外周血中巨噬细胞的检测。(J)巨噬细胞的去除减弱了丁酸盐的促转移功能。
+ + + + + + + + + + +
结 论
本项研究发现复发组的瘤内微生物组多样性较低,并且复发组的丁酸产生菌富集。肿瘤内微生物组特征和循环微生物组 DNA 可以准确预测 LC 复发。瘤内注射产生丁酸的细菌Roseburia可以促进皮下肿瘤的生长。从机制上讲,细菌来源的丁酸盐通过抑制 HDAC2 和增加 H19 启动子处的 H3K27 乙酰化并诱导 M2 巨噬细胞极化来增加肿瘤细胞中 H19 的表达,从而促进 LC 转移。巨噬细胞的消耗部分消除了丁酸盐的促进转移作用。本项研究结果为肿瘤内微生物组和 LC 转移之间的相互作用提供了理论依据,并表明肿瘤内微生物组的潜在预后和治疗价值。
+ + + + +



 English
English


