文献解读|Nat Aging(16.6):小鼠脑内皮的蛋白质组学揭示了衰老过程中囊泡运输途径的失调
✦ +
+
论文ID
原名:Proteomics of mouse brain endothelium uncovers dysregulation of vesicular transport pathways during aging
译名:小鼠脑内皮的蛋白质组学揭示了衰老过程中囊泡运输途径的失调
期刊:Nature Aging
影响因子:16.6
发表时间:2024.03.22
DOI号:10.1038/s43587-024-00598-z
背 景
与年龄相关的脑内皮细胞(BEC)功能下降对神经系统疾病有重要影响。BEC转录组的综合图谱已经可用,但缺乏蛋白质组分析的结果。
实验设计
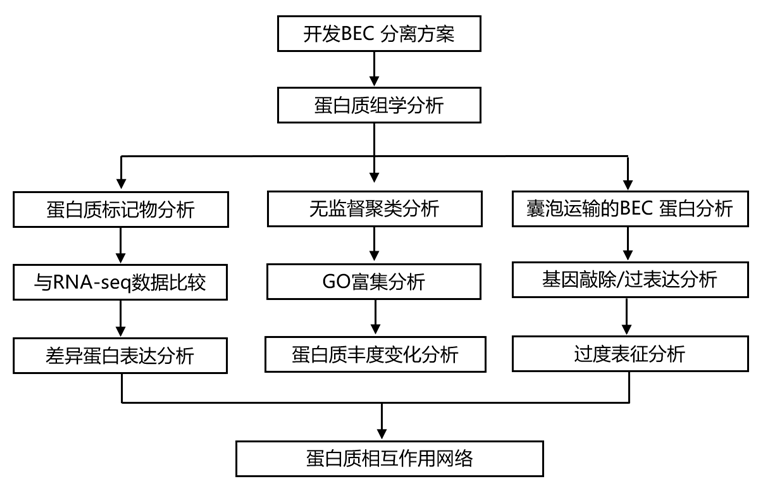
结 果
01
小鼠 BEC 衰老过程的蛋白质组学分析
为了评估小鼠 BEC 蛋白质组在衰老过程中的变化,研究团队首先开发了一种与 LC-MS/MS 兼容的 BEC 富集方案(图1a)。Cd31标记和磁激活细胞分选(MACS)导致表达粘附分子(Pecam1和Cdh5)和紧密连接标记物(Cldn5)的BEC富集(图1b)。从 3 个月大和 18 个月大的动物中分离的 BEC 显示出内皮细胞的超微结构特征,包括具有异染色质的细胞核和内皮突起(图1b)。对 3 个月大小鼠的分离 BEC 和全脑组织 (FT) 制剂进行 LC-MS/MS 分析,然后进行无标记定量 (LFQ),结果显示与 FT 相比,内皮标记物大量富集,包括 Nos3[差异倍数 (FC):1684.5]、BEC 中的 Cdh5(29.9)和 Pecam1(30.7)(图1c)。值得注意的是,他们的BEC、蛋白水平在3个月到18个月之间保持稳定。在其他细胞标记中,发现神经元(Map2)和胶质(Gfap)标记显著减少,胶质末端足标记(Aqp4)中度减少,周细胞(Anpep)标记蛋白部分富集。
对3月龄、6月龄、12月龄和18月龄小鼠分离的BEC进行蛋白质组学分析,共捕获4137个蛋白质。其中,将3754个蛋白鉴定为两个或两个以上的独特肽,其中2516个蛋白在所有年龄组的三个或三个以上的样品中定量。在衰老过程中,总共有850种蛋白质的丰度发生了显著变化(图1d)。与已发表的小鼠BEC RNA-seq数据的比较显示,两个数据集中有193个蛋白和相应的rna发生了显著改变(图1e)。值得注意的是,在老年小鼠(18月龄和19月龄)和幼年小鼠(3月龄)的比较中,显著改变的BEC蛋白和相应rna之间存在微弱但显著的相关性(图1e)。以3个月大的动物为参照,显著改变的蛋白质数量稳步增加,从3个(6个月)到57个(12个月)再到339个(18个月),这与之前对整个器官和BEC的bulk RNA-seq研究一致,这些研究发现,与年轻小鼠相比,老年小鼠中存在大量差异调节基因(图1f)。出乎意料的是,一些神经丝蛋白(Nefm、Nefl和Ina)和髓鞘膜蛋白(Mog、Mbp和Plp1)虽然在BEC中与FT相比明显减少,但在衰老过程中,BEC蛋白质组中的表达却上调(图1f)。对分离的BEC和脑毛细血管的免疫标记和电镜分析分别证实了Mbp的内皮定位和老化内皮对多层膜结构的吞噬(图1g)。这些结果与最近的研究结果一致,表明微血管内皮细胞充当“业余”吞噬细胞,吞噬髓磷脂碎片,并在衰老过程中促进神经丝的降解。
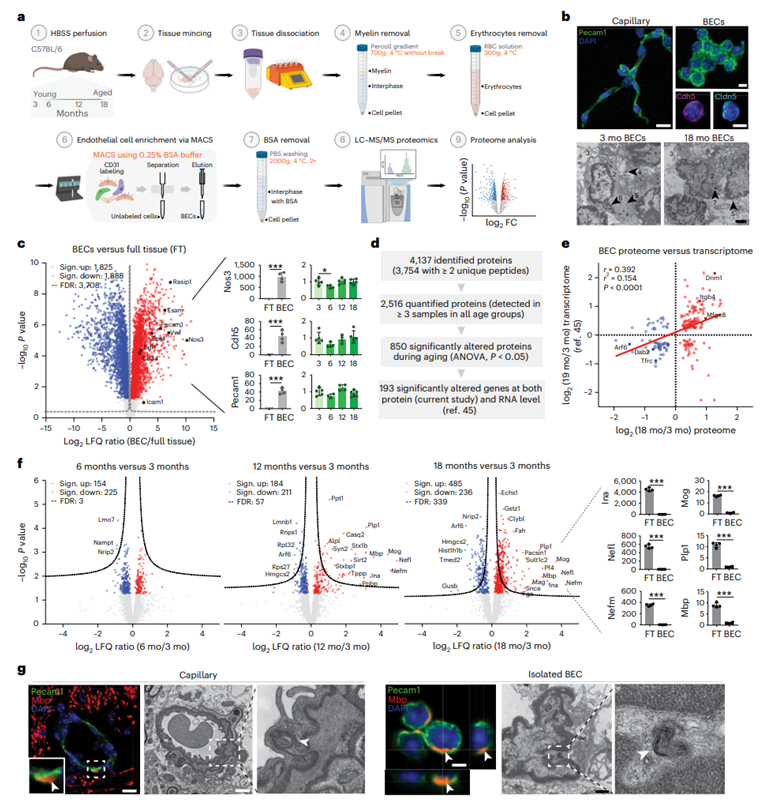
图1. 衰老过程中小鼠BEC的蛋白质组学分析。
(a) 用于蛋白质组学的BEC分离方案。 (b) ,上:CD31、Cdh5和Cldn5染色的分离毛细血管和BEC。下:3月龄和18月龄小鼠离体BECs的超微结构。(c) 左:为火山图,显示BEC制剂中内皮标记蛋白的富集程度。右:不同时间点BEC中Nos3、Cdh5和Pecam1蛋白的相对丰度。(d) LC-MS /MS和LFQ结果总结。(e) BEC蛋白组与转录组年龄相关变化的相关性。(f) 左:火山图显示BEC老化过程中蛋白质丰度的变化。右:BEC中神经丝和髓磷脂标记蛋白的相对丰度。(g) 老龄小鼠脑毛细血管和离体BEC中Mbp定位和多层膜结构吞噬的超微结构图像。
02
年龄相关蛋白表达动态
具有相似表达动态的基因证明具有相同的生物学功能。为了更详细地描述与年龄相关的 BEC 蛋白水平的时间概况,他们首先根据跨时间点(3 个月、6 个月、12 个月和 18 个月龄)的丰度模式对所有已识别的蛋白质进行聚类。使用贝叶斯非参数时间序列模型进行的无监督聚类揭示了 16 个聚类,其大小在 44 到 312 个已识别蛋白质之间变化,以及 6 到 119 个显著改变的蛋白质之间变化(图2a)。值得注意的是,几个最丰富的聚类在老化过程中的丰度动态表现出相反的趋势(图2b)。为了确定BEC蛋白动力学和功能之间可能的联系,他们使用基因本体(GO)分析根据其SL和生物过程(bp)对每个聚类中显著改变的蛋白进行了分类。如聚类1-4所示,这些聚类存在分离,并且SL和相应bp之间存在对齐(图2a)。
他们重点关注显著富集的bp,发现与“翻译”相关的蛋白质(例如Rpl和Rps)在第9聚类中富集超过5倍,其特征是在12个月大时暂时下调(图2a-c)。“RNA剪接”相关蛋白(例如Srsf)在聚类3中富集,直到18个月大时才出现持续下调。相反,与“氧化还原”相关的蛋白质(例如Prdx5)和“脂质代谢”(例如Fasn)在聚类4中富集,在18个月大时表现出显著的上调。与“细胞骨架组织”(如Vcl和Pxn)和“细胞粘附”(如Ctnnd1和Tjp1/2)相关的蛋白质在聚类2中富集,在6个月大时表现出暂时的下调。“囊泡介导的运输”蛋白(例如Arf6和Tmed2)在聚类3中富集,并在衰老过程中表现出持续的下调,而“囊泡/外泌体”SL在多个聚类中表现出不同的特征(图2a)。总的来说,这些结果表明了与年龄相关的蛋白质丰度动态和个体bp之间的密切联系,包括囊泡介导的运输途径。
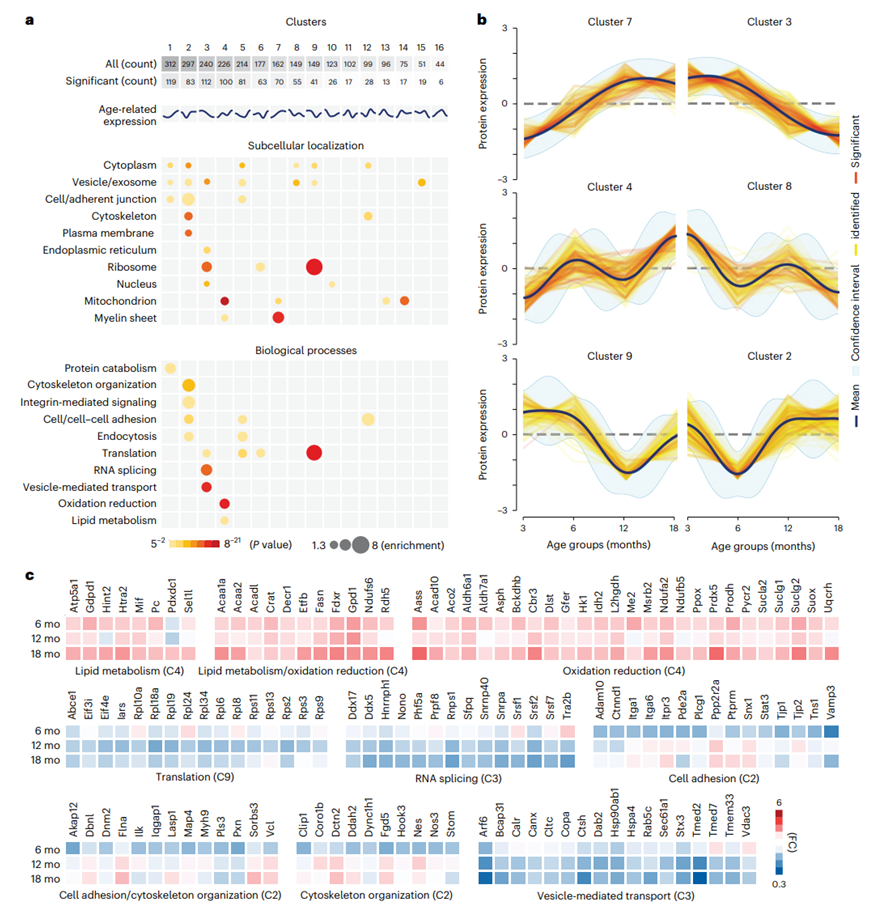
图2. BEC年龄相关蛋白动态的无监督聚类。
(a) 基于GO分析的显著改变蛋白聚类的SL和bp富集分析。(b) 变化的模式与年龄相关的蛋白质丰度变化。(c) 根据bp和按变化方向性排序的选择聚类的显著改变的蛋白质热图。
03
BEC 蛋白参与内皮囊泡运输
鉴于BECs在维持血脑屏障完整性方面的核心作用,以及最近的数据显示,从配体特异性受体介导到非特异性腔泡胞饮的年龄相关转变,他们接下来转向研究囊泡介导的转运蛋白和跨膜受体(图3a)。
聚焦于囊泡相关蛋白,他们发现随着年龄的增长,巨胞饮作用(Rhog)、动力蛋白介导的内吞作用(Dnm1)、胞吐作用(Rab3a)、多泡体形成(Ptpn23)和溶酶体降解(Scarb2和Ctsd)的主要调节因子上调,而囊泡包覆的主要蛋白(Arf6、Clta/c和Cav1)下调(图3a)。在20种胞吐相关蛋白中,16种蛋白是胞吐的正调节因子,且蛋白丰度增加,表明内皮老化过程中胞吐水平增加。内皮型一氧化氮合酶(Nos3),一种调节小窝蛋白介导的内吞作用的酶发生短暂下调。负责内质网和高尔基体之间运输的蛋白质,有些随着年龄的增长而增加了(比如Mia、Uso1和Vti1b),有些则减少了(比如Tmed2和Tmed7)。同时,一些调节细胞通过网格蛋白吸收物质的蛋白质也发生了变化,有些增加了(比如Pacsin1、Hip1r、Aak1和Ap2a1),有些则减少了(比如Dab2、Ap2a和Arf6)。关注内皮受体,他们发现整合素受体复合物的多个亚基(Itga3/7/v和Itgb3/4/8)和配体(Mfge8、Lamc1和Fga/Fgg)随着年龄的增长而上调,而转铁蛋白受体(Tfrc)、Itga1受体亚基和Lama5配体则表现出与年龄相关的短暂下调(图3a)。
接下来,他们探讨了与全脑脉管系统(BV)相比,BEC 中囊泡介导的运输的与年龄相关的蛋白质变化的特异性(图3b)。具体来说,Arf6、Tfrc、Tmed2、Cav1、Rhog 和 Scarb2 是 BEC 中最显著失调的蛋白质,但在衰老过程中 BV 没有显著改变。相比之下,Mfge8(乳脂球-EGF因子-8,也称为乳粘素)和Apoe在BEC和脑血管制剂中均显著上调(图3c-d),这与它们作为整合素受体复合物配体的作用一致。
BEC中下调最显著的蛋白是Arf6,它是网状蛋白依赖性、小泡蛋白依赖性和小泡蛋白非依赖性、小泡蛋白非依赖性内吞作用以及囊泡介导的跨膜受体和连接蛋白循环的关键调节因子(图3a)。为了验证Arf6水平的年龄相关性降低,他们对老年(18月龄)和幼年(3月龄)小鼠制备的分离BEC进行了免疫细胞化学处理。Arf6和Tfrc以及Pecam1的共染色证实了它们在衰老过程中bec-特异性的减少,并有一些证据表明在分离的老年BEC中Tfrc的细胞分布发生了变化(图3e)。相比之下,对分离的脑实质血管的Arf6和Tfrc以及胶原蛋白V的免疫细胞化学分析显示,没有明显的年龄相关改变(图3d-e)。
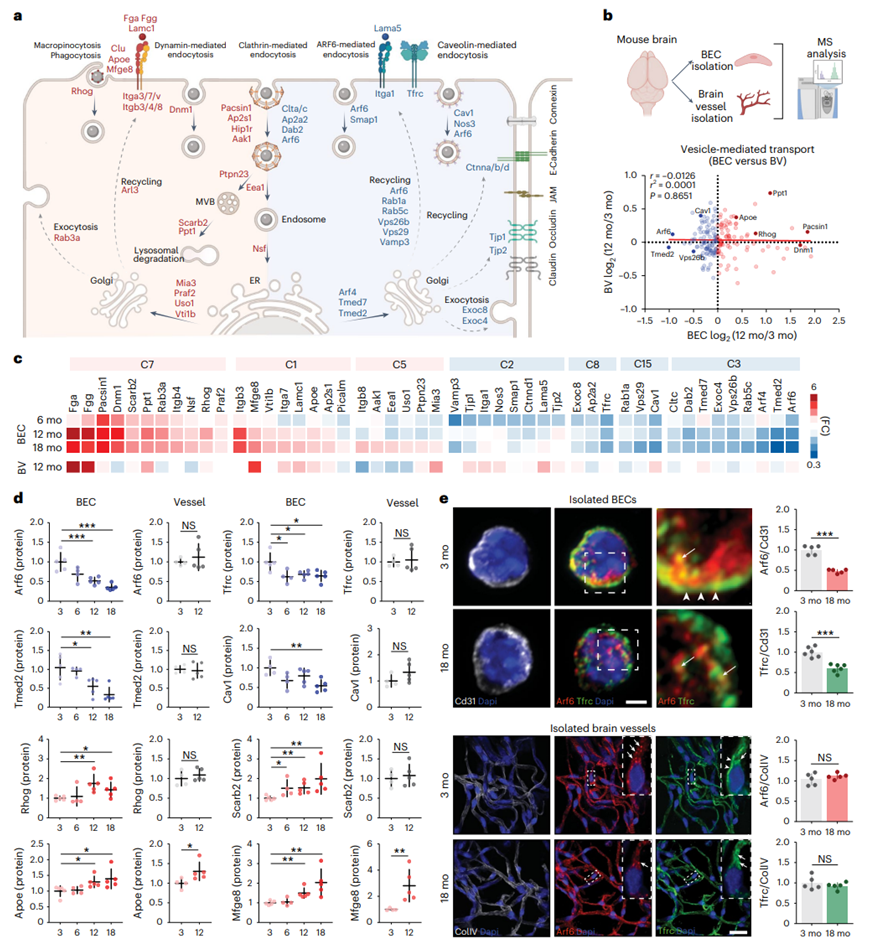
图3. 与囊泡运输相关的BEC蛋白的年龄相关变化。
(a) 内皮泡介导的运输途径和相关蛋白在衰老过程中在BEC中显著上调(红色)或下调(蓝色)。(b) 与整个BV相比,与囊泡运输相关的BEC蛋白没有表现出与年龄的相关性。(c) 年龄相关蛋白质组变化的比较。(d) 所选蛋白质的详细结果。(e) 免疫细胞化学和定量分析。
04
内皮 Arf6 和囊泡介导的转运途径
为了更好地了解 Arf6 在 BEC 中的作用,他们进行了基因敲除和过表达实验。首先对内皮细胞 (EC) 特异性 Arf6 缺陷的小鼠和源自 ARF6-KO 诱导多能干细胞 (iPSC) 的人诱导内皮细胞 (iEC) 进行蛋白质组分析(图4a-e)。他们发现EC-Arf6-KO BEC中Arf6水平降低了30%,而Arf6-ko iPSC中未检测到Arf6(图4b-f)。在BEC和iEC中,分别有312个和1724个蛋白发生了显著改变。对显著下调蛋白的富集分析显示,mRNA加工和剪接是两种模型中受影响最大的bp之一(图4c-g),这与在老化BEC蛋白质组中的发现一致(图2)。此外,在小鼠和人类中,染色质重塑和核小体组装相关蛋白也分别下调。
聚焦于囊泡介导的转运蛋白,他们发现在小鼠中,Arf6缺失后上调和下调的蛋白比例相似(图4b-d),而在Arf6缺失的iec中,上调蛋白的比例过高(图4f-h)。因此,他们在ARF6-KO iEC中进行了功能实验,发现内吞作用水平增加。虽然Arf6缺失,但是这种内吞作用的上调可能反映了代偿反应(图4j)。
为了进一步研究Arf6调节的后果,他们通过用BEC特异性Arf6-GFP-AAV或GFP-AAV(作为对照)感染小鼠进行过表达实验,然后进行BEC蛋白质组学研究(图4a)。为了验证病毒的特异性和病毒转导的效率,他们对GFP- aav处理的小鼠嗅球区域进行了免疫组织化学处理,发现45%的cd31标记的脉管系统是GFP阳性(图4i)。蛋白质组学分析证实BECs中Arf6水平增加了1.7倍(图4k)。对显著上调蛋白的富集分析显示,囊泡介导的转运、GTPase活性的激活和ER-to-Golgi囊泡介导的转运是受影响最显著的bp(图4k-m)。除小GTPase Arf6外,小GTPase结合蛋白Gga2和小GTPase激活蛋白Tbc1d20均上调。下调幅度最大的蛋白是Glb1,它是细胞衰老的标志(图4k)。Arf6在iECs中过表达,Arf6-GFP-AAV处理(与GFP-AAV处理相比)导致Arf6水平增加1.9倍(图4e)。
与Arf6-gfp-aav处理的小鼠一样,对显著上调蛋白的富集分析显示,囊泡介导的运输相关的通路是受影响最显著的bp之一(图4n-o)。具体而言,Arf6及其结合蛋白GGA2、DNM1L和保守的低聚高尔基(COG)复合物亚基COG5在小鼠和人体内均上调(图4m-p)。事实上,COG的几个亚基是iEC中最显著的上调蛋白之一(图4p)。
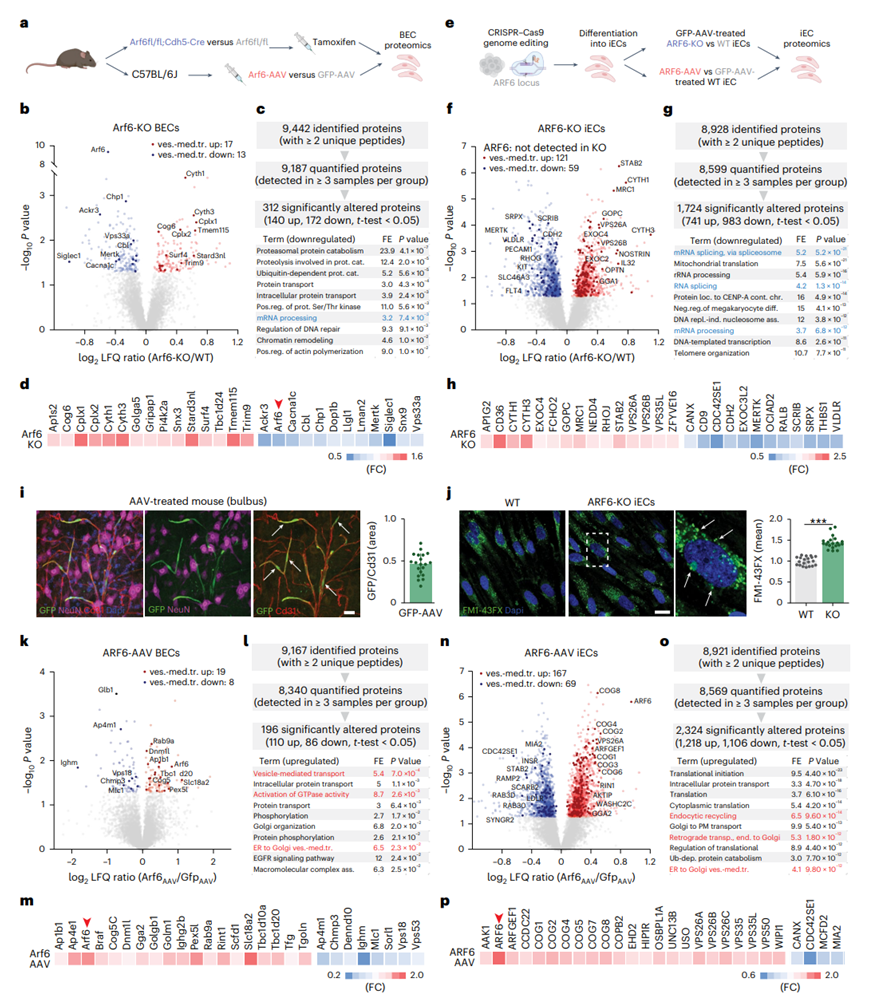
图4. 内皮细胞Arf6对囊泡转运和mRNA加工的影响。
(a)小鼠Arf6基因缺失及过表达实验。(b) 火山图显示了内皮Arf6缺陷小鼠和WT小鼠BEC蛋白丰度的差异。(c) LC-MS /MS结果总结及显著下调蛋白富集分析。(d) Arf6-KO小鼠BEC中27个最显著改变的囊泡介导转运蛋白的热图。(e) 人内皮细胞中Arf6基因缺失及过表达实验。(f) 火山图显示了Arf6缺失细胞和WT细胞之间蛋白质丰度的差异。(g) LC-MS /MS结果总结及显著下调蛋白富集分析。(h) Arf6-KO人类iec中27个最显著改变的囊泡介导转运蛋白的热图。(i) aav处理小鼠脑内皮重组蛋白表达的共聚焦验证。(j) iEC中FM1-43X内吞作用的共聚焦成像和定量。(k) 火山图显示了arf6处理和Gfp-AAV处理小鼠BEC蛋白丰度的差异。(l) LC-MS /MS和LFQ结果总结以及显著上调蛋白的富集分析。(m) 显著改变的囊泡介导转运蛋白的热图。 (n) 火山图显示了Arf6处理和GFP-AAV处理的人iec之间蛋白质丰度的差异。(o) LC-MS/MS结果总结及显著上调蛋白富集分析。(p) 前27个最显著改变的囊泡介导转运蛋白的热图。
05
Apoe 缺乏会导致 BEC 加速老化
为了探索与年龄相关的 BEC 蛋白质组变化与人类大脑疾病之间的潜在关系,他们接下来对疾病相关数据库应用了过度表征分析 (ORA)。关注在衰老过程中发生改变的BEC蛋白,他们发现与神经退行性疾病相关的通路过度表达(图5a)。这些疾病通路涉及阿尔茨海默病(AD)、帕金森氏病(PD)和血管性痴呆(VaD),这些疾病以前都与血管或内皮过程有关。总体而言,他们发现30个ad相关蛋白(23个上升,7个下降),34个pd相关蛋白(18个上升,16个下降)和9个vad相关蛋白(5个上升,4个下降)在衰老过程中显著失调(图5b)。虽然疾病相关性并不意味着这些蛋白是神经退行性疾病的直接诱因,但它们中的许多是已知的AD、PD或VaD的风险基因(例如App、Snca或Apoe)。Apoe和Tomm40在衰老过程中分别在BEC中上调和下调(图5b)。
鉴于Apoe在脑细胞老化中的作用以及Apoe缺乏导致内皮功能障碍,他们接下来比较了幼年(3月龄)Apoe-ko和野生型(WT)小鼠的BEC蛋白质组。通过蛋白质组学分析,Apoe-KO小鼠中111和103蛋白分别显著上调和下调(图5c)。将幼年Apoe- ko小鼠的BEC蛋白质组学特征与老年(18月龄)WT小鼠的BEC蛋白质组学特征进行比较,他们发现两者呈正相关,表明Apoe缺乏对BEC衰老有加速作用。值得注意的是,Arf6在年轻Apoe-KO小鼠中显著下调(图5d)。在幼年Apoe-KO和老年WT小鼠中,进一步观察到与内皮囊泡介导的运输有关的其他几种蛋白质的方向一致的变化(图5d-e)。
关注老年小鼠Arf6- Apoe相互作用网络,他们发现19和24个蛋白在18月龄时与3月龄相比显著改变(图5f)。囊泡转运蛋白Tgoln1(反式高尔基网络整体膜蛋白1)与Arf6和Apoe均有直接关系。值得注意的是,Mfge8和Apoe显示了多个共有连接,Arf6和Tfrc也是如此。此外,整合素(Itgav/b3)受体配体Mfge8、Lamc1和Fga/Fgg均与Apoe和Tgoln1有直接联系。
在 AD 相关蛋白中,他们发现 App(β 淀粉样蛋白前体蛋白)在 12 个月龄与 3 个月龄 BEC 老化过程中表达上调。此外,App处理蛋白Itm2b(整合膜蛋白2B)和Htra2(丝氨酸蛋白酶HTRA2)同样随着BEC老化而上调(图5b)。为了确定 Apoe 在内皮细胞中的细胞自主效应,他们接下来在人 iPSC 中应用基因组编辑以获得人Apoe-KO 系,并将这些细胞分化为 iEC(图5g-h)。蛋白质组学分析显示Apoe-KO 和 WT iEC 之间有 326 个显著改变的蛋白质(图5i)。对显著下调的蛋白质的富集分析显示,囊泡介导的转运和囊泡融合是受影响最显著的BP(图5j)。具体而言,在28种显著改变的囊泡介导的转运蛋白中,23种发生下调(图5k)。因此,他们发现Apoe-KO iEC中新形成的囊泡中FM1-43FX的内吞作用水平降低(图5l)。总的来说,体内研究结果强调了年龄相关的 BEC 蛋白质组变化与人类疾病的相关性,以及 3 个月大的 Apoe-KO 小鼠 BEC 加速衰老的特征。他们进一步表明 Apoe 对人内皮细胞具有细胞自主效应。然而,更全面地了解 Apoe 的 EC 自主调节需要进一步的实验。
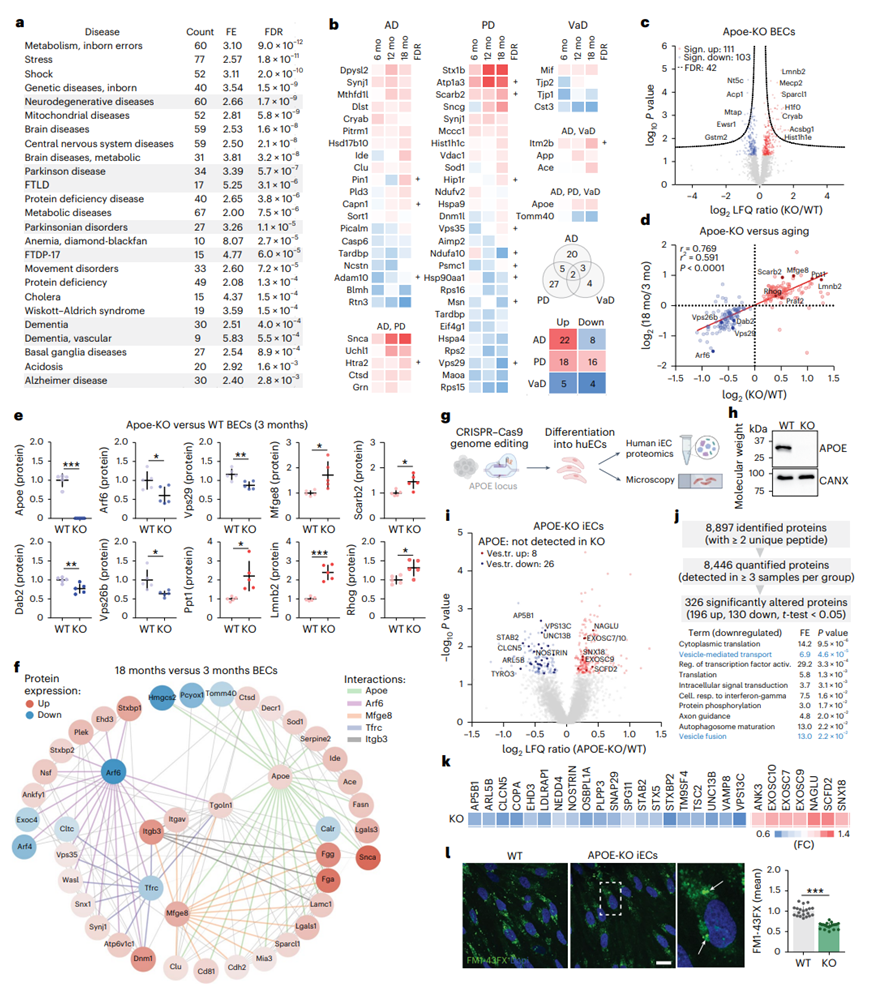
图5. Apoe缺乏导致加速BEC老化的蛋白质组学特征。
(a) 人类脑部疾病的ORA。(b) BEC衰老过程中AD、PD和VaD相关的个体蛋白变化。(c) 火山图显示3月龄apoe缺陷小鼠和WT小鼠BEC蛋白质组的差异。(d) 与3月龄WT动物相比,Apoe-KO和18月龄WT动物BEC中LFQ比率显著失调的相关性。(e) 3月龄Apoe-KO小鼠与WT小鼠所选蛋白的详细结果。(f) 与3月龄相比,18月龄BEC中Arf6和Apoe蛋白与相关蛋白的相互作用网络显著失调。(g) CRISPR-Cas9基因组编辑和人iPSC向iec的分化。 (h)免疫印迹分析。(i) 火山图显示Apoe-KO和WT iec之间蛋白质丰度的变化。(j) LC-MS /MS结果总结及显著下调蛋白富集分析。(k) 前27个最显著改变的囊泡介导转运蛋白的热图。(l) FM1-43X内吞作用的共聚焦成像和定量。
+ + + + + + + + + + +
结 论
本项研究开发了一种与蛋白质组学兼容的基于磁激活细胞分选的小鼠 BEC 富集方案,并解析了衰老过程中蛋白质丰度变化的概况。无监督的聚类分析揭示了与年龄相关的蛋白质动力学与生物学功能的分离,包括囊泡介导的运输的下调。内吞作用和受体再循环(最突出的是 Arf6)、巨胞饮作用和溶酶体降解的关键调节因子存在失调。在基因缺失和过表达实验中,Arf6 影响内皮细胞的内吞途径。对 Apoe 缺陷小鼠的 BEC 进行蛋白质组学分析,揭示了加速衰老的特征。本项研究结果为分析衰老过程中的 BEC 功能提供了新的理论依据。
+ + + + +



 English
English


