文献解读|Cancer Cell(48.8):整合血浆和粪便代谢组学可识别腺瘤-结直肠癌进展中的功能性代谢物,并作为早期诊断生物标志物
✦ +
+
论文ID
原名:Integrative plasma and fecal metabolomics identify functional metabolites in adenoma-colorectal cancer progression and as diagnostic biomarkers
译名:整合血浆和粪便代谢组学可识别腺瘤-结直肠癌进展中的功能性代谢物,并作为早期诊断生物标志物
期刊:Cancer Cell
影响因子:48.8
发表时间:2024.08.12
DOI号:10.1016/j.ccell.2024.07.005
背 景
微生物代谢物与结直肠癌 (CRC) 密切相关,结直肠癌是最常见的癌症类型之一,也是全球癌症死亡的主要原因。已有研究报道,CRC 患者体内促肿瘤发生的肠道代谢物包括氧化三甲胺 (TMAO) 和脱氧胆酸。结直肠癌患者体内的短链脂肪酸和吲哚衍生物却很少,而这些物质已知具有抗肿瘤功能,能够提高癌症治疗效果。目前尚不清楚粪便和血液代谢物在腺瘤-结直肠癌进展中是如何改变的,需要进一步研究来描述循环中的代谢物是否会影响 CRC 进展。
实验设计
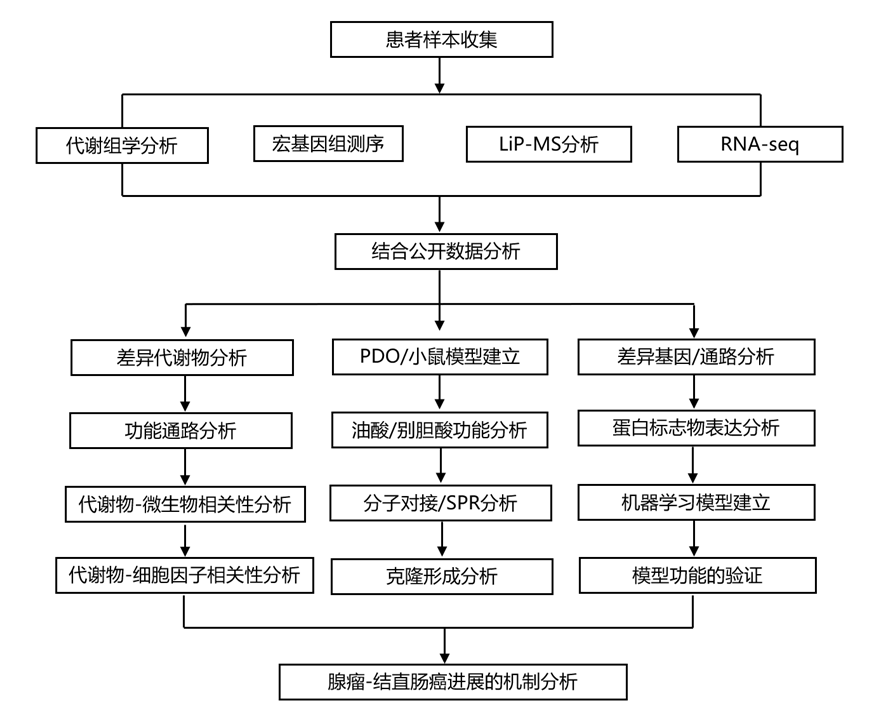
结 果
01
CRC 进展过程中血浆代谢物的变化
研究团队在发现队列中收集了 373 个血浆样本,其中包括 119 名 CRC 患者、143 名结直肠腺瘤 (CRA) 患者和 111 名健康个体[正常对照 (NC)]的样本,并进行代谢组学分析(图1)。
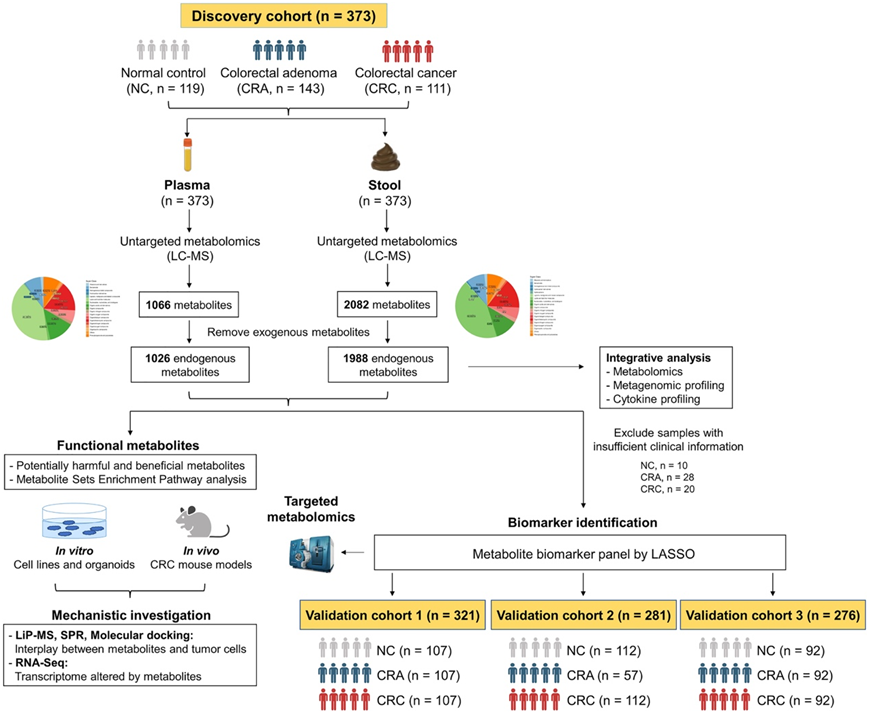
图1. 本研究工作流程示意图。
去除食物来源和外源性代谢物后,鉴定出 1026 种内源性代谢物,且CRC、CRA 和 NC 的血浆代谢组存在显著差异(图 2 A)。他们在 NC、CRA 和 CRC 之间发现了具有一致变化的差异血浆代谢物,其中 22 种代谢物沿腺瘤-结直肠癌进展依次富集,包括犬尿氨酸、二氢胸腺嘧啶和多种脂肪酸(例如油酸)(图2B-C)。他们还观察到 CRA 和 CRC 中 34 种依次耗竭的代谢物,包括别胆酸、L-组氨酸和脱氢表雄酮 (DHEA) 硫酸盐。此外,与非晚期腺瘤患者相比,晚期腺瘤患者血浆中的促肿瘤代谢物(包括犬尿氨酸和石胆酸甘氨酸结合物)明显富集,同时伴有脱氢表雄酮硫酸盐、苯酚和吲哚的消耗。
除了血浆代谢物外,在发现队列中还平行收集了373份粪便样本,他们进行了相同的非靶向 LC-MS 分析,鉴定了 1988 种内源性代谢物。CRC、CRA 和 NC 之间的粪便代谢组存在显著差异(图2D)。他们发现了在 NC、CRA 和 CRC 之间具有一致变化的差异粪便代谢物,其中 4 种代谢物沿腺瘤-结直肠癌进展依次富集,包括 melleolide M、花生四烯酸(脂肪酸(20:4)、羟基脂肪酸的脂肪酰酯 (FAHFA) 和鱼藤素(图 2 E)。他们还观察到 CRA 和 CRC 中 28 种依次消耗的代谢物,包括血栓素 E2、17a-羟基孕酮、鼠尾草酸和香草酸。
在接受化疗的 72 名 CRC 患者中评估了代谢物与治疗反应之间的相关性,其中包括 43 名应答者和 29 名无应答者,化疗应答者和无应答者的血浆代谢组存在显著差异(图2F)。在应答者中发现了硫酸雄酮、L-组氨酸和硫酸 DHEA 的富集,同时发现促肿瘤发生的犬尿氨酸、TMAO 和石胆酸甘氨酸结合物的消耗(图 2 G)。在调整临床参数后,19 种血浆代谢物可以区分化疗应答者与无应答者,ROC 曲线下面积 (AUC) 为 90.8%(敏感性 = 86.4%,特异性 = 83.3%)(图 2 H)。其中包括 5 种在应答者中富集的代谢物(例如硫酸雄酮和 13-L-过氧化氢亚油酸)和 14 种在应答者中耗竭的代谢物(例如甲基丙二酸、4-三甲基氨基丁酸和 hepoxilin B3)。因此,这些发现暗示了微生物代谢物对 CRC 化疗反应的影响。
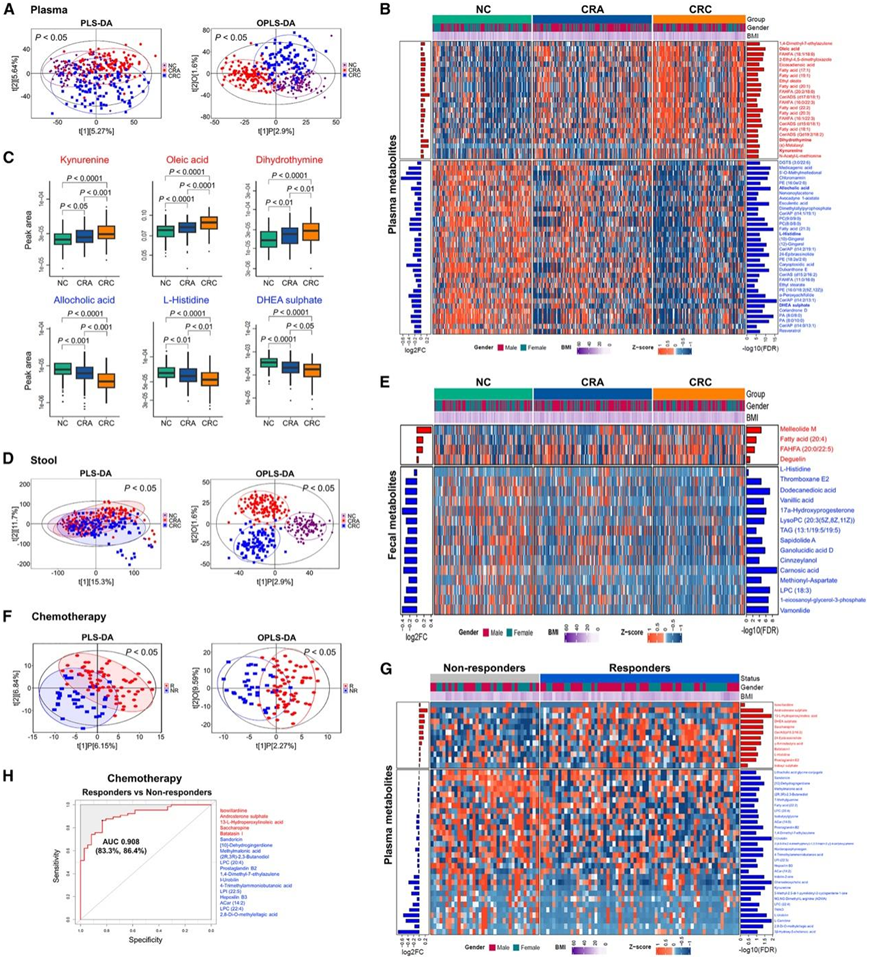
图2. CRC 进展过程中微生物代谢物的变化。
(A) CRC、CRA和 NC 的血浆代谢物分布。(B) 差异血浆代谢物热图。(C) 选定的差异血浆代谢物的特定峰。 (D) 粪便代谢物的分布。(E) 差异粪便代谢物的热图。(F)血浆代谢物分布。(G)差异血浆代谢物热图。(H) 19 种血浆代谢物生物标志物的受试者工作特征 (ROC) 分析,用于区分发现队列中化疗应答者和无应答者。
02
微生物代谢物在 CRC 进展阶段中的相关性和功能作用
为了深入了解 CRC 中改变的代谢物的功能意义,他们进行了代谢物功能富集分析。在血浆代谢物中,CRC 与 NC 相比,前 3 条差异通路是 (1) α-亚麻酸和亚油酸代谢、(2) 组氨酸代谢和 (3) 同型半胱氨酸降解(图 3 A)。CRC 粪便代谢组中前 3 条差异通路是 (1) 组氨酸代谢、(2) 丙氨酸代谢和 (3) 葡萄糖-丙氨酸循环(图 3 B)。然后评估了 CRC 与 NC 相比改变的代谢物和代谢通路的关联网络。CRC 血浆和粪便代谢组中的差异代谢物大多与脂质代谢有关,其中这些脂质代谢物与其他代谢物和代谢通路形成一个独立的聚类(图 3C-D)。此外,脂质代谢中的油酸和组氨酸代谢中的 L-组氨酸位于相关网络的中心,从而表明它们在 CRC 进展过程中的血浆和粪便代谢组中具有重要意义。
他们在 CRC 中确定了血浆和粪便代谢物之间 9 种显著相关的代谢物。这些包括 1,7-二甲尿酸、3-羧基-4-甲基-5-丙基-2-呋喃丙酸 (CMPF)、脱氢表雄酮硫酸盐、hoduloside VI、L-尿胆素、PE(20:5(5Z,8Z,11Z,14Z,17Z)/14:1(9Z))、PS(14:1(9Z)/14:1(9Z))、槲皮素 3-(6-[4-4-glucosyl-p-coumaryl]glucosyl)(1->2)-鼠李糖苷和isoscoparin 2''-(6-(E)-feruloylglucoside) 4'-葡萄糖苷(图3E)。
微生物代谢物与肠道微生物密切相关。为了分析肠道微生物群,他们对发现队列的粪便样本进行了宏基因组测序。结果显示,肠道微生物 α 多样性在 NC、CRA 和 CRC 之间显著降低(图 3 F)。在种水平,CRC相关的致病菌如微小微单胞菌(Parvimonas micra)、具核梭杆菌(Fusobacterium nucleatum)和消化链球菌(Peptostreptococcus sp.)持续富集,同时有益的毛螺旋菌(Lachnospiraceae bacterium)、Roseburia sp.和Faecalibacterium sp.显著降低(图3G)。
然后他们研究CRC中差异代谢物和肠道微生物之间的相关性,发现在CRC患者的血浆和粪便样本富集的代谢物都与CRC中富集的微生物呈正相关。相反,在CRC 样本耗竭的代谢物与CRC 样本中富集的微生物呈负相关。在血浆代谢物中,包括油酸在内的脂肪酸与在CRC样本中富集的微生物呈最显著的正相关。另一方面,F. nucleatum与所有血浆代谢物均呈显著的正相关(图 3 H)。
鉴于炎症是 CRC 进展的标志,他们通过对发现队列中的 80 个血清样本(29 个 CRC、29 个 CRA 和 22 个 NC)进行细胞因子分析来评估血浆代谢物和细胞因子之间的相关性。结果显示,促炎细胞因子如 CXCL10 和白细胞介素 (IL)-8 与富集代谢物(例如犬尿氨酸和油酸)呈正相关,或与耗竭代谢物(例如别胆酸和 L-组氨酸)呈负相关(图 3 I)。相反,抗炎 IL-4 和 IL-13 与富集代谢物呈负相关。
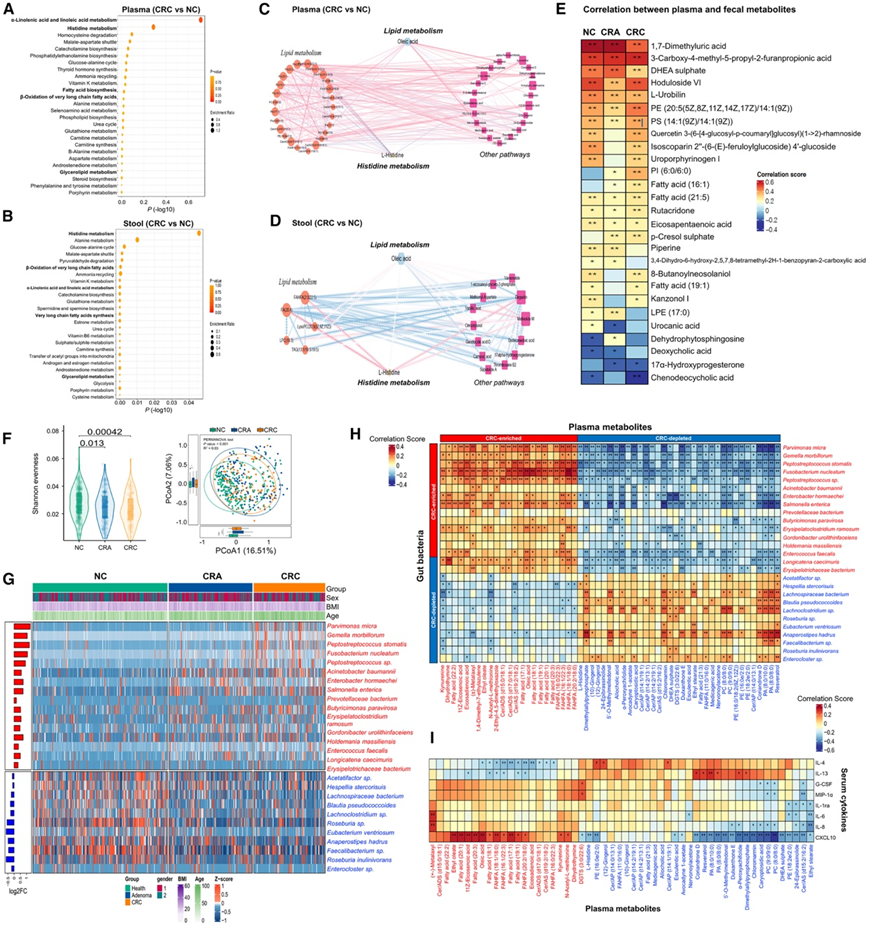
图3. 微生物代谢物在 CRC 进展阶段中的相关性和功能作用。
(A-B) 通过代谢物富集分析确定了 CRC 与 NC 相比血浆或粪便差异代谢物的功能通路。 (C-D) CRC 与 NC 相比的血浆或粪便代谢物之间的相关网络。(E) CRC 进展阶段中差异血浆和粪便代谢物之间的相关性。(F)粪便样本的辛普森多样性和 PCoA 分析。(G)差异肠道微生物热图。(H) CRC 与 NC 中差异血浆代谢物和肠道微生物之间的相关性。(I)差异血浆代谢物和细胞因子之间的相关性。
03
关键代谢物的体外功能验证
他们用在CRC 样本中富集的代谢物(包括油酸和二氢胸腺嘧啶)处理人 CRC 细胞系(HCT116、HT29 和 DLD-1)(图 2 C)。用油酸(50 μM)处理显著提高 CRC 细胞活力并减少 CRC 细胞凋亡(图 4 A-B)。油酸还导致合成(S)期 CRC 细胞显著增加,而 G1 期细胞显著减少(图 4 C)。此外,油酸处理后,CRC 细胞的增殖显著增强(图 4 D)。他们进一步用油酸处理 CRC 患者来源的类器官 (PDO),并观察到类器官生长增加(图4E)。别胆酸 (500 μM)处理显著降低了 CRC 细胞活力并促进CRC 细胞凋亡(图 4F-G)。它还诱导 CRC 细胞周期停滞并显著限制其增殖(图 4 H-I)。此外,别胆酸显著抑制了 CRC PDO 的生长(图 4 J)。
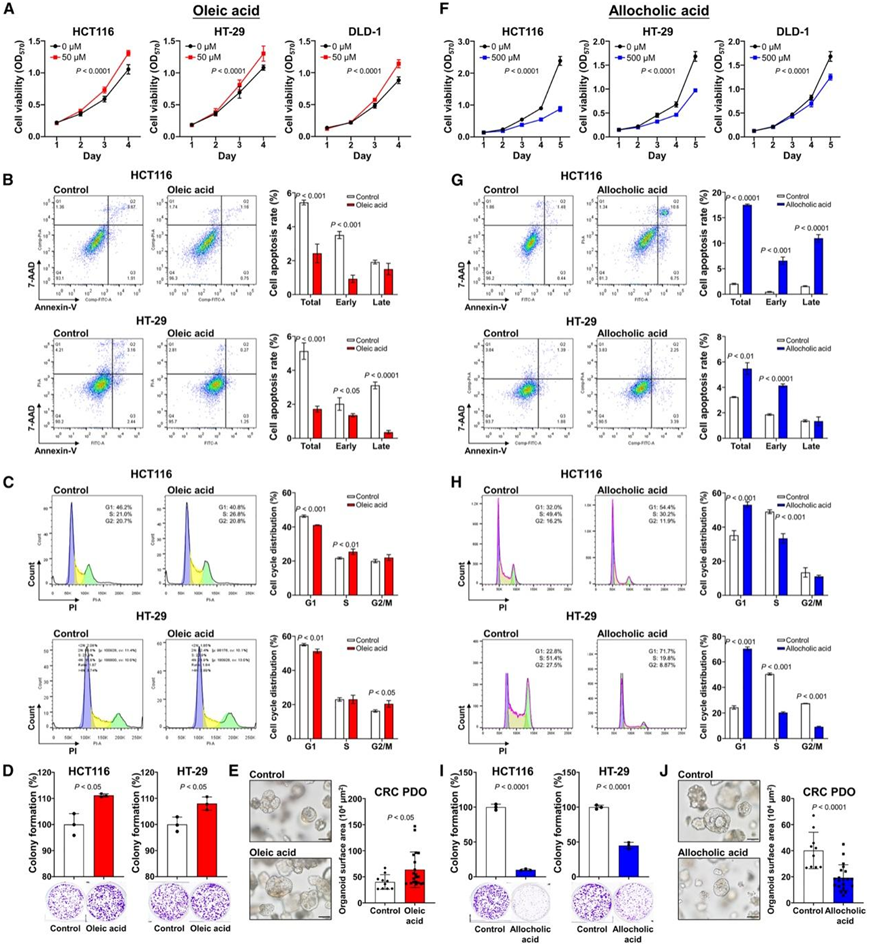
图4. CRC 相关关键代谢物的体外功能验证。
(A)细胞活力分析。(B-D) 油酸处理后的细胞凋亡、细胞周期和克隆形成检测。(E) 用油酸处理的CRC PDO的代表性图像和尺寸。(F- I) 异胆酸处理后的细胞活力、细胞凋亡、细胞周期和克隆形成分析。(J)用异胆酸处理的 CRC PDO 的代表性图像和大小。
04
小鼠中 CRC 肿瘤发生中关键代谢物的功能验证
他们利用致癌物氧化偶氮甲烷 (AOM) 加葡聚糖硫酸钠 (DSS) 建立了 CRC 肿瘤-小鼠模型(图 5 A)。在结肠镜检查下,用油酸处理的小鼠的结肠肿瘤明显更大(相比于对照组小鼠)。经过 6 周的处理后,与对照组相比,油酸显著增加了结肠肿瘤的大小和肿瘤负荷(图 5 B)。组织学评估证实了小鼠结肠肿瘤的发生(图 5 C),并且油酸处理显著增加了增殖细胞的比例(图 5 D)。
他们还向 AOM/DSS 诱导的 CRC 小鼠模型补充了别胆酸(图 5 E)。在 AOM/DSS 治疗的小鼠中,在结肠镜检查下用别胆酸治疗的小鼠中观察到的结肠肿瘤较少。与对照组相比,异胆酸处理的小鼠的肿瘤大小和肿瘤负荷显著降低(图 5 F),异胆酸处理后增殖细胞的比例也显著降低(图 5 G-H)。
接下来,他们建立了转基因Apc Min/+ CRC 肿瘤发生模型,并给这些小鼠补充了异胆酸(图 5 I)。在结肠镜检查下,用异胆酸治疗的小鼠中观察到结肠肿瘤较少。与 AOM/DSS 治疗小鼠的结果一致,与对照组相比,异胆酸显著降低了Apc Min/+小鼠的肿瘤大小和肿瘤负荷(图 5 J)。组织学检查证实了结肠肿瘤的发生(图 5 K),异胆酸处理降低了增殖细胞的比例(图 5 L)。L-组氨酸也减少了Apc Min/+小鼠的肿瘤大小和细胞增殖(图5L)。总之,他们从两种 CRC 肿瘤发生模型中获得的结果一致证明了促肿瘤发生的油酸和抗肿瘤发生的别胆酸和 L-组氨酸对 CRC 进展的影响。

图5. CRC小鼠模型中关键代谢物的功能验证。
(A-D) 补充油酸的 AOM/DSS 处理小鼠的实验示意图和结肠镜检查图像、结肠形态和肿瘤参数、结肠 H&E 图像以及结肠 Ki-67 图像和评分。(E-H) 补充了别胆酸的 AOM/DSS 处理小鼠的实验示意图和结肠镜检查图像、结肠形态和肿瘤参数、结肠 H&E 图像以及结肠 Ki-67 图像和评分。(I-L) 补充异胆酸的Apc Min/+小鼠的实验示意图和结肠镜检查图像、结肠形态和肿瘤参数、结肠 H&E 图像以及结肠 Ki-67 图像和评分。
05
CRC 中关键代谢物的结合受体的鉴定
为了探究代谢物如何与肿瘤细胞相互作用,他们对人类 CRC 细胞进行了有限蛋白水解-质谱 (LiP-MS) 分析(这是一种表征代谢物和蛋白质之间相互作用和结合位点的方法)。他们在 CRC 细胞中鉴定了 241 种可能与油酸结合的蛋白质肽,其中差异最大的肽是 α-烯醇化酶 (ENO1)(图 6 A)。分子对接分析表明,油酸通过烷基相互作用与 ENO1 的 Arg49 残基结合(平均结合能 = −6.28 kcal/mol)(图 6 B),解离常数为 10.6 μM(图 6 C)。
为了验证 ENO1 在油酸诱导的 CRC 中的功能性作用,他们在人 CRC 细胞(HCT116 和 HT-29)中沉默了 ENO1,并表明 ENO1-siRNA 消除了油酸在两种细胞系中的促肿瘤发生作用(图 6 D)。同样,ENO1 拮抗剂 AP-III-a4 抑制了细胞活力(图 6 E),这些结果证实了 ENO1 是 CRC 细胞中油酸的受体。
然后,他们对异胆酸处理的 CRC 细胞进行了 LiP-MS 分析,并揭示了最显著的差异肽是farnesoid X受体1 (FXR1)(图 6 F)。分子对接分析表明,异胆酸通过氢键与 FXR1 的 Arg70 残基结合(平均结合能 = −6.045 kcal/mol)(图 6 G),解离常数为 32.9 μM (图 6 H)。通过 CRISPR-Cas9或 RNA 干扰沉默人 CRC 细胞(HCT116和HT-29)中的 FXR1 后,异胆酸显著丧失其抗肿瘤作用(图 6 I)。FXR1 拮抗剂甘氨酸-β-鼠胆酸也消除了异胆酸的保护作用(图 6 J)。此外,FXR1-sgRNA或 FXR1 拮抗剂均抑制了细胞增殖(图 6 K-L)。与体外观察结果一致,异胆酸的保护作用通过与 FXR1 拮抗剂联合治疗而发生消除,与仅接受异胆酸的小鼠相比,肿瘤生长和肿瘤重量显著增加(图 6 M)。因此,这些结果表明着异胆酸对 CRC 的保护作用取决于 FXR1。
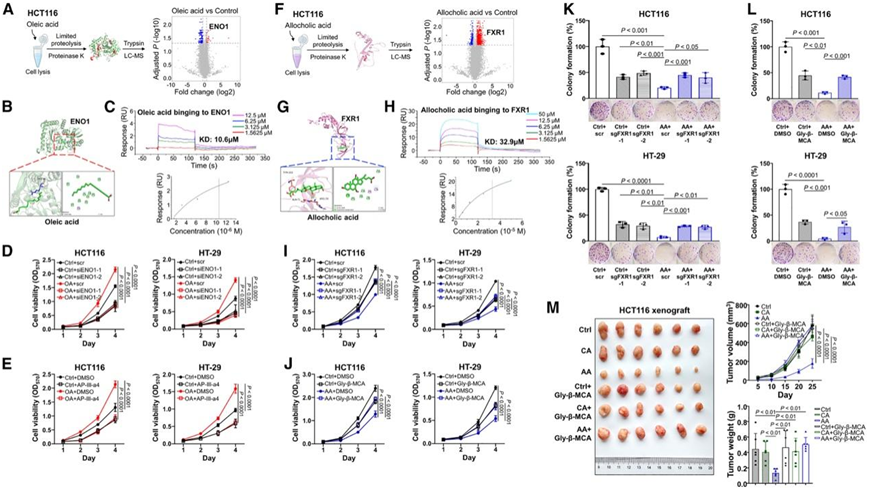
图6. CRC 中关键代谢物的结合受体的鉴定。
(A) LiP-MS实验示意图及油酸处理后CRC细胞中差异肽的火山图。 (B-C) 油酸和 ENO1 结合的分子对接分析和表面等离子体共振(SPR)分析。 (D-E)细胞活力分析。(F) CRC 细胞经异胆酸处理后差异肽的实验示意图和火山图。(G-H) 别胆酸和 FXR1 结合的分子对接分析和 SPR 分析。(I-J)细胞活力分析。(K-L)克隆形成分析。(M)肿瘤参数分析。
06
鉴定 CRC 中关键代谢物改变的信号通路
为了进一步阐明潜在机制,他们对人 CRC 细胞进行了转录组分析(RNA-seq)。在油酸处理的细胞中鉴定出 127 个上调基因和 135 个下调基因。通路分析(KEGG 和 GSEA)显示,PI3K/Akt 是油酸诱导的最富集通路(图 7 A)。油酸持续增加人 CRC 细胞(HCT116、HT-29)中磷酸化 JAK1、PI3K 和 AKT 的蛋白质表达,而这种上调由 ENO1-siRNA 或 ENO1 拮抗剂 AP-III-a4 逆转(图 7 B)。在油酸处理的 AOM/DSS 处理的小鼠的结肠肿瘤组织中证实了 PI3K/Akt 通路标志物的蛋白质表达增加(图 7 C)。这些发现表明,油酸与 CRC 细胞中的 ENO1 结合从而激活致癌 PI3K/Akt 信号通路。
另一方面,异胆酸处理导致人类 CRC 细胞中 36 个基因显著上调,141 个基因下调,MAPK 是异胆酸诱导的最大耗竭通路(图 7D)。异胆酸显著降低人类 CRC 细胞(HCT116、HT-29)中 MAPK 通路标志物的蛋白质表达以及细胞增殖(PCNA)和细胞周期(Cyclin D1)标志物,而这种下调可由 FXR1-sgRNA、FXR1 拮抗剂甘氨酸-β-鼠李酸(图 7E)或 FXR1-siRNA 逆转。这些 MAPK 通路蛋白质标志物在用别胆酸处理的 AOM/DSS 小鼠的结肠肿瘤组织中也发生下调(图 7 F),表明别胆酸与 FXR1 结合导致 CRC 中 MAPK 信号失活。
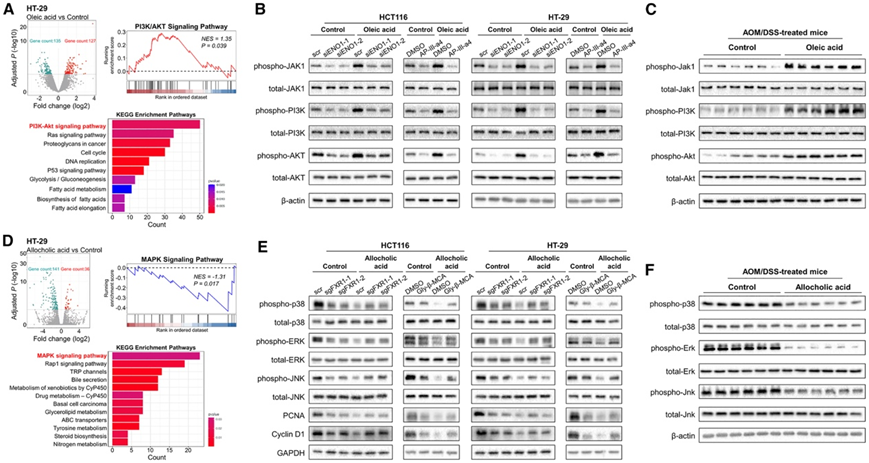
图7. CRC 中关键代谢物改变的信号通路识别。
(A) 油酸处理后 CRC 细胞中差异基因和通路分析(KEGG 和 GSEA)的火山图。(B-C) CRC 细胞或 AOM/DSS 治疗小鼠的结肠肿瘤组织中 PI3K/Akt 通路标志物的蛋白质表达。(D) 异胆酸处理后CRC细胞中差异基因和通路分析的火山图。(E-F) CRC 细胞或 AOM/DSS 治疗小鼠结肠肿瘤组织中细胞增殖、细胞周期或 MAPK 通路标志物的蛋白质表达。
07
血浆代谢物在 CRC 诊断中的表现优于粪便代谢物
接下来,他们在排除临床信息不足的样本后,研究了代谢物作为发现队列中 CRC 和 CRA 诊断生物标志物的应用(图 1)。利用已鉴定的差异血浆代谢物,建立了多种机器学习模型(LASSO 和随机森林)和逻辑回归模型,用于将 CRC 与 NC 个体进行分类。在调整年龄、性别、体重指数 (BMI) 和肿瘤位置等临床参数后,一组包含 17 种血浆代谢物生物标志物在区分 CRC 与 NC 方面表现出色,LASSO 的 AUC 为 0.927(敏感性 = 80.2%,特异性 = 93.6%)(图 8 A)。他们评估了该模型在 CRC 不同阶段分类中的表现。该模型具有 0.958 的 AUC,可区分早期 CRC(I/II 期)和 NC(敏感性 = 89.5%,特异性 = 90.9%)(图 8 A)。它在区分 CRC 和 CRA 方面也表现出色,AUC 为 0.928(敏感性 = 89.0%,特异性 = 88.7%)。
他们建立了一个独立的验证队列(验证队列 1)来验证该模型性能(图 1)。该组区分 CRC 与 NC 的 AUC 为 0.987(敏感性 = 99.1%,特异性 = 88.4%),区分验证队列 1 中的早期 CRC(I/II 期)与 NC 的 AUC 为 0.988(敏感性 = 96.3%,特异性 = 92.0%)(图 8B)。它在区分 CRC 与 CRA 方面也表现出色,AUC 为 0.869(敏感性 = 78.6%,特异性 = 87.7%)。
然后他们在另一个独立的验证队列(验证队列 2)中检测了该模型的性能。正如预期的那样,该模型在验证队列 2 中区分 CRC 与 NC 方面表现出色,AUC 为 0.848(敏感性 = 78.5%,特异性 = 81.3%),在区分早期 CRC(I/II 期)与 NC也表现出色,AUC 为 0.860(敏感性 = 81.5%,特异性 = 78.5%)(图 8 C)。还检测了其区分 CRC 与 CRA 的性能,AUC 为 0.861(敏感性 = 76.6%,特异性 = 81.3%)。
为了确保地区差异不会影响结果,他们进一步建立了一个来自独立地区的验证队列(验证队列 3),以进一步检测该模型的性能。该组区分 CRC 与 NC 的 AUC 为 0.909(敏感性 = 84.5%,特异性 = 88.8%),区分验证队列 3 中的早期 CRC(I/II 期)与 NC 的 AUC 为 0.920(敏感性 = 94.0%,特异性 = 80.0%)(图 8 D)。它在区分 CRC 与 CRA 方面也表现出色,AUC 为 0.928(敏感性 = 77.6%,特异性 = 94.0%),与其他队列的结果一致。因此,发现队列和三个验证队列之间的一致发现证实了该模型在 CRC 诊断中的表现。

图8. 血浆代谢物组作为 CRC 不同阶段的诊断生物标志物。
(A)对 LASSO 选择的 17 种血浆代谢物生物标志物进行接收者操作特性 (ROC) 分析。 (B-D)验证队列分析。
+ + + + + + + + + + +
结 论
本项研究从四个独立队列(422 例 CRC、399 例结直肠腺瘤 [CRA] 和 430 例正常对照 [NC])中收集了血浆和粪便样本。通过代谢组学分析,鉴定出在 NC、CRA 和 CRC 中具有一致变化的特征血浆和粪便代谢物。油酸在 CRC 细胞、患者来源的类器官和两种小鼠 CRC 模型中表现出促肿瘤发生作用,而异胆酸具有相反的作用。通过综合分析,他们发现油酸或异胆酸分别直接与 CRC 细胞中的 α-烯醇化酶或 farnesoid X受体-1 结合,从而调节与癌症相关的通路。在临床上,他们建立了一个由 17 种血浆代谢物组成的模型,可准确诊断 CRC(AUC = 0.848-0.987)。
+ + + + +



 English
English


