文献解读|Adv Sci(15.1):多组学分析揭示小鼠和人类卵母细胞衰老的转化景观和调控
✦ +
+
论文ID
原名:Multi-Omics Analysis Reveals Translational Landscapes and Regulations in Mouse and Human Oocyte Aging
译名:多组学分析揭示小鼠和人类卵母细胞衰老的转化景观和调控
期刊:Advanced Science
影响因子:15.1
发表时间:2023.07.03
DOI号:10.1002/advs.202301538
背 景
减数分裂的异常恢复和卵母细胞质量下降是母亲衰老的标志。转录沉默在衰老减数分裂恢复过程中发挥着至关重要的作用。然而,对衰老相关转化特征和潜在机制的了解是有限的。
实验设计
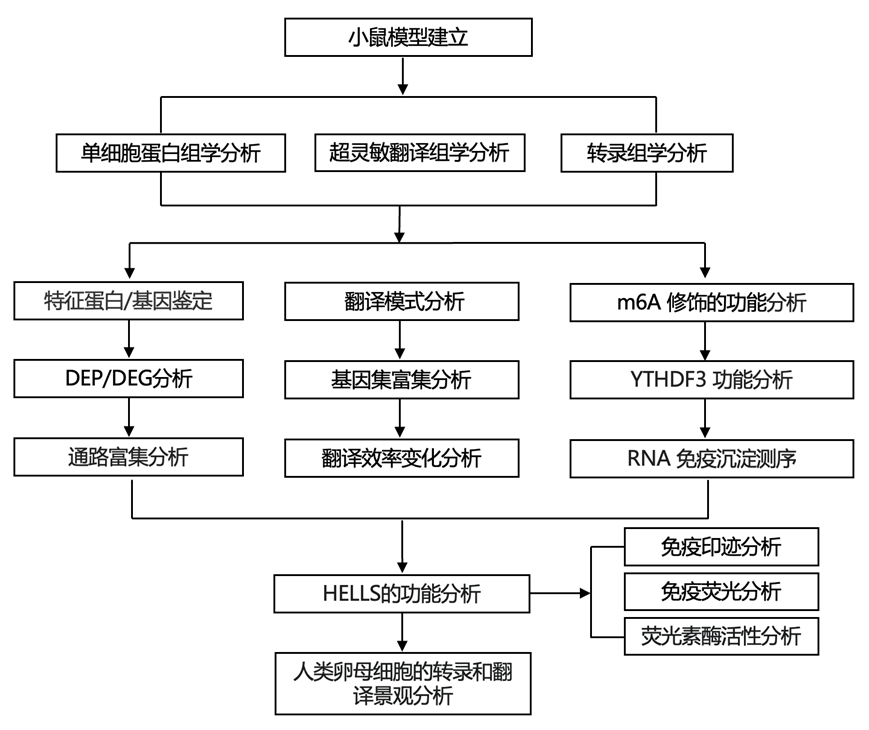
结 果
01
老年和年轻小鼠卵母细胞的多组学分析
为了更好地了解导致老年卵母细胞质量/能力下降的潜在机制,研究团队对年轻和老年雌性小鼠的生殖囊泡(GV)期卵母细胞应用了单细胞蛋白质组分析、超灵敏翻译组学分析和转录组学分析(RNA-seq)(图 1a)。他们在年轻和衰老小鼠卵母细胞中分别检测到约 10 741 个基因,这些基因积极参与翻译过程,这些数量比单细胞蛋白质组学分析检测到的蛋白质数量高出大约 10 倍。更重要的是,超过90%的年轻小鼠GV蛋白和88%的老年小鼠GV蛋白通过翻译组学分析检测到(图 1b-c),表明翻译组学在卵母细胞研究中具有更高的灵敏度和覆盖率。此外,他们还比较并鉴定了单细胞蛋白质组学、翻译组学和转录组学鉴定的下调或上调蛋白质/基因的重叠。与转录组学相比,翻译组学分析检测到的基因表达变化趋势与老年小鼠卵母细胞的蛋白质组学更加一致(图 1d-e)。这些发现表明,翻译组是比转录组更好的工具,可用于研究母体衰老过程中卵母细胞的蛋白质表达。
接下来,他们分别绘制散点图和火山图,以表示老年小鼠卵母细胞中通过蛋白质组学、翻译组学和转录组学鉴定的活化和抑制的蛋白/基因(图1f-h)。与转录组学数据相比,在翻译组学数据中,衰老卵母细胞和年轻卵母细胞之间的差异要大得多,这与哺乳动物卵母细胞减数分裂成熟过程中转录沉默的经典理论相一致。KEGG分析显示,在老年小鼠卵母细胞中,“核糖体”和“自噬”通路持续富集了多种差异表达蛋白/基因(DEP/DEG)。然而,值得注意的是,翻译组学分析提供了更丰富的通路富集信息,并表明老年卵母细胞中的翻译失调与“孕酮介导的卵母细胞成熟”、“同源重组”和“卵母细胞减数分裂”相关(图1i-k)。

图1. 老年和年轻小鼠卵母细胞的单细胞蛋白质组学、超灵敏翻译组学和转录组学分析。
(a) 描绘老年和年轻小鼠 GV 卵母细胞多组学分析主要程序的示意图。(b-c) 单细胞翻译组、RNA-seq和蛋白质组鉴定基因在年轻小鼠卵母细胞和老年小鼠卵母细胞中检测到的基因的Venn图。(d) 维恩图显示从超灵敏翻译组学 (FC<0.67)、RNA-seq (FC<0.67) 和蛋白质组 (FC<0.83) 检测到的老年小鼠 GV 卵母细胞中下调基因的重叠。(e) 维恩图显示从超灵敏翻译组学 (FC>1.5)、RNA-seq (FC>1.5) 和蛋白质组 (FC>1.2) 检测到的老年小鼠 GV 卵母细胞中上调基因的重叠。(f) 散点图显示老年和年轻小鼠 GV 卵母细胞之间差异表达的蛋白质。(g-h) 火山图显示超灵敏翻译组学和转录组学检测到的 DEG。 (i-k) 通过蛋白质组学、翻译组学和 RNA-seq检测到的差异表达蛋白质/DEG 的代表性 KEGG 分析。
02
衰老小鼠卵母细胞的翻译动力学
为了更好地表征母体衰老过程中卵母细胞的翻译和转录动态,他们接下来对通过翻译组学和转录组学检测到的老年和年轻卵母细胞的基因表达数据进行了组合分析(图 2a)。值得注意的是,基因翻译和转录之间的Pearson相关系数仅为 0.1328。大多数老年卵母细胞特异性翻译抑制(II类,1885个基因)或富集(III类,1770个基因)基因具有恒定的转录表达,这与完全生长的卵母细胞转录失活的传统理论一致(图2a)。此外,他们将基因集富集分析(GSEA)应用于衰老卵母细胞中的这些差异翻译基因。具体而言,GSEA 证明,在衰老的小鼠卵母细胞中,氧化磷酸化通路在活跃翻译的基因中富集,而 G2/M 检查点过程在翻译抑制的基因中富集,这表明衰老卵母细胞中氧化应激增加和减数分裂停滞可能归因于翻译失调(图 2b)。
线粒体损伤和 DNA 修复装置功能障碍在与年龄相关的卵母细胞减数分裂错误中发挥着关键作用。因此,他们进一步分析了减数分裂调控因子的表达。有趣的是,老年小鼠卵母细胞中减数分裂相关基因(包括Brca1、Brca2、Sgo2a、Sirt1和Dnmt1)的翻译水平显著下降,而转录水平保持不变(图2c)。与之前的报道一致,DNA甲基化的关键调节因子,如Dnmt3a/3b、Dnmt1和Uhrf1的翻译水平在衰老的卵母细胞中显著降低(图2d)。值得注意的是,DNA甲基化的建立和RNA降解的调节在很大程度上与组蛋白修饰相关。例如,由KDM1A或KDM1B引起的组蛋白3赖氨酸4 (H3K4)去甲基化对于CpG岛甲基化的及时建立是必不可少的。
由于翻译组学与转录组学的相关性较低,他们进一步分析了老年和年轻小鼠卵母细胞中高表达基因的翻译效率(TE),发现大量基因的翻译效率受到抑制,4094个基因和2610个基因在老年小鼠卵母细胞中分别下调和上调(图2e)。2567个年轻卵母细胞GV富集基因的TE>2 (high-TE),而只有1093个老年卵母细胞GV富集基因的TE>2,表明老年小鼠卵母细胞中high-TE基因的数量急剧减少。另一方面,年轻卵母细胞中TE<0.5(low-TE)的基因数量(1093个基因)与老年卵母细胞中的相似(855个基因)(图 2f),表明老年小鼠卵母细胞中的TE抑制通常发生在具有high-TE 的基因中。接下来,他们比较了老年和年轻小鼠卵母细胞中的high-TE基因,发现只有414个基因重叠(图 2g)。

图2. 老年和年轻小鼠 GV 卵母细胞的不同翻译模式。
(a) 散点图显示卵母细胞衰老过程中基因翻译和转录的变化。(b) 翻译组学的基因集富集分析显示,翻译下调基因富含 G2/M 检查点标志,翻译上调基因富含氧化磷酸化标志。 (c) 火山图显示翻译组学鉴定的卵母细胞减数分裂相关基因的变化。(d) 火山图显示翻译组学鉴定的 DNA 甲基化调控基因的变化。 (e) 散点图显示老年小鼠卵母细胞与年轻小鼠卵母细胞相比的 RNA 翻译效率(TE)变化。(f) 条形图分别显示年轻和老年小鼠 GV 卵母细胞中high-TE 基因 (TE>2) 和low-TE 基因 (TE<0.5) 的数量。 (g) 维恩图显示从年轻和老年小鼠 GV 卵母细胞中鉴定出的high-TE 基因的重叠。
03
N6-甲基腺苷 (m6A) 修饰在TE调控中的作用
然后,他们试图了解TE是如何在老年小鼠卵母细胞中翻译下调的。m6A是真核生物中最常见的RNA修饰,在调节RNA翻译中起着关键作用,他们发现m6A富集的RNA TE在衰老小鼠卵母细胞中整体下降(图3a-b)。此外,在比较年轻卵母细胞与老年卵母细胞TE时,只有m6A修饰RNA的TE在年轻卵母细胞与老年卵母细胞之间有显著差异,老年卵母细胞TE较低,而未发生m6A修饰的RNA TE无明显变化(图3c)。更重要的是,老年小鼠卵母细胞中high-TE m6A修饰基因的丰度急剧下降,而low-TE m6A富集基因和未受m6A修饰的high/low-TE基因的数量在老年和年轻卵母细胞中相似(图 3d)。此外,75% 的年轻卵母细胞特异性high- TE 转录本包含 m6A 修饰(图 3e)。因此,这些结果揭示了 m6A 修饰在衰老过程中小鼠卵母细胞翻译调节中的重要作用。
特别是,细胞质多腺苷酸元件(CPE)和多腺苷酸信号(PAS)的存在对于翻译调控至关重要。CPE 和 papCPE(PAS 100 bp 内的 CPE)在完全生长的卵母细胞中具有累积翻译抑制作用。在这项研究中,对卵母细胞衰老过程中 CPE 和 TE 变化的分析显示没有或低相关性。但是papCPE 的转录本中的 TE 发生显著抑制(图 3f)。有趣的是,他们发现大多数含有 papCPE 的基因都经过 m6A 修饰。papCPE 的抑制作用与 m6A 修饰相关(图 3g)。对于未经过 m6A 富集的 RNA,这种抑制作用要弱得多(图 3g)。因此,这些发现也强调了 m6A 在翻译调控中的关键作用。
之后,他们又评估了老年和年轻小鼠卵母细胞中 m6A 相关基因的转录和翻译表达水平。值得注意的是,大多数 m6A的 “writer” 和 “reader”(包括Wtap、Mettl14、Ythdc1、Ythdc2、Ythdf2和Ythdf3)的翻译水平在衰老的小鼠卵母细胞中显著降低,而它们的转录保持恒定(图 3h)。特别是,Wtap、Ythdf2和Ythdf3的基本翻译水平最为丰富(图 3h)。总体而言,在衰老的小鼠卵母细胞中,m6A 修饰在 RNA TE 下调中发挥着关键作用。
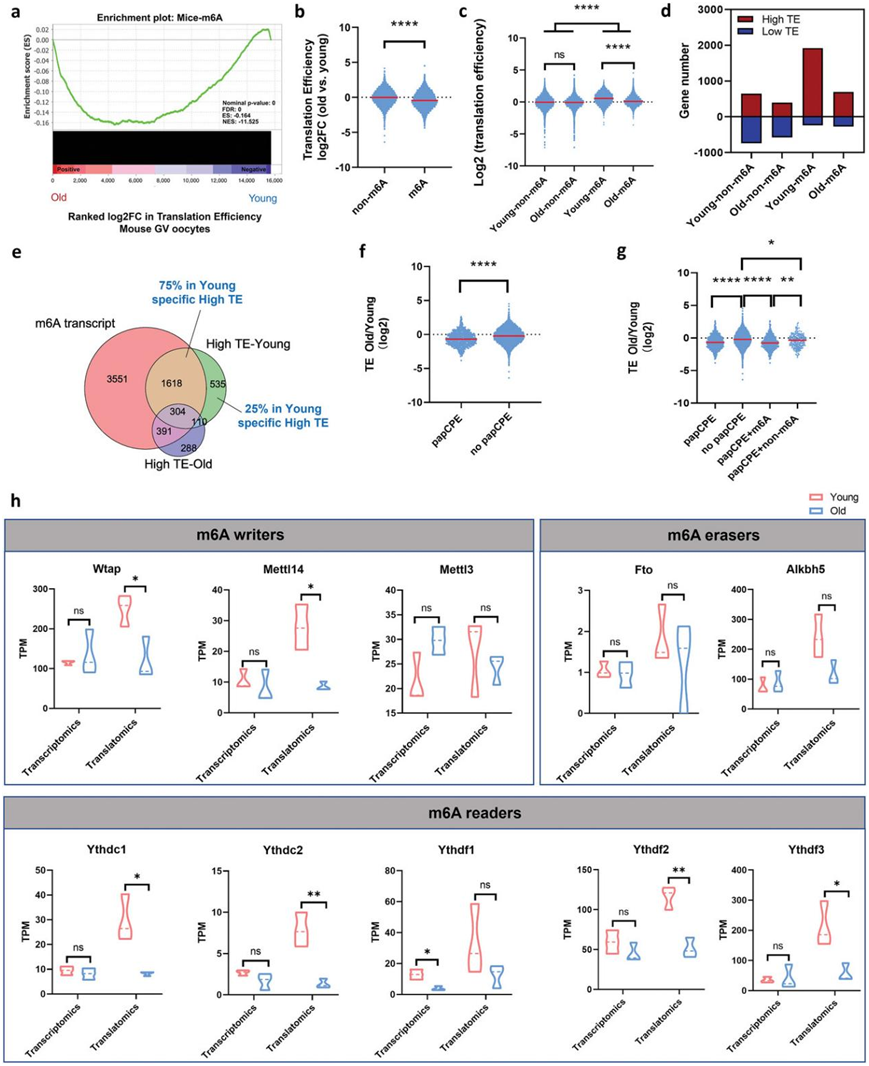
图3. 介导翻译下调的 m6A 修饰在衰老的小鼠 GV 卵母细胞中发生了改变。
(a) 基因集富集分析表明,m6A 富集 RNA 的 TE 显著降低。(b) 小提琴图,显示老年小鼠卵母细胞中未富含 m6A 的组和富含 m6A 的组的基因与年轻小鼠卵母细胞相比的 TE 变化。 (c) 小提琴图显示年轻和老年小鼠卵母细胞中富含 m6A 的基因或未富含 m6A 的基因的 TE 。 (d) 条形图显示四组中high-TE 基因和low-TE 基因的数量。(e) 维恩图显示了富含 m6A 的基因集、年轻小鼠 GV 卵母细胞中的high-TE 基因和老年小鼠 GV 卵母细胞中的high-TE 基因的重叠。(f) 小提琴图,显示老年小鼠卵母细胞中含有 papCPE 的组和不含 papCPE 的组的基因与年轻小鼠卵母细胞相比的 TE 变化。(g) 小提琴图显示老年小鼠卵母细胞与年轻小鼠卵母细胞相比四组基因的 TE 变化。(h) 小鼠 GV 卵母细胞中代表性 m6A 相关基因的转录和翻译表达水平。
04
YTHDF3 耗竭抑制小鼠卵母细胞中的 RNA TE
为了评估 m6A 相关基因在卵母细胞质量和发育能力中的功能,他们接下来使用 Trim-away 方法进行电穿孔以降解卵母细胞中的靶蛋白,并评估体外极体-1(PB1)的发射率。令人惊讶的是,只有当YTHDF3敲低 (YTHDF3 KD) 时,卵母细胞的体外PB1排放率才显著降低(图 4a)。免疫荧光证实 YTHDF3 缺陷和老年小鼠卵母细胞中 YTHDF3 的表达显著下调(图 4b-c)。翻译组中的基因表达与转录组中的基因表达几乎没有相关性,Pearson相关系数为-0.196(图 4d)。
有趣的是,通过分析 RNA 表达和 TE 的全基因组变化,他们发现 YTHDF3 缺失略微减少了卵母细胞中 RNA 的衰减(图 4e)。更引人注目的是,RNA TE的累积频率曲线显示出更明显的变化,表明YTHDF3耗尽导致卵母细胞中的TE显著下降(图 4f)。因此,他们进一步分析了 YTHDF3 KD 后卵母细胞中的 TE。值得注意的是,与衰老小鼠卵母细胞中的RNA TE相似(图 2e),YTHDF3-KD中大多数RNA的TE下调(4192个基因),是上调TE RNA(1925个基因)的两倍以上(图 4g)。GSEA显示,TE上调基因富集在“氧化磷酸化”通路,而TE下调基因富集于“G2/M检查点”过程。更重要的是,与对照组(4108个基因)相比,YTHDF3 KD卵母细胞(1914个基因)的high-TE基因数量急剧减少(图 4i)。与对照组相比,YTHDF3 KD 卵母细胞中的低low-TE 基因也减少(图 4i)。
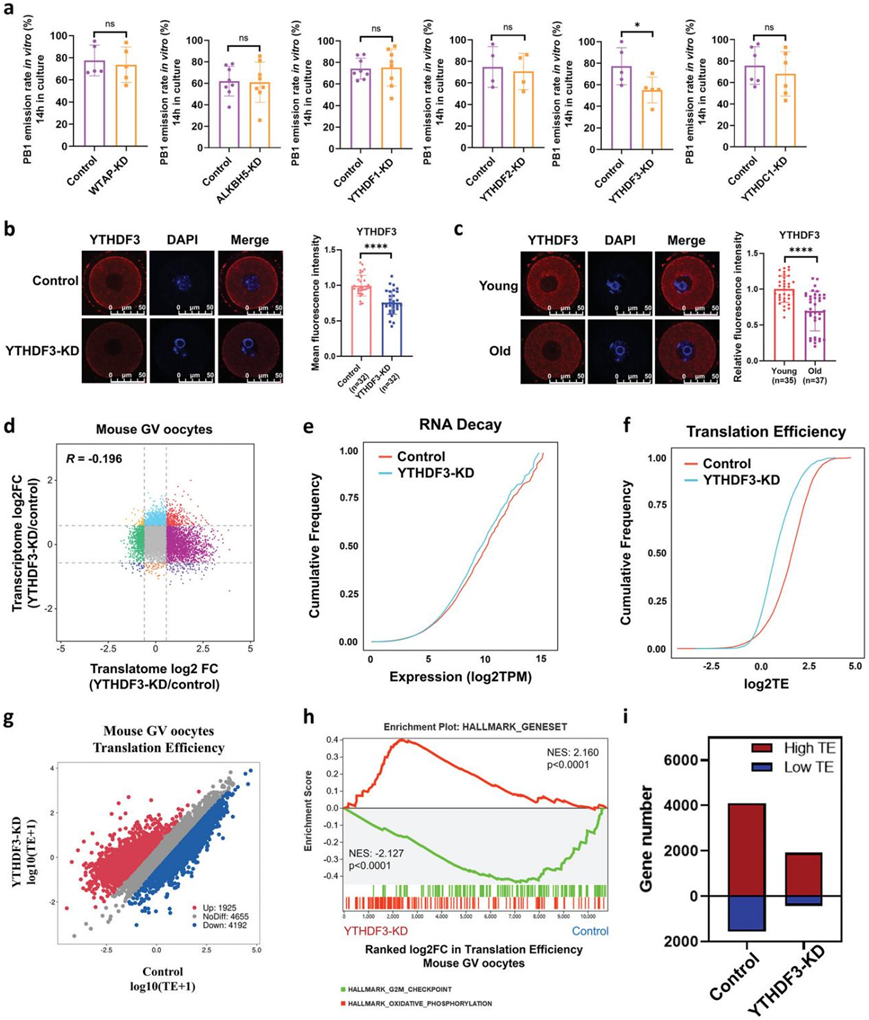
图4. YTHDF3 缺陷会抑制小鼠卵母细胞中的 RNA TE。
(a) 对照组和 m6A 相关基因缺失组小鼠卵母细胞的体外 PB1 发射率。(b) 免疫荧光验证 Trim-Away 对 YTHDF3 的消耗。(c) 免疫荧光验证年轻和老年小鼠 GV 卵母细胞中 YTHDF3 的表达。(d) 散点图显示 YTHDF3-KD 卵母细胞和对照卵母细胞中基因翻译和转录的变化。(e) TE 的累积分布。(f) TE 的累积分布。(g) 散点图显示与对照组相比,YTHDF3-KD 卵母细胞的 RNA TE 变化。 (h) TE 的基因集富集分析显示,TE 下调的基因富含 G2/M 检查点的标志,而 TE 上调的基因富含氧化磷酸化的标志。(i) 条形图分别显示 YTHDF3-KD 组和对照组卵母细胞中high-TE 基因 (TE>2) 和low-TE 基因 (TE<0.5) 的数量。
05
YTHDF3以依赖m6A的方式调节RNA TE
m6A对衰老小鼠卵母细胞中RNA TE的下调至关重要,因此,他们进一步分析了m6A在YTHDF3缺失时介导RNA TE的作用。有趣的是,当YTHDF3敲除时,m6A富集RNA的TE显著降低(图5a-b)。YTHDF3 通过结合 m6A 甲基化转录本来促进 RNA 翻译。因此,他们在过表达 YTHDF3 的 HEK293T 细胞中使用 YTHDF3 特异性抗体进行了 RNA 免疫沉淀测序 (RIP-seq)。在三个重复中,YTHDF3 有 5758 个重叠的潜在候选靶标(图 5c),其中大多数在 3'UTR 位点中富集。功能富集分析表明,YTHDF3 结合基因中富集了不同的基因聚类,参与“翻译”、“RNA 稳定性调节”和“细胞周期”等过程。此外,基序富集的超几何优化 (HOMER) 分析在 YTHDF3-RIP 峰中识别出 m6A 共有基序 GGACU(图 5d)。接下来,通过分析YTHDF3-RIP基因集证实了YTHDF3在调节RNA TE中的作用。YTHDF3 耗尽后,YTHDF3 结合 RNA 的 TE 明显降低(图 5e)。GSEA 证明,当 YTHDF3 缺陷时,富含 m6A 和 YTHDF3 结合基因的 RNA TE 下调幅度更大(图 5f)。这些结果证明 YTHDF3 缺失主要以 m6A 依赖性方式下调 TE,这可能在衰老小鼠卵母细胞的翻译抑制中发挥关键作用。
为了确定衰老小鼠卵母细胞中 YTHDF3 的下游 m6A 修饰靶点,他们通过评估衰老小鼠卵母细胞和 YTHDF3 缺失卵母细胞的差异 TE 基因(经 m6A 修饰并与 YTHDF3 结合)的重叠进行了综合分析并选择了449个候选基因(图 5g)。有趣的是,YTHDF3-KD 卵母细胞和衰老小鼠卵母细胞中 302 个(67%)重叠基因的 TE 均降低(图 5h)。值得注意的是,在YTHDF3-KD卵母细胞和老年小鼠卵母细胞中,36个基因的翻译水平均下调(图 5i)。
HELLS是一种重要的染色质重塑基因,可调节减数分裂着丝点功能和 DNA 双链断裂修复,在卵母细胞减数分裂中发挥关键作用。免疫荧光证实,YTHDF3-KD小鼠卵母细胞中HELLS的表达降低(图5j)。在GV期卵母细胞中的HELLS分布在细胞质和细胞核中,YTHDF3干预降低了HELLS的整体表达水平,包括其在细胞核中的表达(图5j)。
为了确定YTHDF3是否以m6A依赖的方式调节Hells基因的翻译,他们接下来通过将疏水残基W438和W492突变为丙氨酸(图5k),生成了YTHDF3突变体(YTHDF3- mut),根据先前的研究,丙氨酸阻断了YTHDF3与m6A位点的结合。在HEK293T细胞中过表达flag-野生型YTHDF3 (YTHDF3- wt)和YTHDF3- mut质粒。免疫印迹分析证实,YTHDF3以m6A依赖的方式增强了HELLS蛋白的表达(图5l),证明m6A依赖的YTHDF3在HELLS的RNA TE中的调节作用。随即,他们进行了双荧光素酶实验来分析YTHDF3是否通过m6A修饰调节HELLS的翻译。构建带有HELLS 3'UTR的荧光素酶报告基因,并将其转染HEK293T细胞,发现野生型YTHDF3过表达大大增强了HELLS报告基因的荧光素酶活性,而突变的YTHDF3不能增加HELLS报告基因的荧光素酶活性(图5m)。这些结果表明,YTHDF3 与HELLS 3'UTR结合,并以 m6A 依赖性方式促进HELLS的翻译。
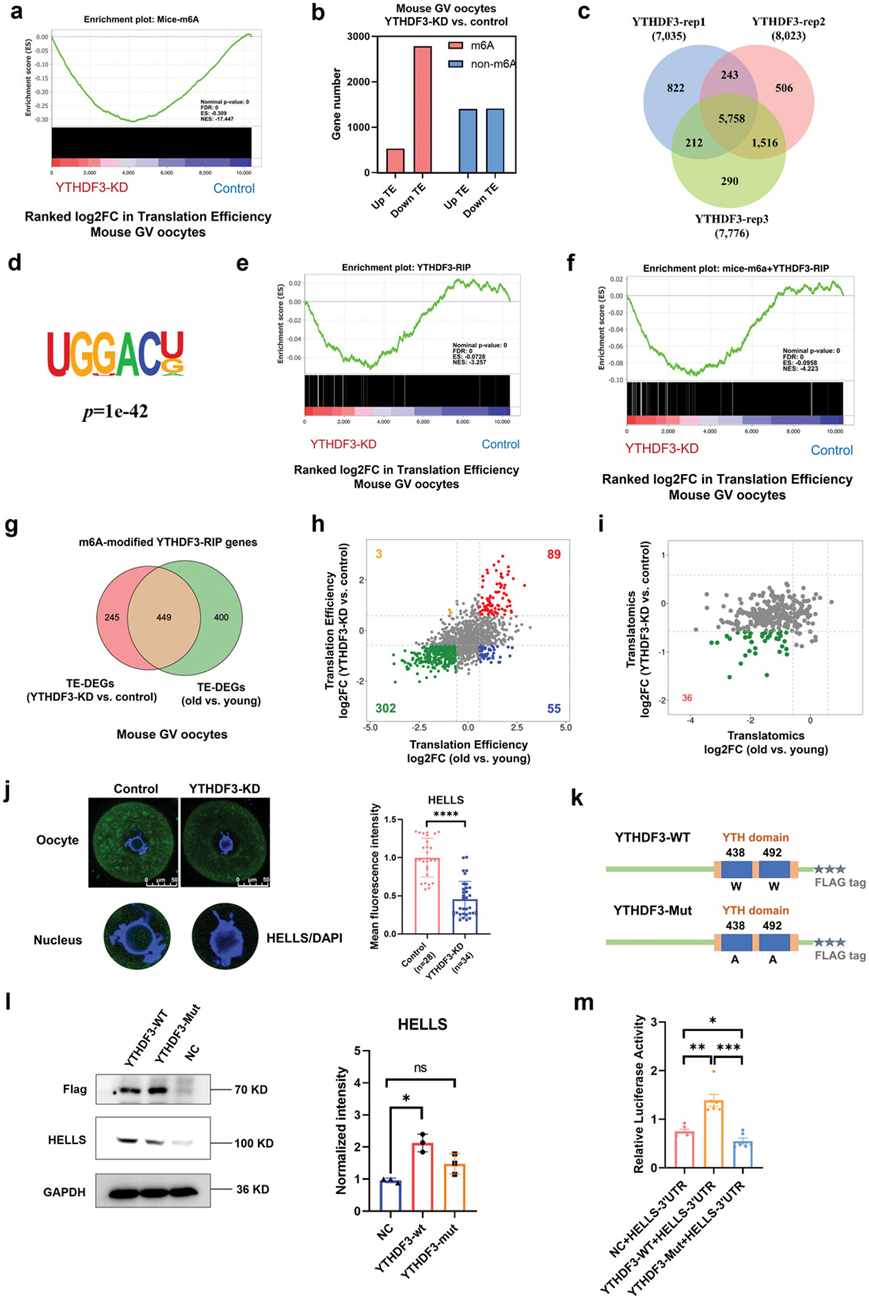
图5. YTHDF3以依赖m6a的方式调节RNA翻译效率。
(a) 基因集富集分析表明,在 YTHDF3 耗尽后,富含 m6A 的 RNA 的 TE 显著降低。 (b) 条形图分别显示 m6A 富集基因或未富集 m6A 的基因的上调 (FC>1.5) 和下调 (FC<0.67) 基因的数量。 (c) 维恩图描绘了YTHDF3 靶基因的重叠。(d) HEK293T 细胞中 YTHDF3 RIP-seq 峰内 HOMER 鉴定的基序。(e) 基因集富集分析显示 YTHDF3 耗尽后 YTHDF3 结合 RNA 的 TE 变化。 (f) 基因集富集分析显示 YTHDF3 耗竭后 YTHDF3 结合 RNA 的 TE 变化。 (g) 维恩图显示 YTHDF3-KD 卵母细胞中差异 TE 基因与老年小鼠卵母细胞中差异 TE 基因之间 m6A 修饰的 YTHDF3 靶基因的重叠。(h) 老年小鼠卵母细胞和 YTHDF3 耗尽的卵母细胞中 449 个重叠基因。(i) 老年小鼠卵母细胞和YTHDF3缺失卵母细胞中302个下调TE基因的RNA翻译水平发生变化。(j) 免疫荧光验证对照组和ythdf3缺失组卵母细胞中HELLS的表达。 (k) 野生型(YTHDF3-WT)和突变型(YTHDF3-Mut)YTHDF3构建体的示意图。(l)免疫印迹分析。(m) HEK293T细胞与NC、YTHDF3-WT或YTHDF3-Mut质粒以及携带HELLS 3'UTR的荧光素酶报告质粒共转染,并检测荧光素酶活性。
06
衰老人类卵母细胞的转录和翻译景观
由于女性人类的生殖衰老发生得比小鼠早得多,他们接下来评估了人类卵母细胞的转录和翻译谱。对年轻(≤31岁)和老年女性(≥38岁)捐献的GV期卵母细胞分别进行单细胞翻译组学和单细胞转录组学研究。主成分分析(PCA)表明,与转录组相比,在翻译组中,年轻和老年的卵母细胞之间有更大的差异聚类(图6a),在翻译组中有1186个基因显著下调,1585个基因显著上调(图6b)。有趣的是,KEGG分析显示,差异翻译基因在“核糖体”、“卵母细胞减数分裂”和“同源重组”通路中富集(图6c)。与衰老小鼠卵母细胞一致,GSEA表明,翻译组学中人类衰老卵母细胞的上调基因在氧化磷酸化中富集,而下调基因则与G2/M检查点相关(图6d)。
小鼠模型广泛用于研究卵母细胞衰老的机制。然而,在两个物种之间,生殖衰老的发生和持续存在着巨大的差异。因此,为了比较人和小鼠卵母细胞衰老的保守性和差异,他们接下来对老年小鼠和老年人类卵母细胞的翻译组学进行了综合分析。有趣的是,发现年轻人类卵母细胞和年轻小鼠卵母细胞之间的相关性相对较高,而老年人类卵母细胞和老年小鼠卵母细胞之间的相关性非常低(图6e)。在人和小鼠的年轻和老年 GV 卵母细胞中,分别有 6328 个(年轻人类 GV 翻译组的 52.4%)和 4641 个(老年人类 GV 翻译组的 49.7%)普遍翻译的基因。然而,在物种之间仅发现了 747 个 DEG(人类 DEG 的 26.9%)(图 6f-h)。这些结果表明,在卵母细胞衰老过程中,翻译改变的保守性较少。然而,有趣的是,发现大多数重叠的DEG在两个物种中表现出相同的表达趋势(图 6i)。此外,还评估了与卵母细胞减数分裂、RNA衰变、组蛋白修饰和DNA甲基化相关的特定基因的表达(图 6j)。与衰老的小鼠卵母细胞一致,减数分裂相关基因DNM1L和BRCA1以及 DNA 甲基化基因UHRF1、DNMT1和DNMT3A/B的翻译水平在衰老的人卵母细胞中显著降低(图 6j)。另一方面,对于RNA衰变相关基因,只有CNOT8和CNOT7的表达在人类衰老卵母细胞中显著降低。此外,与老年小鼠卵母细胞不同,老年人卵母细胞中组蛋白修饰调节因子没有显著改变(图 6j)。这些结果证明了两个物种之间卵母细胞衰老的保守性和差异,并证明了 RNA 翻译失调在老年人卵母细胞质量中的作用。

图6. 衰老人类卵母细胞的转录和翻译景观。
(a) 年轻和老年女性卵母细胞翻译组学的 PCA 图。 (b) 火山图显示超灵敏翻译组学检测到的 DEG。(c) 通过翻译组学在衰老的人类卵母细胞中鉴定出的 DEG 的代表性 KEGG 富集。(d) 翻译组学的基因集富集分析显示,翻译下调基因富含 G2/M 检查点标志,翻译上调基因富含氧化磷酸化标志。(e) 热图描绘了年轻和老年小鼠/人类的每个生物学重复之间翻译组的Pearson相关系数。 (f) 在年轻人类卵母细胞和年轻小鼠卵母细胞中单细胞翻译组学分析中相关基因的维恩图。(g) 在老年人类卵母细胞(≥38 岁)和老年小鼠卵母细胞(>16 个月大)中单细胞翻译组学生成的检测到的基因的维恩图。(h) 维恩图显示了从超灵敏翻译组学中检测到的老年小鼠/人 GV 卵母细胞中 DEG 的重叠。(i) 老年人类和老年小鼠卵母细胞中重叠DEG的数量。(j) 老年人类和老年小鼠卵母细胞中特定基因的差异倍数。
07
衰老人卵母细胞中的 RNA TE 失调与 m6A 修饰无关
与小鼠卵母细胞类似,衰老人卵母细胞中的RNA转录和翻译几乎不相关,Pearson相关系数为-0.0413(图 7a)。因此,为了更好地理解翻译调控,他们接下来尝试评估衰老人类卵母细胞的 TE 变化。与老年的小鼠卵母细胞类似,2691个基因的TE增加,4943个基因的TE减少(图 7b)。然而,与衰老小鼠卵母细胞不一致的是,衰老人卵母细胞中下调的基因主要是low-TE基因(图 7c)。进一步的分析表明,m6A 富集和非 m6A 富集的 RNA 之间的 TE 没有显著差异(图 7d)。此外,YTHDF3-靶标与TE的改变不相关(图 7e)。另一方面,虽然在衰老的人卵母细胞中,含有 papCPE 或 CPE 的 RNA表现出轻微的 TE 抑制作用(图 7f-g),但这种RNA TE 抑制几乎与 m6A 修饰无关(图 7h-i)。此外,他们观察到衰老小鼠卵母细胞中YTHDF3 和 HELLS的翻译水平显著降低,但衰老人卵母细胞中没有显著变化(图 7j-k),这些结果表明衰老的人类卵母细胞具有独特的翻译表达和调节模式。
已经表明,卵母细胞中的翻译表达是由RNA结合蛋白(RBP)与基因3'UTR结合的翻译调节元件介导的。他们总共鉴定出 109 个 RBP 在人类卵母细胞基因的 3'UTR 中富集。其中,30 个 RBP 在老年和年轻卵母细胞之间表达不同。因此,他们认为老年卵母细胞中翻译效率改变的基因可能与不同表达的RBP有关,尤其是选择性剪接因子,例如SRSF6、HNRNPH1、CSTF2和CELF1(图 7l)。
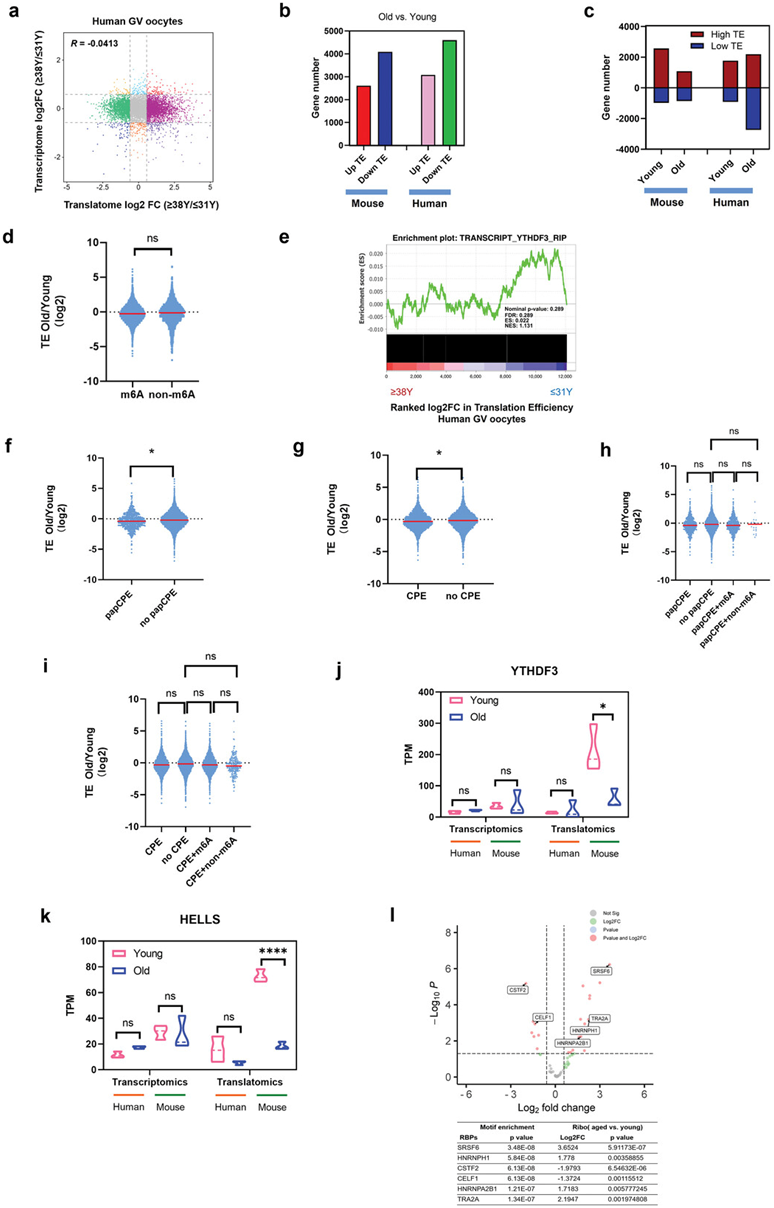
图7. 衰老人卵母细胞RNA翻译效率的变化。
(a) 散点图显示卵母细胞衰老过程中基因翻译和转录的变化。(b) 条形图分别显示年轻和老年小鼠/人 GV 卵母细胞中上调 TE 基因和下调 TE 基因的数量。(c) 条形图分别显示年轻和老年小鼠/人 GV 卵母细胞中高 TE 基因 (TE>2) 和低 TE 基因 (TE<0.5) 的数量。(d) 小提琴图,显示老年卵母细胞中未富含 m6A 的组和富含 m6A 的组的基因与年轻人类卵母细胞相比的 TE 变化。(e) 基因集富集分析证明了衰老人类卵母细胞中 TE 改变与 YTHDF3 靶 RNA 的相关性。 (f) 小提琴图,显示老年卵母细胞中含有 papCPE 和不含 papCPE 的基因与年轻人卵母细胞相比的 TE 变化。(g) 小提琴图,显示与年轻人类卵母细胞相比,老年卵母细胞中含有CPE组和不含CPE组基因的TE变化。(h) 小提琴图显示老年卵母细胞与年轻卵母细胞相比四组基因的 TE 变化。(i) 小提琴图显示老年卵母细胞与年轻卵母细胞相比四组基因的 TE 变化。(j) 人/小鼠GV卵母细胞中YTHDF3的转录和翻译表达水平。(k) 人/小鼠GV卵母细胞中HELLS的转录和翻译表达水平。 (l) 代表性 RBP 富含人类卵母细胞中可能调节 RNA TE 的基因的 3'UTR。
+ + + + + + + + + + +
结 论
本项研究通过对卵母细胞的多组学分析,发现衰老过程中的翻译组学与蛋白质组的变化有关,并揭示了小鼠卵母细胞衰老表型导致的翻译效率下降。翻译效率降低与转录本的m6A 修饰有关。进一步阐明, YTHDF3在衰老卵母细胞中显著降低,抑制卵母细胞减数分裂成熟。YTHDF3 干预会扰乱卵母细胞的翻译组,并抑制与衰老相关的翻译效率,从而影响卵母细胞的成熟。此外,还描绘了人类卵母细胞衰老中的翻译景观,并且观察到人类和小鼠卵母细胞衰老之间表观遗传修饰调节因子的类似翻译变化。特别是,由于人卵母细胞中 YTHDF3 的翻译沉默,翻译活性与 m6A 修饰无关,而是与选择性剪接因子 SRSF6 相关。总之,这些结果描绘了小鼠和人类卵母细胞衰老过程中的特定翻译景观,并揭示了减数分裂恢复和母体衰老过程中翻译控制的非保守调节因子。
+ + + + +



 English
English


