文献解读|Nat Commun(16.6):表观遗传分析揭示了人类甲状旁腺特有的关键基因和顺式调控网络
✦ +
+
论文ID
原名:Epigenetic profiling reveals key genes and cis-regulatory networks specific to human parathyroids
译名:表观遗传分析揭示了人类甲状旁腺特有的关键基因和顺式调控网络
期刊:Nature Communications
影响因子:16.6
发表时间:2024.03.07
DOI号:10.1038/s41467-024-46181-3
背 景
在所有陆生脊椎动物中,甲状旁腺是钙稳态的重要调节者,也是甲状旁腺激素 (PTH) 的唯一来源。甲状旁腺功能亢进症和甲状旁腺功能减退症是影响多个器官的临床重要疾病。然而,目前对甲状旁腺调控机制的了解仍然有限。
实验设计
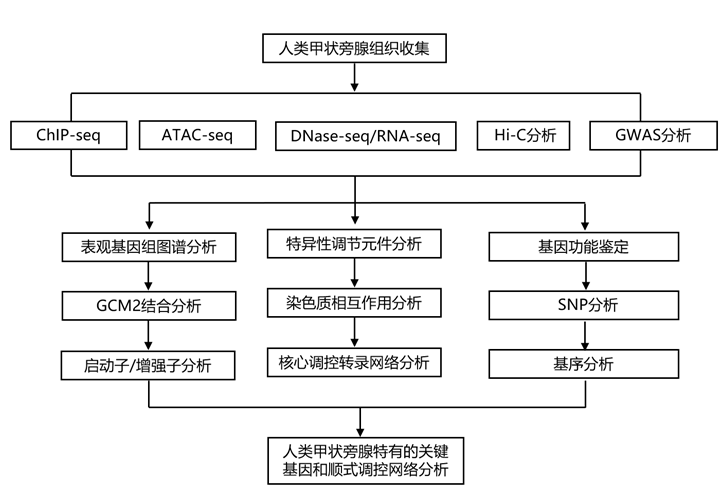
结 果
01
甲状旁腺的表观基因组和转录谱
本项研究使用基于高通量测序的检测方法从十二个人类甲状旁腺腺瘤样本中生成了一组表观遗传图谱。数据集包括 (1) 关键甲状旁腺转录因子(TF)GCM2的 ChIP-seq 数据;(2) 活性和抑制性组蛋白修饰的 ChIP-seq 数据,包括 H3K4me3、H3K4me2、H3K4me1、H3K27ac、H3K36me3、H3K79me2、H2A.Z、H3K9ac、H3K27me3 和 H3K9me3 以及CTCF;(3) ATAC-seq 和 DNase-seq 数据以确定染色质可及性;(4) Hi-C 数据,用于识别高阶染色质相互作用(图 1a)。研究团队还生成了从八个甲状旁腺腺瘤样本中收集的bulk RNA 序列图谱。基于甲状旁腺特异性基因表达水平的 t-SNE 预测揭示了甲状旁腺样本的紧密聚集。它们位于脑下垂体和胰腺(另外两个内分泌器官)附近。然而,它们与 GTEx 项目中描述的其他组织类型明显分开,包括甲状腺和肾上腺等内分泌器官(图 1b)。
他们接下来关注胶质细胞缺失转录因子2 (GCM2) 基因,它是甲状旁腺细胞存活和分化的重要调节因子。在完全分化的成人组织中,GCM2仅在甲状旁腺中表达。对人甲状旁腺瘤生物重复的GCM2 ChIP-seq分析表明,在14373个显著的GCM2峰中,绝大多数(75.4%)位于活性启动子近端或远端增强子区域(图1c)。相比之下,GCM2结合在异染色质和polycomb调控的抑制区等沉默区域发生耗竭(图1c)。GCM2结合位点周围的组蛋白修饰与活性启动子或增强子对应的模式相匹配(图1d)。重要的是,远端增强子区域的GCM2结合位点的一个子集对应于H3K27ac或H3K4me1更宽、更强的区域,可能代表超级增强子(多个增强子聚类)(图1d)。他们根据H3K27ac标记的高信号强度和区域大小来定义超级增强子。在H3K27ac信号定义的634个全基因组超增强子区域中,有433个由GCM2靶向,反映了GCM2在驱动甲状旁腺细胞特征基因表达中的重要性(图1c)。
他们还发现了多个具有超级增强子的基因,这些基因在甲状旁腺中起着重要的作用,如DNAH11(动力蛋白轴突重链11),PAX1(配对盒蛋白1)和PTHLH(甲状旁腺激素样激素,PTHrP)。
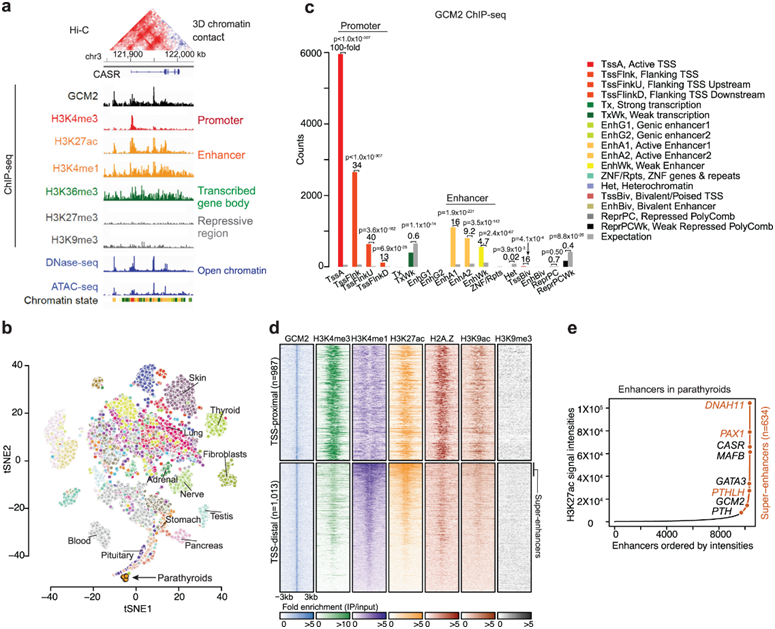
图1. 本研究生成的数据集摘要以及甲状旁腺中GCM2转录因子结合分析。
(a) 本研究中生成的精选表观基因组图谱列表,例如CASR基因。(b) 基于甲状旁腺特异性表达的 8 个甲状旁腺腺瘤样本的 RNA-seq 的 t-SNE 投影以及来自GTEx项目中分析的53个组织的RNA-seq样本,其中每个点代表每个样本,每种颜色代表每种组织类型。 (c) GCM2结合的分布映射到甲状旁腺中的染色质状态。 (d) 热图显示GCM2峰周围的组蛋白修饰模式。(e) 甲状旁腺的超级增强子。
02
分析CASR和PTH基因中甲状旁腺特异性顺式调节元件
通过全基因组染色质状态分析以及与表观基因组路线图数据的比较,他们确定了约 10000 个甲状旁腺特异性增强子。为了验证这些图谱的实用性,他们重点关注了对甲状旁腺细胞功能至关重要的两个基因:CASR和PTH。
虽然CASR在调节PTH分泌的甲状旁腺中高表达,但它也在许多其他组织中表达,如调节钙重吸收的肾脏和控制胰管液体分泌的胰腺。CASR的表达水平在不同组织间存在差异,这种差异可能是由于增强子特征差异引起的。为了揭示这些细胞类型特异性机制,他们在表达CASR的组织中检测了dna酶I超敏(DHS)位点(图2a)。他们在CASR的内含子区发现了突出的DHS峰,特别是在甲状旁腺。在肾脏或胰腺中没有发现它们。这些甲状旁腺特异性DHS峰也与GCM2结合,这表明CASR内含子中的这些增强子元件可能是甲状旁腺功能的基础(图2a)。
在肾脏或胰腺中没有发现它们。这些甲状旁腺特异性DHS峰也与GCM2结合(图2a),这表明CASR内含子中的这些增强子元件可能是甲状旁腺功能的基础。为了探索启动子和远端增强子之间的染色质相互作用,他们生成了甲状旁腺的高分辨率 Hi-C 图(图 1a)。他们确定了22434个调控区域之间的重要相互作用。聚焦于CASR,他们使用启动子捕获Hi-C测定(pcHi-C)将涉及甲状旁腺的该基因与在其他组织中观察到的相互作用进行了对比(图2b)。在甲状旁腺中,他们发现了CASR启动子与位于开放染色质上的四个调控元件(E1-4)之间的相互作用,这些元件与GCM2和CTCF结合。E1位于CD86内,CD86在免疫细胞中表达,在甲状旁腺中沉默;E2位于CASR和CD86之间的基因间区域。鉴于甲状旁腺中CD86启动子的表达缺失和开放染色质缺失,第一和第二元件可能是CASR的增强因子,而不是CD86。E3是位于CASR内含子中的甲状旁腺特异性增强子,E4也位于CASR基因内。这四个启动子-增强子在CASR上的相互作用对甲状旁腺是特异性的。其他表达CASR的组织,如胚胎干细胞和胰腺,在CASR启动子处显示出染色质环,这些染色质环都与不同的基因组区域相互作用(图2b)。
他们通过荧光素酶测定和异源细胞培养系统实验验证了近12种鉴定的增强子的活性(图2c)。他们选择了与GCM2结合的核心甲状旁腺基因如CASR、PTH和MAFB的增强子。事实上,与使用HEK293(人胚胎肾)或DF-1(鸡成纤维细胞)细胞的空载体对照相比,所有假定的增强子都表现出不同程度的显著增强荧光素酶活性(图2c)。
总的来说,这些结果证明了甲状旁腺特异性开放染色质结构、增强子和三维染色质相互作用在理解甲状旁腺特征和功能的关键因素中的实用性。
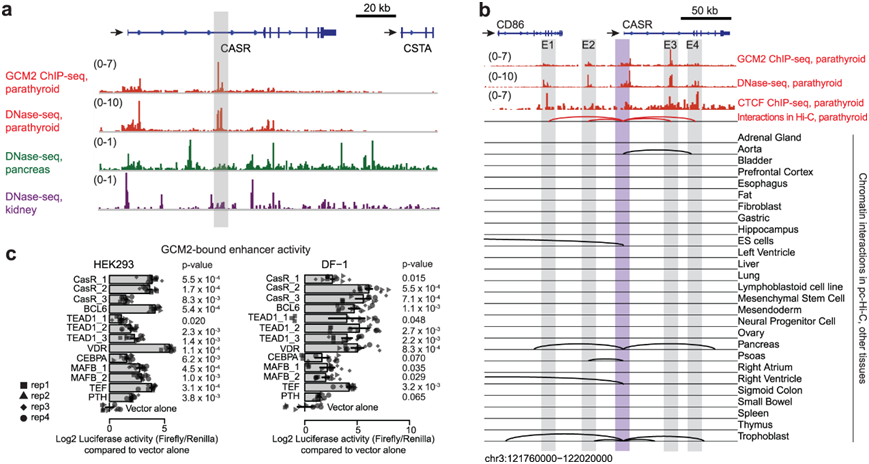
图2. 甲状旁腺特异性调节元件和染色质相互作用。
(a) CASR基因座甲状旁腺中独特的开放染色质谱。(b) 几种组织类型中CASR启动子和调控元件之间的染色质相互作用。(c) 在 HEK293 和 DF-1 细胞系中通过荧光素酶检测验证甲状旁腺增强子活性。
03
甲状旁腺的核心调控转录网络
他们首先通过对GCM2 chiP -seq结合位点进行从头DNA基序分析,研究了GCM2与其他tf的潜在相互作用关系。正如预期的那样,从GCM2峰中发现的基序序列与先前在体外测定的已知GCM2基序CCCGCA最匹配。重要的是,该分析还揭示了两个异二聚体基序,GCM2-ELF和GCM2-ELK的富集。这些异源二聚体基元存在于大约三分之一的GCM2结合位点,这表明GCM2经常与ETS家族ELF或ELK形成异源二聚体(图3a)。分析还表明GATA3和MAFB基序经常与GCM2结合位点共定位(图3a)。有趣的是,GATA3和MAFB基序在GCM2结合位点的共定位在远端增强子上比在启动子上更常见,这表明它们在靶基因的组织特异性调控中起作用。
PTH启动子上游约4.5 kb的远端增强子包含一个GCM2结合位点,其MAFB基序与GCM2基序接近(图3c)。其他tf如STAT1(信号换能器和转录激活因子1)、SP2(特异性蛋白2)、HINFP(组蛋白H4转录因子)和FOX(叉头盒)家族成员也经常与GCM2共定位(图3a)。
接下来,他们定义了以GCM2为中心的甲状旁腺TF的核心调控网络。他们假设这种电路的成员,包括GCM2,结合到与超级增强子相关的其他关键tf的启动子或增强子上。他们首先在GCM2的启动子和增强子上发现了TF结合基序。他们分析了那些在甲状旁腺中表达的tf,这些tf的基因本身与超级增强子有关(图3d)。
他们构建的TF调控回路揭示了几个重要特征:(1) 核心TF网络中的成员在很大程度上与GCM2预测的共结合TF重叠(图3a) (2)回路中很大一部分TF 具有自调节属性,(3)网络包括MAFB等关键甲状旁腺TF、GATA3和VDR(维生素D受体)(4) GATA3以其他核心tf为靶点,但除了SP2之外,它本身并不是其他tf的靶点。这表明 GATA3可能位于或接近这个调控网络的顶部,这与GATA3在甲状旁腺形成中的重要作用是一致的。
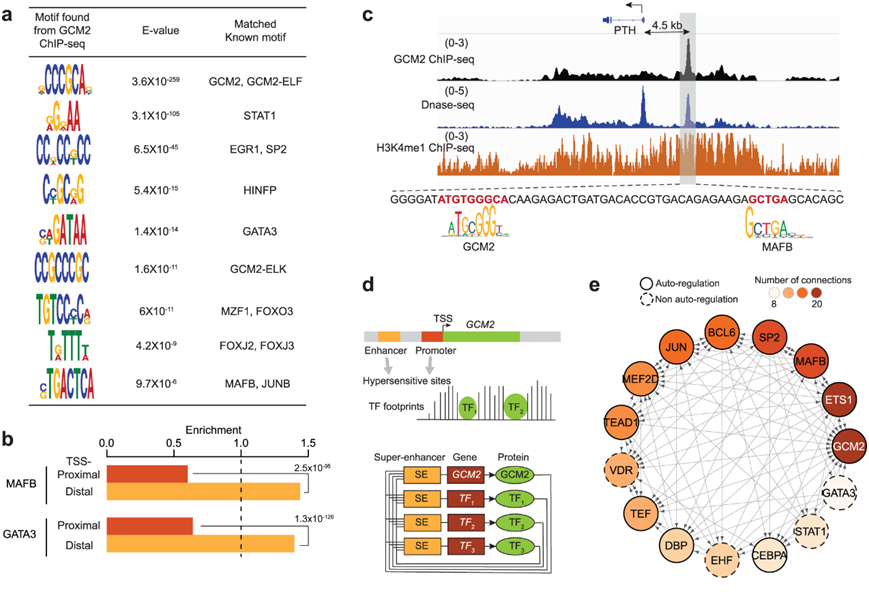
图3. 甲状旁腺的核心顺式调节回路。
(a) 来自GCM2峰的基序序列与已知的 TF 基序相匹配。(b) MAFB和GATA3的 TSS 近端区域(红色)和 TSS 远端区域(橙色)的结合预测富集。(c) 预测的PTH基因远端增强子(距离 TSS 4.5 kb)处的GCM2和MAFB结合位点。(d) 识别与GCM2配合使用的关键 TF 调节子的示意图。(e) 甲状旁腺中的核心 TF 调节回路。
04
潜在的关键甲状旁腺细胞识别基因
他们将顺式调控元件、表达数据和GCM2 ChIP-seq图谱结合:这些基因(1)与甲状旁腺特异性增强子或超增强子相关,(2)在甲状旁腺中高度特异性表达,(3)是GCM2的靶标(图4a)。为了鉴定在甲状旁腺中特异性表达的基因,他们比较了甲状旁腺中基因的转录水平与来自GTEx数据库的54个组织的转录水平。生成的列表包含78个基因,其中包括已知的关键基因,如GCM2、PTH和CASR,以及未知作用的基因,如PAX1、PTHLH、DNAH11、MDRT2(双性和单抗-3相关转录因子2)和TPM3(原肌球蛋白3)。
PAX1是TF配对盒(PAX)家族的一员,在甲状旁腺的发育中起作用。整个PAX1基因广泛而强烈地富集GCM2结合,并含有甲状旁腺特异性超增强子,这与该基因在其他组织类型中的抑制或平衡染色质状态形成对比(图4b)。PTHLH(甲状旁腺激素相关肽或PTHrP)与PTH有足够的相似性,可以结合相同的PTH/PTHrP受体。PTHrP基因在许多组织中表达,并发挥旁分泌/自分泌作用。PTHLH基因显示出高强度的GCM2广泛结合,并在甲状旁腺中显示出超增强子的特征(图4c)。这与其他表达PTHLH但表现出低得多的增强子活性的组织形成鲜明对比,不符合H3K27ac信号强度的超增强子标准。超增强子活性可能是甲状旁腺PTHLH高表达的潜在机制。
DNAH11是一种与原发性纤毛运动障碍相关的纤毛蛋白,虽然DNAH11在其他多种组织中均有表达,但该基因在甲状旁腺中的转录和增强子活性最高,并显示出GCM2的多个结合位点(图4d)。

图4. 先前未知在甲状旁腺中发挥作用的基因的鉴定。
(a) 通过整合表达、增强子和GCM2结合数据,鉴定先前未识别的可能在甲状旁腺中起关键作用的基因。(b) PAX1的GCM2结合和染色质状态(上)。表观基因组路线图(中)显示甲状旁腺和其他组织中PAX1位点的染色质状态,甲状旁腺和其他组织中的表达水平(下)。(c) 与(b)相同,但PTHLH在许多组织类型中表达。(d) 与(b)相同,但针对DNAH11。
05
甲状旁腺特异性增强子中的GWAS snp
全基因组关联研究(GWAS)已经报道了数千个与人类疾病或性状相关的单核苷酸多态性(snp)。这些snp大多位于非编码区,富集增强子元件。
相当一部分snp(2359个snp中的18%)位于甲状旁腺的功能区域,如活性启动子、增强子或超级增强子,并且显著富集(图5a)。有趣的是,在甲状旁腺的超级增强子中存在99个snp(占调控区域的23.7%),与全基因组的预期相比显著增加。与骨密度和骨质疏松症相关的snp显示出类似的模式(图5a)。gwas鉴定的所有7个CASR snp都位于甲状旁腺增强子区域。具体来说,rs9811123定位于GCM2结合的甲状旁腺特异性DHS位点(图5b)。调控区域的snp可导致对tf结合亲和力的改变,进而导致转录物丰度的改变或mRNA剪接和microRNA结合的改变。
当他们检测GCM2 ChIP-seq覆盖该SNP的读数时,观察到SNP rs9811123等位基因失衡(图5c)。在支持该SNP位点的88个读数中,67%映射到主要的G等位基因,33%映射到次要的A等位基因,这表明该等位基因可能通过改变TF结合来影响增强子活性。通过基序分析,预测rs9811123的DNA序列变化会导致甲状旁腺表达的TF HINFP的结合中断(图5d)。HINFP是在GCM2峰上经常发现基序的tf之一(图3a)。他们在两种不同的细胞系(HEK293和DF-1细胞,均内源性表达HINFP)中使用荧光素酶检测验证了SNP效应,结果显示rs9811123区域的次要等位基因显著降低了增强子活性(图5e)。
在RALB附近,他们发现了甲状旁腺特异性超增强子,其中包含与PTH-浓度相关的GWAS snp(图5f);与其他54种组织类型相比,其在甲状旁腺的表达水平最高(图5g)。具体来说,RALB启动子附近的rs6542579与DHS和GCM2结合峰共定位(图5h),基序分析预测TF DMRT2与该SNP的亲和力增加。
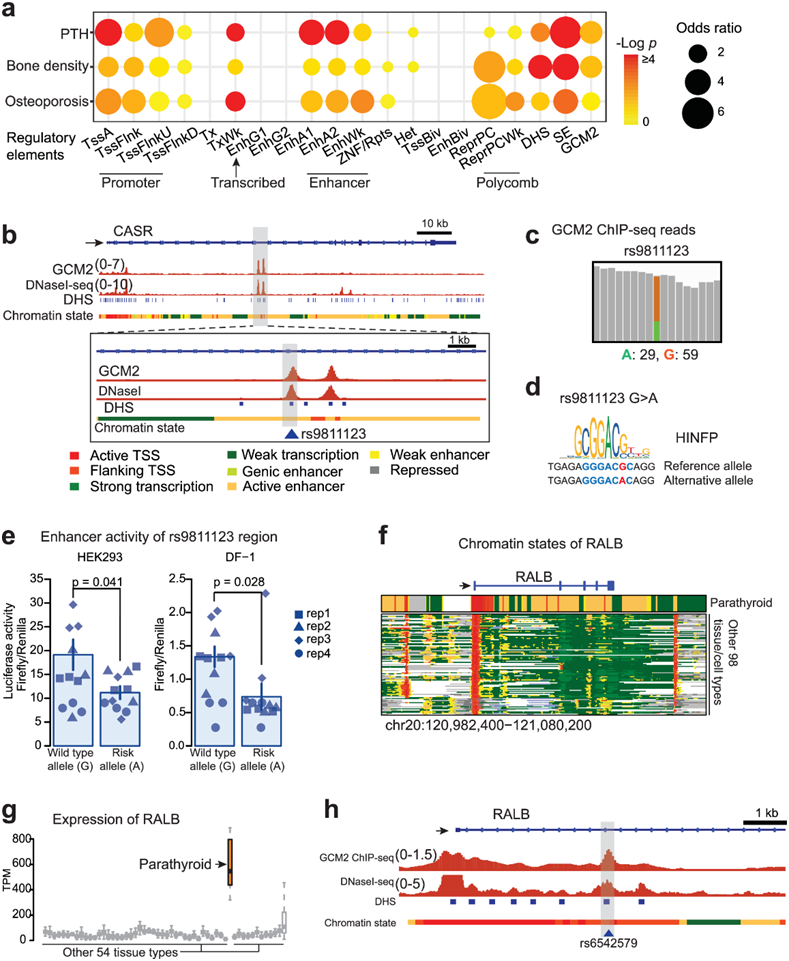
图5. 甲状旁腺相关的 GWAS SNP 在甲状旁腺的调节区域中富集。
(a) 甲状旁腺调节元件中 PTH 水平、骨密度和骨质疏松症的 GWAS SNP 富集。(b) CASR 甲状旁腺特异性内含子增强子中与 PTH 水平相关的 SNP (rs9811123) 。(c) SNP rs9811123 的读数分析。(d) rs9811123 周围的HINFP基序序列,预测了 SNP 的结合亲和力变化。(e) 通过荧光素酶测定在 HEK293 和 DF-1 中检测SNP 的影响。 (f) RALB基因周围的染色质状态。(g) RALB跨组织类型的表达水平。(h)RALB 甲状旁腺特异性内含子增强子中与 PTH 水平相关的 SNP (rs6542579)。
+ + + + + + + + + + +
结 论
本项研究展示了人类甲状旁腺染色质景观的综合图谱,确定了活性调节元件和染色质相互作用。这些数据能够定义在甲状旁腺生物学中发挥关键作用的调节回路和以前未识别的基因。通过实验验证候选甲状旁腺特异性增强子,并证明它们与甲状旁腺相关疾病和性状的 GWAS SNP 的整合。例如,钙感应受体基因的甲状旁腺特异性增强子的活性降低,该基因包含与野生型等位基因相比较高的 PTH 水平相关的风险等位基因。本项数据集为揭示健康和疾病中甲状旁腺的调节机制提供了宝贵的资源。
+ + + + +



 English
English


