文献解读|Cell Rep Med(14.3):肝细胞癌的综合组学景观表明用于精准治疗的蛋白质组学亚型
✦ +
+
论文ID
原名:Integrated omics landscape of hepatocellular carcinoma suggests proteomic subtypes for precision therapy
译名:肝细胞癌的综合组学景观表明用于精准治疗的蛋白质组学亚型
期刊:Cell Reports Medicine
影响因子:14.3
发表时间:2023.12.19
DOI号:10.1016/j.xcrm.2023.101315
背 景
肝细胞癌(HCC)约占所有原发性肝癌的75%~85%,治疗方法有限且预后不良。大多数HCC患者确诊时已属晚期,只能接受全身抗肿瘤治疗,疗效较差,有效率较低。特别是,处于同一临床阶段的 HCC 患者的预后存在显著差异,因此预测结果具有挑战性。因此,准确的分期和后续适当的个体化治疗是改善HCC临床结果的关键。
实验设计
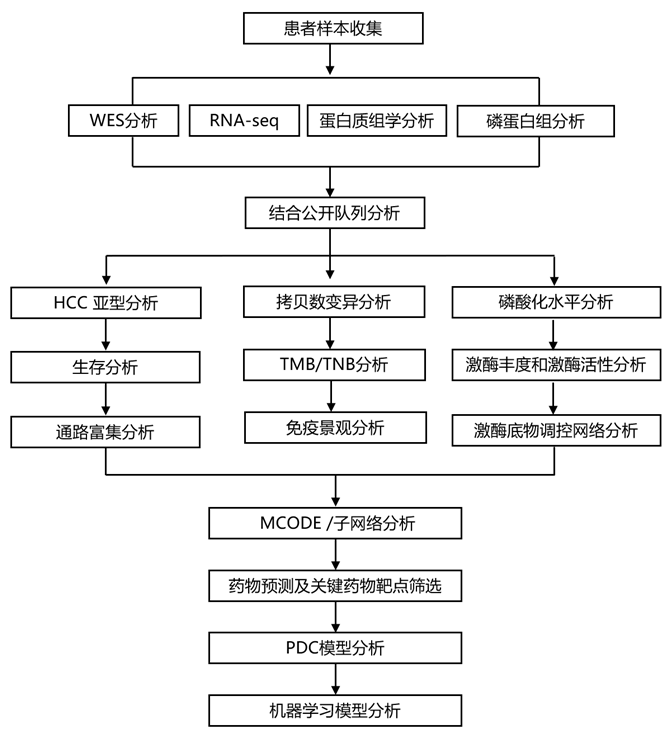
结 果
01
蛋白质组学表征确定了三种 HCC 亚型
研究团队对 160 名 HCC 患者的原发肿瘤组织 (T) 和配对的肿瘤旁组织 (N) 进行了多组学分析[蛋白质组学、磷酸化蛋白质组学、全外显子组测序(WES)、转录组分析 (RNA-seq)(图 S1 A)。HCC 亚型通过基于数据独立采集 (DIA) 的蛋白质组学分析进行鉴定(图 S1 B),并在三个独立的公开可用的外部验证集中进行验证,以确认其稳健性和普遍性。
他们鉴定出了 6512 个蛋白质(图 S1 C-D),质谱(MS)平台的高稳定性导致HCC样品的定量稳定性和准确性高(图 S1E-F)。正如预期的那样,T的变异系数值高于N(图S1G),并且T和N明显区分(图S1H-I),突出了HCC的高肿瘤间异质性。
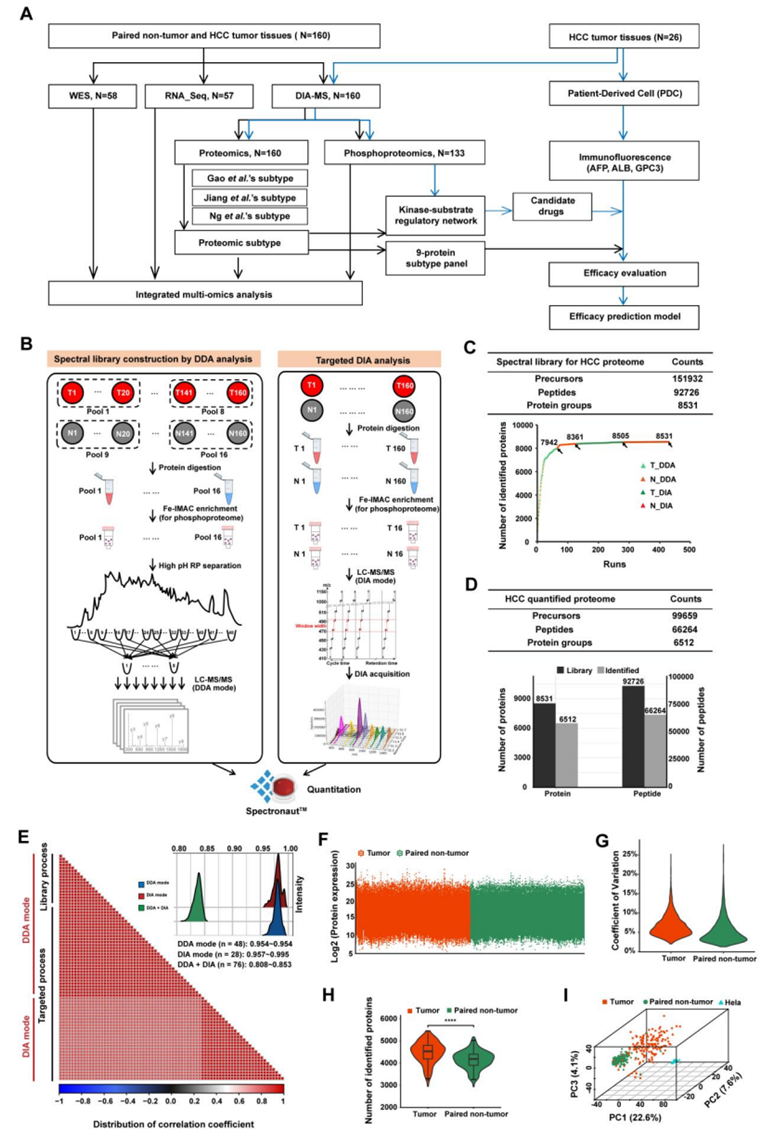
图S1. 肝细胞癌蛋白质组学研究设计。
(A) HCC多组学研究概况。(B)蛋白质组学实验流程概述。(C) HCC组织谱库概述。(D) HCC组织DIA蛋白质组总结。(E)稳健和精确的蛋白质组学平台。(F)在HCC肿瘤和配对的32个非肿瘤组织中鉴定的蛋白丰度分布。(G) HCC肿瘤与配对非肿瘤样本的变异系数分布。(H) HCC肿瘤与配对的非肿瘤之间的蛋白数量有显著差异。(I)主成分分析(PCA)。
无监督共识聚类在152例HCC患者中鉴定出三种蛋白质组学亚型,分别为SI (n = 49)、SII (n = 47)和SIII (n = 56)(图1A)。此外,三种蛋白质组亚型在总生存期(OS)和无复发生存期(RFS)方面存在显著差异(图1B)。在公开的队列中进一步验证了这三个蛋白质组学亚型,这支持了本项研究的蛋白质组学亚型的可靠性(图1C-E)。与目前临床特征一致的是,SIII比SI更突出BCLC晚期和TNM期、α-胎蛋白(AFP)阳性、显微血管侵犯(MVI+)、肿瘤低分化、多个肿瘤数目、肿瘤包膜缺失等特征(图1A)。
为了全面表征三种HCC蛋白质组亚型的分子特征,他们分析和总结了每种亚型特异性富集的信号通路(图1F)。SI的特征是代谢相关通路的富集程度最高,占所有富集通路的大多数。SII是从SI到SIII的过渡亚型,细胞生长和免疫相关通路增加,但代谢相关通路减少。SIII显示增殖、转移和免疫相关通路增加,证实SIII亚型的增殖特征(表示为增殖亚群,s-pf),表明SIII比SI和SII更具侵袭性(图1G)。
因此,三个独立研究中三种蛋白质组亚型的分子特征高度一致,表明HCC蛋白质组亚型的稳定性和可靠性。同时,HCC的相关或特异性通路与其蛋白质组亚型显著相关,进一步凸显其临床意义。
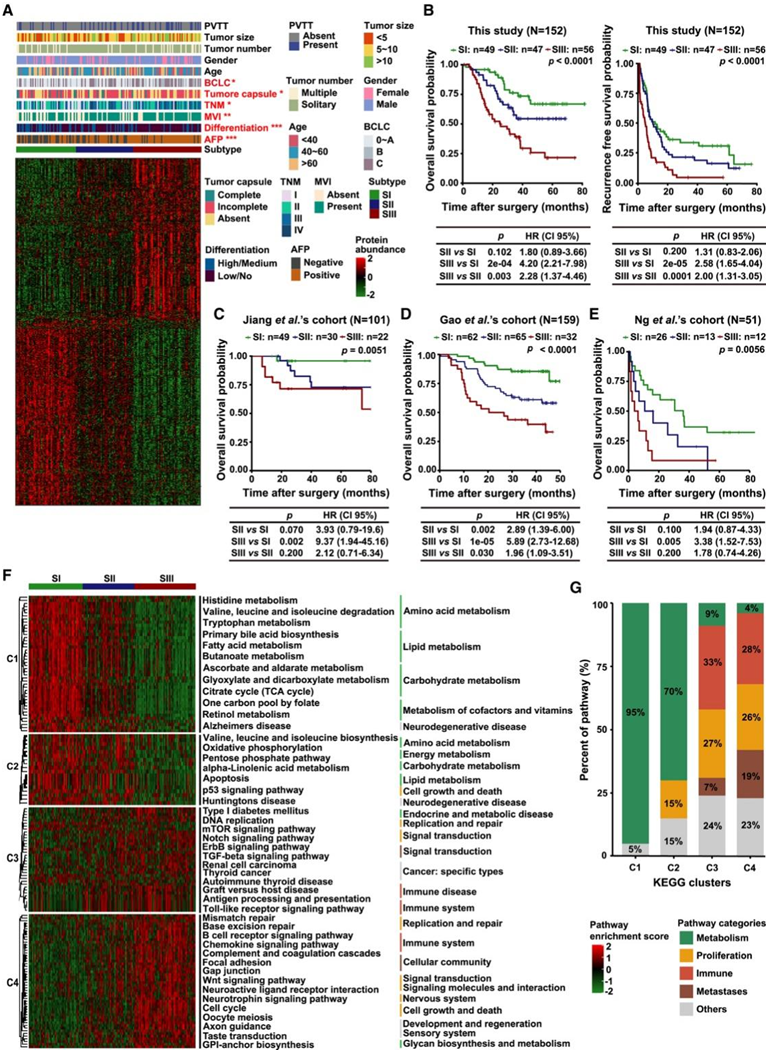
图1. 蛋白质组学表征确定了三种 HCC 亚型。
(A) 152 个 HCC 肿瘤的共识聚类。(B) 每个蛋白质组亚型的 OS 和 RFS 的 Kaplan-Meier (KM) 曲线。(C–E)每种蛋白质组亚型的 OS KM 曲线。 (F) ssGSEA 揭示了在三种蛋白质组亚型中显著富集的通路。(G) 四个聚类 (C1-C4) 中的信号通路变化趋势。
02
肝细胞癌蛋白质组亚型具有稳健性和普遍性
为了研究HCC蛋白质组亚型的普遍性,他们将本项研究的亚型与公开队列的蛋白质组亚型进行了交叉验证(图2A)。通过无监督共识聚类从公开队列中提取出特征聚类,产生了三个不同OS的亚型(图2B)。本项研究的特征聚类与公开队列一致性高达约80%(图2C-D)。这些结果表明,三个蛋白质组学研究的特征是稳健和普遍的。
总的来说,在三个独立的队列中验证了三个蛋白质组学亚型的强一致性,其中SIII在三个独立队列中三个亚型的一致性最高,其次是SI,而SII由于其过渡特性而一致性最低(图2E)。
接下来,他们建立了机器学习模型,产生了一个简化的面板 (SP9),其中包含九种蛋白质(DCXR、EHHADH、ALDH4A1、ABAT、ALDH6A1、ALDH7A1、SULT2A1、SORD 和 ACSM2B),这些蛋白质在 SIII 中均大幅下调。在验证队列中,SP9对SI辨别的敏感性和特异性分别为84.5%和96.4%,曲线下面积(AUC)为0.961;对于 SII 判别,敏感性和特异性分别为 72.7% 和 89.4%,AUC 为 0.881;在区分 SIII 与 SI 和 SII 患者时,分别具有最高的敏感性 (95.8%) 和特异性 (95.5%),AUC 最高为 0.988(图 2 G)。此外,使用SP9的亚型与原始亚型的相似度高达84.3%,与不同队列中三种亚型的相似性一致(图2H)。这些结果表明SP9对于HCC亚型分型稳定可靠,为HCC蛋白质组亚型的临床应用提供了可能性。
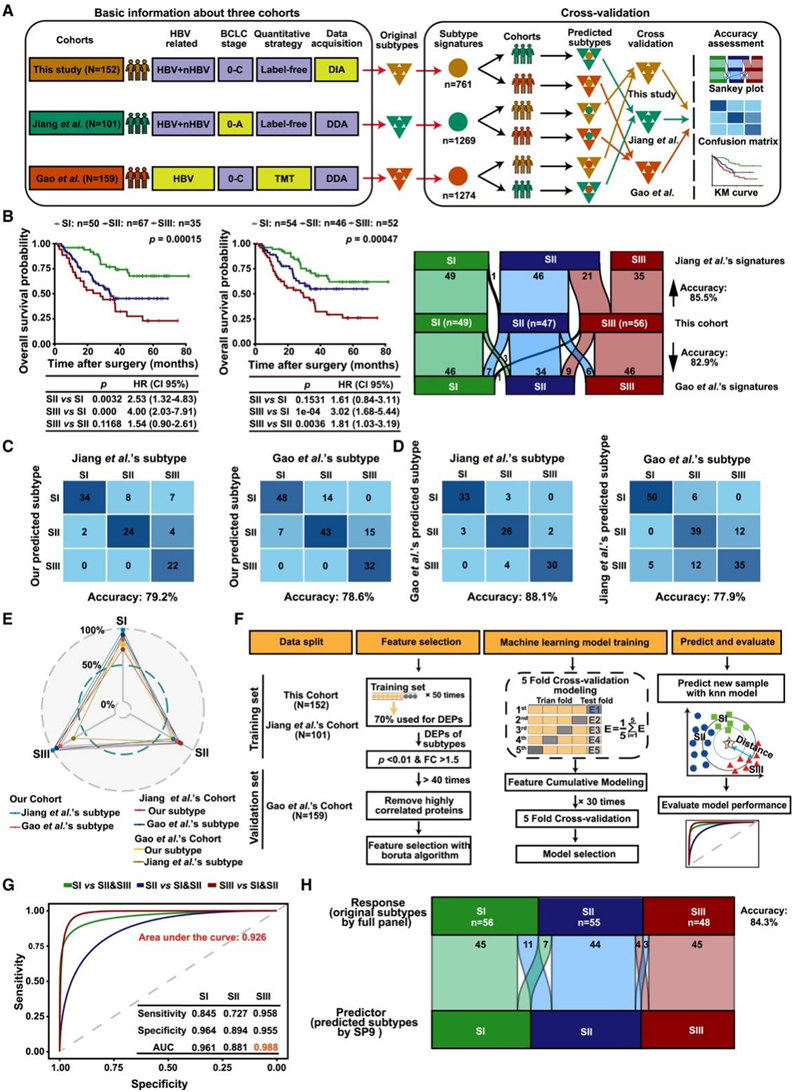
图2. HCC蛋白质组亚型及其简化判别组的稳健性和普遍性。
(A) 三个队列中蛋白质组特征交叉验证的工作流程。(B)左:显示了根据蛋白质组亚型的 OS 和 RFS 的 KM 曲线。右:冲积图显示了这些亚型与原始亚型之间的比较。(C-D)结合公开队列验证蛋白组特征。(E) 三个队列中三个蛋白质组特征的一致性率。(F) 开发用于区分蛋白质组亚型的简化面板的工作流程。(G) 用于区分验证集中蛋白质组亚型的简化面板的接收器操作特征准确性、灵敏度和特异性。(H) 冲积图显示了简化面板识别的蛋白质组亚型与验证集中的原始亚型之间的比较。
03
三种 HCC 蛋白质组亚型的突变和拷贝数变异情况
为了进一步探讨这三种蛋白质组亚型的分子特征,他们对配对的 T 和 N 样本进行了 WES、RNA-seq和磷酸化蛋白质组分析(图3A)。突变情况显示,TP53、TNN、OBSCN、CTNNB1、RYR2、PCLG、MUC16、RYR1、ARIDA1和RB1是 HCC 中最常见的突变基因(图 3B)。CTNNB1突变是 SI 和 SIII 中最重要的特征,并且与 OS 和 RFS 显著相关,而不是WNT 通路改变(图3C-F)。同时,不同HCC亚型之间的拷贝数变异(CNV)景观显示出显著差异,在肝癌发生和进展过程中具有不同的调控基因。1q 主要在 SII 和 SIII 中共同扩增,表明它们可能共同调节基因表达(图 3 B)。此外,个体患者的肿瘤突变负荷(TMB)和肿瘤新抗原负荷(TNB)揭示了HCC的异质性。然而,三种蛋白质组亚型之间的TMB和TNB没有显著差异(图3B)。
为了研究三种 HCC 蛋白质组亚型的免疫景观,他们使用基于蛋白质组和转录组数据的单样本基因集富集分析 (ssGSEA) 方法估计了 28 个免疫细胞群的丰度。三种 HCC 蛋白质组亚型的免疫景观表现出高度异质性,免疫细胞群丰度明显不同(图 3G-H)。SIII组免疫浸润评分明显高于SI和SII组(图3I)。
SIII组免疫活化细胞的ssGSEA富集评分均显著高于SI组和SII组(图3J)。同时,SIII中抗肿瘤免疫与促肿瘤免疫抑制显著正相关,表明侵袭性HCC中免疫激活与免疫抑制并存(图3K)。

图3. 三种HCC蛋白质组亚型的蛋白质组和免疫图谱。
(A) 单个组学实验中使用的 152 个配对 HCC 病例的图示。(B) 基于 WES 的三种 HCC 蛋白质组亚型的基因组图谱。(C–E) SI、SII和 SIII的随机森林算法的特征重要性排名。(F) CTNNB1 突变或野生型 HCC 患者 OS 的 KM 曲线。(G) 热图显示属于不同蛋白质组亚型的 HCC 患者的免疫细胞群。(H) 基于三种蛋白质组亚型的蛋白质组数据的免疫细胞群免疫评分的主成分分析(PCA)图。(I) 三种蛋白质组亚型基于蛋白质组的免疫评分。(J) 三种蛋白质组亚型中基于蛋白质组的抗肿瘤免疫和促肿瘤免疫抑制的免疫评分。(K)基于三种蛋白质组亚型的蛋白质组的抗肿瘤免疫和促肿瘤免疫抑制之间的相关性。
04
三种 HCC 蛋白质组亚型的磷酸化蛋白质组和激酶谱
在磷酸化蛋白质组学分析中,HCC肿瘤间的高度异质性在蛋白质组中也得到了清晰的体现,并且磷酸化修饰的特征与其他报道相似(图4A)。在磷酸化水平上富含三种蛋白质组亚型的信号通路也与RNA水平和蛋白质水平上的信号通路非常相似(图4B-C)。
鉴于蛋白激酶已经发展成为癌症治疗的可行药物靶点,他们接下来研究了三种蛋白质组学亚型的激酶活性(通过底物的总体磷酸化水平反映)及其与底物磷酸化水平和激酶丰度的相关性。在HCC中共发现215个激酶,其中75个激酶的活性在3个亚型中存在差异,这些富集的通路也提示激酶活性与HCC的发生发展密切相关(图4D-E)。此外,激酶与底物的相关性在SIII中显著低于SI和SII(图4F-G)。然而,激酶丰度和激酶活性之间没有相关性(图4H)。此外,激酶活性和激酶丰度在HCC中的临床价值也有显著差异。例如,BCKDK、CDK16和MAP3K2的激酶活性,而不是激酶丰度,对HCC的预后有显著影响(图4I-J)。因此,有必要结合蛋白质组学和磷酸化蛋白质组学系统分析激酶的丰度和活性,以进行药物筛选和精准治疗。
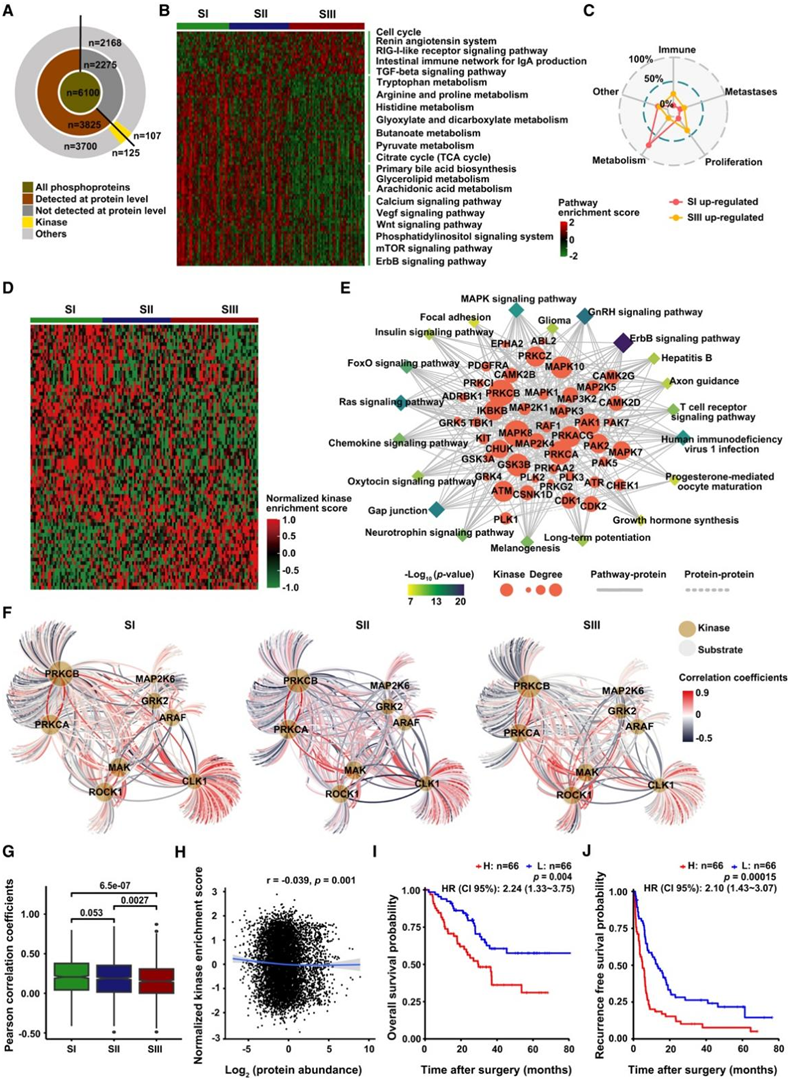
图4. 三种HCC蛋白质组亚型的磷酸化蛋白质组谱和激酶底物调控网络。
(A) 磷蛋白和激酶的鉴定总结。(B) 三种蛋白质组亚型中磷蛋白的通路改变。(C) ssGSEA 鉴定了三种蛋白质组亚型的功能。(D) 三种蛋白质组亚型之间差异富集的磷酸位点的激酶激活富集。(E) 激酶调节通路网络。(F) 三种蛋白质组亚型中的激酶-底物调控网络。(G) (F) 中激酶-底物网络的 Pearson 相关系数的分布。(H) 激酶丰度和激酶活性之间的相关性。(I-J) BCKDK 活性的 OS和 RFS的 KM 曲线。
05
三种 HCC 蛋白质组亚型的多组学景观
为了探究组间的相关性,他们使用Pearson相关系数将不同组间的相关性可视化。结果表明,相关性随着“中心法则”而降低,这可能归因于减毒蛋白的富集(图5A-C)。值得注意的是,磷酸化水平与CNV改变、mRNA和蛋白质丰度相关性较差,表明PTM蛋白在HCC的发生和进展中起重要作用(图5D-E)。此外,他们发现三分之二的显著mrna -蛋白协变量为正,同时显示出更多的蛋白质磷酸化负调控相互作用,这些相互作用可分为三个聚类(图5F)。与蛋白质组学亚型的特征一致,si特异性正相关聚类具有代谢特征,siii特异性正相关聚类显著参与增殖和转移通路(图5G)。
分子复合体(MCODE)/子网络分析显示了前五个关键的共变磷酸基-蛋白MCODE(图5H)。他们注意到一些激酶在MCODE中是共有的,例如,AKT1和CDK1,这两个共同变化的磷酸化蛋白MCODE,在三种蛋白质组亚型中是不同的。mRNA加工是si阳性聚类中的排名靠前的MCODE,并且鉴定了参与上游mRNA剪接转录调控的激酶PRKCA(图5I)。此外,核质转运是SII阳性聚类中最重要的MCODE,并且还绘制了实验验证或预测的上游激酶(CLK1、MAPKAPK2)(图5J)。相比之下,肌动蛋白细胞骨架的调节是SIII阳性聚类中最上面的MCODE,并且还报道了参与肌动蛋白细胞骨架组织上游调节的激酶AKT1(图5K)。
综上所述,由于具有较高的异质性和患者特异性,多组学的综合分析更适合于HCC的综合分子表征。特别是蛋白质组学和磷酸化蛋白质组学的综合分析在HCC的药物筛选和精准治疗中具有广阔的应用前景。
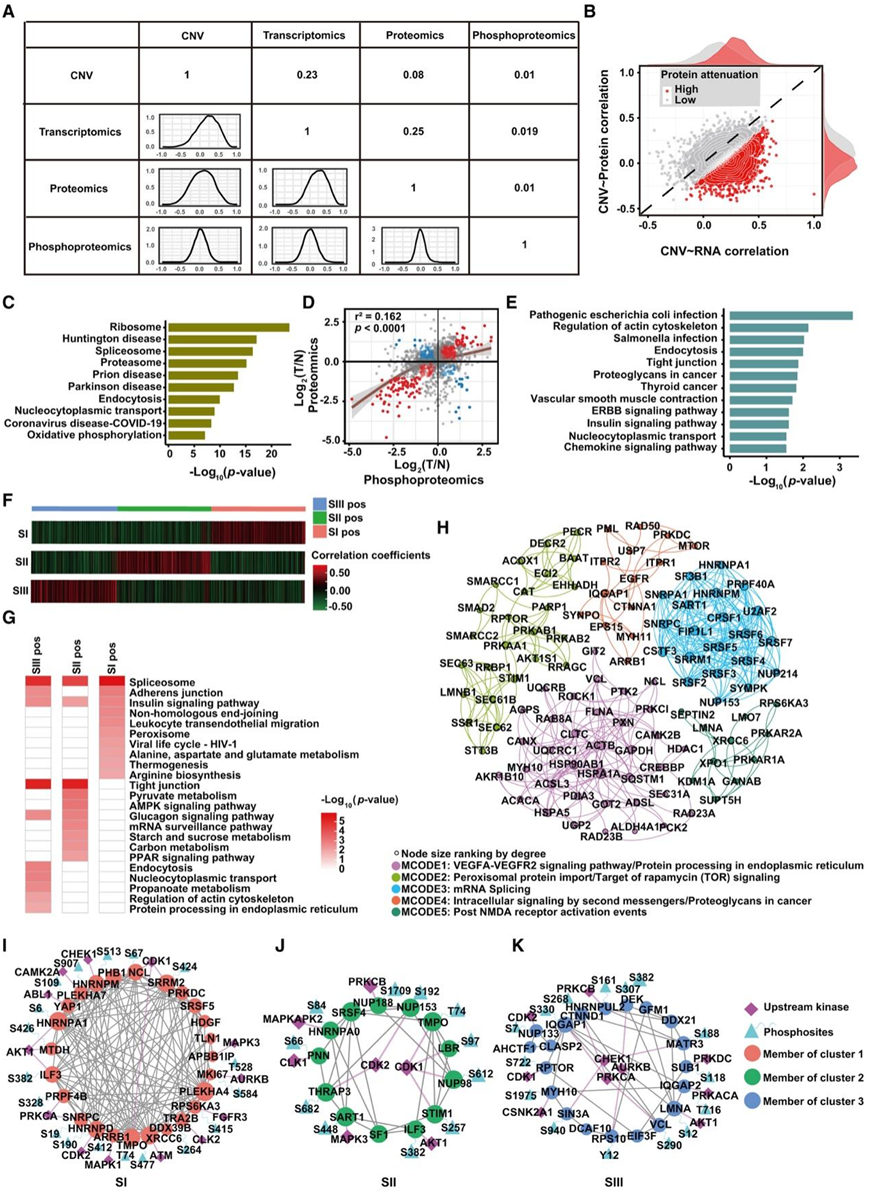
图5. 三种HCC蛋白质组亚型的综合多组学分析。
(A) WES、转录组、蛋白质组和磷蛋白质组之间的相关性。(B) CNV 与 mRNA 和蛋白质的 Spearman 相关性。(C) 减毒蛋白的富集的KEGG通路分析。(D) 散点图描绘蛋白质(x 轴)和磷蛋白(y 轴)丰度。(E) 富集 (D) 中负相关蛋白的 KEGG 通路。(F) 三种蛋白质组亚型之间显著变化的磷酸位点与蛋白质相关性的层次聚类分析图。(G) 每个聚类中显著的磷酸位点与蛋白质相关性的功能富集。(H) 三种蛋白质组亚型之间磷酸位点与蛋白质相关性显著改变的磷酸位点与蛋白质共变 MCODE/子网。(I–K) SI、SII和 SIII阳性中最重要的特定 MCODE 与上游激酶结合。
06
三种 HCC 蛋白质组亚型的药物反应预测
为了确定针对三种 HCC 亚型的潜在临床药物,他们使用定量蛋白质组和磷酸蛋白质组数据在 DrugBank 数据库中筛选实体瘤的药物靶点。共鉴定出属于 33 种临床可用药物的 38 个可量化药物靶点(包括 11 种激酶),三种蛋白质组亚型之间的丰度存在显著差异(图6A)。他们确定了贝伐单抗(C1QC、C1QB、C1QA、FCGR3A、FCGR2C)、达沙替尼(RSC、HSPA8、PPAT、CSK、LYN、MAPK14、FRK)和来拉替尼(ORM1、ORM2)的靶点,SIII 中的丰度高于 SI和SII。值得注意的是,索拉非尼和瑞戈非尼的关键靶点 RAF1 和 LYN 在 SIII 中的激酶丰度显著高于 SI 和 SII。然而,影响索拉非尼和瑞戈非尼药物活性(UGT1A9、UGT1A1、UGT1A3)或药物代谢(CYP2D6、CYP3A4)的酶在 SI 和 SII 中确定为高排名靶标,但在 SIII 中则没有。此外,SIII 中激酶 RAF1、MAP2K1、MAP2K2 和 LYN 的磷酸化底物也显著升高,表明 SIII 中激酶活性调节异常。激酶丰度和底物磷酸化之间的不一致表明激酶的异常调节是由激酶丰度和活性共同引起的(图6A)。
与 SI 和 SIII 相比,SII 中的 EGFR 激酶活性显著增加;与 SI 和 SII 相比,SIII 中 ERBB2 的激酶活性显著降低;而与 SI 和 SII 相比,SIII 中 MAP2K1 的激酶活性显著增加,与这三种亚型中这些激酶的蛋白丰度高度一致。然而,与SI和SII相比,SIII中RAF1的激酶活性显著下调,这与蛋白质丰度完全相反(图6B)。此外,SIII 中下游 mTOR 激酶活性的降低及其底物 EIF4EBP1 磷酸化的增加表明,针对 RAF-MEK-ERK 和 mTOR通路的联合治疗可能是治疗 SIII 更有效的方法(图 6 C)。
经过严格的筛选过程,临床可用药物的 22 个药物靶点中有 19 个显示出对 HCC 的显著预后价值(图 6D)。在这些靶点中,RAF1 与 OS 和 RFS 的负相关性最高(图 6 E)。SIII 中 RAF1 的丰度也显著高于 SI(图 6 F)。此外,与 SI 相比,RAF1 及其上游激酶之间的相关性在SII和SIII中显著增加,表明 RAF1 在 SII 和 SIII 中具有重要的调节作用(图 6 G)。这些观察结果可以表明 RAF1 靶向疗法(如索拉非尼、瑞戈非尼和达拉非尼)对 SIII 亚型 HCC 患者的潜在临床益处。
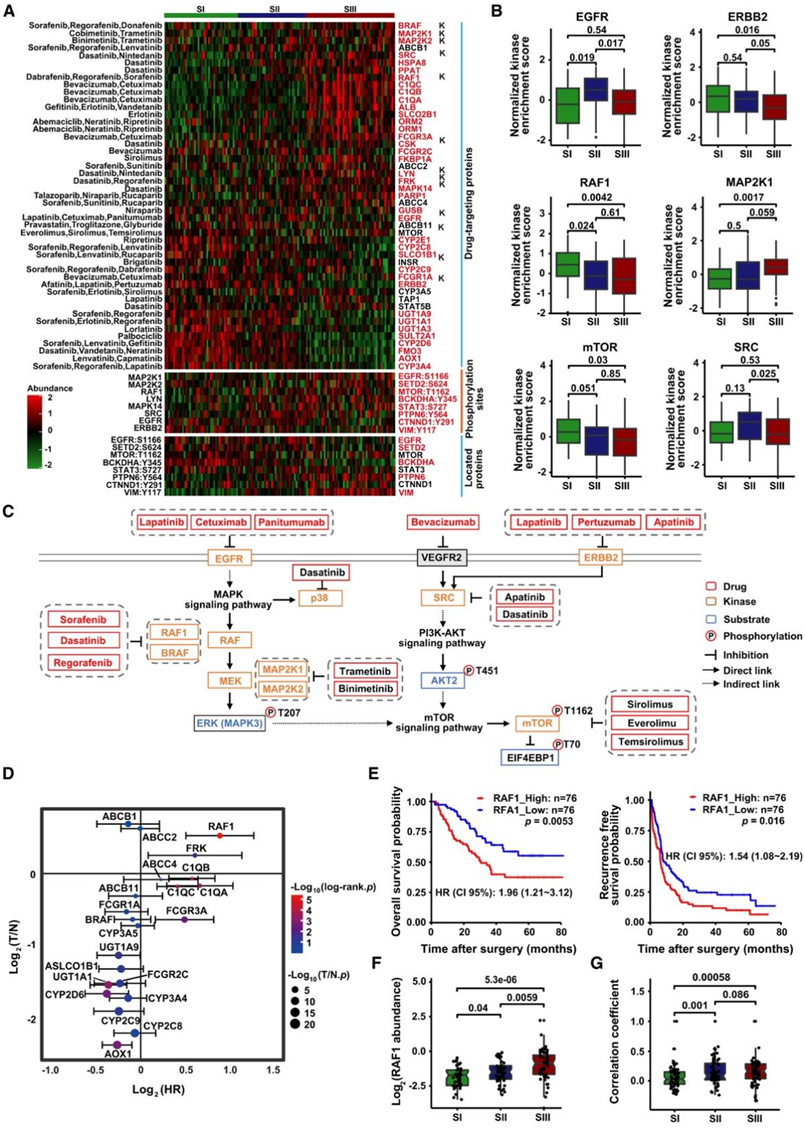
图6. 三种HCC亚型的药物预测及关键药物靶点筛选。
(A) 激酶的磷酸底物与临床可用药物以及激酶和底物分别在蛋白质组和磷酸蛋白质组水平上的差异倍数。(B) FDA 批准的药物靶标在三种蛋白质组亚型中的激酶活性。(C) 基于所选磷酸底物和激酶的通路,以及靶标显示的相关药物。(D) FDA 批准的 HCC 临床药物中每个靶标的预后风险评分。(E) RAF1 的 OS 和 RFS 的 KM 曲线。(F) 三种蛋白质组亚型中 RAF1 的丰度。(G) 三种蛋白质组亚型中底物 RAF1 和上游激酶活性之间的相关性。
07
SIII亚型比SI亚型对索拉非尼具有更高的特异性药物敏感性
为了进一步探讨 HCC 患者在三种蛋白质组亚型中的潜在药物反应,他们研究了索拉非尼对 26 个患者来源细胞(PDC)模型的治疗效果(图 7A-B)。这些 PDC 模型的临床病理学特征与蛋白质组亚型发现队列的临床病理学特征没有显著差异。
然后,他们通过计算治疗 4 天后剂量反应曲线的 AUC 来测量每个 PDC 对索拉非尼的药物反应,并比较三种蛋白质组亚型对索拉非尼反应的差异。总体而言,索拉非尼有效抑制 PDC 的增殖,每种亚型具有广泛的药物敏感性,表明 HCC PDC 具有高度异质性。值得注意的是,SII 和 SIII 肿瘤对索拉非尼表现出高度敏感性,而 SI 大多具有耐药性(图 7 C)。特别是,当索拉非尼浓度为 32 μM 甚至更高时,SII 和 SIII 中 PDC 生长的抑制明显强于 SI(图7D)。此外,SIII中达到半最大抑制浓度(IC50)的肿瘤百分比显著高于SI中(图7E),表明SIII肿瘤可能从索拉非尼中获得更多益处。这些发现证明了蛋白质组亚型在预测 HCC 患者靶向药物敏感性方面的强大潜力。
他们开发了一个弹性网络模型,以16个肿瘤作为训练集来预测对索拉非尼的反应,而其余10个肿瘤作为验证集。值得注意的是,观察到索拉非尼的预测和实际AUC之间存在高度相关性(图7F)。总的来说,该模型选择了19个蛋白质特征来预测索拉非尼的药物反应,其中大多数与索拉非尼敏感性呈负相关(图7G)。代谢相关通路在索拉非尼耐药肿瘤中高度富集,而细胞周期和mRNA监测通路在索拉非尼敏感肿瘤中高度富集(图7H-I)。
这些结果与SI和SIII的分子特征高度一致,进一步证明SIII和SII肿瘤对索拉非尼的敏感性高于SI。
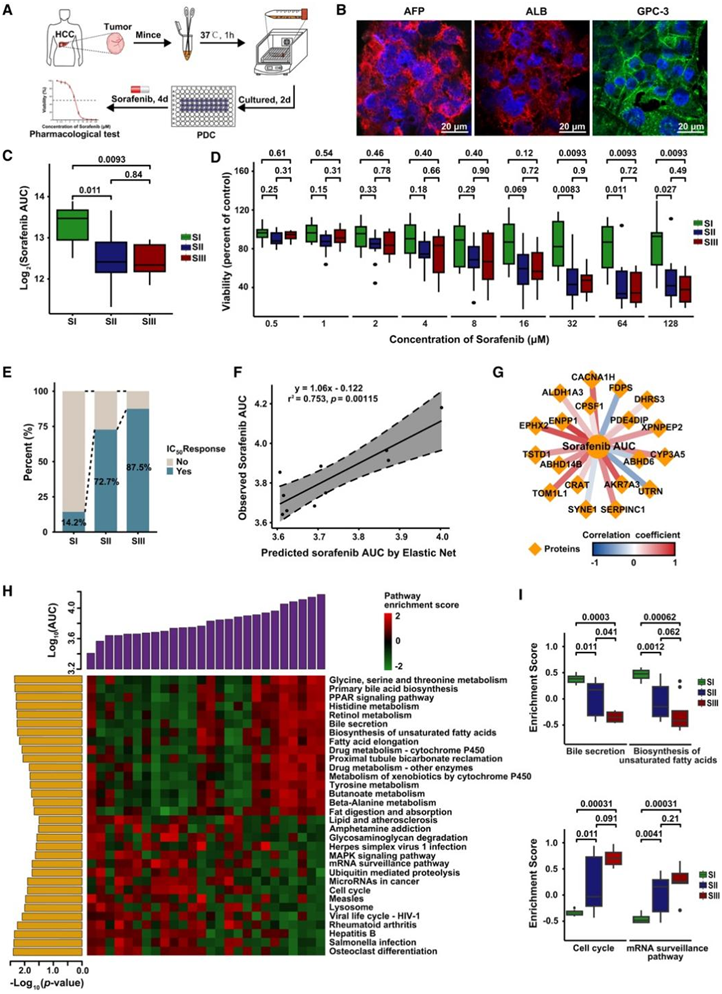
图7. 索拉非尼亚型特异性药物敏感性和基于机器学习的疗效预测模型。
(A) 使用 PDC 模型的药理测试工作流程。(B) PDC 的免疫荧光。(C) 三种蛋白质组亚型中 PDC 模型的索拉非尼敏感性结果。(D) 三种蛋白质组亚型不同浓度下索拉非尼PDC模型的敏感性结果。(E)三种蛋白质组学亚型中达到IC50的患者比例。(F)验证集中弹性网络预测和观察到的AUC之间的相关性。(G) 索拉非尼敏感性预测模型中选定蛋白质特征的调节网络。(H) PDC 模型中富集通路与观察到的 AUC 之间的相关性。(I) 三种蛋白质组亚型中与索拉非尼敏感性相关的通路的富集。
+ + + + + + + + + + +
结 论
本项研究整合了 HCC 患者的原发肿瘤组织和配对肿瘤旁组织的基因组、转录组、蛋白质组和磷酸蛋白质组分析。蛋白质组学分析确定了具有不同临床预后的三种 HCC 亚型,并在三个公开可用的外部验证集中进行了验证。与代谢重编程相关的九种蛋白质进一步鉴定为临床应用的潜在亚型特异性生物标志物。多组学分析进一步揭示,三种蛋白质组亚型在遗传改变、微环境失调、激酶底物调节网络和治疗反应方面具有显著差异。患者衍生的基于细胞的药物测试显示了索拉非尼在三种蛋白质组亚型中的个性化反应,这可以通过机器学习反应预测模型进行预测。总体而言,这项研究为更好地了解 HCC 亚型以进行精准临床治疗提供了新的理论依据。
+ + + + +



 English
English


