文献解读|Cell Discov(33.5):人类胎儿小脑谱系发育和空间组织的单细胞多组学分析
✦ +
+
论文ID
原名:Single-cell multi-omics analysis of lineage development and spatial organization in the human fetal cerebellum
译名:人类胎儿小脑谱系发育和空间组织的单细胞多组学分析
期刊:Cell Discovery
影响因子:33.5
发表时间:2024.02.26
DOI号:10.1038/s41421-024-00656-1
背 景
人类小脑包含大量神经元,表现出与大脑不同的发育模式。几乎所有种类的脊椎动物成熟的小脑都具有三层,即分子层(ML)、浦肯野细胞层(PCL)和颗粒细胞层(GCL)。在白质上方,GCL 包含密集颗粒细胞 (GC),其上覆盖着一层浦肯野细胞 (PKC)。在发育过程中,小脑中的大多数神经元源自两个生发中心,即心室区(VZ)和菱形上唇(URL)。目前对人类小脑发育和进化的分子机制尚不明确。
实验设计
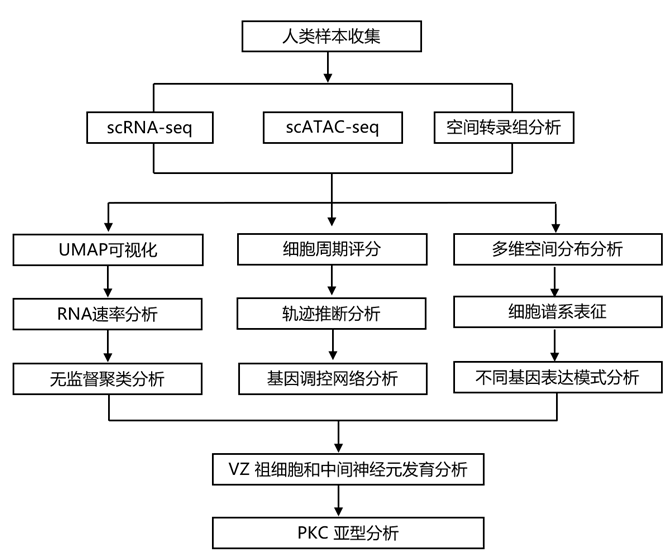
结 果
01
人类小脑发育过程的高质量多组学分析
研究团队应用 scRNA-seq、scATAC-seq 和空间转录组学方法来获得发育中的人类小脑的高质量多组学特征,包括覆盖人类妊娠周(GW)13-GW18样本的单细胞转录组分析(scRNA-seq)、GW13和GW16样本的空间转录组分析(Stereo-seq)以及GW13样本的单细胞转座酶可及染色质测序(scATAC-seq)(图1a)。他们鉴定了gaba能谱系,如中间神经元(PAX2+),PKC (CA8+WNT7B+)和兴奋谱系,包括ubc (EOMES+LMX1A+)、GC祖细胞(ATOH1+LHX9 -)和分裂后GC (NHLH1+LHX9 - tbr1-)(图1b-c)。并对主要来源于VZ的HES1+祖细胞和胶质细胞进行了分类(图1b-c),并探索更多的细胞类型特异性标记(图1d)。
以往的研究发现,ATOH1在外部颗粒层(EGL)的url来源的兴奋性祖细胞中高表达,包括GC祖细胞,而PTF1A在VZ出现的祖细胞中富集。RNA速率分析确定了一致的幼稚祖细胞(图1e)。G2/M期标志物(如TOP2A)与ATOH1共表达,而TOP2A与PTF1A几乎未见共表达(图1c)。这可能是由于与兴奋性祖细胞相比,PTF1A+祖细胞的比例较小。此外,PKC丰度在GW13中最高,随后急剧下降(图1f)。PKC在GW13左右就产生结束(图1a),而EGL正在迅速增殖,产生大量的gc,迅速超过PKC。ubc的比例在GW16左右达到峰值(图1f)。每个数据集与相邻时间点的数据也有很好的相关性(图1g)。这些结果表明,本项研究的scRNA-seq数据总体上捕获了人类小脑发育的特征。
本项研究的空间转录组学数据在bin 50分辨率下进行分析。在GW13和GW16收集的样本中分别对3609个bin(平均2481个基因/bin)和15880个bin(平均1890个基因/bin)进行了分析(图1h-k)。scRNA-seq和空间转录组数据之间的相关性是根据每个数据集的伪体积计算的(图1l)。无监督聚类表明,GW13空间转录组数据中不同细胞类型的多层环形分布,分别与外EGL (oEGL)和内EGL(iEGL)区域相关(图1h)。在GW16空间转录组数据中还检测到菱形唇(RL)、EGL和浦肯野细胞层(PKL)的明显分离(图1j)。
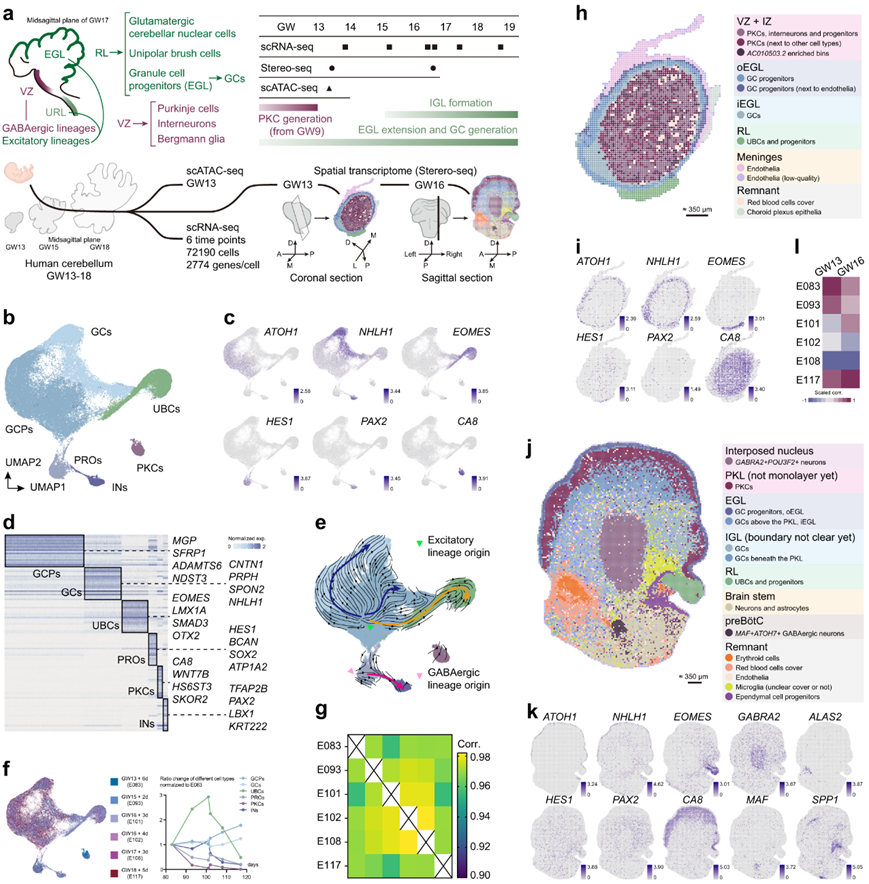
图1. 人类小脑发育的多组学分析。
(a) 人类小脑中主要细胞类型发育的示意图(左上)以及胎儿样本的时间点和相应的生物事件(右上)。多组学分析的示意图(下)。(b) 整合的人类 scRNA-seq 数据的可视化以及细胞特征颜色编码。(c)整合的 scRNA-seq 中标记基因的基因表达模式。(d) 热图显示不同细胞类型的标记基因。(e) 基因速度流图在集成数据的 UMAP 嵌入上可视化。(f) scRNA-seq 数据中不同时间点的人类样本和主要细胞类型的贡献(左)。显示不同细胞类型比率变化的折线图(右)。(g)不同时间点的scRNA-seq数据之间的相关性。(h-k)不同细胞类型标记基因在 GW13和 GW16 的空间基因表达模式。(l) 不同时间点的空间转录组数据和scRNA-seq数据之间的相关性。
02
GC谱系中的发育轨迹和瞬时扩增祖细胞
GC 占小脑兴奋性神经元的大部分,其特征是表达NRN1。为了研究 GC 的发育,他们首先对NRN1+ EOMES– GC 谱系细胞进行细胞周期评分。可以明显区分G1期或S/G2/M期高增殖的SFRP1+ATOH1+ GC祖细胞,以及NHLH1+STMN2+有丝分裂后GC(图2a)。GO分析证实,与祖细胞相比,有丝分裂后GC的轴突发育具有较高的活性。
基于G1期细胞,他们使用Monocle3构建GC谱系的伪时间轨迹(图2a)。沿轨迹,NEUROD1表达的升高往往比有丝分裂后GC的其他标志物更早(图2b)。同时还发现NEUROD1和S/G2/M期标志物的共表达,表明这些细胞具有增殖特征。他们进一步分类将GC祖细胞分为ATOH1+ GC祖细胞(AT+GCP)和NEUROD1+ GC祖细胞(ND+GCP)。ND+GCP中NEUROD1和ELAVL2表达水平较高,但与AT+GCP相比,在ND+GCP中几乎没有检测到SOX2(图2c)。最近的研究表明,ND+GCP类似于小鼠的瞬时扩增祖细胞,位于AT+GCP下方。特别是在本项研究的GW13空间转录组数据中,可以观察到这种内外分离,其中可以检测到清晰的iEGL和oEGL边界(图2d)。基因集富集分析(GSEA)表明,趋化因子、Ras或Rap1信号通路在人和小鼠ND+GCP神经分化过程中的形态学变化中具有激活作用,提示其调控通路在物种间具有保守性(图2e)。
此外,通过整合scRNA-seq和scATAC-seq数据,选择在祖细胞或有丝分裂后细胞中富集的转录因子进行GRN分析。他们利用推断的发育轨迹和基因调控网络(grn)来确定在GC分化过程中可能调节细胞状态转变的关键基因(图2f)。除了ATOH1之外,还发现YBX3和MEF2C等转录因子可能参与 GC 的发育(图2f)。有趣的是,他们根据 GC 谱系的伪时间轨迹,在有丝分裂后 GC 中发现了一个标记PRPH 。PRPH显示出与SFRP1几乎互补的表达模式,但在最成熟的GC中检测不到(图2g)。
与 scRNA-seq 数据一致, SFRP1和PRPH的非重叠表达模式在空间转录组数据中都可见(图2g)。PRPH的表达在iEGL中几乎受到限制,并且在迁移GC和IGL GC中几乎检测不到(图2g)。进一步探索具有相似表达模式的基因,他们发现CPLX3只在iEGL前部检测到,而SV2B在iEGL中富集,特异性较低(图2h)。PRPH编码神经元中间丝蛋白外周蛋白,其突变可导致神经丝网络组装的破坏。CPLX3和SV2B均参与调节神经递质分泌。根据STRING数据库,这些蛋白质参与了蛋白质相互作用网络(图2h)。他们推测这个蛋白质相互作用网络以区域特异性的方式参与了GC迁移的调节。
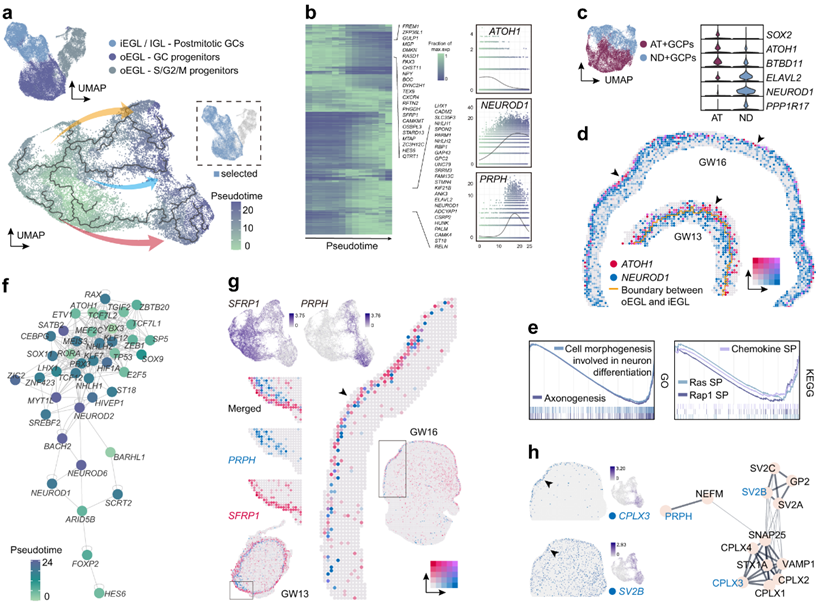
图2. GC 谱系中的轨迹推断和 EGL 祖细胞亚型。
(a) 细胞周期不同阶段 GC 谱系的可视化(上)。G1 期 GC 祖细胞和有丝分裂后 GC 的 UMAP可视化(下)。(b) 不同基因沿伪时间的表达模式发生改变。(c) AT+GCP 和 ND+GCP 的可视化(左)和显示其标记基因表达模式的小提琴图(右)。(d) 空间基因表达模式显示ATOH1和NEUROD1在人小脑 GW13 和 GW16 EGL 中的独立表达。(e) AT+GCP 与 ND+GCP 中通路富集图。(f) GC 发育的 GRN。(g) scRNA-seq 和空间 RNA-seq 数据中SFRP1和PRPH的基因表达模式。(h) CPLX3和SV2B在 GW16 的空间基因表达模式,箭头突出显示 EGL 中的富集(左)。根据 STRING 的蛋白质相互作用网络(右)。
03
GC亚系及其多维空间分布
神经回路分析揭示了不同小脑区域的功能偏好,例如负责感觉运动功能的前叶和负责认知功能的外侧后叶。由于CPLX3在前部区域特异性表达(图2h),伪时间轨迹中标记的GC的三个亚谱系也可能类似于在不同区域组织的GC(图2a)。进一步的分析揭示了GC祖细胞和有丝分裂后GC中以BARHL1和TLX3为代表的相互排斥的表达基因组(图3a)。BARHL1和TLX3的前后(AP)分布尤其在GW16的矢状切面中清晰可见(图3b)。在伪时间轨迹中识别出三个亚谱系,分别对应于前叶、后叶和小叶结节叶,其中小叶结节叶和后叶均为TLX3+(图3c-d)。在scRNA-seq和空间转录组数据中发现了相似的基因表达模式,如CERKL富集于絮凝结节叶,NTF3富集于后叶,TRH富集于絮凝结节叶和前叶(图3d)。可以在EGL祖细胞或IGL有丝分裂后GC中观察到区域特异性基因表达(图3d)。
先前的报道和Allen Brain的原位杂交数据表明,小鼠Tlx3在后叶高度表达,而在絮凝结节叶中不表达(图3e)。令人惊讶的是,在人类中发现的与a-p轴分布相关的基因群与小鼠的数据几乎没有相关性,反之亦然,这表明了巨大的跨物种差异(图3f)。例如,PARM1在人类的后叶富集,而在小鼠的前叶富集,在物种间表现出完全相反的分布(图3d-e)。
在分化过程中,一些转录因子似乎是核心调控因子,如前部的RORB、RORA、ESRRG和后部的TLX3、ETV5、GLI3(图3g)。综合数据显示,不同区域的GC对多个标记基因位点的可达性有偏好,这与其表达模式一致(图3g)。除了沿A-P轴的分离外,在GW13空间转录组数据的oEGL中还发现了背-内侧(DM)和腹-外侧(VL)轴的变异。根据scRNA-seq数据中EBF2、PRR35、GALNTL6、HEY1的表达将GC祖细胞分为四组(图3h)。PRR35特异性表达于oEGL的VL区,而EBF2和HEY1似乎富集于DM区(图3h)。DM-VL的差异提示了小脑蚓部和半球之间的异质性。EN1在小脑蚓的发育中起着至关重要的作用,在本项研究数据中,EN1在大多数EBF2+前亚型中都有高表达(图3h)。
为了了解各种GC亚谱系的功能含义,他们参考了人类表型本体数据库来分析与小脑疾病相关的风险基因。以小脑发育不全为特征的肢端胼胝体综合征与GLI3突变有关。GLI3在小叶结节状叶GC祖细胞中高表达(图3d),提示特定小叶在小脑发育中的重要作用。
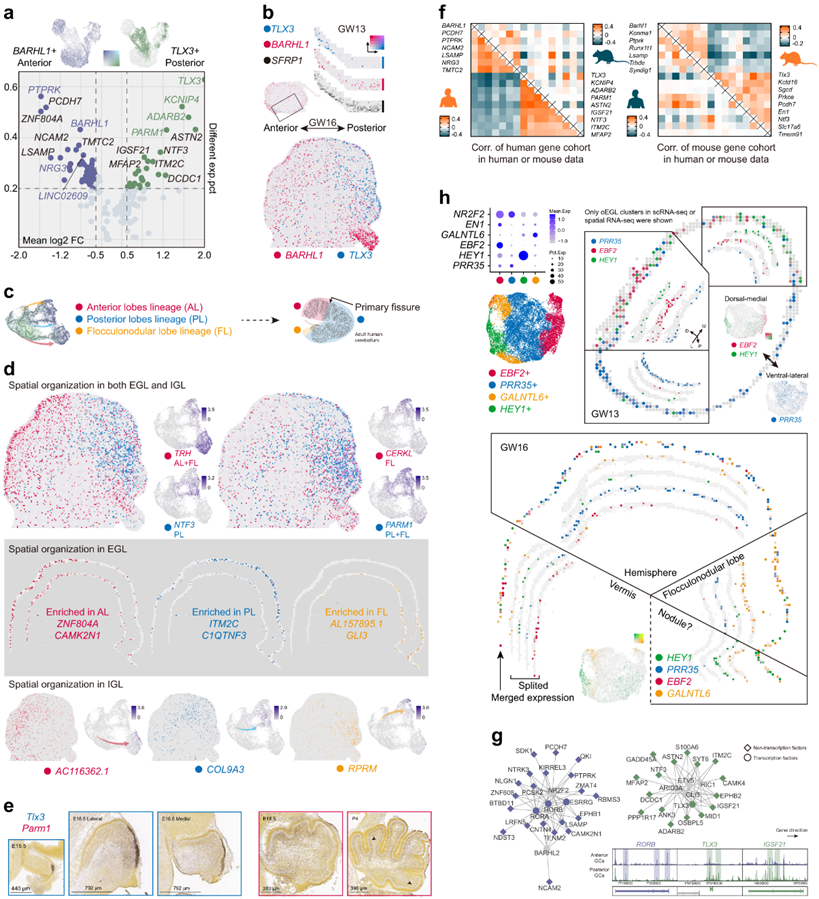
图3. GC 谱系的空间分离和亚谱系的表征。
(a) GC 谱系中BARHL1和TLX3的基因表达模式(上)。显示互补表达基因组的火山图(下)。(b) GW13(上)和 GW16(下)前部区域BARHL1和后部区域TLX3的空间基因表达模式。(c) 对应于人类小脑三个叶的三个 GC 亚系的示意图。(d) EGL 和 IGL 中 GC 亚系的空间组织。(e) 小鼠 E15.5 和 E18.5 的Tlx3和Parm1原位杂交结果。(f) 人类和小鼠数据集中人类(左)或小鼠(右)基因组的相关性,显示物种特定的空间基因表达模式。(g) GRN 显示前部(蓝色)或后部(绿色)特定基因(左上)的潜在调控程序以及不同基因中可访问区域的可视化(右下)。(h) scRNA-seq 数据中 GC 祖细胞四种亚型的可视化及其标记基因的表达(左上)。GW13 的 oEGL 中PRR35、EBF2和HEY1的空间分布(右上)。GW16 的 EGL 中HEY1、PRR35、EBF2和GALNTL6的空间分布(下)。
04
UBC血统发展
ubc是一种兴奋性中间神经元,富集于小脑正中皮层和小叶/小叶旁复合体的一部分。ubc和GC是由RL中的WLS+祖细胞产生的神经元谱系。他们描述了一种新特征的潜在神经上皮(标记为UBCpro-1),它可能产生经典的WLS+CALCB+ UBC祖细胞(标记为UBCpro-2)(图4a)。根据scRNA-seq数据,他们发现了COL2A1+PIK3C2G+祖细胞(UBCpro-1)的新聚类,该聚类高水平表达SOX2和CYP26B1等干细胞相关标记(图4b),且UBCpro-1与经典WLS+ UBC祖细胞之间似乎存在一些相关性(图4a)。然后他们参考空间转录组数据来研究这些细胞的分布。首先,通过GW13数据的共表达基因模块分析和GW16数据的形态来定义RL(图4c)。
在标记的RL区域检测到UBC标记,包括eome、LMX1A和OTX2。RLVZ和RLSVZ (RL的室下区)的区隔分别以CALCB和EOMES的表达为特征,也在本项研究的空间转录组学数据中重新捕获(图4d)。CALCB和EOMES的结构由内向外,COL2A1似乎在最内侧的区域高表达(图4d)。因此,他们推测UBCpro-1是产生经典WLS+CALCB+ UBC祖细胞的神经上皮细胞。他们还确定了关键转录因子(TF)如ASCL1、ETV3、ELF1和ATOH1,这些TF可能在UBC谱系分化过程中调控细胞状态转变(图4e)。
成熟的ubc可根据CALB2或GRM1的表达情况分为两种亚型。他们还发现了两种潜在的UBC亚型,它们可以通过LMX1A和CNTNAP5的表达来区分(图4f)。LMX1A+ ubc更可能是具有先前报道的分子特征的典型GRM1+ ubc,而CNTNAP5+ ubc可能是未成熟的CALB2+ ubc(图4f)。
利用两个UBC谱系的标记(图4g),他们构建了参与UBC谱系多样化的grn(图4h)。他们发现EOMES和PBX3是控制所有UBC谱系特化的核心调控因子,而SP5可能对CNTNAP5+亚谱系的发展至关重要(图4h)。
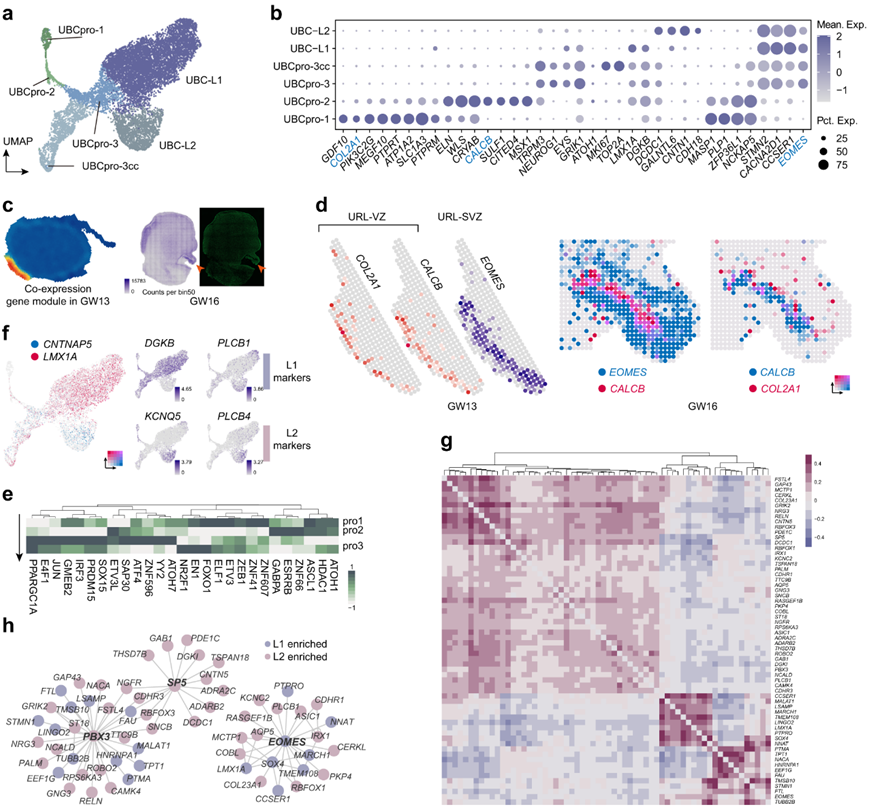
图4. UBC 祖细胞和 UBC 亚系的 GRN。
(a) UBC 谱系的可视化。(b) 点图显示(a)中不同细胞类型标记基因的表达模式。 (c) 热图显示 URL 中包含EOMES和CALCB的共表达基因模块的高强度(左)。人类 GW16 小脑的 RNA 计数图和荧光图像(右)。(d) 空间基因表达模式显示COL2A1 +细胞在 URL 中的分布。(e) 热图显示不同 UBC 祖细胞中的调节子强度。(f) CNTNAP5和LMX1A在不同 UBC 亚系中的基因表达模式(左)。已报道的 UBC 亚系标记的基因表达模式(右)。(g) 热图显示 UBC 亚系标记基因的相关系数。(h) GRN 显示不同 UBC 亚系的潜在调控程序。
05
VZ祖细胞和中间神经元发育
与发育中的前脑中神经节隆起的作用类似,VZ 产生多种类型的 GABA 能神经元,包括 PKC 和各种中间神经元。为了表征GABA能谱系的发育,他们选择VZ衍生的祖细胞和神经元进行进一步分析(图5a),发现了几种非神经元细胞,包括OLIG2 + PDGFRA+少突胶质细胞祖细胞和PIFO+ RSPH1+室管膜细胞祖细胞(图5b-c)。根据TNC和FAM107A的表达也可以鉴定促进PKC和GC迁移的Bergmann胶质细胞。此外,LINC01727似乎是小脑伯格曼神经胶质细胞的特异性标记(图5b),伪时间分析仅适用于潜在的中间神经元谱系(图5c)。GO富集分析表明,从PANTR1 +细胞中活跃的轴突形成转变为IGFBP5 +细胞中活跃的突触组织(图5c),表明中间神经元的成熟进程。
PKC在小脑回路中以相对有限的细胞数量执行关键功能。根据Zebrin II(由ALDOC基因编码的蛋白)沿外侧-内侧(L-M)轴的交替表达条带,成熟PKC可分为两个亚型。他们鉴定了三种分子上不同的PKC亚型,标记为PKC1、PKC2和PKC3(图5d)。PKC1为EBF2+IGF1+细胞,与报道的Zebrin II阴性PKC相对应(图5d)。因此,FGF3表达的LSAMP+PCP4L1+ PKC2和SLA+PBX3+ PKC3都可能是Zebrin II阳性PKCs的亚型。在GW16空间转录组数据中可以发现IGF1-FGF3和PCP4L1-SLA的分离(图5e),这表明PKC的三种分子亚型及其空间组织之间存在对应关系。POSTN和IGSF21的分布类似于GC谱系中提到的A-P模式(图5e)。
虽然POSTN是神经突生长促进因子,但IGSF21可以调节抑制性突触前分化。这种差异可能与前后PKC的功能多样化或发育速率不同步有关。调控细胞迁移的信号蛋白家族的不同成员在不同的区域富集(图5e)。先前的研究表明,Sema3e和Sema3d通过不同的分子途径介导内皮细胞排斥。他们还发现CADM1和PLCB4/CADM2之间沿背腹(D-V)轴存在保守分离,特别是在PKC发育早期的后部区域(图5f)。CADM1的表达似乎在腹侧区域富集,在人(GW13)和小鼠(E15.5)中都可以检测到(图5f)。
他们还检测了PKC的跨物种相似性。据最近的一项研究报道,小鼠Car8+ PKC可分为四种亚型(图5g)。在GW13空间转录组数据中,FOXP1high和RORB+ PKC沿L-M轴存在空间分离,这在人和小鼠之间相似(图5g)。
利用整合的scRNA-seq和scATAC-seq数据,他们还生成了grn,并研究了PKC谱系多样化的潜在调控元件(图5h)。在本项scATAC-seq数据中,PKC也可以分为三种类型(图5h)。他们发现EBF2可能通过远离启动子的增强子特异性激活SEMA3A(图5i),这与报道的EBF2缺失小鼠中SEMA3A+ PKC的明显减少一致。NR2F2和ZNF664也可能参与不同PKC亚型的分化(图5i)。
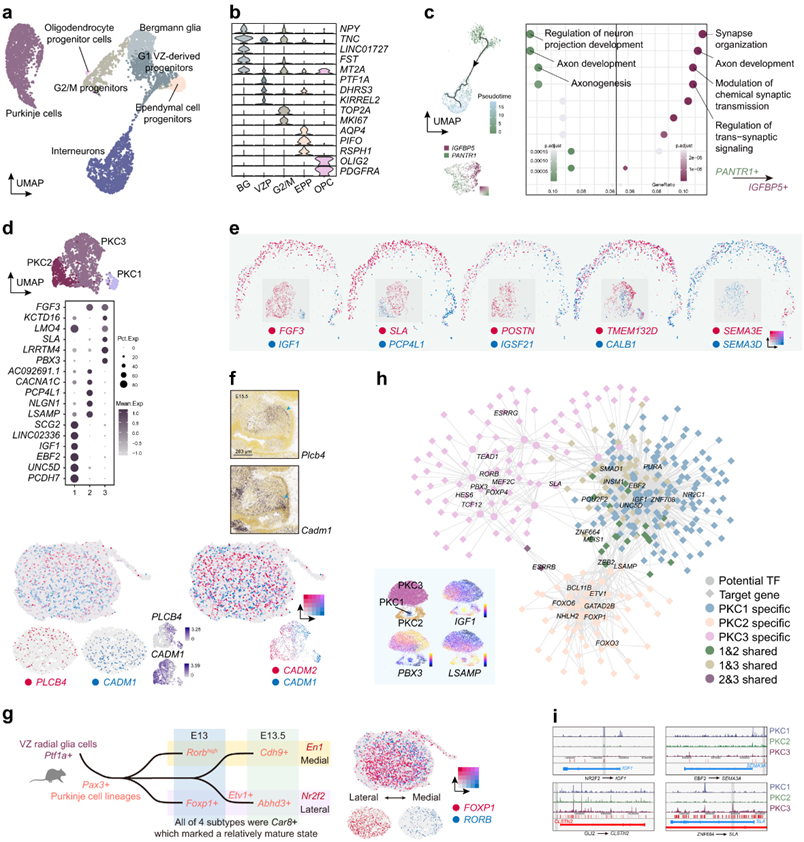
图5. 中间神经元谱系和 PKC 亚型的轨迹。
(a) 不同祖细胞、GABA 能神经元和神经胶质细胞的可视化。 (b) 小提琴图显示(a)中细胞类型标记基因的表达模式。(c) 从 VZ 祖细胞到中间神经元的伪时间轨迹(左上)。PANTR1和IGFBP5的基因表达模式(左下)。PANTR1 +和IGFBP5 +中间神经元的富集结果(右)。 (d) 三种 PKC 亚型的可视化(上)和显示标记基因相应表达模式的点图(下)。(e) GW16 Stereo-seq 揭示的 PKC 多维空间基因表达模式以及 scRNA-seq 揭示的相应基因表达模式。(f) scRNA-seq 和 GW13 Stereo-seq 揭示的 PKC 中PLCB4、CADM1和CADM2的基因表达模式(下)。E15.5 小鼠中Plcb4和Cadm1的原位杂交结果(上)。(g) 小鼠 PKC 发育进展示意图(左)。FOXP1和RORB在人 GW13 小脑中沿 LM 轴的表达(右)。(h) GRN 显示不同 PKC 亚型的潜在调控程序(右上)。scATAC-seq 数据中无监督聚类的可视化及其标记基因的分数,其中蓝色代表低水平,黄色代表高水平(左下)。(i) 三种 PKC 亚型中不同基因的可及区域的可视化。
+ + + + + + + + + + +
结 论
本项研究对妊娠周 (GW) 13 至 18 的胎儿样本进行了 scRNA-seq、scATAC-seq 和空间转录组分析,以探索发育中的人类小脑中细胞多样性和发育程序的出现,鉴定出了跨物种保守的暂时性颗粒细胞祖细胞。对小脑叶的物种特异性基因表达模式进行了表征,发现PARM1在人和小鼠颗粒细胞中表现出不一致的分布。在RL上发现了一个新的潜在神经上皮聚类。他们还解析了浦肯野细胞和单极刷状细胞的各种亚型,并揭示了控制其多样化的基因调控网络。因此,这项研究提供了人类胎儿小脑的有价值的多组学景观,并增进了对人类小脑发育和空间组织的理解。
+ + + + +



 English
English


