文献解读|Nat Metab(20.8):导致 3-磷酸甘油和磷酸乙醇胺积累的稳态开关通过引起脂质代谢重塑引发衰老
✦ +
+
论文ID
原名:A homoeostatic switch causing glycerol-3-phosphate and phosphoethanolamine accumulation triggers senescence by rewiring lipid metabolism
译名:导致 3-磷酸甘油和磷酸乙醇胺积累的稳态开关通过引起脂质代谢重塑引发衰老
期刊:Nature Metabolism
影响因子:20.8
发表时间:2024.02.19
DOI号:10.1038/s42255-023-00972-y
背 景
细胞衰老影响许多生理和病理过程,其特征是持久的细胞周期停滞、炎症分泌表型和代谢重编程。衰老细胞通过衰老相关分泌表型(SASP)与免疫细胞在功能上相互作用,其特征是产生炎症因子[如白细胞介素(IL)-6、IL-1α和IL-1β]、趋化因子(如CCL2和CXCL8)、免疫调节剂(前列腺素)和基质重塑因子(如MMP、serpin、PAI1和TIMP)。甘油三酯(TAG)代谢的深刻改变反映了脂质摄取、合成和脂肪酸氧化(FAO)之间复杂的相互作用。目前尚不清楚衰老过程中FAO的上调是否主要用于能量平衡、脂肪解毒、SASP维持或通过组蛋白乙酰化进行表观遗传修饰。
实验设计
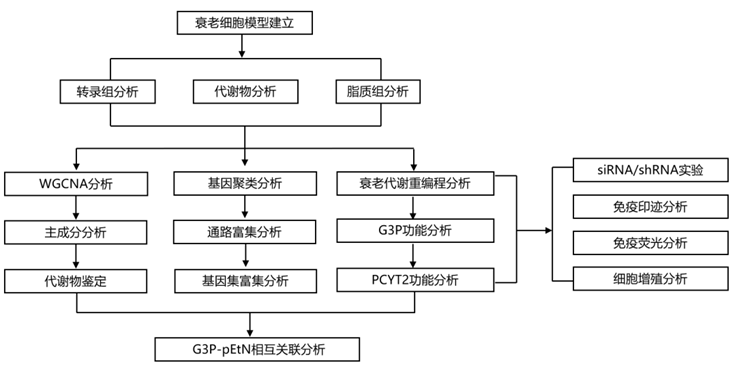
结 果
01
衰老细胞亚型的代谢景观
为了确定单个衰老细胞的代谢特征和潜在的代谢脆弱性,研究团队使用基于质谱(MS)的分析对暴露于各种形式的衰老诱导应激的正常人类二倍体成纤维细胞(WI38细胞系)进行了有针对性的、时间分辨的代谢谱分析,包括高活性癌基因(RAS和RAF OIS)、复制性衰老(RS)和DNA损伤诱导衰老(DDIS)(依托泊苷诱导)(图1a)。为了表征不同衰老亚型的代谢进化,他们在MS分析中通过靶向模式鉴定代谢物,使用加权相关网络分析(WGCNA)对它们的时间过程进行独立聚类,识别出具有高度相关代谢物表达轨迹的代谢物模块,从而揭示衰老状态和诱导剂特异性代谢物模式(图1b-e)。RAS OIS中115种代谢物、RAF OIS中71种、DDIS中107种、RS中118种、静止状态中94种代谢物水平发生显著变化。与之前在各种衰老细胞生物学模型中的研究一致,他们发现脂肪酸代谢(如酰基肉碱)增加,葡萄糖分流到乳酸,戊糖磷酸通路(sedoheptulose-7 phosphate;S7P)和尿苷二磷酸n -乙酰氨基葡萄糖(UDP-GlcNAc)以及中枢碳代谢[如α-酮戊二酸酯(α-KG)和苹果酸酯]和Kennedy通路(如pEtN)的改变。
接下来,他们可视化了每种衰老诱导剂的代谢组动力学,以确定单个衰老亚型的共性和特异性,并进行了综合动态代谢组主成分分析(PCA)(图1f-g)。PCA显示了三个关键点。首先,衰老和静止的代谢景观是截然相反的(PC1)。其次,衰老亚型代谢组之间的总体时间轨迹与相邻状态相对应,在PCA象限的右上方结束(图1f)。第三,绘制代谢物与主成分之间的相关性(图1g),识别出对静止相关代谢位移(相关圈左上象限)和衰老相关代谢位移(SAMS)(相关圈右上象限)有显著贡献的代谢物,特别是α-酮戊二酸(α-KG)、甘油三磷酸(G3P)、磷酸乙醇胺(pEtN)、UDP-GlcNAc、肌苷、S7P、氧尿醇、酰基肉碱和乳酸。
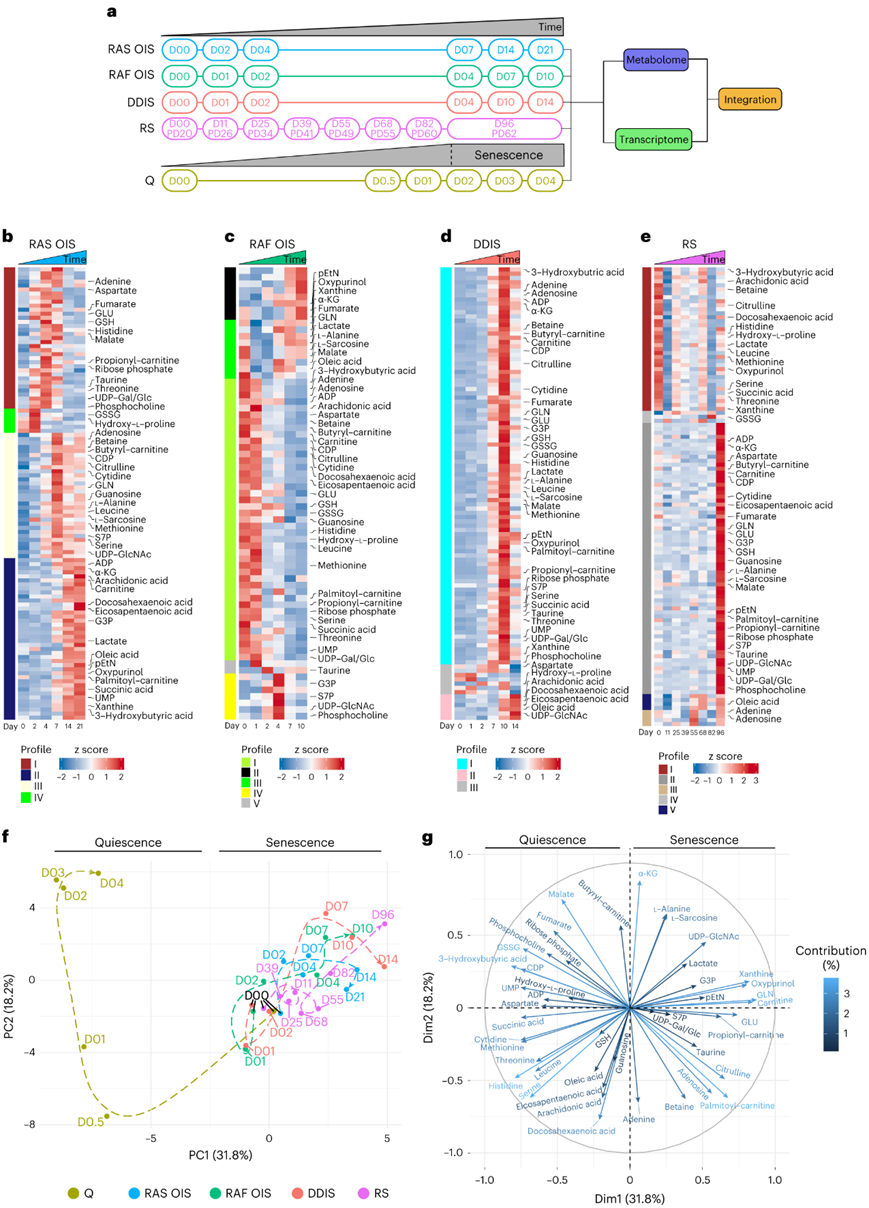
图1. 非靶向代谢组学揭示了几种衰老模型的共同代谢特征。
(a) 实验设计。(b-e) 热图显示使用层次聚类方法 (WGCNA) 在指定时间点 WI38 成纤维细胞中指定衰老诱导剂的暂时共表达代谢物模块。 (f)主成分分析(PCA) 。(g) 相关圈表示指示代谢物对(f)的主成分PC1和PC2的百分比贡献。
他们通过计算每个衰老亚型的同一代谢通路中代谢物与其直接前体或终产物之间的比率,并使用个体的分母起点(增殖)和分子终点(衰老)代谢物水平来合并 SAMS时间进程(图2a-d)。无论诱导因子是什么,衰老细胞的乳酸:丙酮酸、α-KG:琥珀酸、G3P:甘油、G3P:二羟基丙酮磷酸(DHAP)和磷酸乙醇胺pEtN: cdp -乙醇胺(Etn)比值均显著升高。乳酸:丙酮酸比值的增加与衰老过程中观察到的糖酵解移位和线粒体活性下降一致。
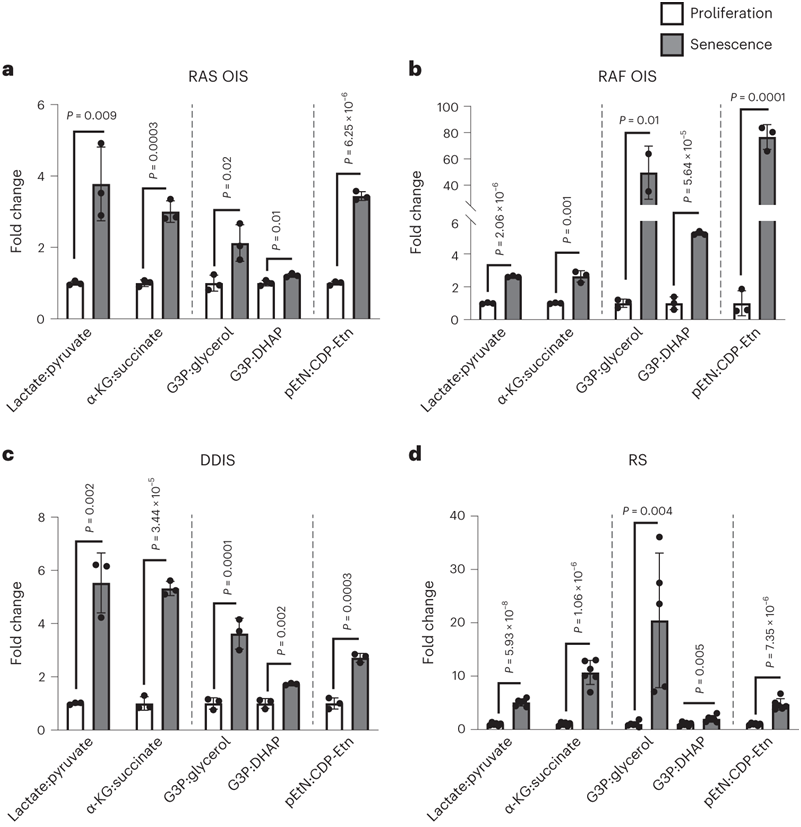
图2. 常见SAMS的鉴定。
(a-d) 代谢物之间的差异倍数(FC)。
02
mTOR 和 α-KG 的抑制将 SAMS 和 SASP 表达联系起来
为了检验SAMS是否能预测衰老状态,他们对经历DDIS的WI38细胞给予mTOR抑制剂雷帕霉素(rapamycin),对经历RAS OIS的细胞给予二甲氧基草酸甘氨酸(DMOG)(一种模拟缺氧的竞争性α-KG拮抗剂)。
雷帕霉素和DMOG分别显著减少了SABG阳性细胞的数量2.5倍和4倍(图3a-b)。接下来,他们进行了时间分辨基因表达和代谢分析,以检测雷帕霉素和dmog介导的衰老转录组和代谢组的变化。基因聚类、通路富集和基因集富集分析(GSEA)显示,雷帕霉素和DMOG使转录状态更接近增殖对照细胞,显著干扰SASP表达,下调周期蛋白依赖性激酶抑制剂CDKN1A/p21(图3c-d)。
与衰老转录组的衰老效应一致,代谢分析表明雷帕霉素和 DMOG 也显著减弱 SAMS(图3e-f)。这些结果强调了所确定的代谢改变与衰老状态相关,而不是与应激诱导物的性质相关,并表明 SAMS 和衰老基因表达程序之间存在功能重叠。
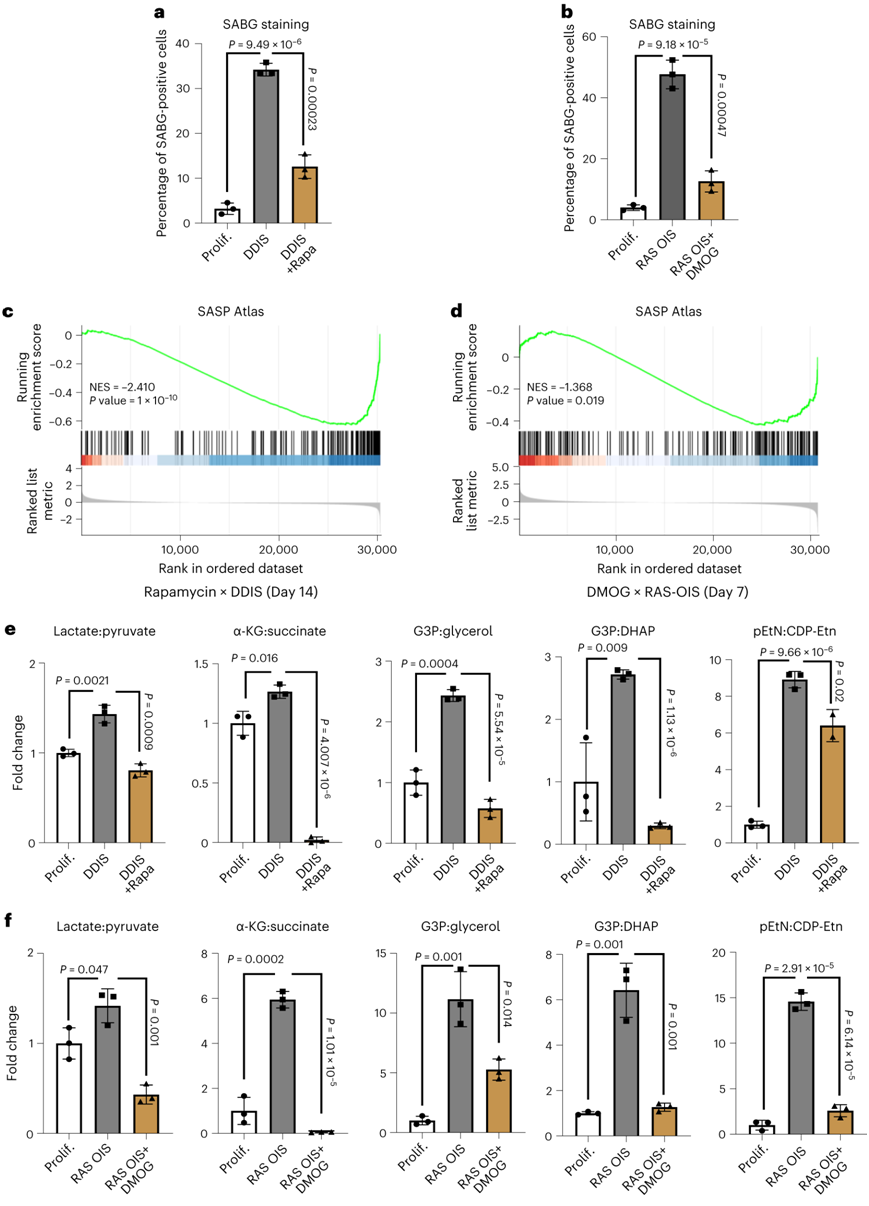
图3. 衰老抑制与 SAMS 抑制相关。
(a-b) WI38成纤维细胞培养物中SABG阳性细胞的百分比。(c-d) GSEA富集分析。(e-f) WI38成纤维细胞SAMS的FC。
03
甘油分流与衰老程序相重叠
他们计算了所有差异表达基因和代谢物之间的Spearman相关性,考虑到个体衰老亚型和静止可能的非线性分子相互作用,通过选择所有数据集的绝对相关性大于0.5的基因-代谢物对来组合每个实验的结果,发现S7P和G3P在基因-代谢物网络中具有最高的中介中心性(图4a)。对G3P相关基因的反应组分析显示,G3P与炎症和细胞周期基因的表观遗传调控有关,因此他们提出了G3P作为调节衰老基因表达程序的新核心“枢纽”代谢物的假设(图4b)。
G3P位于多种代谢通路的“十字路口”。G3P通过氧化还原转化为DHAP,进入糖酵解和糖异生(图4c)。G3P脱氢酶(GPD1)将DHAP还原为G3P,再生G3P梭体细胞质侧的NAD+水平,而GPD2催化的线粒体侧形成DHAP和FADH2,为电子传递链提供营养。最后,G3P和FFA是脂肪生成、TAG和PL合成的关键中间体。
脂质组学分析显示,与对照细胞相比,DDIS中二酰基甘油(DAG)显著增加。DAG是中性脂(NL) TAG和PL的前体。值得注意的是,RS和DDIS也会导致TAG的积累。相比之下,与对照细胞相比,除了磷脂酰甘油(PG)水平降低外,不同PL种类的水平没有受到实质性影响(图4d)。因此,衰老细胞中总PL相对于总TAG (NL)的量减少(图4e)。
甘油激酶(GK)表达水平在所有衰老模型中均上调,这一效应在RAS、OIS和DDIS的蛋白水平上得到了证实(图4f-g)。通过siRNA或shrna介导的DDIS细胞中p53的缺失,肿瘤抑制因子p53调节GK的表达(图4h)。
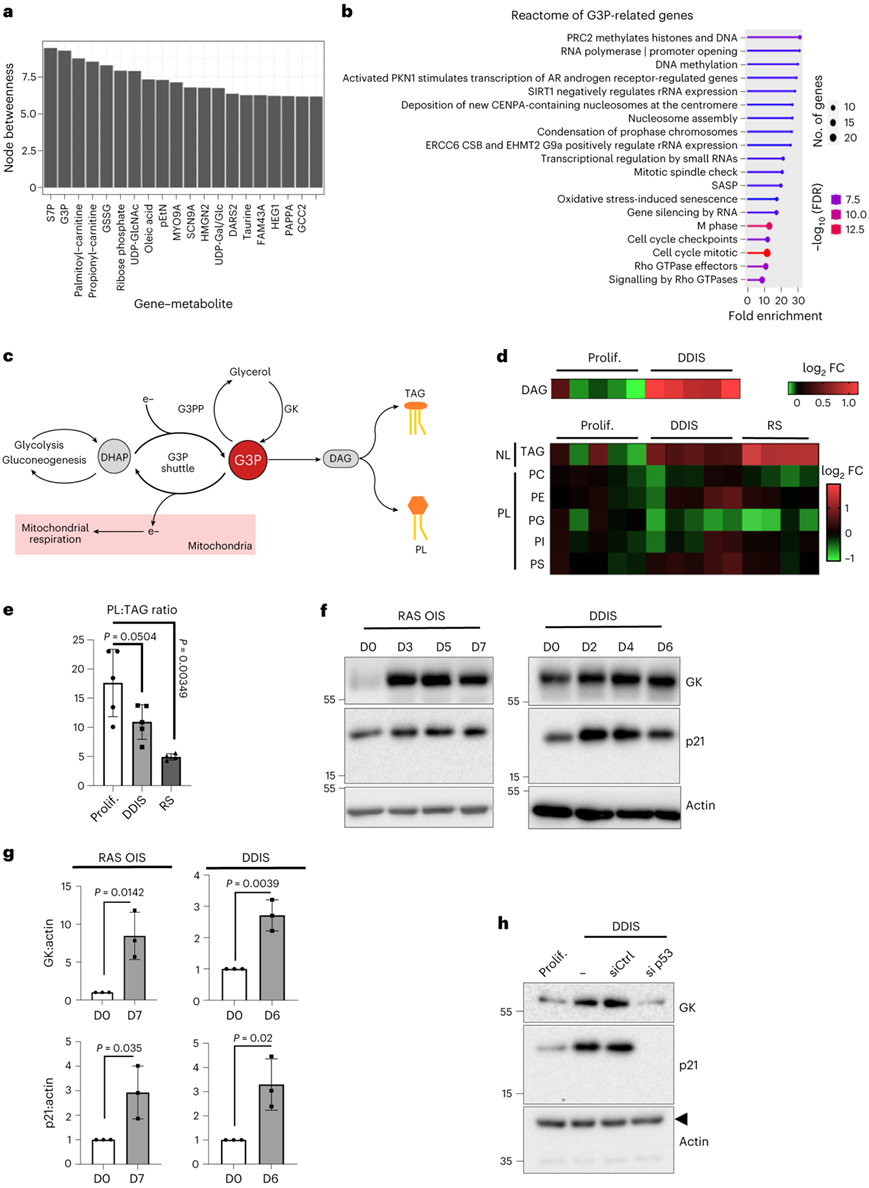
图4. 衰老代谢重编程开始时G3P 的积累。
(a) 连接基因和代谢物的基因-代谢物相关网络中介数值最高的节点。(b) WI38成纤维细胞衰老过程中与G3P积累呈正相关或负相关基因分析。(c) 涉及G3P的代谢通路的示意图。(d) 热图表示脂质种类的水平。(e) 总PL与TAG水平与蛋白质含量的比值归一化。(f)免疫印迹分析。(g) 蛋白水平定量分析。 (h) 免疫印迹分析。
为了评估 GK 在衰老程序中的功能作用,他们首先用过表达 GK 的腺病毒(GK-OE)转导增殖的成纤维细胞。GK-OE足以触发类衰老状态,SABG阳性细胞的百分比以及SASP基因CXCL8和IL-1α的表达显著增加证明了这一点(图5a-b)。这些效应伴随着NL的大量积累,这与G3P在TAG合成中的利用相一致(图5c)。因此,GK-OE 具有促进衰老的作用。相反,GK 敲低抑制了 RAS OIS 细胞中的 SASP 基因。同时,p21和p16表达分别不受影响或轻微受影响(图5d)。与上述发现一致,通过过表达G3P磷酸酶(G3PP-OE)(使G3P转化为甘油)消除G3P具有与GK耗竭相似的效果,逆转了RAS OIS细胞中G3P的积累(图5e),并伴有一定数量的SASP基因的下调(图5f)。最后,巯基甘油(一种竞争性GK抑制剂)的药物治疗也降低了RAS OIS中的SASP因子,如IL-1α、CXCL8和IL-6(图5g)。总之,这些结果强调了G3P代谢在衰老调节中的关键作用。
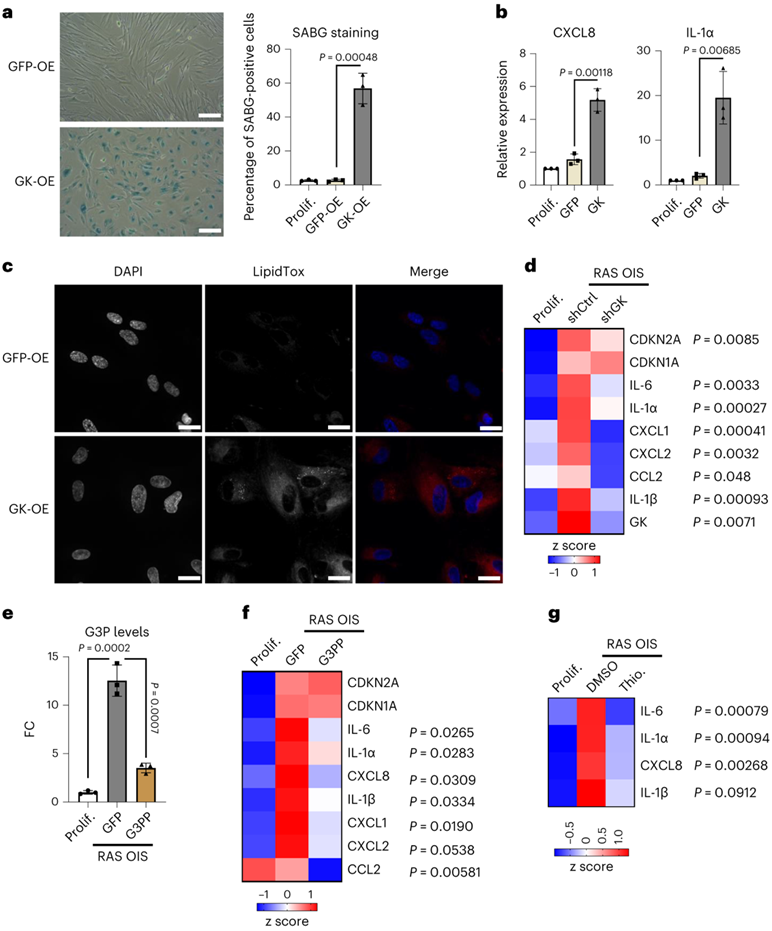
图5. G3P 积累驱动代谢衰老程序和 SASP 诱导。
(a) SABG 阳性 WI38 成纤维细胞的代表性图像(左)和百分比(右)。 (b) 通过 RT-qPCR 在按(a)处理的 WI38 成纤维细胞中检测的所示 SASP 标记的 mRNA 水平。 (c) 用GFP-OE或GK-OE腺病毒感染7天的WI38成纤维细胞的4,6-二脒基-2-苯基吲哚(DAPI)和LipidTox染色的代表性图像。 (d) 通过 RT-qPCR 检测的 WI38 成纤维细胞中所示 mRNA 水平的热图。(e) WI38成纤维细胞中G3P水平的FC。 (f) RT-qPCR 检测的所示 mRNA 水平的热图。(g) 通过 RT-qPCR 检测的 WI38 成纤维细胞经 RAS OIS 并用二甲基亚砜 (DMSO) 或 1-硫代甘油 (1 mM) 处理 7 天后所示 mRNA 水平的热图。
04
G3P和pEtN稳态开关(switch)调节衰老
G3P 和 pEtN 是 TAG 和 PL 合成的构建模块,并在衰老细胞中积累。pEtN 在Kennedy通路中用于生物合成磷脂酰乙醇胺 (PE),磷脂酰乙醇胺是细胞膜的主要成分,占总 PL 的 25-35%。乙醇胺 (Etn) 首先由细胞摄取,随后由乙醇胺激酶 1 (ETNK1) 磷酸化为 pEtN,最后通过磷酸乙醇胺胞苷转移酶 (PCYT2)与CDP结合,再通过乙醇胺磷酸转移酶(EPT 和 CEPT)与 DAG 反应生成 PE(图6a)。
为了探究Etn代谢在衰老中的作用,他们首先进行了外源13C-Etn (Etn MW + 2)通量实验,没有发现增殖细胞和衰老细胞之间Etn摄取和Etn转化的差异;然而,与增殖细胞相比,衰老细胞中的pEtN和CDP-Etn (MW + 2)转化效果较差,这表明PCYT2酶活性降低(图6b)。
他们通过Phos-tag分析确定了PCYT2的磷酸化状态。PCYT2在增殖细胞的提取物中显示出几个条带移位,这与它在多个位点的磷酸化一致(图6c)。
值得注意的是,与对照细胞相比,DDIS和RAS OIS细胞表现出PCYT2条带移位的显著减少,表明蛋白质磷酸化减少。这种效应依赖于p53,因为(1)p53沉默(siRNA或shrna介导)挽救了PCYT2磷酸化(图6d),而降低RAS OIS细胞中的pEtN:CDP-Etn比率(图6e)和(2)Nutlin-3激活p53降低了PCYT2磷酸化并增加了细胞中的pEtN:CDP-Etn比率(图6f-g)。
因此,p53在衰老过程中负调控PCYT2磷酸化和活性,导致pEtN积累。PCYT2磷酸化对选择性PKC抑制剂双吲哚酰马来酰亚胺(BisIndo.I)很敏感(图6h)。
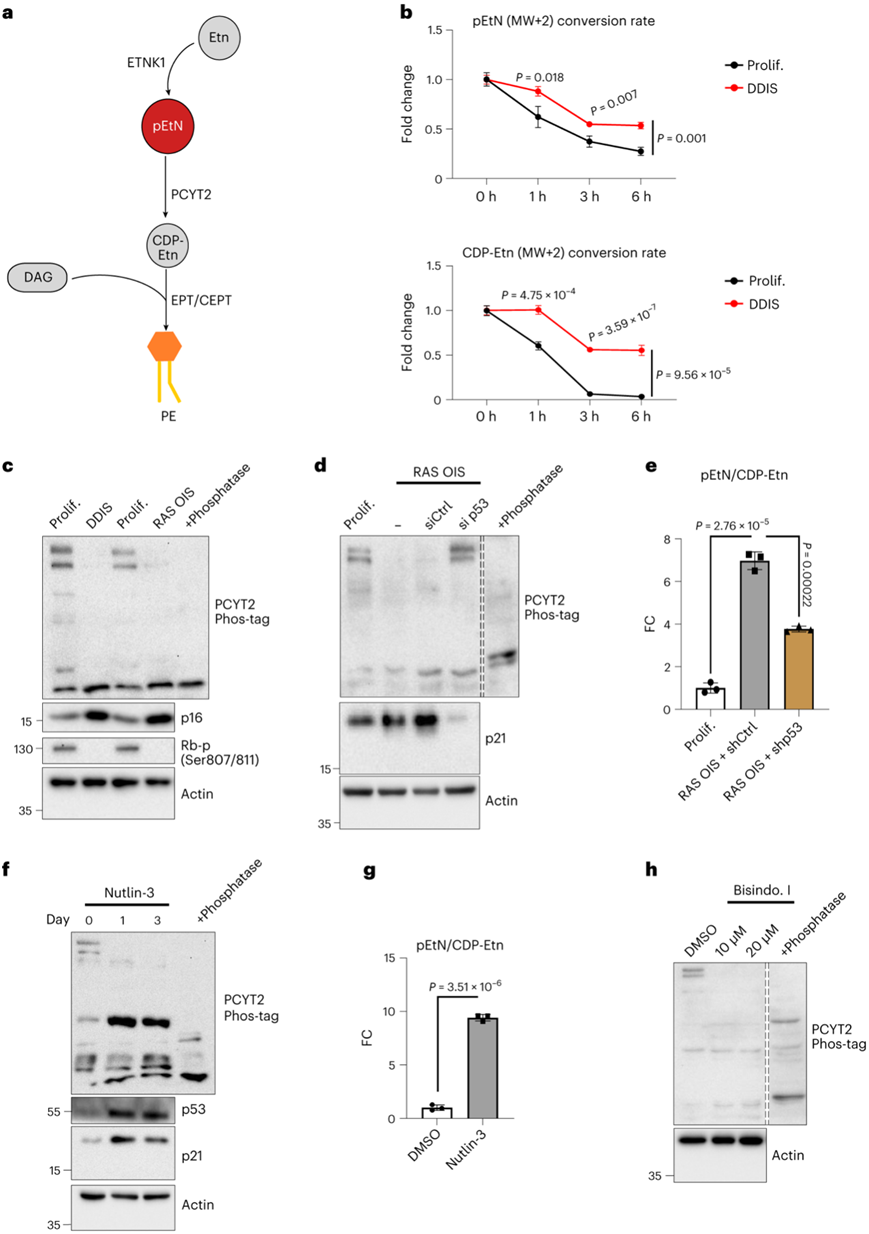
图6. PCYT2 在衰老细胞中活性较低且去磷酸化。
(a) 磷脂酰乙醇胺通路的示意图概述。 (b) 在1小时的脉冲后跟随指定时间的追踪后,增殖或经历DDIS(第10天)的WI38成纤维细胞中标记的pEtN或CDP-Etn的衰减曲线。(c-d)免疫印迹分析。 (e) 经历RAS OIS并用shCtrl-OE或shp53-OE腺病毒感染7天的WI38成纤维细胞中pEtN:CDP-Etn比率的FC。 (f)免疫印迹分析。(g) 用 Nutlin-3 (10 µM) 处理 7 天的 WI38 成纤维细胞中 pEtN:CDP-Etn 比率的 FC。(h)免疫印迹分析。
05
PCYT2 和 pEtN 调节衰老代谢重编程
为了评估pEtN水平改变的功能后果,他们在增殖细胞中进行了PCYT2敲低实验,从而阻止pEtN转化并导致pEtN:CDP-Etn比率增加(图7a)。与 GK-OE 类似,PCYT2敲低足以引发衰老样表型,SABG 染色阳性细胞的增加以及典型衰老生物标志物 CDKN1A、CDKN2A 和 IL-1α 表达的增加证明了这一点(图 7b-c)。此外,PCYT2敲低也会引发中性脂滴积累(图7d)。相比之下,PCYT2 OE在RAS OIS细胞中降低了SASP因子IL-1α、IL-1β、IL-6和CXCL8的表达(图7e),同时重建了与增殖对照细胞相似的pEtN:CDP-Etn比率(图7f)。
为了进一步证实pEtN在细胞中的积累指导衰老命运,他们过表达了乙醇胺-磷酸解磷酶(ETNPPL),这是一种促进pEtN分解为氨、无机磷酸盐和乙醛的酶。与上述结果一致,ETNPPL-OE降低了pEtN:CDP-Etn比率(图7f),抑制了RAS OIS细胞中SASP生物标志物IL-1α、IL-1β、IL-6和CXCL8(图7e)。因此,他们得出结论,衰老表型与pEtN稳态复杂相关。
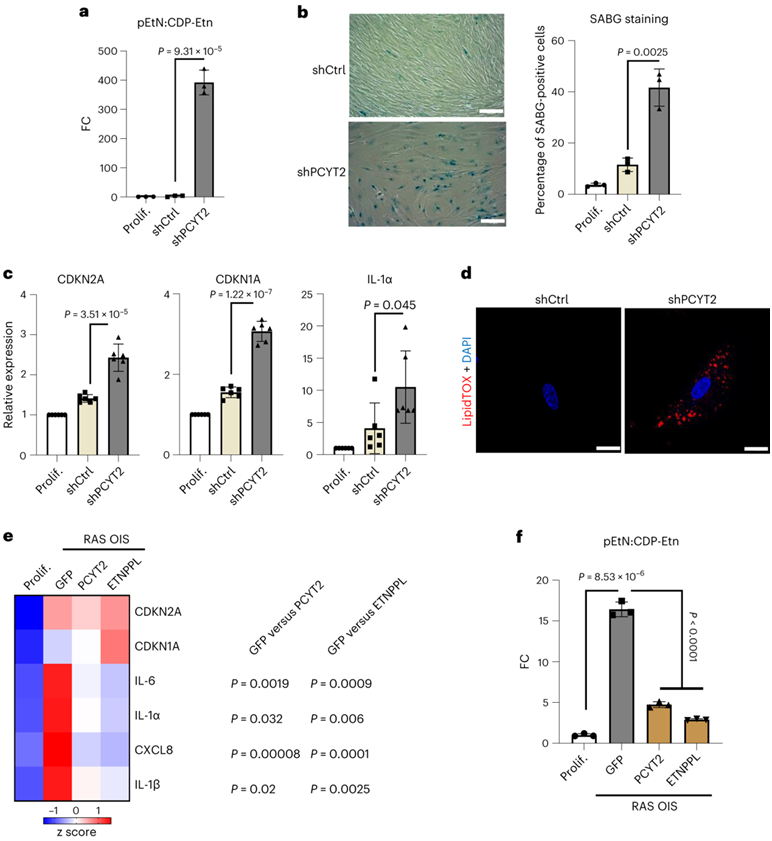
图7. PCYT2 和 pEtN 调节衰老代谢重编程。
(a) 用驱动对照shRNA (shCtrl)或靶向PCYT2 mRNA (shPCYT2)的shRNA表达7天的腺病毒感染的WI38成纤维细胞中pEtN:CDP-Etn比率的FC。 (b) ABG 阳性 WI38 成纤维细胞的代表性图像(左)和百分比(右)。(c) 通过 RT-qPCR 对按(a)处理的 WI38 成纤维细胞中衰老标记物的 mRNA 水平进行评分。(d) 用驱动对照shRNA (shCtrl)或靶向PCYT2 mRNA (shPCYT2)的shRNA表达的腺病毒感染7天的WI38成纤维细胞的DAPI和LipidTox染色的代表性图像。(e) 通过 RT-qPCR 在增殖 (Prolif.) 或接受 Ras 诱导并用过表达 GFP、PCYT2 或 ETNPPL 的腺病毒感染 7 天的 WI38 成纤维细胞中检测的所示 mRNA 水平的热图 。(f) 如(e)中处理的 WI38 成纤维细胞中 pEtN:CDP-Etn 比率的 FC 。
为了探究衰老如何重塑 PL 代谢,他们深度进行了脂质组学分析。尽管PCYT2活性降低,但衰老细胞中的磷脂酰乙醇胺(PE)水平没有改变(图4d)。值得注意的是,PCYT2敲低重现了衰老诱导剂对甘油脂代谢的改变,G3P和脂滴的积累证明了该结果(图8a、图7d)。同样,GK或G3PP OE对G3P水平的调节影响了pEtN水平,表明细胞中G3P和pEtN之间存在稳态联系(图8b-c)。在分子水平上,G3P和pEtN的增加促进了CDKN2A/p16的积累、RB的低磷酸化(激活)以及随后对促增殖RB/E2F靶基因Cyclin A2(CCNA2)的抑制(图8d-e),且没用内质网(ER)应激迹象。值得注意的是,p16转录上调伴随着Id1转录因子和Polycomb Group复合物1和2(PRC1和PRC2)成分Bmi1、Ezh2和SUZ12的大幅下调(图8d-e),这些成分与p16抑制有关。
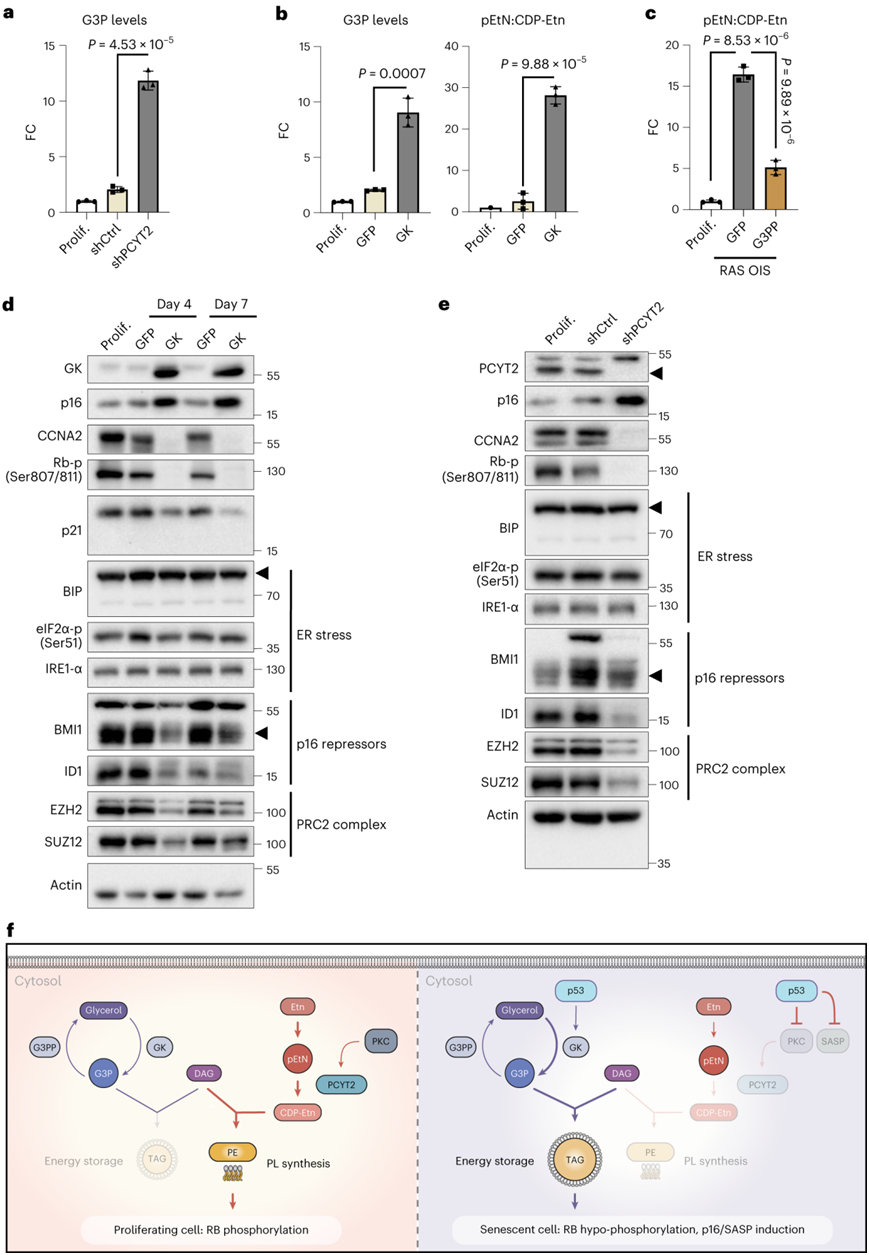
图8. pEtN和 G3P 积累相互关联分析。
(a) 用过表达对照shRNA(shCtrl)或靶向PCYT2 mRNA的shRNA(shPCYT2)的腺病毒感染7天的WI38成纤维细胞中G3P水平的FC。(b) 感染GFP-OE或GK-OE腺病毒7天的WI38成纤维细胞中G3P水平和pEtN:CDP-Etn比率的FC。(c) 用GFP-OE或G3PP-OE腺病毒感染7天的WI38成纤维细胞中pEtN:CDP-Etn比率的FC 。(d-e)免疫印迹分析。(f) G3P和pEtN代谢重塑导致TAG积累和衰老的示意图。
+ + + + + + + + + + +
结 论
通过对不同衰老亚型的人类成纤维细胞进行动态转录组和代谢组分析,发现导致G3P和pEtN积累的稳态开关将脂质代谢与衰老基因表达程序联系起来。从机制上讲,PCYT2调节这种代谢开关,从而促进脂滴中甘油三酯的积累并诱导衰老基因表达程序。相反,G3P 磷酸酶和基于乙醇胺磷酸酯磷酸裂合酶的 G3P 和 pEtN 清除作用通过减少 G3P 和 pEtN 积累发挥作用。总的来说,本项研究将 G3P 和 pEtN 积累与控制衰老细胞中的脂滴生物发生和磷脂通量联系起来,为靶向衰老和相关病理生理学提供了潜在的治疗通路。
+ + + + +



 English
English


