文献解读|Cell Res(46.297): 综合代谢组学拓宽三阴性乳腺癌的精准医疗
✦ +
+
论文ID
原名:Comprehensive metabolomics expands precision medicine for triple-negative breast cancer
译名:综合代谢组学拓宽三阴性乳腺癌的精准医疗
期刊:Cell Research
影响因子:46.297
发表时间:2022.2.1
DOI号:10.1038/s41422-022-00614-0
背 景
三阴性乳腺癌(TNBC)是一种高度异质性疾病,且缺乏公认的治疗靶点。在之前针对中国TNBC患者的研究中将TNBC分为四种具有不同分子特征的转录组亚型(BLIS,IM,MES和LAR),并揭示了每个亚型的潜在治疗靶点。然而,在雨伞试验(Umbrella trial)中潜在靶点的治疗效果并没有达到预期。代谢重编程是癌症的重要标志,先前的研究已表明不同类型的乳腺癌之间代谢途径存在显著差异。目前,仍然缺乏将TNBC代谢组学与基因组学联系起来的研究。在本研究中,作者将代谢组学与之前基因组和转录组学数据相结合,以探索TNBC的潜在代谢靶点。
实验设计

结 果
01

TNBC患者代谢组学景观概述
作者使用330个TNBC样本和149个配对的正常乳腺组织样本集进行TNBC代谢组学的分析。首先,从整体上,作者分析了肿瘤和正常样品之间代谢物和脂类的表达差异。与正常组织相比,肿瘤中显著富集了与氧化反应和糖基转移相关的代谢产物(如氧化谷胱甘肽和尿苷二磷酸葡萄糖)(图1a)。另外,磷脂酰肌醇、脂肪酸和神经酰胺等脂类也在TNBC肿瘤组织中富集(图1b)。进一步,作者还分析了肿瘤组织中失调的代谢途径(图1c)。随后,作者将TNBC代谢组学数据通过相似网络融合(SNF)方法分为三个亚型(图1d)。其中,代谢组C1亚型特征性富集鞘脂和脂肪酸,而代谢组C2亚型的特征为碳水化合物代谢和氧化反应上调(图1e)。而代谢组C3亚型在正常组织和肿瘤组织中仅表现出轻微的代谢差异(图1f)。总体来说,TNBC的代谢组学聚类分析揭示了代谢异质性,并为进一步的靶点探索提供了见解。

图1 TNBC代谢组学景观
02

代谢组分型细化TNBC转录组分型
进一步,作者探讨了代谢组分型、转录组分型和基于代谢途径分型(MPS)之间的关联。在转录组亚型方面,LAR亚型几乎与代谢组C1亚型重叠;BLIS、免疫调节(IM)和间充质样(MES)亚型主要分为代谢组C2和C3亚型(图2a)。并且,代谢组亚型可以作为于BLIS患者的独立预后因素(图2b)。接下来,作者通过机器学习方法为BLIS肿瘤建立一个简化的代谢组分型方法,并且该方法在测试队列中都具有良好的预测效果(图2c,d),作者通过受试者体操作特性(ROC)曲线以及所包含的六种代谢产物的贡献进一步证明了LASSO模型的预测效力(图2e,f)。总之,代谢组学分析完善了之前的TNBC转录组分型(图2g)。
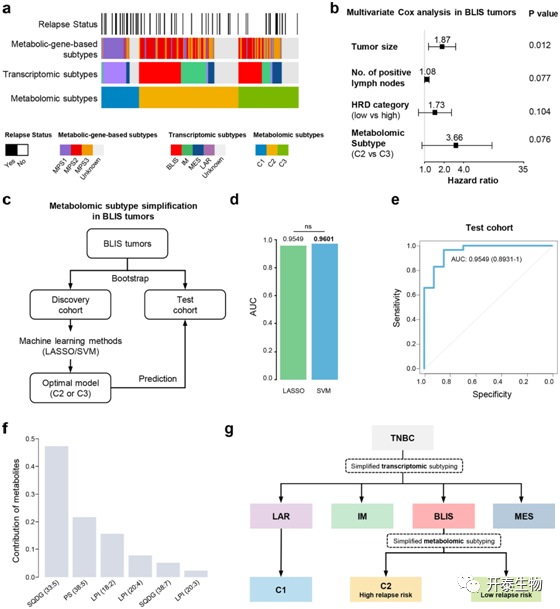
图2 代谢组分型细化TNBC转录组分型
03

神经酰胺代谢分析显示鞘氨醇-1-磷酸(S1P)是LAR亚型潜在治疗靶点
转录组LAR亚型与代谢组C1亚型几乎重叠(图2a),其特征是鞘脂相关代谢产物的富集(图1e)。因此,作者分析了鞘脂代谢途径的详细中间体来确定LAR肿瘤的关键代谢产物。与正常组织和非LAR肿瘤相比,LAR肿瘤的特征是神经酰胺的富集(图3a)。对代谢产物的和代谢相关基因的进一步分析表明,神经酰胺途径的从头合成和降解在LAR肿瘤中更为活跃,而糖基和磷酸基的转移在LAR肿瘤和非LAR肿瘤之间没有显著变化(图3b,c)。这些结果表明神经酰胺途径的从头合成和降解在LAR肿瘤中的关键作用。此外,作者还利用稳定同位素示踪实验来进一步说明LAR亚型中活跃的神经酰胺途径(图3d)。为了研究LAR肿瘤的潜在治疗策略,作者系统地阻断了细胞系和患者衍生的类器官(PDO)模型中神经酰胺途径从头合成和降解的每一步。结果表明,PF-543(SPHK1的抑制剂)和FTY-720(S1P拮抗剂)对LAR肿瘤显示出了更有效的抑制效果(图3e,f)。此外,作者使用患者来源异种移植(PDX)模型同样验证了PF-543和FTY-720对LAR肿瘤生长的抑制作用(图3g,h)。总之,结果表明S1P是神经酰胺途径的重要中间体,在LAR肿瘤中起着关键作用。PF-543和FTY-720可能是LAR亚型肿瘤的特异性治疗方法。
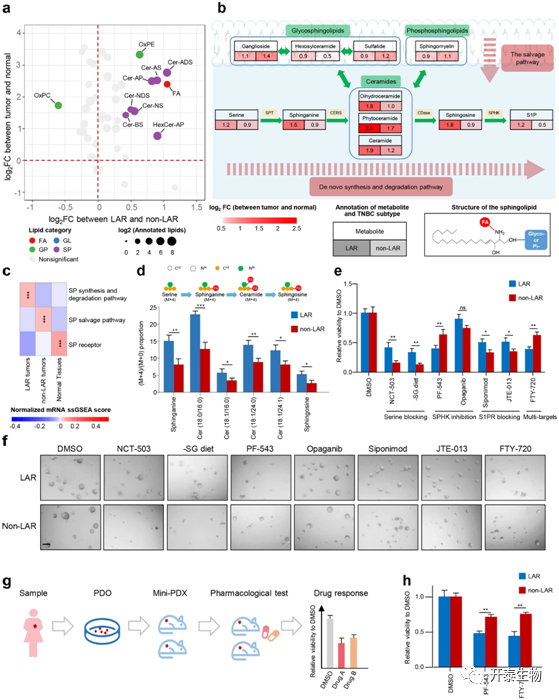
图3 神经酰胺代谢分析显示S1P是LAR亚型潜在治疗靶点
04

NAAG鉴定为BLIS肿瘤中关键促肿瘤代谢产物
作者进一步探究了BLIS肿瘤的重要促肿瘤代谢产物。在分析了BLIS肿瘤中特异性上调和预测不良预后的代谢物后,作者确定N-乙酰天冬氨酰谷氨酸(NAAG)为潜在候选(图4a,b,c)。据报道,RIMKLA和RIMKLB这两种酶负责NAAG的产生(图4d),进一步RIMKLB在转录组水平上显著高于RIMKLA,并且与NAAG的丰度呈正相关,因此,作者推测RIMKLB是决定TNBC中NAAG水平的关键酶(图4e,f)。在HCC1806和LM2-4175细胞系中用shRNA敲除RIMKLB后,NAAG丰度显著降低,并伴随着生长速率、迁移和入侵能力的降低。在培养基中加入NAAG后,RIMKLB敲除导致的肿瘤抑制作用得到部分缓解(图4g,h)。随后,作者通过小鼠荷瘤实验进一步验证了RIMKLB敲除显著抑制了肿瘤生长,并通过补充NAAG部分缓解了抑制肿瘤生长的作用(图4i–k)。这些数据表明,NAAG是BLIS肿瘤中重要的促肿瘤代谢产物,靶向NAAG的生物合成可能是一种可行的治疗策略。

图4 NAAG鉴定为BLIS肿瘤中关键促肿瘤代谢产物
+ + + + + + + + + + +
结 论
在本研究中,作者构建了TNBC的大型代谢组图谱,并结合之前的转录组学和基因组学数据综合分析,从而改进了之前的TNBC转录组分型。本研究发现转录组LAR亚型与代谢组C1亚型重叠,并鉴定S1P是LAR亚型的潜在治疗靶点。另外,BLIS亚型包含代谢组C2亚型和C3亚型,并鉴定NAAG是BLIS肿瘤的重要促肿瘤代谢产物,可作为BLIS肿瘤的潜在治疗靶点。总之,该研究揭示了TNBC代谢组学的临床意义,通过结合基因组、转录组和代谢组学数据,作者确定了TNBC的几种亚型特异性代谢组学治疗靶点,这拓宽了基于基因组的TNBC精确医学前沿。
+ + + + +



 English
English

