文献解读|Cell(64.5):液体活检蛋白质组学与人工智能相结合,识别体内眼睛衰老和疾病的细胞驱动因素
✦ +
+
论文ID
原名:Liquid-biopsy proteomics combined with AI identifies cellular drivers of eye aging and disease in vivo
译名:液体活检蛋白质组学与人工智能相结合,识别体内眼睛衰老和疾病的细胞驱动因素
期刊:Cell
影响因子:64.5
发表时间:2023.10.06
DOI号:10.1016/j.cell.2023.09.012
背 景
人眼是一个复杂的器官,由所有三个胚层的组织组成,包含多种细胞类型,包括神经细胞、血管细胞、基质细胞、免疫细胞和血细胞。眼组织透明度允许对从遗传状况到代谢、炎症和神经退行性疾病等人类疾病进行直接可视化和精确的临床表型分析。
本项研究展示了一种整合微体积液体活检蛋白质组学、单细胞转录组学和人工智能(AI)的方法,创造了一种强大的工具来检查体内细胞水平的疾病机制。研究者团队将这种方法称为 TEMPO(追踪多个蛋白质来源的表达)。以人眼为例,TEMPO 对疾病机制以及衰老与疾病之间的联系产生了新见解。
实验设计
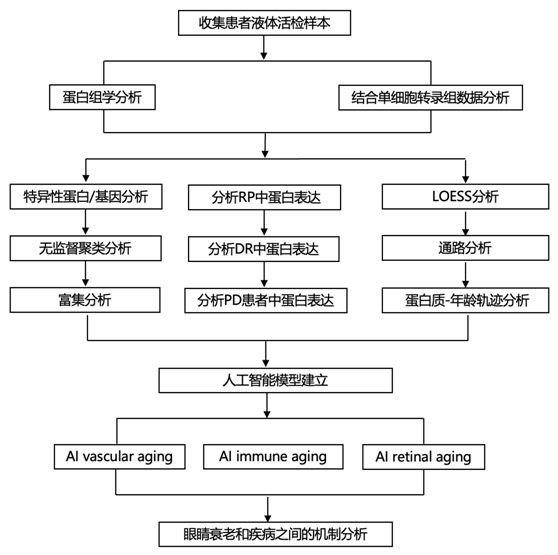
结 果
01
多组学方法确定液体活检蛋白的细胞起源
研究者团队从接受眼科手术的患者的房水 (AH) 或玻璃体中获取了 120 份液体活检(图 1 A),进行高分辨率蛋白质组分析,涵盖了 6345 种人类蛋白质,其中在健康样本中检测到了 5953 个蛋白质(图 1 B)。
为了确定哪些细胞类型表达编码这些蛋白质的基因,他们组合了涵盖所有 57 种已知健康眼细胞类型和 15 种健康眼外细胞类型(包括血液和肝细胞)的 82072 个单细胞转录组(scRNA-seq)数据(图 1 C),并与液体活检蛋白质组学数据整合(图1D)。
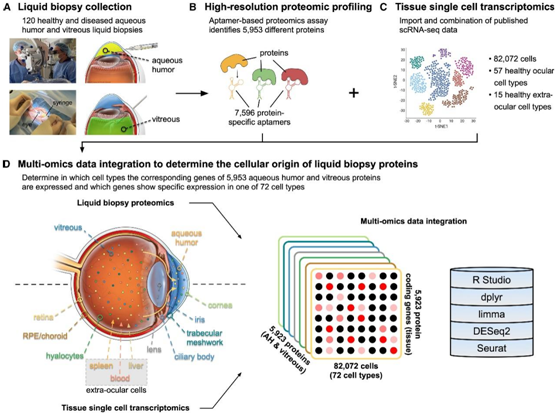
图1. TEMPO 多组学方法确定液体活检蛋白的细胞起源。
(A) 从接受眼科手术的患者获得房水 (AH) 和玻璃体液体活检。(B)蛋白质组分析。(C)将来自健康眼部和眼外细胞类型的 scRNA-seq 数据与蛋白质组学数据进行整合。(D) AH 和玻璃体蛋白由眼睛前房或后房中的点表示;点颜色代表每种蛋白质的细胞起源。
对于 99.5%的已识别蛋白质,相应基因的表达在 RNA-seq 数据中得到确认,并且这些基因中的 99.4%在眼睛中局部表达(图 2A)。通过手术,AH 比玻璃体更容易进入。使用基于核酸配体的测定,他们发现在50 μL的AH中可以检测到87.0%的玻璃体蛋白,这表明在这两个充满液体的隔室之间存在以前未报道的大量蛋白质交换(图2A)。基于所有5923个蛋白质编码基因的无监督聚类分析显示,主要是细胞类型依赖而不是组织类型依赖的聚类,包括免疫、基质、血管和视网膜细胞的不同聚类(图2B)。
多组学数据整合鉴定出 1920 个细胞类型标记蛋白在各自的细胞类型中具有高度特异性表达(图 2C)。他们建立了细胞特异性标记物,(1)单个视网膜细胞,包括神经节细胞、无长突细胞、视网膜胶质细胞、双极细胞、水平细胞、视杆细胞和视锥细胞的标记物;(2)多种免疫细胞,包括巨噬细胞、透明细胞(玻璃体腔巨噬细胞)、中性粒细胞、T细胞和B细胞;(3)其他细胞类型,如视网膜色素上皮(RPE)细胞、成纤维细胞、睫状体细胞、血管内皮细胞和周细胞。胆管组织作为阴性对照,所有已识别标记均显示阴性基因表达。从视网膜检测到的细胞特异性细胞内蛋白表明蛋白质自然释放到玻璃体中并成功迁移到眼睛前房(图 2 C)。与血浆相比,来自眼睛特异性细胞类型(如光感受器或睫状体细胞)的蛋白质在AH中强烈富集。有趣的是,128种分泌蛋白仅在肝细胞中表达,这意味着一些蛋白通过血浆并通过血眼屏障转运到眼睛(图2C)。液体活检中的细胞特异性蛋白质提供了一种有价值的信息,可以在不需要直接组织活检的情况下,对患有非再生组织(如视网膜)疾病的活体细胞类型进行分子监测。
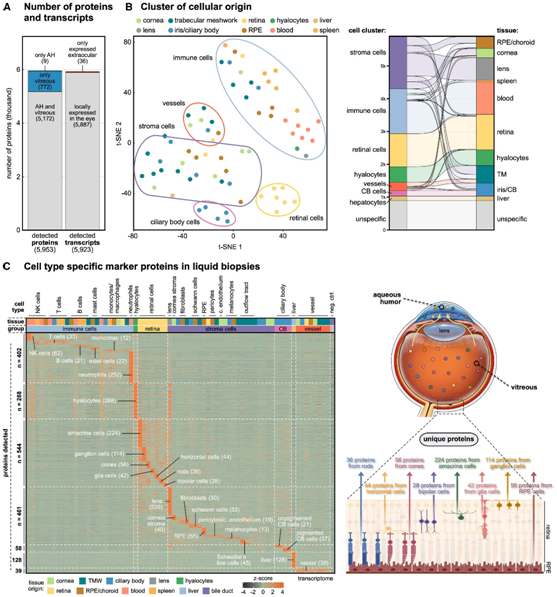
图2. 液体活检中的细胞类型特异性标记蛋白。
(A) 检测到的在眼部和眼外组织中表达的蛋白质和相应基因的数量。(B) (左)无监督聚类。(右)每个聚类的蛋白质数量以及与组织类型的关联。(C) 液体活检中的细胞类型特异性标记。
02
疾病期间可以对复杂组织内的细胞回路进行分子监测
色素性视网膜炎 (RP)是一种罕见的遗传性视网膜疾病,其特征是杆状光感受器进行性死亡,是人类基因治疗试验的主要目标(图3A)。视杆细胞光感受器特异性蛋白质受影响最大(所有视杆细胞标记物中 38.9% 的 RP 降低)(图 3 A)。他们还发现来自视锥细胞(16.1%)、视网膜双极细胞(14.3%)、视网膜无长突细胞(7.6%)的标记蛋白减少、红细胞(11.3%)和血管内皮细胞(10.3%)(图3B),而其他视网膜细胞类型,包括水平细胞和神经节细胞,相对不受影响。
总之,TEMPO 能够对视网膜回路中的光感受器和其他六种细胞类型进行分子监测,并检测免疫介导的对活体人类不同旁观者神经元细胞的分子损伤。
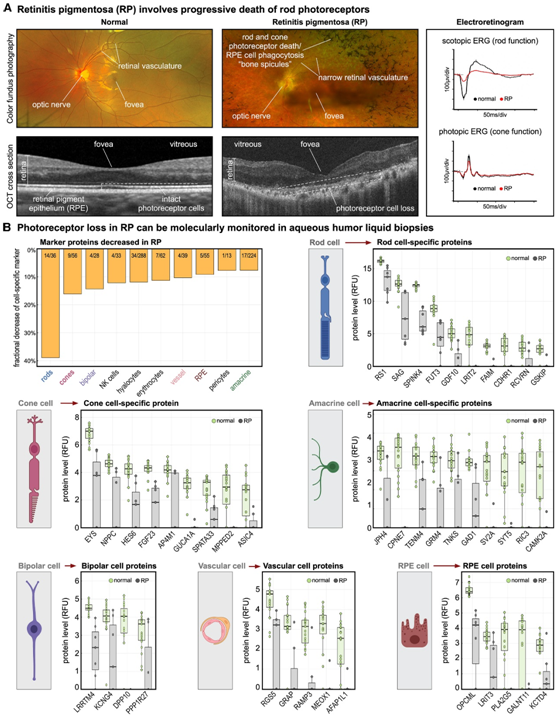
图3. 组织疾病表型可以通过局部富集液体活检进行分子监测。
(A) 色素性视网膜炎 (RP) 的临床表型。(B) 从 7 名 RP 患者和 19 名对照患者获得房水 (AH) 液体活检。
03
DR随疾病阶段切换的细胞驱动因素
糖尿病视网膜病变 (DR) 的特征是血管损伤和血管通透性增加,导致视网膜缺血和继发性病理性新生血管形成(图4A)。该疾病从非增殖期(NPDR)进展到增殖期(PDR),后者的特点是视网膜新生血管形成,可导致严重的致盲并发症。
在 DR 患者的液体活检中,他们首先分析了哪些细胞类型特异性标记蛋白显著增加,观察到免疫细胞(B 细胞、巨噬细胞、中性粒细胞、T 细胞和肥大细胞)、血管内皮细胞、周细胞和视网膜胶质细胞的标记蛋白表达变化(图 4 B)。肝脏蛋白也显著增加,其中包括 CRP、APOA1、F13B、SERPINA10 和 IGFBP1(图 4 B),这可能是 DR 中血视网膜屏障破坏导致血管通透性增加的结果。通路分析显示,DR中的肝源性蛋白参与急性期反应、急性炎症反应、凝血和伤口愈合。
他们接下来关注血管生成蛋白,因为已知此类蛋白在 DR 中发挥关键作用。与对照相比,DR 中总共有 58 种血管生成蛋白差异富集(图 4 C)。在两个疾病阶段都有 29 种蛋白质增加,包括 ANGPT2、MMP19、VEGFD、ANGPTL4 和 ENG(图 4 C)。
然而,令人惊讶的是,PDR 特异性血管生成蛋白主要源自完全不同的一类细胞,即免疫细胞,包括巨噬细胞、中性粒细胞和视网膜小胶质细胞(图 4 C)。这表明与 NPDR 相比,PDR 是一种细胞和分子上不同的疾病,并且由一组独特的血管生成细胞和血管生成因子驱动,而不是简单地由表达更多相同血管生成蛋白的相同 NPDR 细胞驱动。这些发现证明了巨噬细胞等免疫细胞是活体人类晚期 DR 的重要分子驱动因素。
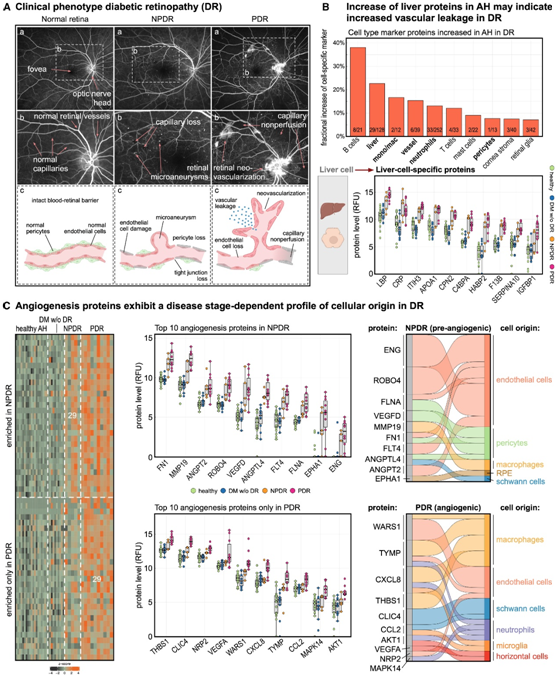
图4. 疾病阶段之间的分子和细胞表型不同。
(A) 糖尿病视网膜病变 (DR) 的临床表型。(B)条形图显示了细胞类型特异性标记蛋白。箱线图显示了 AH 中前 10 种肝脏蛋白的蛋白水平。
04
在眼液中检测到脑疾病蛋白质
由于脑组织活检极其复杂,帕金森病 (PD) 等神经退行性疾病的诊断和预后评估通常具有挑战性。他们研究了 PD 患者的 AH,作为一种补充、微创且可能比血浆更直接的评估神经元细胞的方法。总共收集了 48 种 PD 相关蛋白,在 AH 中检测到 18 种蛋白质,其中 9 种在 PD 中显著增加,其中包括 NSF、SYT4 和 INPP5F(图 5 A)。视网膜中的神经元细胞类型是主要细胞类型,包括神经节细胞、无长突细胞、双极细胞、水平细胞、视锥细胞和视杆细胞(图5B)。此外,他们还发现了几种视网膜细胞类型存在分子功能障碍,包括无长突细胞、神经节细胞、双极细胞和水平细胞(图 5 C)。此外,他们还发现了视杆细胞和视锥细胞光感受器发生分子改变,它们位于视网膜外层并且没有显示出解剖学变化,这表明分子生物标志物可能比成像/结构生物标志物更敏感。
这些结果在分子和细胞水平上重新定义了视网膜中的 PD 表型,并突出了 AH 液体活检作为诊断评估甚至 PD 治疗分子监测的有价值工具的潜力。
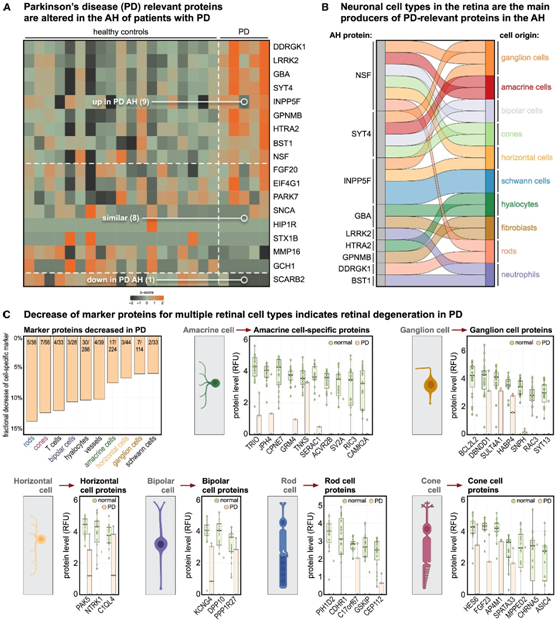
图5. 眼液反映帕金森病的表型分子。
(A) 从 5 名帕金森病 (PD) 患者和 19 名对照患者获得房水 (AH) 液体活检。热图可视化 PD 患者与对照患者中 PD 相关蛋白的 AH 蛋白水平。(B) 桑基图显示 PD 相关蛋白增加的细胞起源。(C) 条形图显示细胞类型特异性标记蛋白。箱线图显示细胞类型中前 10 种蛋白质的 AH 蛋白质水平。
05
眼睛的分子年龄遵循非线性轨迹
他们发现健康眼睛中 6313 个 AH 蛋白随着年龄的增长而发生波动(图 6 A)。为了分析这些蛋白质组变化的复杂性,他们使用无监督的层次聚类分析将所有 6313 个蛋白质分为 10 个具有相似轨迹的聚类(图 6 B)。几乎所有聚类都显示出随老化的非线性轨迹(图 6C-L)。七个聚类富集了生物通路和特定细胞类型(图6C -L),表明眼睛衰老过程中生物通路和细胞类型发生了明显变化。例如,晶状体和睫状体特异性蛋白质在 50 岁左右达到峰值(聚类 6)(图 6 H)。源自免疫细胞(例如巨噬细胞、中性粒细胞和视网膜小胶质细胞)的蛋白质在 80 岁之前保持相对稳定,然后显著增加(聚类 2)(图 6 D),而来自视网膜细胞(包括视锥细胞和神经节细胞)的蛋白质从 80 岁左右开始急剧下降(聚类 9)(图 6 K)。视网膜特异性细胞在眼睛衰老过程中的参与指向器官特异性衰老模式,这与在血浆中观察到的年龄轨迹不同。
补体和凝血级联以及肝素结合等通路中的蛋白质主要来自肝脏,并表现出两波增加,在 60 岁和 90 岁左右达到峰值(聚类5)(图 6 G),这与血浆中的发现一致。他们还分析了已知的衰老相关蛋白的轨迹,包括衰老分泌组、线粒体衰老、DNA修复、端粒体和血清反应因子的靶基因,也表明与衰老主要呈非线性关联(图6M-P)。从这些结果中,他们得出了三个重要的结论:眼睛蛋白质组在正常衰老过程中的变化主要沿着非线性轨迹,衰老过程可能在很大程度上是器官特异性的,特定的通路和细胞类型在眼睛的衰老过程中起着关键作用。
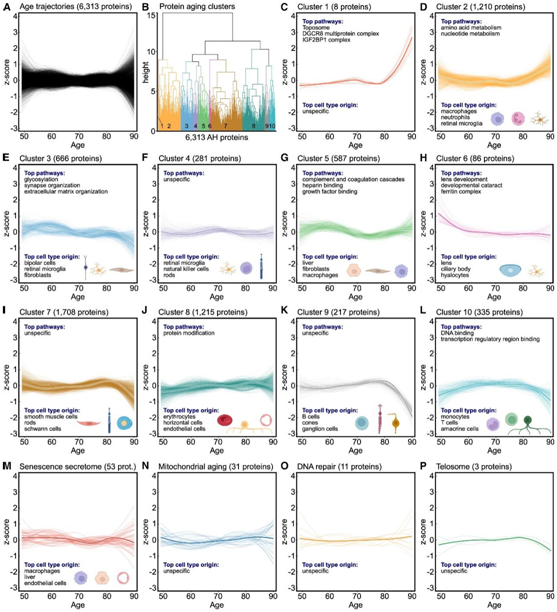
图6. 眼睛的分子年龄主要遵循非线性轨迹。
(A) 46 份房水 (AH) 液体活检取自接受白内障手术但眼睛健康的患者。对 AH 蛋白水平进行Z评分,并通过局部散点图平滑估计 (LOESS) 分析 6313 个 AH 蛋白的年龄轨迹。(B) 无监督聚类将具有相似轨迹的 AH 蛋白分组。(C-L) 10 个已识别聚类的蛋白质轨迹。(M–P)已知参与衰老相关过程的分子的蛋白质轨迹。
06
人工智能模型预测整体和细胞分子年龄
他们首先在由46例健康患者组成的训练队列中训练了一个10倍交叉验证的XGBoost模型,用于预测患者的实际年龄(图7A)。然后他们将该模型在一个由19名健康患者组成的独立队列中进行了验证,证明该验证队列对年龄有较强的预测能力(图7B),这表明人工智能可以准确评估健康眼睛的分子年龄。
接着,他们将人工智能模型应用于与出生年龄无关的眼部疾病患者(图7C-D)。预测早期DR (NPDR)患者的分子年龄较健康患者增加12岁,PDR患者的分子年龄增加31岁(图7C-D)。同样,RP患者的分子年龄增加了16岁(图7D),葡萄膜炎患者增加了29岁(图7D)。这些结果表明,患病的眼睛会加速衰老,衰老和疾病过程之间存在重叠。
他们发现年龄相关蛋白主要来源于内皮细胞、周细胞和几种免疫细胞类型,包括巨噬细胞、单核细胞、中性粒细胞和肥大细胞(图7E)。
然后,他们探索了疾病是否与特定细胞类型的加速衰老相关,开发了AI模型来预测血管、免疫和视网膜年龄,基于相应细胞类型的特异性蛋白。在训练队列和验证队列中,AI血管衰老(AI vascular aging)(22个蛋白质)、AI免疫衰老(AI immune aging)(21个蛋白质)和AI视网膜衰老(AI retinal aging)(20个蛋白质)均与实际年龄相关。三个AI模型揭示了眼部疾病涉及疾病特异性细胞类型的加速老化:PDR中的血管细胞(图7F),葡萄膜炎中的免疫细胞(图7G),以及RP中的视网膜细胞(图7H)。令人惊讶的是,他们还发现,在没有任何临床可见的视网膜病变迹象的糖尿病患者中,免疫细胞和视网膜细胞已经开始加速老化(图7G-H),这强调了评估细胞类型特异性衰老而不是整个器官衰老的潜在重要性。它还表明分子评估可能比当前的临床成像技术更敏感,并进一步表明早期预防干预可能对这些患者有益。
他们还确定了导致眼睛血管、免疫和视网膜老化的细胞类型。视网膜和 RPE/脉络膜中的内皮细胞对 AI 血管老化特征作用最大(图 7 I)。B细胞、透明细胞和T细胞是AI免疫衰老特征的主要驱动因素(图7J),双极细胞、视杆细胞和无长突细胞驱动AI视网膜衰老模型(图7K)。总之,本项研究的人工智能模型证明了眼部疾病与疾病特定细胞类型的加速衰老有关,并且不同的分子和细胞对衰老的影响可能更大。
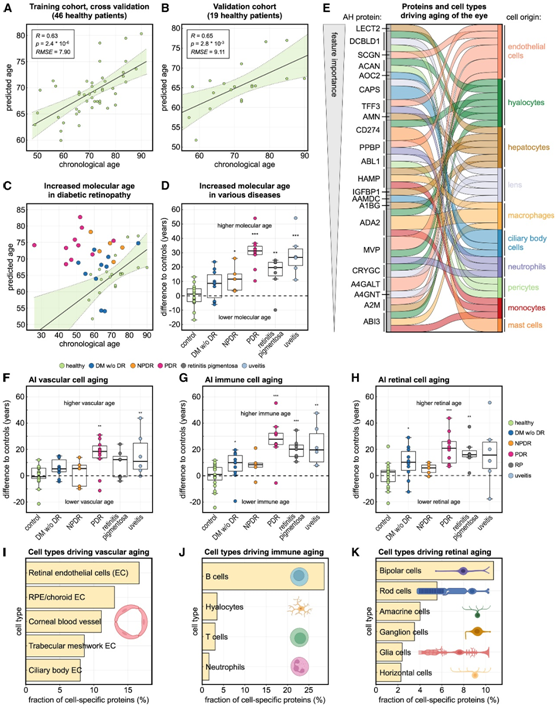
图7. AI模型预测眼睛的整体和细胞分子年龄。
(A) 基于对照患者(训练队列)的房水 (AH) 液体活检蛋白质组学对患者年龄的人工智能 (AI) 模型预测。(B) 在 19 名对照患者组成的独立验证队列中预测患者年龄。(C-D) 预测糖尿病视网膜病变 (DR)、葡萄膜炎和色素性视网膜炎 (RP)患者的分子年龄。(E) 桑基图显示年龄蛋白的细胞起源。(F–H) 开发了三种人工智能模型来预测眼睛的血管、免疫和视网膜年龄。(I–K) 条形图显示细胞类型特异性 AI 模型识别的蛋白质的细胞起源
+ + + + + + + + + + +
结 论
本项研究通过将液体活检的蛋白质组学与所有已知眼细胞类型的单细胞转录组学相结合,以追踪房水中检测到的 5953 种蛋白质的细胞起源,鉴定了数百种细胞特异性蛋白质标记,包括针对单个视网膜细胞类型的蛋白质标记。本项研究揭示了帕金森病中发生视网膜变性,并且驱动糖尿病视网膜病变的细胞随着疾病阶段的变化而变化。最后,他们开发了人工智能模型来评估个体细胞衰老,发现许多与实际年龄无关的眼部疾病会加速疾病特异性细胞类型的分子衰老。本项研究的方法可应用于其他器官系统,有可能改变分子诊断和预后,同时揭示新的细胞疾病和衰老机制。
+ + + + +



 English
English


