文献解读|Nat Genet(30.8):透明细胞肾细胞癌的多组学分析确定与疾病进展相关的代谢重编程
✦ +
+
论文ID
原名:Multi-omic profiling of clear cell renal cell carcinoma identifies metabolic reprogramming associated with disease progression
译名:透明细胞肾细胞癌的多组学分析确定与疾病进展相关的代谢重编程
期刊:Nature Genetics
影响因子:30.8
发表时间:2024.02.15
DOI号:10.1038/s41588-024-01662-5
背 景
肾细胞癌 (RCC) 是全球十大最常见的恶性肿瘤之一,主要表现为透明细胞肾细胞癌 (ccRCC)。代谢失调是 ccRCC 的一个关键特征。迄今为止,大多数临床代谢组学研究仅集中于代谢组学分析,而基因组、表观基因组或其他改变与代谢紊乱之间的关系在很大程度上尚未得到探索。
实验设计
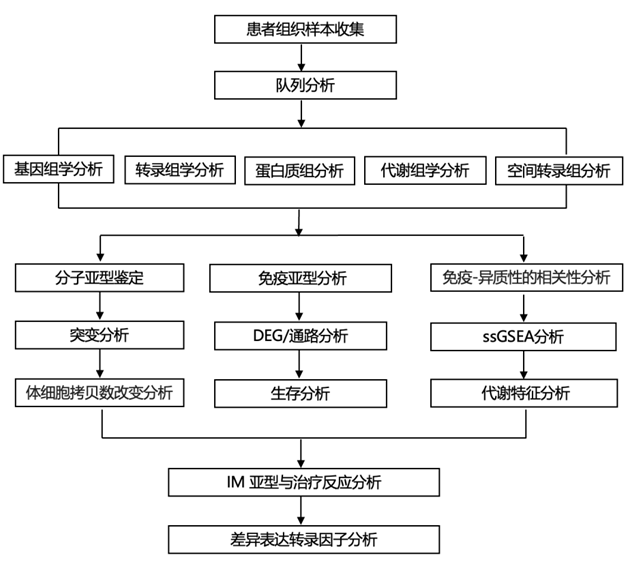
结 果
01
同济医院肾细胞癌 (TJ-RCC) 队列的多组学表征
本项研究使用全外显子测序(WES)、全转录组测序(WTS)、蛋白质组学和非靶向代谢组学对100个未经治疗的ccRCC样本和50对正常邻近组织(NAT)进行了分析,以确定TJ-RCC队列的一般分子特征(图1a)。已确定VHL、PBRM1、BAP1、SETD2和KDM5C是 ccRCC 中最常见的突变基因。此外,在罗马尼亚和中国队列中还发现了与马兜铃酸(AA)暴露相关的突变特征,其特征是 T>A 颠换。本研究中最常见的突变基因与之前的研究一致(图1b)。然而,频繁突变的基因在AA相关组中并未表现出显著更高的突变率(图1c)。主成分分析(PCA)显示肿瘤和NAT之间存在显著差异(图1d)。通路分析表明,ccRCC组织中血管生成、糖酵解和免疫相关通路的激活,以及几种代谢途径的抑制(图1e-f)。代谢组学分析结果与转录组学和蛋白质组学分析结果相关(图1g),但甘油脂代谢和谷胱甘肽(GSH)代谢途径除外。
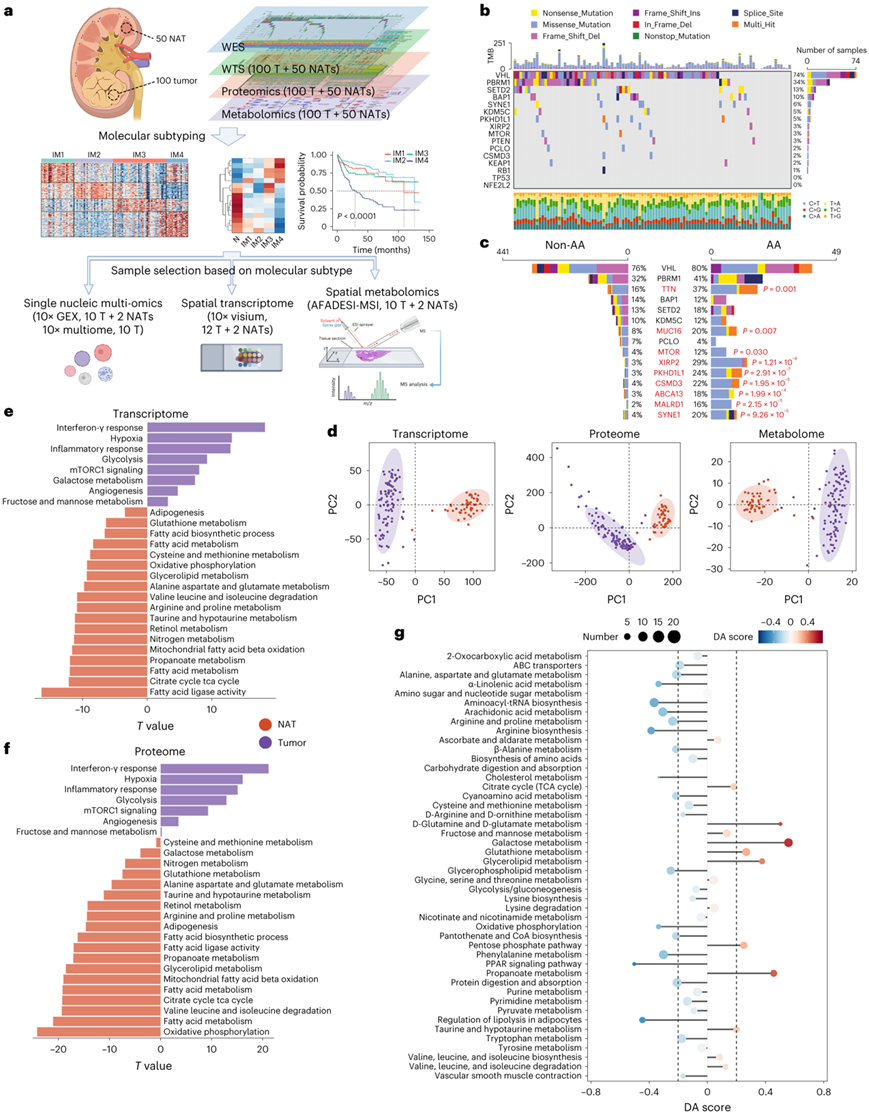
图1. TJ-RCC 队列的 RCC 队列的多组学特征。
(a) TJ-RCC 的研究设计和实验流程。 (b) 100 个 TJ-RCC 肿瘤的基因组图谱。(c) AA组和非AA组中频繁突变基因的突变率。(d) 100个肿瘤和50个NAT之间的整体转录组、蛋白质组和代谢组差异的PCA。(e-f) 条形图显示 100 个肿瘤和 50 个 NAT 之间转录组和蛋白质组中基于 ssGSEA 的通路差异。 (g) 100个肿瘤和50个NAT之间代谢物丰度的通路水平差异。
02
ccRCC可分为四种免疫亚型
研究者团队从公共 scRNA-seq 数据集生成了 ccRCC 特异性特征矩阵,并鉴定了 25 种不同的细胞类型。该矩阵用于将肿瘤样本分为四种免疫亚型(IM1-IM4),他们还进行了 xCell 分析,发现两个反卷积管道通常产生相似的输出(图2a)。IM1 的特点是富集内皮细胞(图2a)和基质细胞特征,但缺乏提示免疫排斥的免疫细胞特征。IM2 肿瘤还具有丰富的内皮特征,并且缺乏免疫和基质细胞特征。在四个亚组中,IM3 肿瘤的内皮细胞和基质细胞特征水平最低,但 T 细胞和肿瘤相关巨噬细胞 (TAM) 评分增加。IM4 肿瘤表现出最高水平的基质和 TAM 评分,以及中等水平的 T 细胞评分。差异表达基因(DEG)的通路分析表明,急性炎症反应和补体级联在IM4肿瘤中具有最高的活性。
接下来,他们研究了基因组和临床特征是否与免疫亚型相关。如图2b所示,IM4拥有最多的染色体臂水平体细胞拷贝数改变(SCNA),其次是IM3,而体细胞突变负担(即单核苷酸变异)在四组之间没有显示差异(图2b-c)。具有更多 SCNA 的亚组与更高的肿瘤分级和更晚期的疾病相关(图2d)。
接下来,他们进行了单细胞核转录组分析 (snRNA-seq),将97978 个单核分为 5 个主要细胞类型和 41 个亚聚类(图2e-f)。免疫细胞聚类的分布因免疫亚型而异,而内皮细胞亚群则表现出较小的变异性(图2g)。IM3 和 IM4 肿瘤的 TAM 存在显著差异。增殖性巨噬细胞(Mø–prolif)、GPNMB + 巨噬细胞(Mø04–GPNMB)、C3 +巨噬细胞(Mø06–C3)和GBP1 +巨噬细胞(Mø07–GBP1)也在 IM3 肿瘤中富集(图2g)。IGF1 + 巨噬细胞在 IM4 肿瘤中的富集程度更高。通路富集分析表明,生长因子复合物通路在该亚群中富集(图2g)。随后的免疫荧光染色显示IGF1巨噬细胞(F13A1)主要定位于成纤维细胞(PDGFRA)富集区域,验证了关于IGF1巨噬细胞促进成纤维细胞聚集的假设(图2h)。
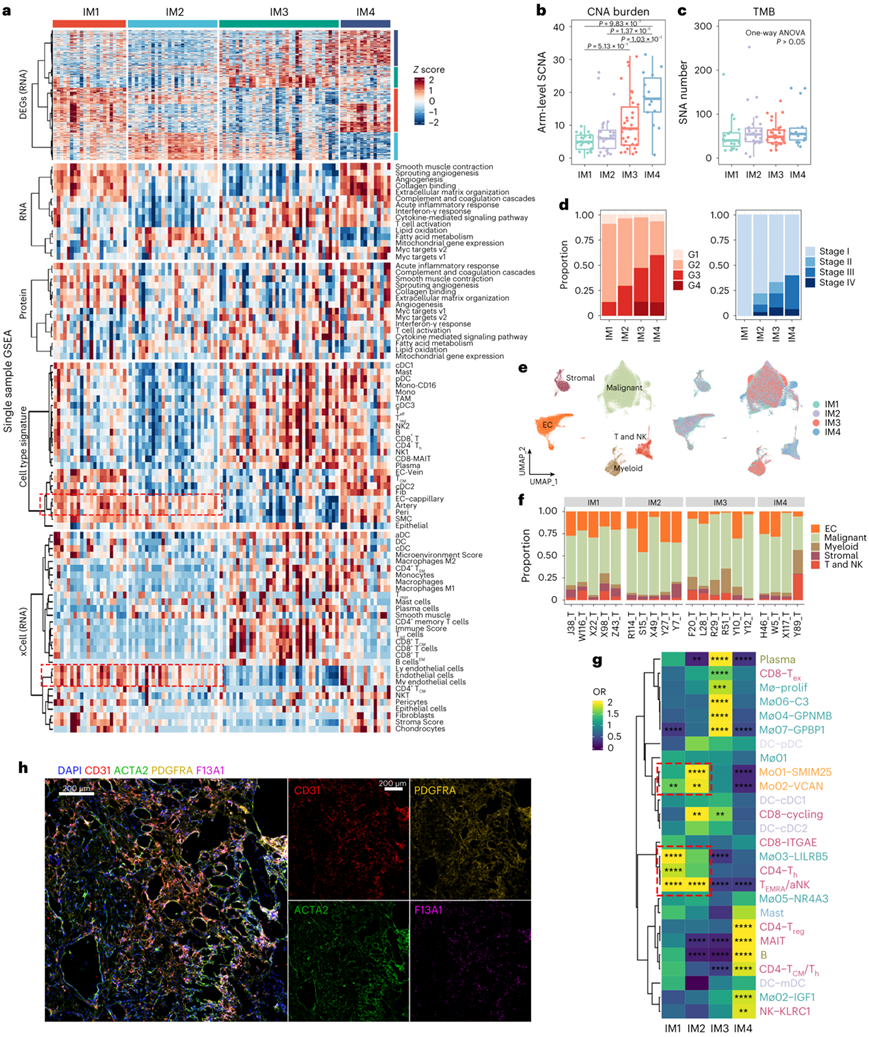
图2. 基于肿瘤微环境(TME)的 ccRCC 分子亚型。
(a) 100个肿瘤样本的综合分类。热图依次显示由 ssGSEA 算法计算的 DEG、mRNA 和蛋白质水平通路评分、ssGSEA 预测的细胞丰度和 xCell 预测的细胞丰度。(b-c) 免疫亚型中的臂级 SCNA 和非同义突变负担。(d) 四种免疫亚型之间肿瘤分级和阶段的差异。 (e) snRNA-seq 数据的 UMAP 图,按主要细胞类型(左)和免疫亚型(右)着色。(f) 每个样本的主要细胞类型比例的条形图。 (g) OR 热图显示免疫亚型之间细胞丰度的差异。(h) W5_T 上的多色荧光。
03
TME 中免疫和代谢异质性的相关性
无监督聚类揭示了四个不同的代谢基因表达,聚类1 涉及胶原蛋白和蛋白聚糖代谢,可能与细胞外基质重塑相关。聚类 2 与类固醇激素代谢有关。聚类1和聚类2的活性主要来自间质细胞和内皮细胞,聚类3 与脂肪酸和氨基酸代谢相关,并且富含 IM2 和 IM3,聚类4主要与核苷代谢相关。仅核苷代谢就可以将 IM3 样品与其他亚型区分开来(图3a)。联合分析揭示了 IM3 样品中转录组和蛋白质组水平上胞苷、嘧啶和其他核苷代谢相关途径的增强(图3b)。随后,TCGA KIRC 数据集中对 Teff细胞的单样本基因集富集分析 (ssGSEA) 评分与嘧啶代谢之间的相关性分析表明,嘧啶/胞苷代谢活性增加与 CD8 + T 细胞浸润增加和不良预后相关,与在 TJ-RCC 队列中的结果一致(图3c-d)。此外,在代谢组数据中观察到IM3样品中嘧啶衍生物的增加(图3e)。
然而,尽管IM3是CD8+ T细胞浸润的亚群,但IM3肿瘤的预后仍优于IM4肿瘤。这些结果提示CD8+ T细胞浸润可能限制ccRCC的肿瘤进展。
他们对12个肿瘤切片(4个IM1、4个IM2、3个IM3和1个IM4)和2个NAT对照进行了空间转录组学(ST)和代谢组学分析。在属于IM3组的CD8 T细胞浸润样本(R29_T)中检测到高鸟嘌呤和次黄嘌呤信号(图3f-g)。相反,在R51_T中,同样有局灶性淋巴细胞浸润的IM3样本,非肿瘤浸润淋巴细胞(TIL)浸润区仅检测到鸟嘌呤和次黄嘌呤的微弱信号(图3f-g)。这些发现表明ccRCC的肿瘤内异质性(ITH)以及嘧啶衍生物与TIL之间的潜在相关性。这一假设在另一个局灶性CD8+T细胞浸润的样本中得到进一步证实(图3h-l)。
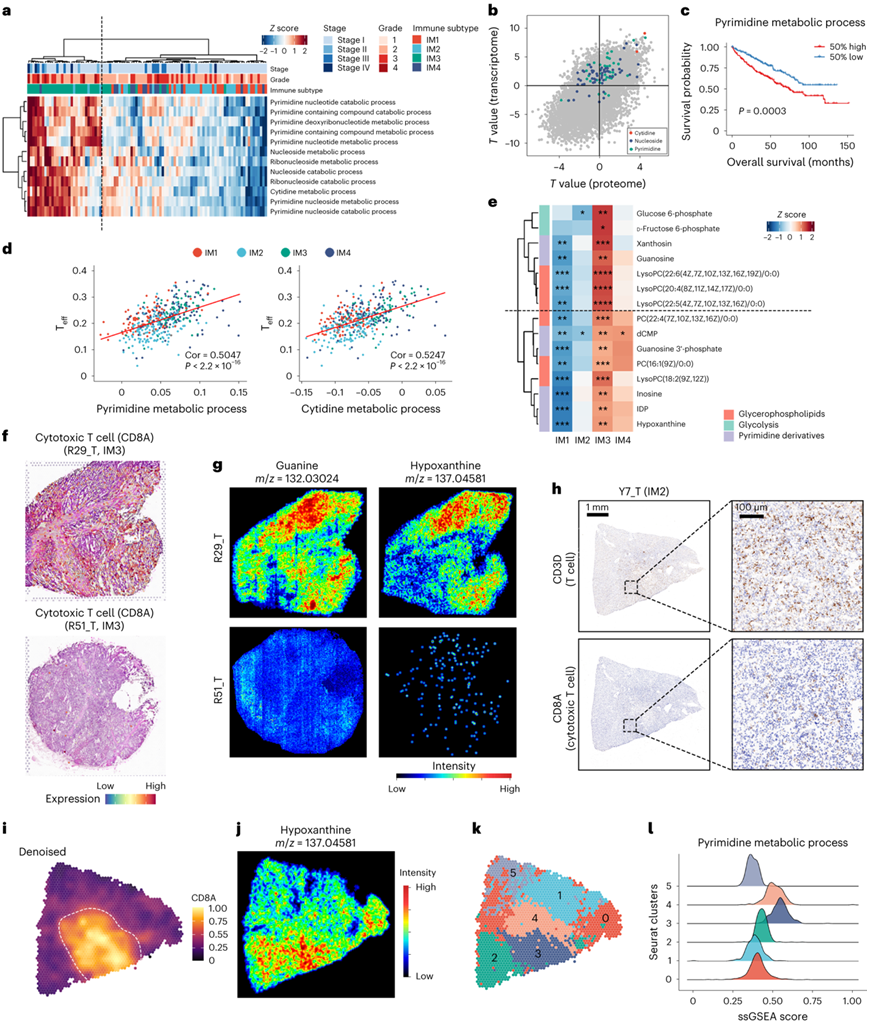
图3. TME 中免疫异质性和代谢异质性之间的相关性。
(a) 基于 ssGSEA 的嘧啶相关通路评分的热图。(b) IM3 肿瘤和 TJ-RCC 的其他肿瘤之间差异 ssGSEA的可视化。(c) TCGA KIRC 中按较高或较低嘧啶代谢活性分层的生存数据的 KM 图。(d) 嘧啶和胞苷代谢活性与T eff细胞丰度呈正相关。 (e) 热图显示 IM3 中给定代谢物的富集。 (f) ST 数据中CD8A的表达。 (g,j) 按代谢物丰度着色的空间代谢组切片。(h) Y7_T上CD8A和CD3D的免疫组织化学染色。 (i,k) Y7_T 的空间转录组,按CD8A表达水平和 Seurat 聚类着色。(l) 空间转录组的通路富集显示聚类3和聚类4具有更高的嘧啶代谢活性。
04
IM4 肿瘤表现出独特的代谢特征且预后较差
聚类3在IM4亚组中下调,包括各种代谢途径,涉及脂肪酸和氨基酸代谢。这些途径通常在 ccRCC中下调,表明 IM4 样品中代谢失调增强。为了系统地研究这些差异,他们确定了 IM4 和其他肿瘤亚组之间的 DEG。使用无监督分析,将853个DEG聚类分成四个基因模块(图4a)。IM4 肿瘤中模块 1 和 2 中的基因表达高于属于 IM1-IM3 的其他肿瘤样本。值得注意的是,NAT 的模块 1 基因表达水平最高。模块3基因在正常近端小管中显著表达并在非IM4肿瘤中下调,在IM4肿瘤中进一步减少(图4a)。这些基因富含脂肪酸、氨基酸和碳水化合物的代谢(图4b)。
与模块3中的基因相反,模块4中的基因在非IM4肿瘤中上调,但在IM4肿瘤中下调至NAT水平以下(图4a)。ccRCC 癌基因HIF2A也包含在该模块中。这些基因富含多种生物合成途径,包括脂肪酸生物合成途径(图4b),导致脂滴(LD)在肿瘤细胞中积累。由于这些特征在IM4肿瘤中很大程度上受到抑制,因此模块4相关特征可能对ccRCC具有双重作用。通过对20个随机选择的TJ-RCC队列样本进行油红O (ORO)染色验证,显示非IM4样本中LD积累表现为“透明细胞”表型,但在IM4样本中几乎没有观察到LD,这与转录组学特征一致(图4c)。
IM4 肿瘤中的代谢重编程也通过代谢组学分析得到证实。IM1-IM3 肿瘤中与丙氨酸、天冬氨酸和谷氨酸代谢以及精氨酸生物合成相关的代谢物水平低于 NAT。这些生物合成途径在IM4组中也发生下调(尽管程度较小),这与转录组学发现相对应(图4d-e)。有限的精氨酸生物合成表明 IM4 肿瘤中的尿素循环有限(图4f-g)。值得注意的是,IM4肿瘤中的尿素循环功能障碍似乎并不依赖于酶失调,表明机制未知(图4g)。
相反,IM4 中 GSH 代谢发生激活。IM4 肿瘤中 GSH 和氧化 GSH (GSSG) 均高度富集。这些分子可以消耗肿瘤细胞中的活性氧(ROS),导致更高的增殖率和耐药性。与高 GSH 三阴性乳腺癌不同,IM4 肿瘤并未表现出 GSH 生物合成底物水平升高(图4f-g)。此外,大多数参与 GSH 生物合成的酶在 IM4 肿瘤中并未失调。只有GGT1(催化GSH谷氨酰部分转移的酶)发生下调(图4g)。尽管构成尿素循环一部分的鸟氨酸水平在IM4肿瘤中降低,但两种鸟氨酸衍生物精胺和亚精胺的水平仍然大幅升高(图4f-g),两者都与癌细胞增殖有关。
鉴于代谢能量生成途径的下调和增殖速度的加快,IM4 肿瘤可能有替代能源。编码葡萄糖转运蛋白(SLC2A1和SLC2A3)、谷氨酰胺转运蛋白(SLC1A5和SLC38A5)、支链氨基酸转运蛋白(SLC7A5)和硫胺素转运蛋白(SLC35F3)的基因表达上调(图4h),可能导致增加IM4 肿瘤中的营养吸收。尽管IM4肿瘤可能摄取额外的葡萄糖,但在该组中只有糖酵解发酵过程得到增强,而糖异生受到抑制(图4i)。
IM4肿瘤的特征包括营养摄取增加,ROS和LD水平降低,代谢活性低,增殖率较高(图4j)。由于ccRCC的特点是LD在癌细胞中积累,他们将这一过程命名为ccRCC的去清除细胞分化(DCCD)。此外,由于IM4肿瘤已经完成了这一转化过程,他们将其命名为DCCD-ccRCC。由于在早期(I期和II期)诊断出原发肿瘤的患者未接受术后药物治疗,因此他们询问了早期DCCD肿瘤患者的预后是否较差。值得注意的是,在局限于肾脏的ccRCC患者(I期和II期)中,原发肿瘤分层为DCCD肿瘤的患者的总生存期(OS)和无进展生存期(PFS)显著较差(图4k)。这表明仅靠手术不太可能治愈这些患者。
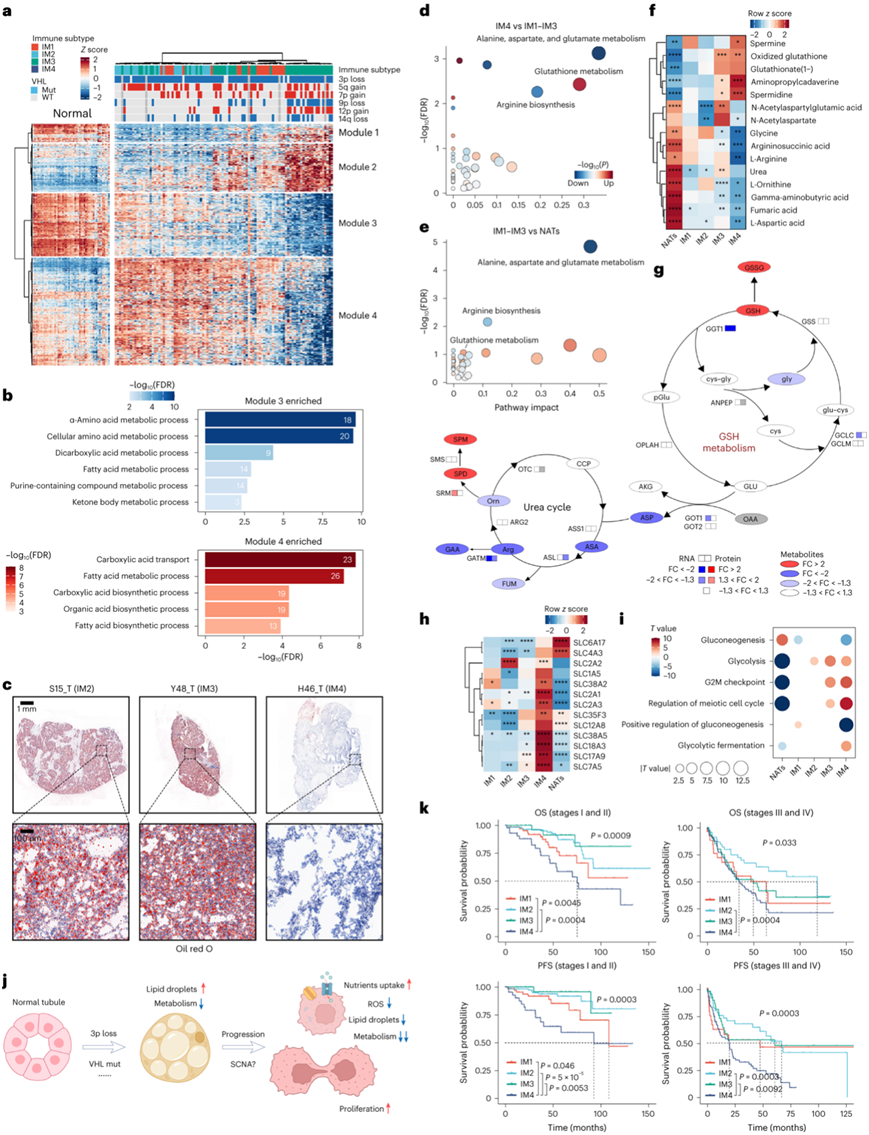
图4. DCCD 亚型在 ccRCC 中表现出严重的代谢紊乱和更差的结果。
(a) DCCD 肿瘤中上调和下调基因的无监督聚类。 (b) 模块3和模块4基因中的GO分析。(c) 对给定肿瘤样品进行ORO染色以可视化LD 。(d-e) IM4 与 IM1-IM3和 IM1-IM3 与 NAT中差异代谢物的富集分析。 (f) IM4 中富集或不存在的代谢物。 (g) IM4 与 IM1-IM3 的关键代谢变化总结。(h) IM4 中 mRNA 水平的转运蛋白上调。 (i) 使用 ssGSEA 算法对批量转录组进行通路富集分析。 (j) 参与癌发生和肿瘤进展的关键变化的示意图。(k) 早期(左)和晚期(右)ccRCC 中的生存曲线图,按免疫亚型分组。
05
IM 亚型与治疗反应相关
为了确定 DCCD (IM4) 和非 DCCD (IM1–IM3) ccRCC 患者的潜在治疗计划,他们分析了来自三项临床试验的bulk RNA-seq 数据。在 IMmotion 151 试验中,与sunitinib [受体酪氨酸激酶抑制剂(TKI)]相比,atezolizumab [程序性细胞死亡1配体1 (PD-L1)抑制剂]和bevacizumab [血管内皮生长因子(VEGF)抑制剂]联合使用可改善IM3和DCCD (IM4)组的预后(图5a-c)。
在另一项 III 期临床试验 JAVELIN 中,DCCD 患者表现出最差的预后,与治疗类型无关,这验证了 IMmotion 151 的观察结果(图5d-e)。与单独使用sunitinib相比,avelumab(PD-L1抑制剂)和axitinib(VEGFR抑制剂)的联合治疗改善了IM1、IM3和IM4组的PFS(图5f)。IM1组以血管生成相关基因高表达为特征,因此可以从avelumab + axitinib治疗中受益,但不能从atezolizumab和bevacizumab中受益(图5c-f)。
在接受nivolumab治疗的转移性肾癌(mRCC)患者中,患者分层影响OS,但不影响PFS(图5g-h)。值得注意的是,在everolimus [雷帕霉素激酶(mTOR)抑制剂的机制靶点]治疗组中,IM3肿瘤患者的OS和PFS最短。相比之下,在IM2和IM3患者中,nivolumab (PD-1抑制剂)治疗比everolimus(mTOR抑制剂)治疗延长了OS(图5i)。
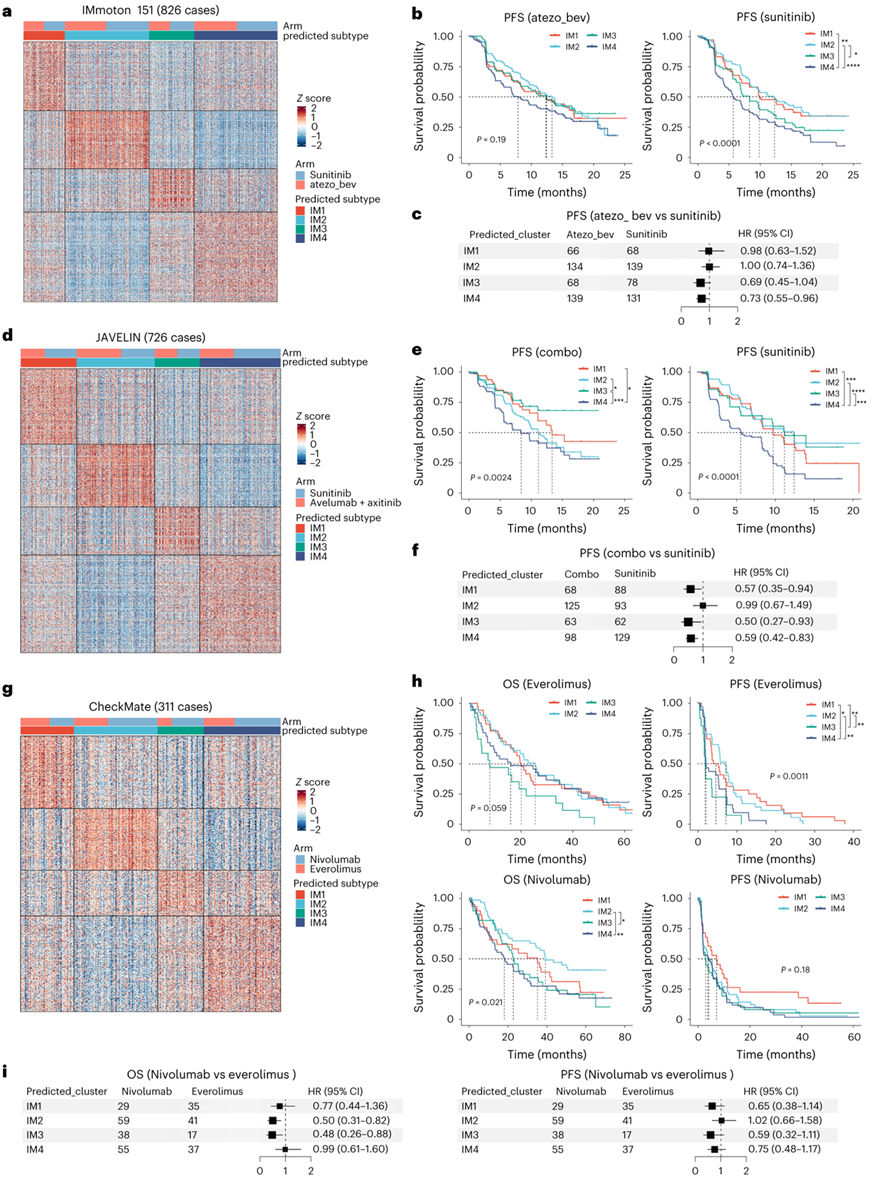
图5. IM 亚型与治疗反应相关。
(a,d,g) 热图显示 IMmoton 151、JAVELIN 和 CheckMate 中特征基因的表达水平。 (b,e,h) 给定队列 IMmoton 151、JAVELIN和 CheckMate 中免疫亚型的生存曲线图。 (c,f) 联合治疗与sunitinib治疗患者的 PFS 风险比森林图。(i) nivolumab与everolimus治疗患者的 OS 和 PFS 风险比的森林图
06
ccRCC 中从非 DCCD 到 DCCD 的亚聚类级别转换
ssGSEA 分析揭示了 IM1 和 IM3 样本中的中间 IM2 和 IM4 分数,其中 IM1 和 IM3 样本之间的特征呈负相关(图6a)。因此,他们根据显性基因标记将这些样本命名为IM2样或IM4样,并将DCCD评分定义为IM4和IM2评分的D值(图6a-b)。生存分析显示,IM4样肿瘤患者的OS和PFS优于IM4患者,但低于IM2和IM2样肿瘤患者,两者预后相似(图6c)。
snRNA-seq 数据的后续分析揭示了IM2 和 IM4 分数之间相同的负相关性(图6d-e)。因此,他们根据 DCCD 评分将单个癌细胞分为 IM2 样或 IM4 样表型。有趣的是,IM2样或IM4样细胞的比例与bulk RNA-seq水平上的DCCD评分相关,表明DCCD反映了肿瘤内部IM4样癌细胞的积累(图6f)。在snRNA-seq数据中,亚克隆SCNA仅在两个肿瘤中发现,其中部分恶性细胞表现出DCCD特征(图6g)。
值得注意的是,Y7_T在bulk RNA-seq和snRNA-seq数据中均表现出IM2特征(图6f),在visium切片中显示了亚克隆DCCD的偏移,反映了DCCD诱导的ITH。非DCCD区域表现出典型的“透明细胞”表型,对应于通过ORO染色观察到的表型(图4c)。在X98_T的DCCD区发现9号染色体缺失,与snRNA-seq数据一致(图6g-j)。综上所述,这些结果表明SCNA事件和DCCD之间没有绝对的相关性。空间代谢组分析显示,无论是否存在亚克隆SCNA,DCCD区域的脂肪酸(尤其是长链脂肪酸)较少,导致这些区域的LD积累减少。

图6. 在 ccRCC 中可以观察到从非 DCCD 到 DCCD 的亚聚类水平转换。
(a) IM1 和 IM3 肿瘤中 IM4 和 IM2 特征基因的热图。 (b) IM1和IM3组具有中等DCCD评分。 (c) 来自 TCGA KIRC 的生存数据的生存曲线图。(d) 恶性细胞 snRNA-seq 的 UMAP 图,按样本 ID 着色。 (e) snRNA-seq 的 UMAP 图,按 IM2 分数(上)和 IM4 分数(下)着色。(f) 条形图显示每个样本中 IM2 样和 IM4 样癌细胞的比例。(g) X98_T恶性细胞中的单核水平SCNA。(h) X98_T的H&E染色。 (i) X98_T 的 visium 数据中的空间特征分数。 (j) chr 9 分数的可视化。(k) Y7_T 中 IM2 样区和 IM4 样区之间的差异代谢物。 (l) Y7_T中脂质代谢物的空间分布。
07
建立 DCCD 的轨迹
为了更深入地了解向 DCCD 的转化过程,他们使用 snRNA-seq 数据构建了一条轨迹。IM4 样单细胞位于轨迹末端的中心。在整个假时间内观察到IM4分数的增加和IM2分数的减少(图7a-b)。随后,他们提取了差异表达的转录因子,得到了83个差异表达的转录因子,分为两个聚类(图7c)。HNF1A和HNF1B是肾小管发育所必需的,并且与ccRCC肿瘤发生相关,HNF1A的调节因子HNF4A,以及维持正常肾近端小管代谢特征的主要转录因子PPARA也参与其中。它们沿轨迹的下调可能与DCCD肿瘤中近端小管特异性代谢特征的抑制有关(图4a)。雄激素受体在IM4样单细胞中也下调。其在ccRCC中的缺失与较高的淋巴结转移率有关。HIF1A是肾癌的传统抑癌基因,在肾癌向DCCD分化的后期显著升高。在转移性肾癌中,HIF1A的上调与较低的药物反应率相关。两个样本的空间轨迹与snRNA-seq数据的结果一致(图7d-g)。
由于部分DCCD样本是IM2样细胞和IM4样细胞的混合物,因此可以利用基于DCCD特征评分的数据建立轨迹。因此,他们使用Monocle 2生成轨迹,DCCD得分作为伪时间。在bulk RNA-seq和snRNA-seq数据中,参与DCCD的关键转录因子的持续变化高度一致(图7h-i),这表明DCCD在ccRCC中是一个广泛的、连续的生物过程。

图7. 利用多组学数据建立 DCCD 的轨迹。
(a) 用伪时间着色的单个恶性细胞的扩散图。 (b) IM2 和 IM4 分数在整个伪时间内发生变化。 (c) 热图显示 snRNA-seq 数据中转录因子 (TF) 的表达在整个伪时间内逐渐变化。 (d,f) Y7_T和 X98_T中从类 IM2 模式到类 IM4 模式转换的空间轨迹。 (e,g) Y7_T和X98_T中TF的表达沿着空间轨迹变化。 (h) TCGA KIRC 样品的三维扩散图。 (i) TCGA KIRC 中 DCCD 相关 TF 的平滑热图。
snATAC-seq 数据的 ChromVAR 偏差分析揭示了 DCCD 和非 DCCD 群体之间差异最大的激活转录因子。AP-1转录因子亚基排在顶部,其次是BACH1、BACH2和肝细胞核因子家族的成员(图8a),并通过基序足迹分析(footprinting analysis)进行验证(图8b)。综合多组学数据还揭示了转录组和染色质可及性之间的异步现象 (asynchronous phenomena)。H46_T是一种雄激素受体低表达(ARlow)肿瘤。然而,基序足迹分析显示,H46_T的雄激素受体结合位点在所有样品中显示出最高的染色质可及性(图8c-e)。
他们还在癌细胞中发现了与CEBPB表达相关的几个峰,这些峰可能是促进CEBPB表达的增强子(图8f-g)。最后,scMEGA分析能够构建DCCD和非DCCD癌细胞的独立基因调控网络(图8h)。综上所述,这些数据提供了对参与ccRCC进展的转录因子调控网络的见解。
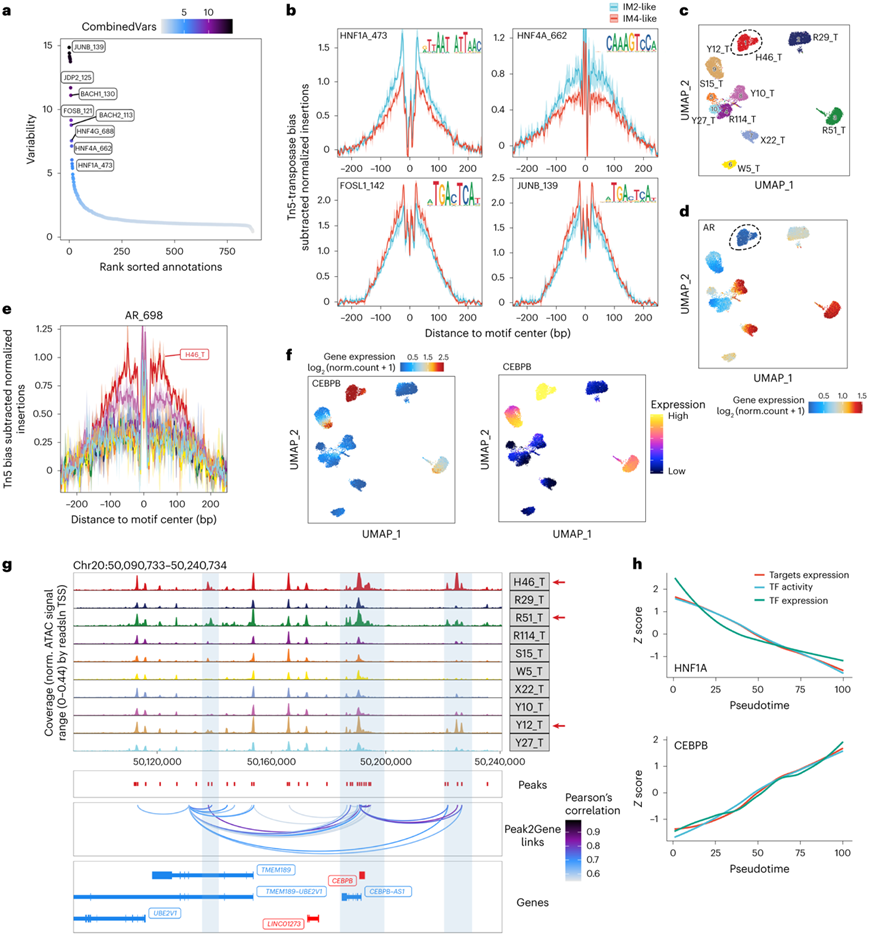
图8. snATAC-seq 揭示了 DCCD 中涉及的转录因子。
(a) IM4 样和 IM2 样单核之间的基序偏差。 (b) 按 IM2 样和 IM4 样癌细胞分组的给定 TF 的 Tn5足迹。 (c-d) 癌细胞snATAC数据的UMAP形式呈现,按样品名称和AR的mRNA表达水平着色。 (e) 按样本名称分组的癌细胞中 AR 的 Tn5足迹。(f) 由 mRNA 着色的癌细胞 UMAP(左)和预测基因评分(右)。(g) CEBPB 的基因组可及性轨迹可视化。 (h) 靶标表达、TF 活性和 TF 表达随着伪时间逐渐变化。
+ + + + + + + + + + +
结 论
本项研究对来自TJ-RCC队列的 100 名 ccRCC 患者进行基因组、转录组、蛋白质组、代谢组以及空间转录组,确定了四种 ccRCC 亚型,包括去透明细胞分化 (DCCD)-ccRCC,这是一种具有独特代谢特征的亚型。DCCD癌细胞具有脂滴较少、代谢活性降低、营养吸收能力增强、增殖率高等特点,导致预后不良。使用单细胞和空间轨迹分析,证明 DCCD 是 ccRCC 进展的常见模式。即使在 I 期患者中,DCCD 也与较差的预后和较高的复发率相关,这表明仅通过肾切除术无法治愈它。本项研究还提出了一种基于亚型特异性免疫细胞浸润的治疗策略,可以指导 ccRCC 的临床管理。
+ + + + +



 English
English


