文献解读|Cell Rep Med(11.7):利用患者来源的类器官进行个性化药物筛选及其在胃癌中的临床意义
✦ +
+
论文ID
原名:Personalized drug screening using patient-derived organoid and its clinical relevance in gastric cancer
译名:利用患者来源的类器官进行个性化药物筛选及其在胃癌中的临床意义
期刊:Cell Reports Medicine
影响因子:11.7
发表时间:2024.07.01
DOI号:10.1016/j.xcrm.2024.101627
背 景
胃癌(GC)是全球第五大常见癌症和第四大癌症死亡原因,并且过去几十年来其发病率一直在增加。手术切除联合围手术期化疗是局部晚期胃癌患者的一线治疗选择。最常见的常规化疗药物包括氟尿嘧啶(例如,5-氟尿嘧啶 [5-FU]、卡培他滨和S-1)和铂化合物(例如,顺铂和奥沙利铂)。然而,胃癌患者对这些化疗的反应差异很大,原因也不明确,目前尚未开发出能够准确预测胃癌患者化疗疗效的方法。
实验设计
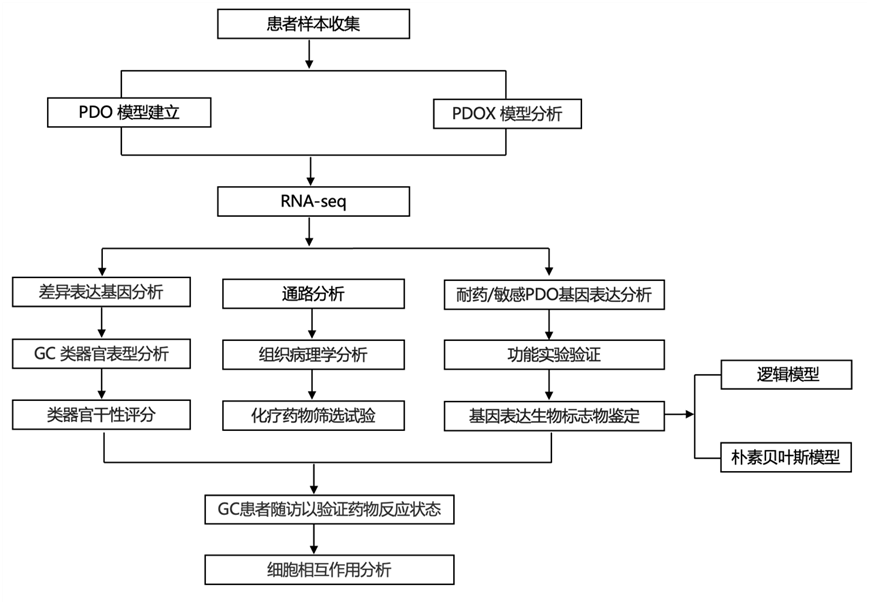
结 果
01
建立活体患者来源的胃肠道类器官生物库
研究团队从 73 例经组织学诊断为胃腺癌的患者的手术切除标本中获取了胃肿瘤组织,并成功建立了源自这些 GC 肿瘤组织的 57 个类器官(PDO),总体成功率为 78%(图 1 A)。具体而言,53 个类器官来自初治患者,4 个类器官来自接受新辅助化疗的患者(图 1 B)。GC 类器官来自胃的各个部位,例如贲门、胃底、胃体、胃窦和胃角。这些类器官来自不同肿瘤淋巴结转移 (TNM) 分期的患者,包括 I 期、II 期、III 期和 IV 期(图 1 B)。不同的 GC 类器官具有不同的生长率。五种类器官培养物可以连续繁殖多达 17 代,而其繁殖能力没有任何明显减弱。因此,他们将这些类器官(包括 G5T、G9T、G27T、G30T 和 G72T)定义为高生长率类器官,它们表现出增殖祖细胞表型和形成无腔的球形囊状形态(图 1C)。其他类器官培养物成功建立,但在 8-9 代后未能进一步繁殖;因此,将它们定义为低生长率类器官。这 52 个低生长率类器官具有腺状形态,并有腔状外观(图 1C)。因此,这些结果表明已成功建立 GC PDO 生物库。这些类器官具有不同的生长特征,例如高生长率类器官或低生长率类器官。
接下来,他们进行了转录组分析(RNA-seq) 以比较高生长率或低生长率的 GC 类器官。与低生长率类器官相比,高生长率类器官中的基因表达存在显著差异(图 1 D)。增殖和干细胞相关基因REG4、KLF4、ERBB3、HRAS、NOTCH1和MYC是异常基因,在高生长率类器官中显著上调(图 1 E),而与细胞生长抑制相关的基因,包括BAX、DKK3、TNFSF12、MCC、BNIP3和TP53BP1,在高生长率类器官中与低生长率类器官相比下调(图 1 D-E)。
一致地,基于直系同源性的注释系统 (KOBAS) 的差异表达基因证实,增殖和干性相关通路在高生长率类器官中上调更多,包括丝裂原活化蛋白激酶 (MAPK) 家族信号级联和 NOTCH 信号传导,所有这些通路均可加速细胞增殖并维持干性功能(图 1 F)。与低生长率类器官相比,细胞分化和凋亡相关通路,包括 Hippo 信号通路和 p53 信号通路,在高生长率类器官中相对下调(图 1 F)。与低生长率类器官 (0.345) 相比,高生长率类器官的干性评分 (0.784) 也更高(图 1 G)。因此,高生长类器官和低生长类器官具有不同的基因表达模式,高生长类器官表现出更强劲的增殖和干性特性。
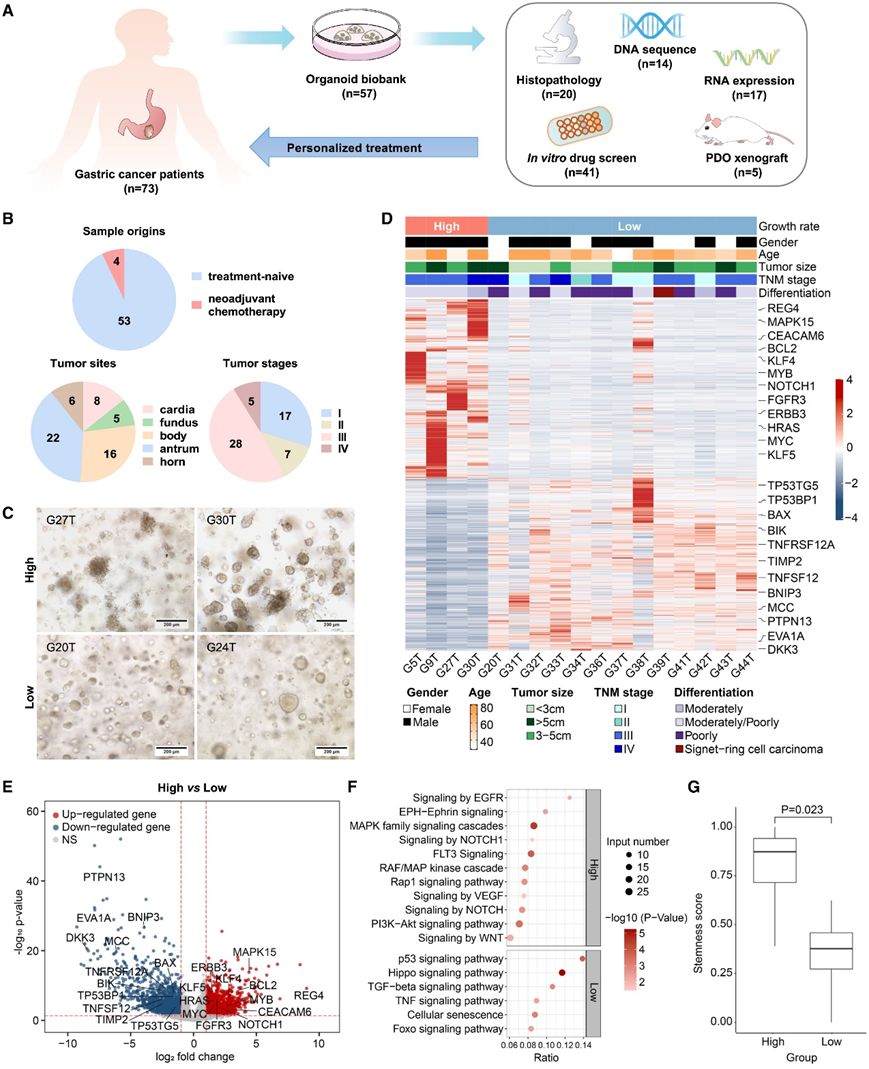
图1. 建立活体患者来源的胃肠道类器官生物库。
(a) GC 类器官培养建立和分析的示意图。 (b) 饼图显示已建立的 57 个 GC 类器官的样本来源、肿瘤部位和 TNM 分期。(c) )2 个生长速度快的 GC 类器官和 2 个生长速度慢的 GC 类器官的代表性图片。(d-e) 热图和火山图分析显示,与低生长率类器官相比,高生长率类器官中最显著的差异表达基因。 (f) 高生长率类器官与低生长率类器官相比的差异基因表达谱的 KOBAS。(g) 高生长率类器官和低生长率类器官之间的干性评分。
02
GC 类器官保留了其衍生的原代 GC 的组织病理学特征
通过 RNA-seq,观察到类器官与其相应的原发性肿瘤组织之间的基因表达模式高度相似(图2A-B)。GC 类器官保留了在其相应原发性肿瘤中观察到的特定腺体特征,包括腺状、松散或实性生长模式和核分层(图 2C)。类器官还表现出与其相应原发性肿瘤亚型相似的组织学特征,包括弥漫型、肠型和混合型 GC。源自肠型肿瘤(G20T 和 G43T)的 GC 类器官呈现由单个上皮层或筛状腺体形态组成的大球体,细胞形成多个大小不一的管腔。源自弥漫型肿瘤(G27T 和 G72T)的 GC 类器官形成松散粘结的实性细胞簇或囊性结构(G24T 和 G39T)。来自混合型 GC(G36T 和 G41T)的 GC 类器官显示出弥漫型和肠型肿瘤的组织学模式或两种模式(图 2C)。
为了确认 GC 类器官保留了其起源肿瘤的特征,他们对 GC 标志物细胞角蛋白 7 (CK7) 和癌胚抗原 (CEA) 的蛋白质表达进行了免疫组织化学分析。与相应的原发性肿瘤相比,GC 类器官显示出这些蛋白质标志物的存在和强度相似(图2D)。这些结果表明 GC 类器官保留了其原发肿瘤的组织病理学特征,推断 GC PDO 可以模拟个别患者的原发性 GC 进行药物测试。
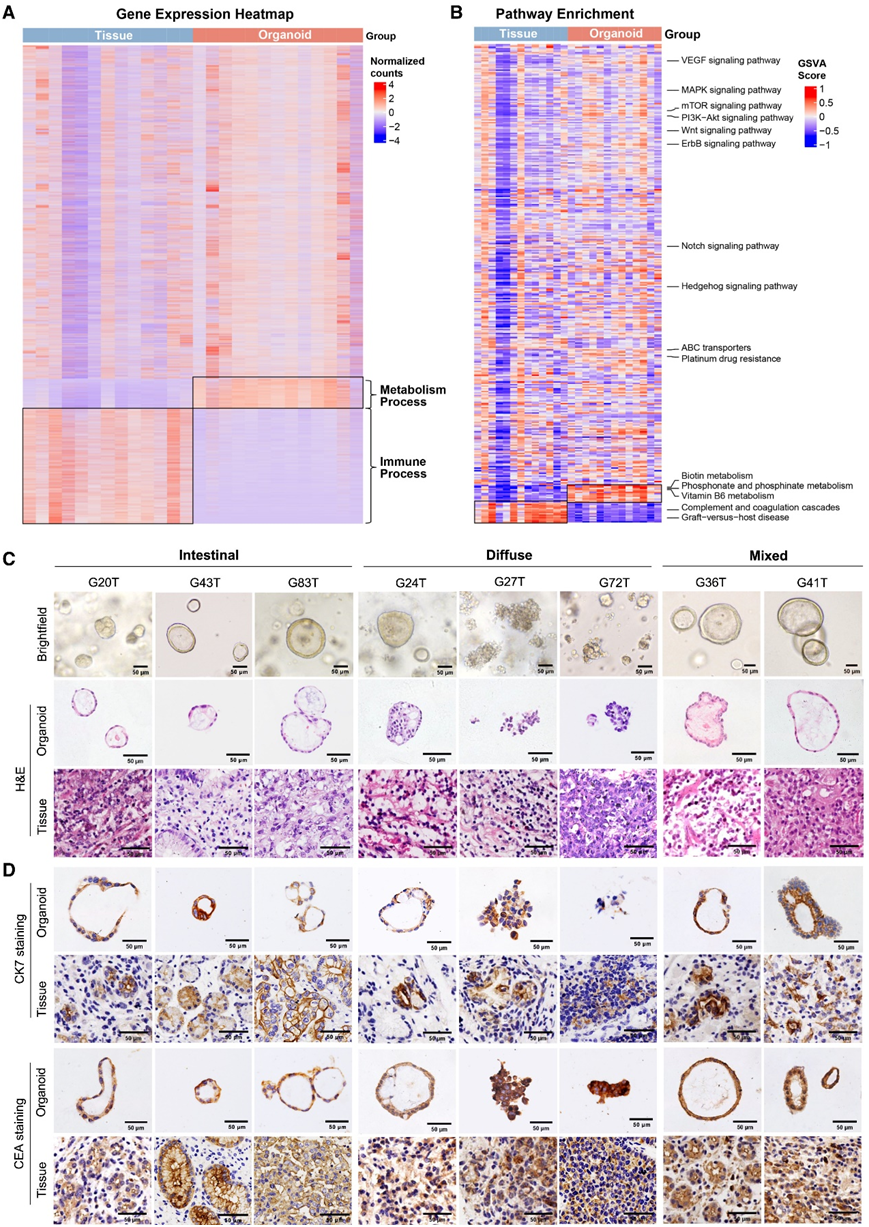
图2. 高生长率类器官和低生长率类器官之间的干性评分。
(a-b) 类器官和其相应肿瘤组织之间的差异表达基因热图和通路。 (c) GC 类器官和匹配的原发性 GC 肿瘤组织的明视野显微镜、苏木精和伊红染色的代表性图像。(d) 类器官及其相应的原发性 GC 肿瘤组织中的 GC 蛋白标志物 CK7 和 CEA 的免疫组织化学分析。
03
GC PDO的化疗药物筛选
为了探索胃癌类器官对不同药物的反应,他们将六种常规化疗药物应用于 41 个胃癌类器官,每种药物以五种不同的浓度进行三次筛选。来自同一类器官系的两个类器官传代生物学重复的剂量反应曲线下面积 (AUC) 值高度相关,表明该培养系统稳定,不受外部条件和类器官传代差异的影响(图 3 A)。不同 GC 患者产生的类器官对化疗药物的反应各不相同(图3B),一些类器官对 5-FU、奥沙利铂、顺铂、紫杉醇、SN-38 和阿霉素有抗药性,另一些类器官对 5-FU、奥沙利铂、顺铂、紫杉醇、SN-38 和阿霉素有部分敏感性或敏感性(图 3C)。弥漫型 GC 产生的类器官对 5-FU 和紫杉醇更敏感(图 3C)。这些结果共同表明,GC PDO 是潜在的有效药物筛选工具,对不同的传统化疗药物有不同的反应。
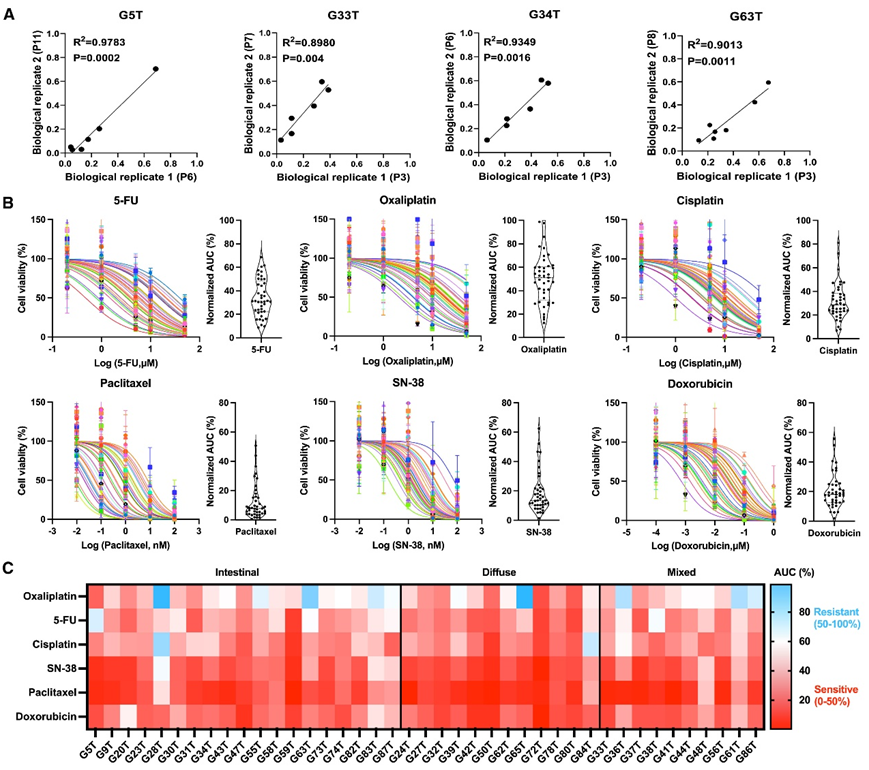
图3. GC PDO对化疗药物的筛选。
(a) 散点图显示两次独立药物筛选中 1-AUC 值之间的相关性。(b) ) 剂量反应曲线分析。(c) 41 个 GC 类器官中 6 种化疗药物的 AUC 热图。
04
GC PDO 对化疗药物反应的基因表达特征
根据对5-FU或奥沙利铂的反应,将17种GC类器官分为敏感组或耐药组(敏感组:AUC <50%,耐药组:AUC ≥50%)。比较敏感组和耐药组之间的基因表达谱,结果显示对5-FU敏感组和耐药组的GC类器官存在差异基因表达(图4 A)。与5-FU耐药类器官相比,5-FU敏感组中鉴定出显著上调的肿瘤抑制基因,包括MSMB、S1PR4、PURPL、TP53INP1和TRIM16(图4 B)。KOBAS 结果显示,在 5-FU 敏感的类器官中,肿瘤抑制 p53 信号通路和细胞衰老通路上调(图 4C),而与增殖和侵袭相关的基因,如FKBP10、DARPP32、ASCL2、BCL2、ABCC2和NOTCH1,在 5-FU 敏感的类器官中显著下调(图4A-B)。这些下调的基因在肿瘤侵袭和干细胞相关通路中富集,包括 NOTCH 信号、WNT 信号、Rho GTPases 信号和细胞外基质组织(图 4C)。
在对奥沙利铂敏感组和耐药组的 GC 类器官中也观察到了差异基因表达(图4D)。与奥沙利铂耐药类器官相比,奥沙利铂敏感组中与肿瘤抑制相关的基因显著上调,包括MYO1A、CLDN3、DMBT1、TNFRSF1B和TRIM15(图 4 E)。奥沙利铂敏感类器官中这些上调的基因主要富集在肿瘤抑制通路中,特别是肿瘤坏死因子 (TNF) 信号传导和 FOXO 信号传导(图 4 F),而与耐药组相比,奥沙利铂敏感组中与增殖和侵袭相关的基因显著下调,包括NDUFA4L2、DKK4、KLK10、FOSL1、STC2和L1CAM(图 4 E)。这些下调的基因参与增殖途径,包括 PI3K 信号传导和 WNT 信号传导(图 4 F)。
此外,他们进行了功能实验,与对照细胞相比,G27T 和 G72T 类器官中MSMB或S1PR4 (5-FU 敏感基因)敲除显著降低了对 5-FU 治疗的药物敏感性(图 4 G)。G9T类器官中FKBP10(5-FU 抗性基因)的敲除增加了对 5-FU 治疗的药物敏感性(图 4 H)。MYO1A(奥沙利铂敏感基因)或 NDUFA4L2(奥沙利铂抗性基因)的敲除也分别降低或增加了对奥沙利铂治疗的药物敏感性(图 4 I-J)。这些结果证实了这些基因在类器官中对其对 5-FU 和奥沙利铂治疗的反应的功能影响。
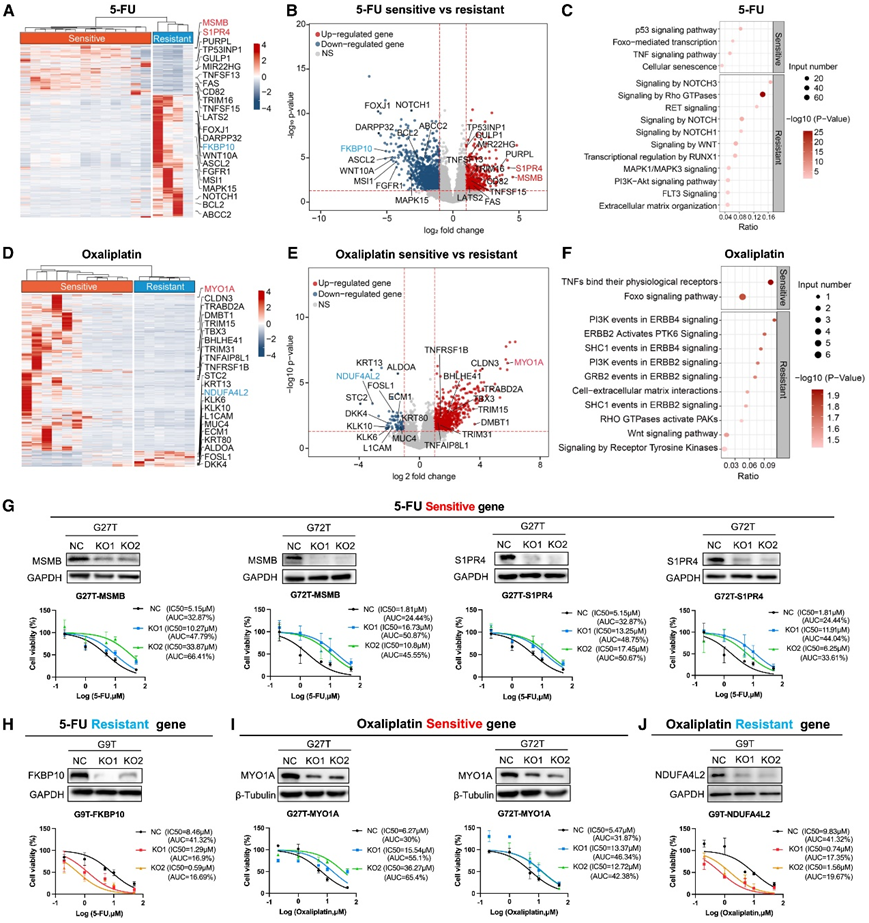
图4. GC PDO对化疗药物反应的基因表达特征。
(a-B) 热图和火山图分析显示 5-FU 敏感类器官与 5-FU 抗性类器官相比,差异最显著的基因。(c) 5-FU 敏感类器官与 5-FU 抗性类器官的差异基因表达谱的 KOBAS。 (d-e) 热图和火山图分析显示,与对奥沙利铂有抗性的类器官相比,对奥沙利铂敏感的类器官中差异最显著的基因 。(f) 奥沙利铂敏感类器官与奥沙利铂耐药类器官的差异基因表达谱的 KOBAS。 (g) G27T 和 G72T 类器官中5-FU 敏感基因MSMB和S1PR4的敲除 (h) G9T 类器官中 5-FU 抗性基因FKBP10的敲除。(i) G27T 和 G72T 类器官中奥沙利铂敏感基因MYO1A的敲除。(J) G9T 类器官中奥沙利铂耐药基因NDUFA4L2的敲除。
05
基因表达生物标志物用于区分胃癌患者对化疗的敏感和耐药反应
与 5-FU 耐药患者的肿瘤组织相比,在 5-FU 敏感患者的肿瘤组织中,共鉴定出 9 个具有显著差异表达的基因,包括 6 个上调基因(RNASEH2A、MMP3、CXCL1、COL5A2、MXRA5和PTTG1)和 3 个下调基因(SLC2A1、RRAD和APLP1)(图 5 A)。然后,他们利用这 9 个基因通过逻辑模型 (logistic model) 和朴素贝叶斯模型 (naive Bayes model) 来验证准确性。结果表明,该基因表达生物标志物可以区分 5-FU 敏感患者和耐药患者,通过逻辑模型的 AUC 为 87%,通过朴素贝叶斯模型的 AUC 为 86%(图 5 B)。
他们进行了类似的分析以鉴定肿瘤组织中的基因表达生物标志物,以区分对奥沙利铂治疗敏感的患者和耐药患者。与奥沙利铂耐药患者的肿瘤组织相比,在奥沙利铂敏感患者的肿瘤组织中共鉴定出 6 个差异表达基因,包括 3 个上调基因(TNFSF9、WNT2和EGR3)和 3 个下调基因(MT2A、SULT2B1和ALDOB)(图 5 C)。使用逻辑模型和朴素贝叶斯模型进一步验证了该基因表达生物标志物,可以区分对奥沙利铂治疗敏感的患者和耐药患者,逻辑模型的 AUC 为 81%,朴素贝叶斯模型的 AUC 为 83%(图 5 D)。这些结果表明基因表达生物标志物可以区分对 5-FU 和奥沙利铂化疗敏感的患者和耐药患者。
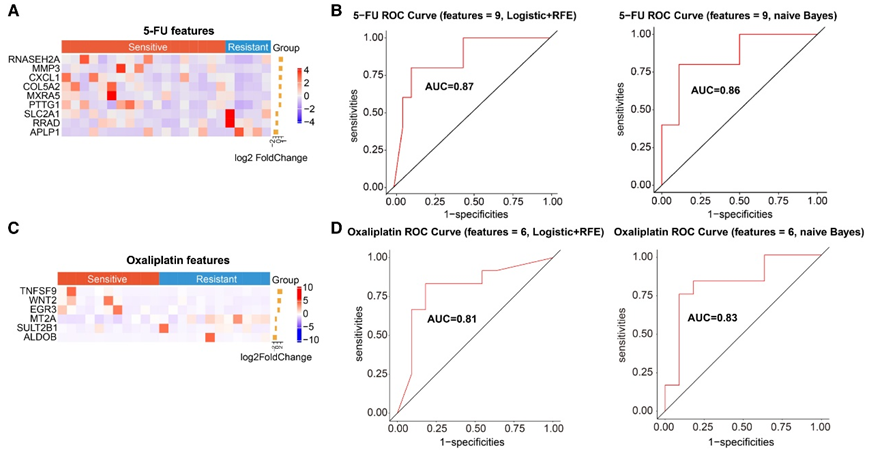
图5. 基因表达生物标志物用于区分胃癌患者对化疗的敏感和耐药反应。
(a) 热图显示 5-FU 敏感患者和 5-FU 耐药患者之间共有 9 个基因具有显著的差异表达。(b)利用受试者操作特性 (ROC) 分析以区分 5-FU 敏感性和耐药性。(c) 热图显示奥沙利铂敏感患者和奥沙利铂耐药患者之间共有 6 个基因具有显著差异表达。 (d) 利用ROC 分析以区分奥沙利铂敏感性和耐药性。
06
在PDOX模型中验证了 GC PDO 中观察到的药物反应状态
为了验证在 GC PDO 中发现的药物反应结果,他们建立了患者来源的类器官异种移植 (PDOX)模型。首先将不同系的 GC 类器官植入小鼠体内。一旦肿瘤长到 50 mm3以上,所有小鼠将随机接受药物或载体处理 28 天(图 6 A)。G5T-PDO 对紫杉醇敏感,对 5-FU 有抗药性(图 6 B)。与未经治疗的 G5T-PDOX 相比,植入 G5T-PDOX 的小鼠始终表现出对紫杉醇的显著反应,表现为肿瘤生长显著减少(图 6 C)和肿瘤重量显著降低(图 6 D)。此外,G5T-PDOX 小鼠对 5-FU 治疗有抗药性,这与 G5T-PDO 的结果一致(图 6 B)。与未经治疗的对照组相比,用紫杉醇治疗的 G5T-PDOX 中细胞增殖显著减少并且细胞凋亡显著增加,而在 5-FU 处理组中没有观察到差异(图 6 E)。此外,对 G9T-PDO 进行了评估,它们对 5-FU 敏感并且对奥沙利铂具有抗性(图 6 F)。正如预期的那样,植入 G9T-PDOX 的小鼠对 5-FU 表现出显著的治疗反应,但对奥沙利铂治疗没有反应(图 6 G-H)。5-FU 治疗后,与未治疗的 G9T-PDOX 相比,G9T-PDOX 中的细胞增殖显著减少,并且细胞凋亡显著增加,而奥沙利铂处理组没有差异(图 6 I)。
他们进一步用实际的临床治疗和结果验证了 GC 患者中 GC PDO 的药物敏感或耐药结果。对 12 名接受化疗的原发性 GC 患者进行了随访,并从其衍生的类器官中获得了联合药物筛选结果(图 6 J-K)。这些患者接受了奥沙利铂和 5-FU 的围手术期或术后辅助化疗,并进行了 1-49 个月的随访。6.05 个月内复发的患者定义为临床上对化疗反应不佳的患者。他们发现 12 名 GC 患者中有 11 名(91.7%)的药物反应结果与他们衍生的 PDO 中的结果相一致(图 6 K)。例如,患者 G32T 诊断为局部晚期 GC,并接受奥沙利铂和 S-1 术后辅助化疗,已随访 35 个月,无肿瘤复发。与实际临床反应一致,源自 G32T 的类器官对联合疗法也敏感。因此,GC PDO 中的药物反应可以在其相应的随访 GC 患者中得到验证,表明 GC PDO 是药物筛选和预测患者药物反应的有用工具。
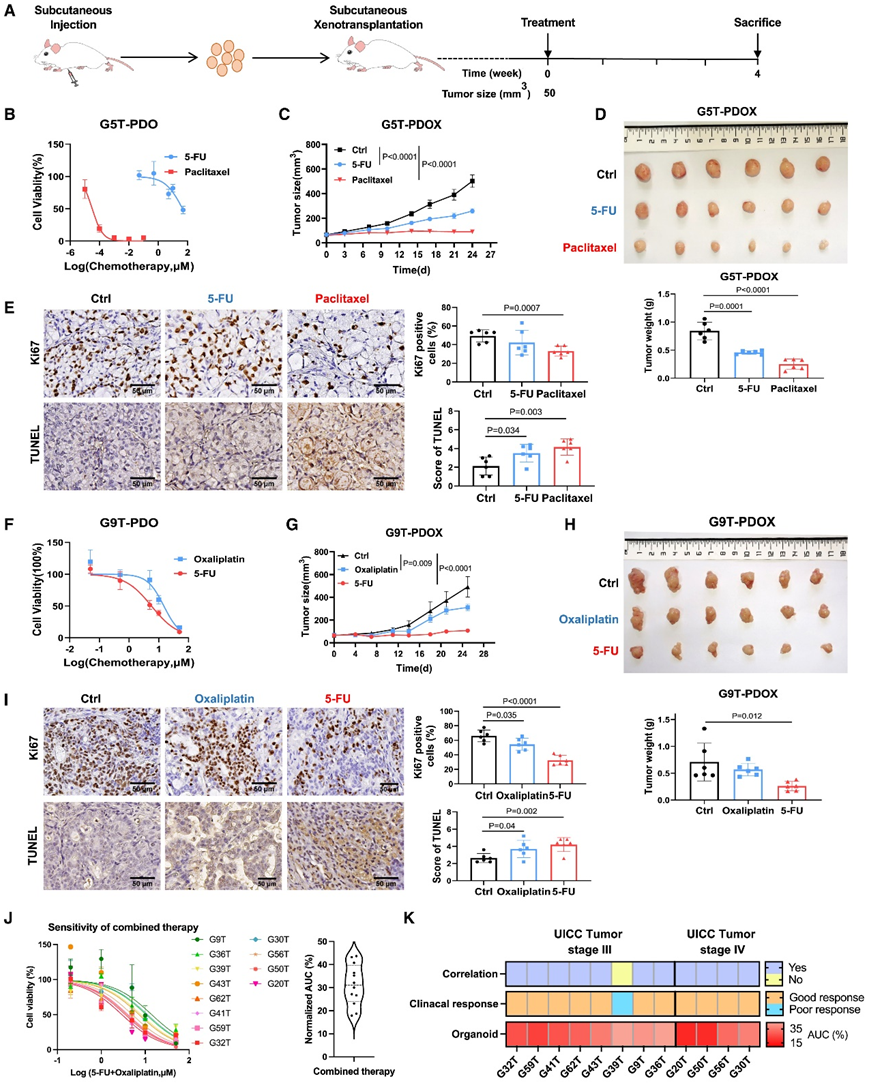
图6. 在 GC PDO 中观察到的药物反应状态在小鼠和相应的 GC 随访患者的 PDOX 中得到验证。
(a) 小鼠实验示意图。(b) 细胞活力分析。(c) 平均肿瘤大小 (mm3)。(d) G5T-PDOX肿瘤图像和处死时的肿瘤重量。(e) 小鼠肿瘤切片的代表性 Ki-67 染色和 TUNEL 染色以及定量分析。(f) 剂量-反应曲线。(g) 平均肿瘤大小 (mm3) 。(h) G9T-PDOX 肿瘤图像和处死时的肿瘤重量。 (i) 代表性 Ki-67 染色和 TUNEL 染色及定量分析。(J) 剂量反应曲线显示 12 个 GC 类器官对联合化疗药物(5-FU 和奥沙利铂)的化学敏感性。(K)热图总结了 12 种 PDO 的结果和相应的药物反应。
07
类器官模型作为研究肿瘤微环境细胞与肿瘤细胞之间相互作用的平台
为了探索将类器官与成纤维细胞共培养的可能性,他们共培养了 GC 类器官(G83T 和 G84T)和匹配的癌症相关成纤维细胞 (CAF)。CAF生长变大,并在 3 天后逐渐形成环绕类器官的网状结构(图 7 A)。另一方面,与 CAF 共培养在 5 天后显著扩大了类器官的尺寸(图 7 B)。然后,他们检测了 CAF 对肿瘤类器官对 5-FU 和奥沙利铂的反应的影响。值得注意的是,自体来源的CAF显著增强了G83T和G84T两种类器官样体对5-FU 和奥沙利铂的耐药性(图 7 C)。与单独的类器官相比,与异源 CAF 共培养的类器官 (G27T 和 G72T)也持续增加了耐药性。这些结果表明了 CAF 对化疗后类器官的影响(图 7 D)。自体T细胞的加入导致G72T(G72T 处于高微卫星不稳定性 [MSI-H])类器官结构受损,免疫荧光染色显示细胞凋亡增加(图7E)。与T细胞共培养的微卫星稳定(MSS)状态的G83T和G85T类器官中未观察到这种影响(图7E和S9B)。这些结果显示了肿瘤微环境中的细胞与肿瘤细胞之间的相互作用。
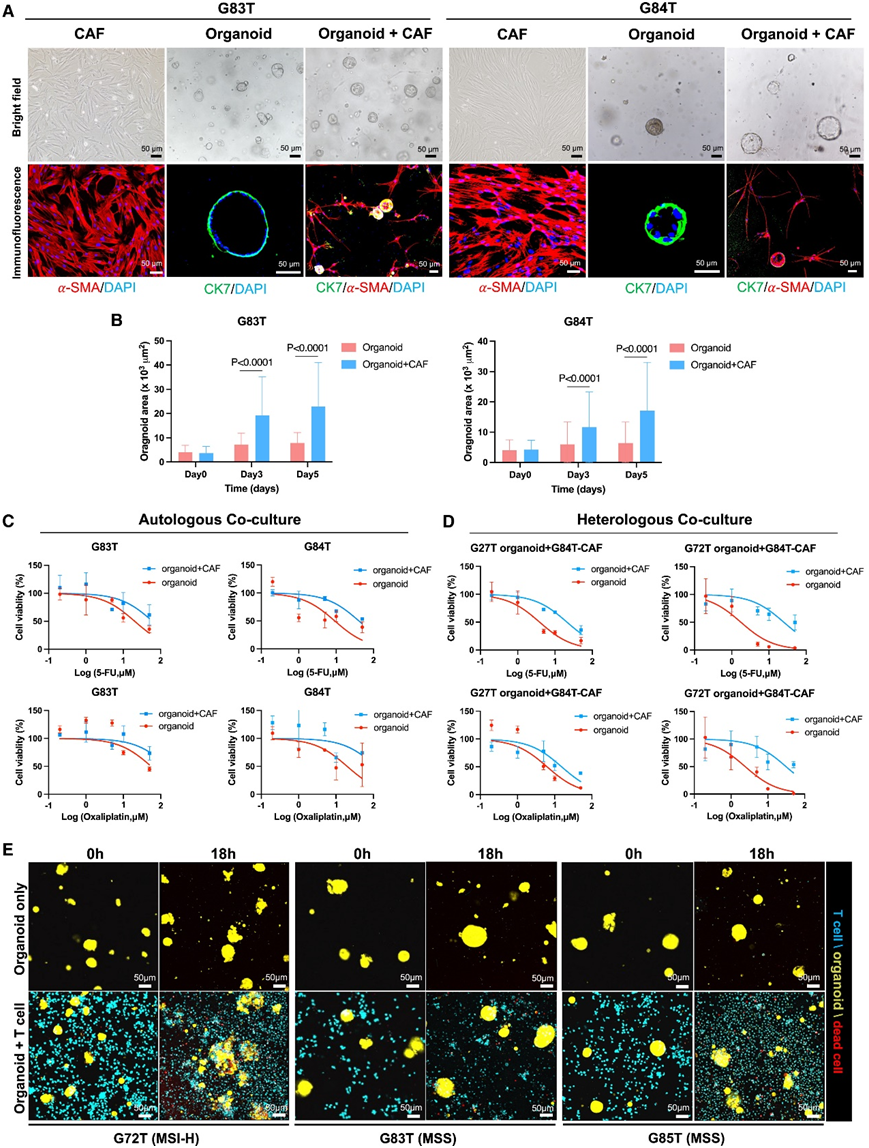
图7. 类器官模型作为研究肿瘤微环境细胞与肿瘤细胞之间相互作用的平台。
(a) 免疫染色分析。(b) CAF 在第 0、3 和 5 天对类器官生长的影响。(c-D) 剂量反应曲线显示类器官和与自体或异源 CAF 共培养的类器官对 2 种化疗药物(5-FU 和奥沙利铂)的化学敏感性。 (e) 指定时间点的 T 细胞和 GC 类器官共培养的 3D 多光谱图像。
+ + + + + + + + + + +
结 论
本项研究成功建立了GC PDO,这些类器官保留了相应原发性 GC 组织的组织学特征。GC PDO 对不同的化疗药物表现出不同的反应。通过RNA-seq,在 5-氟尿嘧啶 (FU) 或奥沙利铂敏感的类器官中发现了肿瘤抑制基因/通路的上调,而与增殖和侵袭相关的基因/通路在化疗耐药的类器官中富集。本项研究确定了基因表达生物标志物,可以区分对 5-FU 和奥沙利铂敏感和耐药患者(AUC >0.8)。此外,PDO 中的药物反应结果在基于PDOX的小鼠模型中得到验证,并且与 91.7% GC 患者的实际临床反应一致。因此,评估 PDO 中的化学敏感性可用作筛选 GC 患者化疗药物的有用工具。
+ + + + +



 English
English


