文献解读|Cancer Cell(50.3):综合多组学分析剖析转移性肝细胞癌的时空演化
✦ +
+
论文ID
原名:Integrated multi-omics profiling to dissect the spatiotemporal evolution of metastatic hepatocellular carcinoma
译名:综合多组学分析剖析转移性肝细胞癌的时空演化
期刊:Cancer Cell
影响因子:50.3
发表时间:2023.12.24
DOI号:10.1016/j.ccell.2023.11.010
背 景
肝癌是全球第三大癌症,其中肝细胞癌 (HCC) 占大多数病例。高达 60% 的局部可切除疾病患者在诊断后 5 年仍存活,相比之下,只有 4% 的远处转移患者存活。由于转移在很大程度上仍然无法治愈,因此了解这一过程对于改善晚期 HCC 患者的预后非常重要。
实验设计
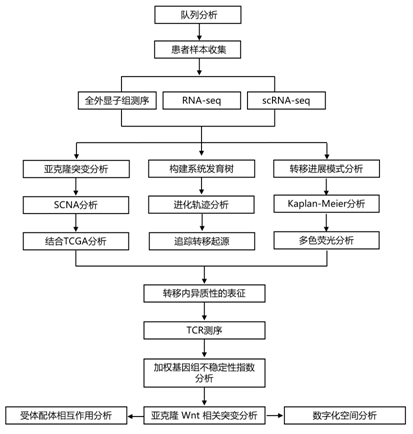
结 果
01
患者队列和HCC 的基因组景观分析
研究者团队从 182 名 HCC 患者中收集了 461 个福尔马林固定石蜡包埋 (FFPE) 肿瘤区域。该发现队列由复旦大学附属中山医院的两个不同的临床人群组成。肝外转移组(MET组,N= 335个区域)包括78例配对原发肿瘤(PT)、肝内复发肿瘤(RT)和肝外转移肿瘤(MT),无复发/转移组(NRM组)包括31例术后无复发或转移患者(≥6年)的PT组织。内部验证队列包括65例临床结局不同的未配对PT患者,外部验证队列包括8例来自天津医科大学肿瘤研究所和医院的配对PT和MT患者(图1A,图S1A)。他们使用全外显子组测序(WES)和RNA测序(RNA-seq)对所有区域进行分析。其中,对MET组中52.3%的PT和MT进行了多区域测序。MET组的转移具有广泛的时空代表性,包括原发性HCC手术后0-67个月的9个不同的转移部位(图1B-C,图S1B)。
为了揭示配对原发性和转移性 HCC 的基因组图谱,首先使用 Mutect2 对所有肿瘤区域进行单核苷酸变异和小插入和缺失(Indel) 识别。他们在 MET 组的 PT 和 MT 中分别检测到中位数 945 和 964 个突变。独立Sanger 测序证实了超过 95% 的 WES 代表性突变调用(图 S1 C-D),富集的突变特征与之前的研究一致(图S1E)。
克隆或亚克隆突变是根据癌细胞的部分以及它们在多个采样区域的存在来区分的。应用MutSigCV方法检测8种常见突变基因(TP53、RB1、PTEN、ALB、CTNNB1、RPS6KA3、BRD7和ARID1A)在发现队列患者中的克隆性突变。在本项研究的队列和癌症基因组图谱(TCGA)中,PT中HCC驱动基因的突变率相似(图S1F)。
他们专注于克隆突变来鉴定MT中反复突变的基因。只有三个肿瘤抑制基因鉴定为MT中的显著复发突变:TP53、RB1和PTEN。接下来,他们使用Sequenza和Gistic推断体细胞拷贝数改变(SCNA)。在PT和MT中观察到的广泛和局灶性复发性SCNA模式与先前的研究报告基本一致,例如在1q、8q和5p15.33 (TERT)处拷贝数增加,以及在16q、4p、17p13.1 (TP53)和9p21.3 (CDKN2A)处拷贝数丢失(图1D)。综上所述,MT中高频突变和SCNA的特征与本项研究的队列和先前研究的PT高度一致。
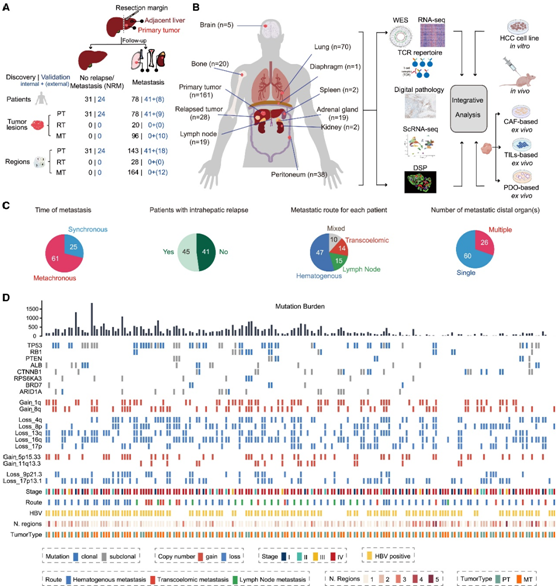
图1. HCC 转移队列概述。
(A) 从发现(黑色)、内部验证(蓝色)和外部验证队列(蓝色)收集肿瘤区域的流程图。(B) 研究设计,包括样本、分析和验证方法。(C) MET 组和外部验证队列中具有不同临床特征的患者的比例。(D) MET 组中具有配对 PT 和 MT 的 HCC 患者的遗传特征和临床病理特征。
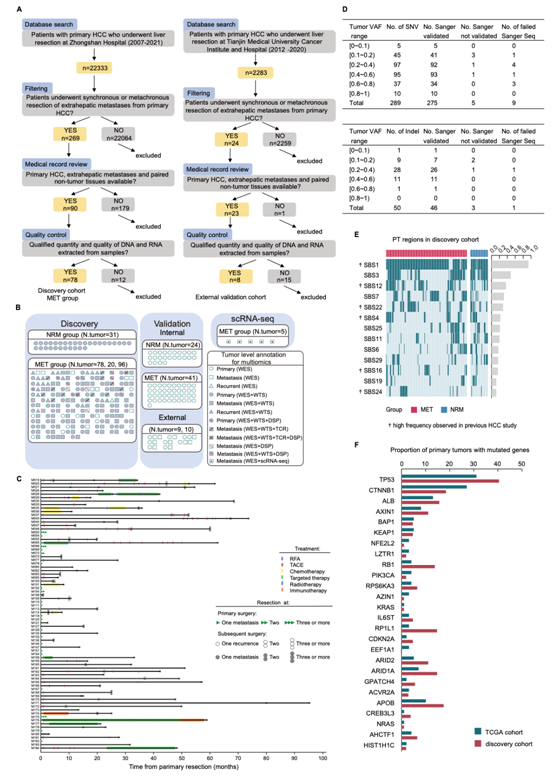
图S1. 队列描述和突变景观。
(A)从复旦大学中山医院22333名患者和天津医科大学肿瘤研究所2283名患者中选择样本的流程图。(B)发现、验证和scRNA-seq队列中的肿瘤概述。(C)发现队列中MET组所有78例患者在初始诊断后转移灶取样和治疗的时间。(D) Sanger测序验证WES检测到的SNV/Indel。(E)在发现队列中频率>10%的PT区域检测到的突变特征热图。(F)发现队列和TCGA中HCC频繁突变基因(在TCGA队列中定义)非同义突变的PT比例。
02
追踪肝癌转移的克隆起源
为了追踪MT的克隆起源,他们使用Treeomics和PTI重建了同一患者中所有已测序肿瘤的系统发育树。他们集中研究了三种复杂但临床相关的情况:多灶性PT患者,RT和MT同时存在的患者,以及多发性MT患者。大约41%-75%的HCC病例临床诊断为多灶性PT, 30%的多灶性PT为多中心性(即基因起源不同)。在一名多中心患者 M180 中,MT 和两个 PT 在遗传上彼此不同。在另一名患者 M054 中,PT1 和 PT2 在遗传上是多中心的。所有三个 MT 均源自 PT2 谱系(图 2 A)。这一 M054 病例表明 MT 更有可能由一种多中心 HCC 谱系播种。
在 HCC 中,RT 可分为遗传相似的肝内转移 (IM) 和遗传不同的多中心发生 (MO)。然而,IM-RT 和 MO-RT 谱系是否同时或仅一种谱系可以作为转移来源仍不清楚。在发现队列中,10 名具有配对 PT 的患者同时具有 RT 和 MT。在患者M021 中,连续发生了 3 次独立的复发(图 2 B)。前两次复发(RT1 和 RT2)为 IM-RT,而第三次复发(RT3)为 MO-RT。进化轨迹分析表明骨转移起源于IM-RT谱系(RT1/RT2),而不是MO-RT谱系(RT3)。同样,患者 M048 中遗传上不同的 MO-RT 并未引发转移(图 2C)。这些结果表明MO-RT谱系的转移能力弱于IM-RT谱系,这与MO-RT较好的预后一致。
一些病例表明,转移细胞不仅播散到不同的器官,而且还自我播种到原始器官。例如,在患者 M048 中,系统发育分析表明肺转移可能源自膈肌转移组织(图 2C)。在另一个病例 M028 中,系统发育分析假设,位于初始器官的一个区域 (AGM1-3) 内的肿瘤细胞转移到同一器官中的后续转移部位 (AGM2)(图 2 D) 。总之,这些结果表明肝外转移是以单谱系方式播种的。该谱系的任何阶段的肿瘤(PT、IM-RT 或 MT)都可能是潜在来源(图 2 E)。
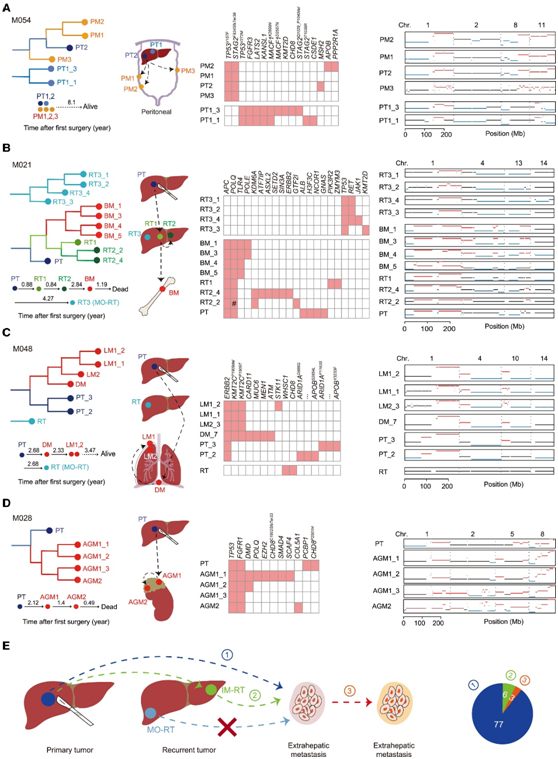
图2.追踪转移的起源。
(A-D) 患者 (A) M054、(B) M021、(C) M048 和 (D) M028 的系统发育树的构建。临床病程(以年为单位)如下系统发育树所示。插图显示了每位患者的转移途径。(E) 显示转移起源模型的卡通图。饼图总结了 MET 组中 MT 来源的比例。
03
HCC 转移播种模式的表征
癌症转移可以通过单个亚克隆(单克隆播种)或多个不同的亚克隆(多克隆播种)进行播种。在这项研究中,在39例具有多区域采样的MT和配对的PT/RT的患者中,10/43个MT(23%)由来自PT/RT的多个不同亚克隆接种的(图3A)。然后他们检测了单克隆和多克隆接种是否与不同的临床疾病进展率相关。33 名患者术后出现异时转移,进一步分为两个亚组:快速进展(多部位疾病进展 < 手术后 12 个月)或减弱进展。多克隆接种的患者进展迅速,而单克隆接种的患者进展缓慢(图3B)。
然后,他们研究了开发多克隆 MT 的 PT 的基因组和转录组特征。由于样本量有限,没有基因组改变与多克隆播种显著相关。基因集富集分析 (GSEA) 强调了多克隆接种 PT 中缺氧信号的转录激活(图 3D),并通过HIF1A的免疫组织化学 (IHC) 染色进行了验证(图 3E-F)。为了证实缺氧信号增强和多克隆接种之间的因果关系,他们进行了体内细胞混合实验。他们原位注射了各种经过工程改造的HCC细胞系,包括HIF1A敲低对照(NC)、HIF1A敲低(KD)、HIF1A过表达对照(载体)和MHCC-LM3细胞的HIF1A过表达(OE)变体,每一种细胞均转染了绿色荧光蛋白或红色荧光蛋白,用于跟踪(图3G)。随后对肺转移的分析表明,HIF1A-KD细胞在多色病变的发展中显著减少。与对照组相比,HIF1A-OE细胞的转移明显增加(图3H-I)。
这些结果表明多克隆播种与较差的预后相关,并且缺氧程序可能有助于HCC的多克隆传播。
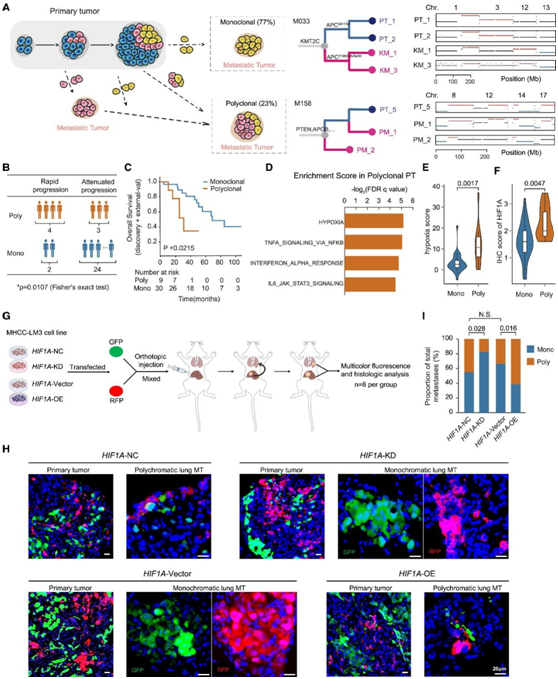
图3. 多克隆转移与生存率低相关。
(A) 单克隆和多克隆转移示意图。(B) 转移进展与播种模式之间的关联。(C) Kaplan-Meier 曲线比较多克隆和单克隆播种之间的总存活率。(D) HALLMARK 基因集在多克隆转移的 PT 区域中富集。(E-F) 小提琴图,显示具有多克隆或单克隆转移接种模式的 PT 区域中 HIF1A 的缺氧评分和IHC 染色评分。(G)自发体内转移实验的示意图。(H) 原发性肿瘤和肺转移性肿瘤的代表性多色荧光图像。(I)比较四组中单色(单克隆)和多色(多克隆)肺转移的比例。
04
PT 和 MT 之间的基因组差异表明早期转移扩散
克隆突变分为PT-私有突变、MT-私有突变和共有突变。PT 私有突变计数显著高于共有和 MT 私有突变计数(图 4 A)。为了模拟转移扩散的时间顺序,他们开发了一个基于配对 PT 和 MT 之间基因组异质性程度的模型(图 4 B)。转移前体的早期出现定义为 0 < R * ≤0.5,晚期扩散定义为 0.5 < R * <1.0。例如,M055患者的R *为0.1,表明腹膜转移早期发生,而M158患者的R *为0.7,表明腹膜转移晚期(图4C)。在发现队列和外部验证队列中,大多数 MT 都是从 PT 早期传播的(图 4 D)。此外,早期出现的 MT 表现出明显更多的亚克隆突变,这也证明它们的早期转移播种(图 4 E)。接下来,他们探讨了传播时间和临床参数之间的关联。基因定义的晚期传播在跨体腔转移中更为常见(图 4 F)。
他们将所有已传递变异体映射到临床注释数据库(CIViC、dgdb和DrugBank)和HCC相关可用药基因。与共有突变相比,在MT-private和PT-private突变中观察到更多的假定药物靶点(图4G)。
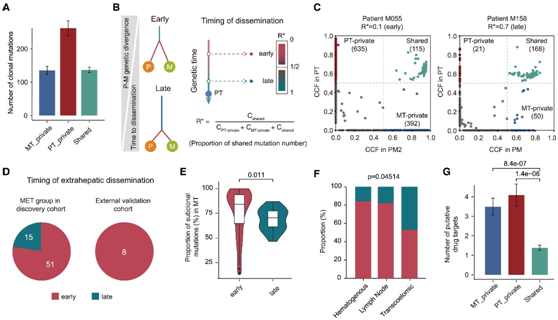
图4. 转移扩散的时间。
(A) 在 MT 或 PT 中单独检测到的克隆突变数量,或者由 MET 组的 PT 和 MT 共有的克隆突变数量。(B) 根据配对 PT 和 MT 之间的遗传差异,将转移时间分为早期传播和晚期传播。(C) 基于具有早期传播 (M055) 和晚期传播 (M158) 的代表性患者的 PT-MT 对之间 SNV 的 CCF 的不同传播时间。(D) 饼图总结了发现组(左)和外部验证组(右)中早期和晚期传播的比例。(E) 小提琴图,显示 MET 组中早期或晚期传播的 MT 中亚克隆突变的比例。(F) MET 组经血行、淋巴和经体腔途径的患者中早期和晚期传播的比例。(G) 在 MT 私有、PT 私有或共有突变组中检测到的假定药物靶点的数量。
05
转移内异质性阐明了免疫逃逸的演变
最近的一项全癌症未配对 PT 和 MT 分析(MSK-MET 研究)表明,与 PT 相比,大多数癌症的 MT 更加同质(图 5 A)。然而,在包括 HCC 在内的少数癌症中,MT 与 PT 一样具有异质性(图 5 A-B)。与 MSK-MET 研究一致,本研究队列中的 MT 表现出与配对 PT 相似的亚克隆突变水平(图 5 C)。这些结果表明 HCC MT 中存在高度基因组瘤内异质性 (ITH)。
为了研究 MT 中新抗原 ITH 的临床相关性,他们将 MT 区域分为两组,具有不同的新抗原 ITH 阈值(下四分位数与中四分位数或上四分位数),通过亚克隆新抗原分数 (neo-ITH) 进行分析以避免测序深度偏差。具有高新抗原 ITH 的 MT与显著缩短的总生存期相关(图 5 E)。具有高新抗原ITH的MT区域具有显著较低的克隆新抗原负荷和较高的亚克隆新抗原负荷,而各组之间的总新抗原负荷没有差异(图5F)。
接下来,他们检测了新抗原 ITH 高 MT 和低 MT 之间肿瘤微环境(TME)免疫组成的差异。表现出高新抗原异质性的区域显著减少了 CD3、CD4、CD8和 GranB 细胞的浸润,并且往往具有较少的 CD45RO 细胞(图 5G)。此外,TCR测序显示,在新抗原ITH高的区域,T细胞克隆性显著降低,这意味着T细胞克隆扩增有限(图5H)。这些分析表明,高新抗原异质性与转移过程中抗肿瘤T细胞免疫功能失调有关,这可能归因于新抗原耗竭或抗原加工和递呈机制(APM)的破坏。为了区分这两种可能性,他们逐个区域映射了它们的发生区域(图5I)。
他们首先应用了一种已发表的方法来量化每个转移区DNA免疫编辑的程度(观察到的/预期的新抗原比率)。新抗原ITH高比例MT和低比例MT之间的免疫评分无显著差异(图5J)。与低比例新抗原ITH MT相比,在高比例新抗原ITH MT中,通过人类白细胞抗原杂合性缺失(HLA-LOH)和编码APM成分的基因体细胞突变或拷贝数丢失事件导致的抗原呈递中断更常见(图5K)。
接下来,他们评估了 APM 的破坏是从接种的肿瘤细胞遗传而来还是在定植后获得。在 84.6% 的病例中,这些 APM 缺陷事件并不存在于 MT 配对的 PT 中(图 5L-M),这表明癌细胞在转移接种后进化出这些事件。与没有此类改变的配对区域相比,具有亚克隆 APM 缺陷事件的区域表现出明显较少的 HLA-A 蛋白染色(图 5 N)。这些结果表明,MT 在 HCC 中表现出更高水平的转移内异质性。高新抗原 ITH MT 在转移定植后会出现新抗原呈递功能障碍,这可能会损害抗肿瘤 T 细胞免疫并导致不良的临床结果。
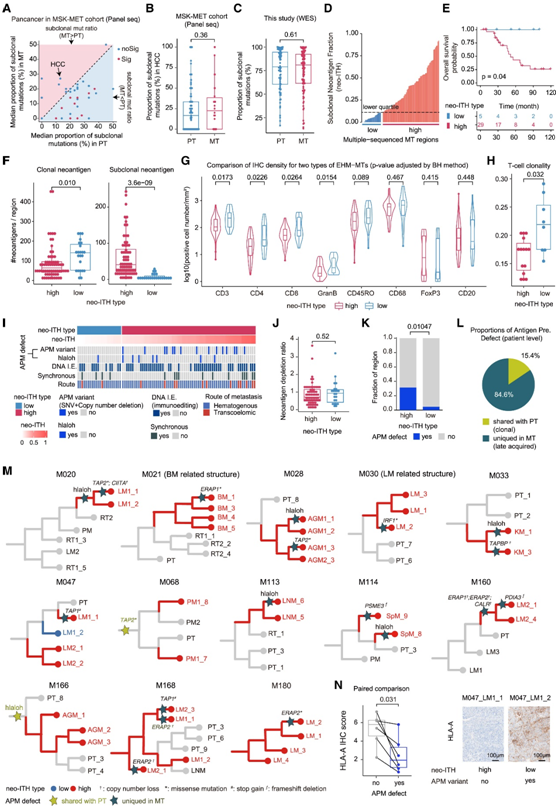
图5. 转移内异质性的表征。
(A) MSK-MET 队列中 PT 和 MT 中亚克隆突变的中位比例。(B-C) MSK-MET 队列和 MET 组中 HCC PT 和 MT 亚克隆突变的比例。(D) MET 组 (neo-ITH) 中每个 MT 区域的亚克隆新抗原分数的分布。(E)患者总生存率的 Kaplan-Meier 图。(F)克隆新抗原或亚克隆新抗原负荷的比较。(G) 小提琴图显示 neo-ITH 高和低 MT 区域肿瘤浸润的免疫细胞密度。(H) T 细胞克隆性的比较。(I)对于每个MT区域,显示了新ITH值、免疫逃避能力、APM变异、HLA-LOH、DNA免疫编辑(IE)、同步转移和转移途径。(J)新抗原消耗率的比较。(K)发生 APM 缺陷事件的区域比例。(L) 饼图显示具有 MT 独特和 MT-PT 共有 APM 缺陷事件的患者比例。(M) 具有多区域测序和 APM 缺陷事件的 MT 系统发育树。(N) 同一 MT 内有或没有 APM 缺陷事件的区域中 HLA-A 的 IHC 评分(左图)。HLA-A IHC 染色的代表性图像(右图)。
06
HCC 转移期间选定的 SCNA
根据加权基因组不稳定性指数 (wGII) 衡量,MT 比 PT 具有更高的 SCNA 负担(图 6 A)。此外,与 NRM 组相比,肝外转移的 PT 显示 wGII 显著升高(图 6 B)。为了识别可能促进转移的大规模基因组改变的候选者,他们比较了每个事件的“选定”与“未选定”克隆中发现的每个 SCNA 的次数比例(图 6 C)。经过多重假设调整后,所选克隆中显著富集了三个局灶性 SCNA 缺失(11p15.5、14q32.33 和 4q35.2)和四个臂水平缺失(14q、19p、21p 和 22q)(图6D-E)。
鉴于癌症转移过程中的“多任务过程”,任何单一选定的 SCNA 可能不足以完成整个任务。因此,他们通过对每个转移灶中选定的 SCNA 数量进行求和来生成富含转移灶的 SCNA (Met SCNA) 的分数。与配对的 PT 相比,MT 显示出显著更高的 Met SCNA 评分(图 6 F)。一致的是,具有转移结果的 PT 的得分显著高于 NRM 组的 PT。Met SCNA 评分较高的患者在本项研究的发现队列(图 6G)和内部验证队列(图 6H)中表现出明显更短的转移时间,并且在 TCGA 数据集中表现出更差的无进展生存期。
为了在功能上验证三个局灶性缺失(11p15.5、14q32.33 和 4q35.2)的促转移作用,他们总共提取了位于这些片段内的 142 个基因。如果基因满足以下标准,则保留基因用于进一步分析:(a) 与没有缺失的样本相比,在含有缺失的样本中显著下调,(b) MT 与 PT 中的下调,以及 (c) 与临床结果显著相关。应用这些过滤参数后,三个基因——CHID1、RNH1和PNPLA2——将保留用于后续的功能验证测定(图6I)。他们构建了稳定抑制这三个基因表达的人类肝癌细胞系,并检测了它们的体内转移潜力。敲低 CHID1和RNH1显著增加转移发生率和负担(图6J-K)。
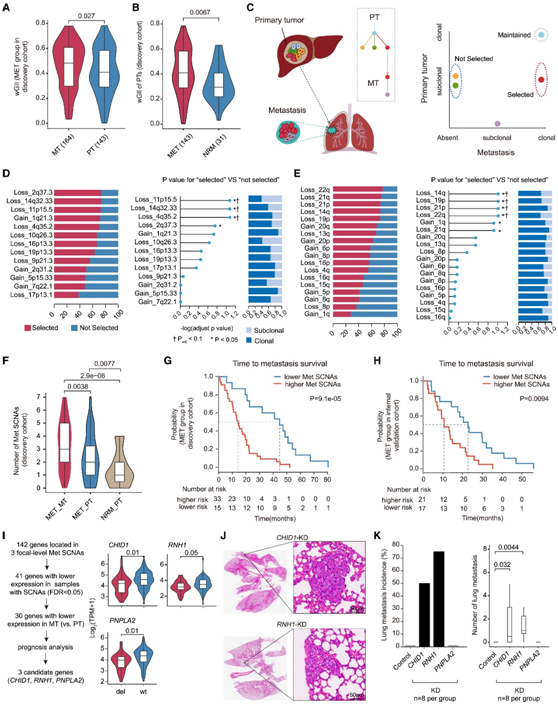
图6. SCNA 在转移进展过程中富集。
(A-B) 小提琴图显示 MET 组 (A) 中的 MT 和 PT 以及 MET 和 NRM 组中的 PT (B) 中的 wGII。(C) 用于对肿瘤克隆进行分类的方法的示意图。(D-E) 在发现队列中 MET 组的“选定”和“未选定”亚克隆中观察到每个病灶水平或臂水平 SCNA的时间比例。(F) 比较来自 MET 组的 MT 和 PT 以及来自 NRM 组的 PT 中的 Met SCNA。(G-H) 基于 PT 中 Met SCNA 状态(较高与较低)的(异时)转移生存时间的 Kaplan-Meier 曲线。(I) 工作流程过滤位于三个病灶水平 Met SCNA 中的转移相关候选基因,用于体内功能测定。(J) CHID1 -KD 和RNH1 -KD 组肺转移灶的代表性 H&E 染色图像。(K) 比较不同动物组之间的肺转移发生率(左)和总体肿瘤负荷(右)。
07
在转移进展过程中不选择亚克隆 Wnt 相关突变
然后,他们尝试描述转移进展过程中驱动突变的进化选择。令人惊讶的是,除了TP53和CPS1之外,HCC 特异性驱动因素的大多数亚克隆突变都没有发生选择(图 7A)。在13个“未选择”的亚克隆驱动突变中,有4个基因(CTNNB1、AXIN1、APC和NCOR1)参与致癌Wnt通路。如患者M127所示,肺转移来自无Wnt突变的PT亚克隆,而竞争外显子3 CTNNB1突变(S33P)亚克隆未能转移。IHC通过对谷氨酰胺合成酶(GS)和β-catenin的染色进一步证实了“非转移”亚克隆中Wnt信号的激活(图7B)。特别是,转移过程中wnt相关突变的非选择仅适用于亚克隆突变,而不适用于克隆突变。这些结果表明,亚克隆Wnt突变在进展到转移过程中的进化动力学模式是“非选择”的。
他们继续探究在有或没有Wnt相关突变的亚克隆之间观察到的明显的选择性转移优势的机制。MET组的所有PT区域均分为两个亚型。四个Wnt相关基因(APC、CTNNB1、NCOR1和AXIN1)频繁突变的区域指定为Wnt突变(Wnt-mut),而没有Wnt相关突变的区域定义为Wnt野生型(Wnt-wt)(图7C)。GO分析和GSEA显示,Wnt-mut区域表现出Wnt β-catenin信号传导和代谢过程的强富集,而Wnt-wt区域富集于与免疫反应、癌症相关成纤维细胞(CAF)活化、上皮-间充质转化(EMT)和血管生成相关的基因集(图7D)。介导TME相互作用的细胞因子在Wnt-wt区域显著上调。
为了分析肿瘤生态系统的细胞组成,他们应用了15个标记的免疫组化模块,然后进行了数字病理分析。Wnt-wt区域具有较高的TME细胞密度(图7E),其特征是CAF活化标志物(FAP、αSMA和IL6)(图7E))、效应性CD8+ T细胞(CD8、CD45RO和GranB)、免疫抑制信号(免疫细胞的PD1和肿瘤细胞的PD-L1)以及抑制性免疫细胞类型,包括调节性T细胞(FOXP3)、髓源性抑制细胞(CD11b+HLA-DR-)和M2巨噬细胞(CD206)的染色较多(图7E)。
为了分析细胞和表达程序在多细胞群落中的空间组织方式,他们使用 Nanostring GeoMx 人类全转录组图谱(WTA;>18000 个基因)对 Wnt-mut 和 Wnt-wt 区域进行了数字化空间分析 (DSP),这些区域共同发生在同一肿瘤内(图7F)。首先用 CAF (FAP)、CD8+ T 细胞 (CD8) 和恶性细胞 (PanCK)标记物对肿瘤切片进行染色。他们区分了具有丰富 CAF 和 CD8 + T 细胞浸润的多个感兴趣区域 (ROI),为 ROI 内的每个细胞类型片段创建自定义照明区域 (AOI)(图 7 F)。总共 143 个 AOI 用于单独分析。DSP 数据的反卷积显示细胞毒性评分没有差异,但 Wnt-wt 区域与 Wnt-mut 区域的 CD8 + T 细胞 AOI 中的终末耗尽 T 细胞评分显著升高(图 7G)。来自 Wnt-wt 区域的 CAF AOI 表现出肌成纤维细胞 CAF 减少,但炎症 CAF 特征增加,这意味着富含 CD8 + T 细胞的 ROI 中的 CAF 具有免疫调节表型(图 7 G),他们通过多重免疫荧光测定验证了这些结果(图 7 H)。
在 Wnt-wt 生态系统中观察到的多细胞群落促使他们考虑恶性细胞和各种 TME 细胞之间的相互作用。他们先使用公开发表的来自发生肝内转移的 Wnt-wt HCC 的单细胞 转录组分析 (scRNA-seq) 数据推断出假定的肿瘤-基质相互作用。当考虑恶性细胞的“传入”和“传出”信号时,发现 CAF 和恶性细胞表现出最强的细胞相互作用(图7I)。鉴于在Wnt-wt区域观察到更丰富的CAF,他们假设Wnt-wt HCC细胞比其Wnt-mut对应物具有更强的激活成纤维细胞的能力,并且高CAF丰度可能反过来有利于肿瘤扩散。与AXIN1-敲除(KO) 细胞相比,MHCC97H-wt 细胞表现出显著更高的 CAF 募集能力(图 7J)。
与AXIN1-KO细胞相比,MHCC97H-wt细胞中TGFβ、FGF2、PDGFA、PDGFB和HGF等成纤维细胞激活的关键介质的表达明显更高(图7K)。此外,Wnt-wt 患者来源类器官(PDO)比Wnt-mut PDO募集了更多的CAF(图7L)。
为了研究CAF是否促进了Wnt-wt恶性细胞的侵袭行为,他们接下来研究了发表的Wnt-wt与Wnt-mut HCC恶性细胞的单细胞谱。与Wnt-mut肿瘤相比,来自Wnt-wt肿瘤的恶性细胞在血管生成、EMT和TP53通路上富集(图7M)。WTA DSP验证了EMT程序在Wnt-wt与Wnt-mut区域侵袭边缘的肿瘤细胞中显著富集(图7N),这也通过经典EMT标志物的IHC染色得到了验证(图7O)。然后,他们通过细胞系模型、PDO和组织芯片验证了CAF对HCC侵袭行为的影响。来自Wnt-wt HCC的CAF-条件培养基(CAF-CM)显著提高了MHCC97H-wt细胞的侵袭能力,但对AXIN1-KO细胞没有影响(图7P)。Wnt-wt PDO与Wnt-wt CAF-CM共培养后,上皮细胞标志物CDH1表达下调,间质细胞标志物CDH2和VIM表达上调。相比之下,Wnt-mut CAF-CM未能激活Wnt-mut PDO中的上皮间质转化(EMT)程序(图7Q)。最后,在来自一个独立HCC队列的组织芯片中,PT中的FAP阳性染色与较高的循环肿瘤细胞负荷显著相关(图7R)。
总之,Wnt-wt HCC区域似乎含有富含活化成纤维细胞的反应性TME,这使Wnt-wt癌细胞通过激活EMT程序具有更强的转移传播能力。

图7. Wnt通路基因的亚克隆突变在转移中未受到选择。
(A) HCC 中未配对 MT 选择的频繁突变基因的比例。(B) M127 中的系统发育树以及免疫组化分析。(C) 将 PT 区域分类为 Wnt-mut 和 Wnt-wt 组的实验流程。(D) Wnt-mut 或 Wnt-wt PT 中上调基因集的富集图。(E) 通过 GPC3 IHC 染色估计 TME 细胞结构。(F) 显示 DSP-WTA 测序样本选择步骤的流程图(左)。ROI示例以及所有ROI中每个隔室占用的总分割面积的总百分比(右)。(G)用DSP比较Wnt-mut区和Wnt-wt区之间CD8+ T细胞的祖细胞和终末耗竭特征(左)和FAP+细胞的myCAF和iCAF特征(右)。(H)采用免疫荧光法比较Wnt-mut区和Wnt-wt区前提(Tim3−TCF1+)和终末(Tim3+TCF1-)耗竭CD8+ T细胞的浸润情况以及myCAF (α-SMA+COL1A1+)和iCAF (FAP+IL6+)的丰度。(I) Wnt-wt HCC肿瘤中恶性细胞与指示细胞类型之间假定的受体-配体相互作用的数量。(J) MHCC97H-wt 细胞和AXIN1 -KO 细胞招募的 CAF 的定量。(K) AXIN1 -KO 和 MHCC97H-wt 细胞中TGFβ、FGF2、PDGFA、PDGFB和HGF的相对表达。(L) 通过 Wnt-wt 和 Wnt-mut 人类 HCC PDO 对募集的 CAF 进行定量。(M) 来自外部 scRNA-seq 数据集的 Wnt-wt 肿瘤细胞中富集的 HALLMARK 基因集。(N) 肿瘤边缘的代表性免疫荧光图像 (GeoMx DSP),显示选定的 ROI(圆圈,左)。HALLMARK EMT 通路富集的 Wnt-wt ROI(右)。(O) 比较 Wnt-mut 和 Wnt-wt PT 区域之间 EMT 相关标记的 IHC 染色分数。(P)Transwell 实验。(Q)在与或不与相应 CAF 的 CM 共培养的 Wnt-wt 或 Wnt-mut PDO 中CDH、CDH2 和VIM (VIM) 的相对 mRNA 水平。(R)小提琴图比较FAP染色阳性和阴性患者术前分离的循环肿瘤细胞数量。
08
富含免疫抑制 B 细胞的 Wnt-wt MT 通过 HLA-E:CD94-NKG2A 检查点轴介导 CD8+ T 细胞的终末耗竭
为了进一步解读 Wnt-mut 和 Wnt-wt MT 之间的免疫生态系统差异,他们对新鲜手术转移性 HCC 标本中的 CD45 +细胞进行了 scRNA-seq 分析,根据谱系特异性标记物表达对总共 23713 个细胞进行了分类,并随后进行了注释(图 8 A)。他们鉴定了几种 T 细胞、自然杀伤细胞、B细胞/浆细胞和多个骨髓细胞亚群,尽管 Wnt-mut 和 Wnt-wt MT 的 T 细胞比例相似(图 8 B),但观察到四个 CD8 + T 细胞聚类沿轨迹的位置有很大差异(图 8 C)。来源于Wnt-mut MT的CD8+ T细胞,主要位于轨迹的中央段,以CD8固有样T细胞(IL7R+、KLRG1+、NCR3+、RORA+和CD69+)和CD8效应T细胞(CD8 EFF;GZMB+和PRF1+)为特征(图8C)。相反,来自Wnt-wt mt的CD8+ T细胞严重向轨迹末端倾斜,以CD8终末耗竭T细胞(CD8 Term.Exh.; PDCD1+、HAVCR2+、LAG3+、TOX+、EOMES+和TCF7-)和CD8循环(MKI67+和PCNA+)细胞为特征(图8C)。多重免疫荧光测定证实 Wnt-wt MT 中最终耗尽的 CD8 + T 细胞的浸润程度更高(图 8D)。
相对于 Wnt-mut,Wnt-wt MT 中B细胞浸润具有明显的偏好(图 8 B)。通过免疫组织化学(IHC) 检测进一步证实了这一观察结果(图 8 E)。值得注意的是,记忆B细胞表达较高水平的各种调节B细胞相关分子,包括IL10、TGFB1、CD40、CD24和CD27,这表明免疫抑制表型(图8F)。值得注意的是,记忆B细胞表达了更高水平的各种调节性B细胞相关分子,包括IL10、TGFB1、CD40、CD24和CD27,这表明存在免疫抑制表型(图8F)。
随后,他们通过CellChat推测记忆B细胞和所有免疫细胞之间的配体-受体相互作用。预测记忆B群体与CD8 Term .Exh.细胞的之间存在强烈的相互作用(图8G)。进一步的表征表明,HLA-E:CD94-NKG2A是记忆B细胞与CD8 Term .Exh.细胞之间存在最强烈的免疫相互作用,特别是在Wnt-wt mt的背景下(图8H)。
肿瘤切片最初用B细胞(CD20)、CD8+ T细胞(CD8)和恶性细胞(PanCK)标记物染色(图8I)。随后,确定了以丰富的B细胞和CD8+ T细胞浸润为特征的多个ROI。共对144个aoi分别进行了分析,来自Wnt-wt mt的CD8+ T细胞表现出明显更高的终末衰竭转录程序(图8J)。在B细胞表达的免疫检查点配体谱中,HLA-E表达水平最高,与Wnt-mut mt相比,Wnt-wt显著上调(图8K)。在Wnt-wt MT微环境中,他们进行多重免疫荧光染色。NKG2A+ CD8+ T细胞/PD-1+ CD8+ T细胞和HLA-E+ CD20+ B细胞在空间上共定位(图8L)。同时,与随机选择的细胞相比,HLA-E+ CD20+ B细胞与NKG2A+ CD8+ T细胞和PD-1+ CD8+ T细胞的细胞亲和性更强(图8M-N)。这些结果表明,免疫抑制B细胞可能通过诱导Wnt-wt MT中CD8+ T细胞的终末衰竭而损害抗肿瘤免疫。为了从功能上验证这一假设,他们进行了涉及CD8+肿瘤浸润淋巴细胞(til)和HLA-E+或HLA-E-肿瘤浸润B细胞(TIB)的共培养实验。HLA-E+ TIB显著降低了CD8+ TIL的脱颗粒能力,诱导了CD8+ TILs的终衰竭(图8O)。值得注意的是,当与HLA-E+ B细胞共培养时,NKG2A阻断(monalizumab处理)有效地恢复了CD8+ TIL的细胞毒性能力,并显著降低了最终耗尽的CD8+ TIL的比例(图8P)。
综上所述,Wnt-wt mt表现出免疫抑制B细胞的浸润增加,通过HLA-E:CD94-NKG2A相互作用导致CD8+ TIL的最终耗尽。这些结果强调了靶向这种相互作用作为转移性HCC治疗策略的潜力。
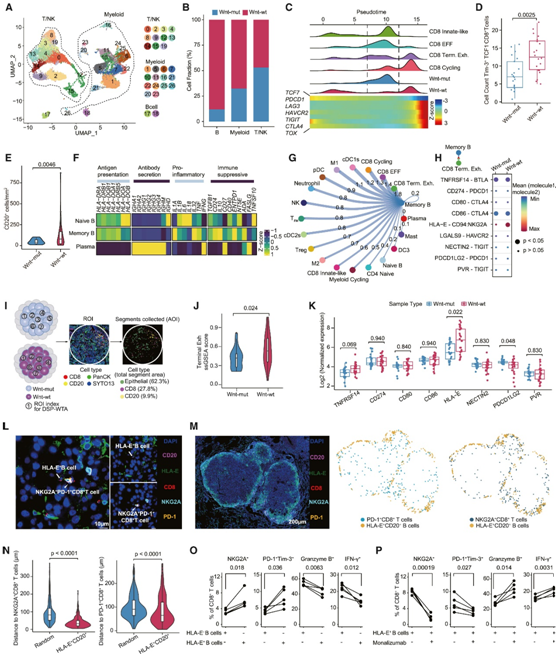
图8. Wnt-wt 和 Wnt-mut MT 之间的免疫生态系统差异。
(A) UMAP 图显示转移生态系统中免疫细胞类型。(B) 条形图显示 Wnt-mut 和 Wnt-wt MT 之间 B 细胞、骨髓细胞和 T/NK 细胞的相对比例。(C) CD8 + T 细胞的四种亚型和按 Wnt 突变状态分类的 CD8 + T 细胞在假时间内的密度分布(上图)。热图显示了伪时间内代表性基因表达的动态变化(下图)。(D)通过多重免疫荧光测定对 Wnt-mut 和 Wnt-wt MT 中的Tim-3 + TCF1 - CD8 + T 细胞进行计数。(E) 比较 Wnt-mut 和 Wnt-wt MT 之间 CD20 + B 细胞的 IHC 染色。(F) 热图代表不同 B 细胞亚型中功能标记的表达水平。(G) 基于记忆 B 细胞和其他免疫细胞之间的配体-受体相互作用的潜在细胞间通讯。(H) B 细胞和 CD8 Term.Exh. 之间的免疫检查点配体-受体对概述。(I) 显示 Wnt-mut 和 Wnt-wt MT 进行 DSP-WTA 测序的步骤的图。(J) Wnt-mut 和 Wnt-wt MT 之间终末耗竭的 CD8 + T 细胞评分的比较。(K) 箱线图显示基于 DSP 的 Wnt-mut 和 Wnt-wt MT 之间 B 细胞中免疫检查点配体的标准化表达水平。(L-M) 多重免疫荧光图像分析。(N)随机细胞或 HLA-E + CD20 + B 细胞到 NKG2A + CD8 + T 细胞(左)和 PD-1 + CD8 + T 细胞(右)距离的定量分析。(O) 与 HLA-E -或 HLA-E + TIB 共培养的CD8 + TIL 中NKG2A +、PD-1 + Tim-3 +、颗粒酶 B +和 IFN-γ +的百分比。(P)与HLA-E + TIB 共培养的CD8 + TIL 中 NKG2A +、PD-1 + Tim-3 +、颗粒酶 B +和 IFN-γ +的百分比。
+ + + + + + + + + + +
结 论
本项研究对 182 名 HCC 患者的 257 个原发区域和 176 个转移区域进行了多组学分析。富含缺氧特征的原发肿瘤促进了多克隆传播。原发性和转移性肝癌之间的基因组差异很大,并且早期传播很普遍。在转移瘤中观察到的显著的肿瘤内新抗原异质性与新抗原呈递中断导致的 T 细胞反应性降低有关。他们确定体细胞拷贝数改变是驱动转移的高度选择性事件。没有Wnt突变的亚克隆在转移方面比那些有Wnt突变的亚克隆表现出更强的选择优势,并且其特征是微环境中富含激活的成纤维细胞,有利于促进转移表型。最后,没有Wnt突变的转移灶表现出更高的免疫抑制B细胞富集,这些B细胞通过HLA-E:CD94-NKG2A检查点轴介导CD8+ T细胞的终末衰竭。总的来说,这些结果提供了一个复杂的转移进化过程的多维分析。
+ + + + +



 English
English


