文献解读|Nature(64.8):AHR 配体的内皮传感调节肠道稳态
✦ +
+
论文ID
原名:Endothelial sensing of AHR ligands regulates intestinal homeostasis
译名:AHR 配体的内皮传感调节肠道稳态
期刊:Nature
影响因子:64.8
发表时间:2023.08.16
DOI号:10.1038/s41586-023-06508-4
背 景
内皮细胞排列在血液和淋巴管系统中,充当重要的物理屏障,控制营养物质运输,促进组织免疫监视并协调血管生成和淋巴管生成。在肠道中,与饮食和肠道微生物相关信号分子的对于器官稳态的调节特别重要。然而,肠内皮细胞是否主动感知和参与调节这些信号目前尚不清楚。
芳基碳氢化合物受体(AHR)是一种配体激活的转录因子,能够感知膳食微量营养素和微生物代谢物,在维持肠道稳态方面发挥着重要作用。AHR 的遗传缺陷与肠道屏障完整性受损、微生物群组成改变以及宿主对病原体和损伤的反应失调有关,但 AHR 在肠脉管系统中的作用尚不清楚。
实验设计

结 果
01
单细胞分辨率下的肠脉管系统
首先将野生型小鼠用AHR配体6-甲酰基林多洛(3,2-b)咔唑 (FICZ) 处理后,研究者团队对总内皮细胞(CD31+CD45−)进行单细胞转录组分析(scRNA-seq)(图S1a-b),收获了21117个高质量的肠内皮细胞,分为11个内皮细胞聚类,明确划分两个超聚类:淋巴内皮细胞(LEC)和血液内皮细胞(BEC)(图1a-b)。通过对BEC的已知标记(Bcam、Esam、Ly6c1、Ly6a、Cd36、Sox17、Nrp1、Vwf和Plvap)和LEC的已知标记(Prox1、Lyve1、Pdpn、Thy1、Mmrn1、Prss23、Fxyd6、Cp和Nrp2)的分析,证实了BEC的超聚类特性(图S1c-d)。层次聚类在基因水平上划分清晰,其中LEC 2a和LEC 1最相似(图S1e-f)。在肠系膜脂肪中发现的LEC聚类与毛细血管更加一致(图S1g)。
他们使用内皮特异性基因集对每个超聚类进行了通路和基因集过分散分析(Pagoda2)(图1c),并使用了单细胞调控网络推断和聚类(SCENIC),在数据中确定了167个独特的调节子,并揭示了每个聚类中富集的调节子活性(图1d-e)。正如预期的那样,毛细血管后小静脉(PCV)富集了参与白细胞运输的基因和通路(图1c)。他们还发现了一个动脉剪切应力聚类(表达Slc6a6、S100a4和Pi16并富集Crem和Klf11调节子)(图1d-e)。毛细血管内皮细胞富集脂肪酸转运和代谢通路,而大血管内皮细胞显示出增加的氧化磷酸化活性。主要的BEC群体是毛细血管细胞(50%),由高活性的Rara定义,提示维生素a代谢物维甲酸在肠道毛细血管稳态中的作用(图1d-e)。毛细血管1(Cap1)细胞富集血管生成或尖端细胞基因(Apln、Chrm2和Car4)、增殖和趋化通路,所有这些都与其作为新型肠道血管生成内皮亚群的鉴定一致。相反,毛细血管2 (Cap2)标记物包括Ces2e、Ramp3和Rbp7,并表现出特定的Rarg活性。毛细血管3(Cap3)细胞与Aqp7+毛细血管相似,并表现出对水通道蛋白介导的水运输的偏好。
他们将肠内LEC分为四个新的聚类(LEC1、LEC2a、LEC2b和LEC IFN),主要成分是LEC 1和LEC 2a,它们具有相似的典型LEC标记(例如Nrp2、Cp和Mmrn1)(图1c)。在 IFN LEC 中在标记物(Ifit1-3、Rsad2和Isg15)和调节子(Stat1-2、Irf2和Irf7)中发现了明显的干扰素 (IFN) 反应特征。值得注意的是,他们还检测到免疫调节的LEC群体:LEC 2b,由金属硫蛋白基因表达(Mt1和Mt2)定义,富集了白细胞运输通路和许多类似的转录因子,包括NF-κB信号(Relb和Hivep2)(图1c)。
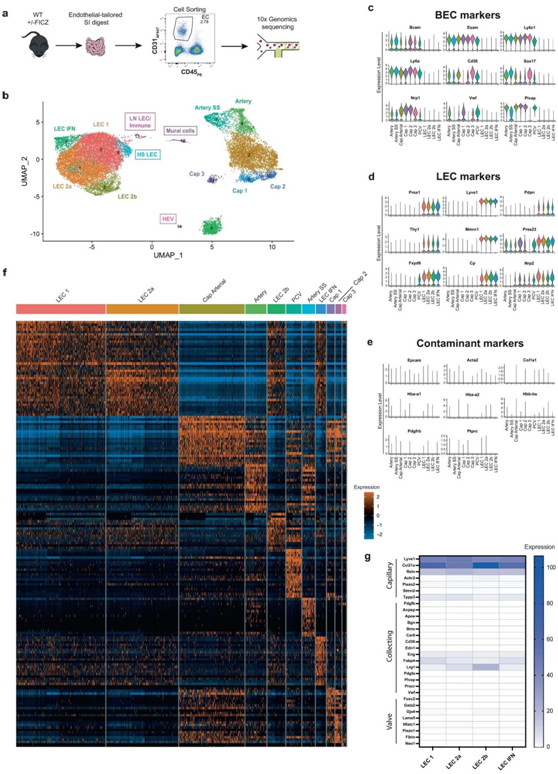
图S1. 肠内皮单细胞 RNAseq 数据集中的设计和聚类鉴定。
(a)实验设计。(b)UMAP可视化。(c-e)小提琴图显示常见 BEC 标记物、常见 LEC 标记物和潜在污染物标记物。(f) 毛细血管、集合管和瓣膜基因平均表达的热图。(g) LEC 聚类中毛细管、瓣膜和集合管 LEC 标记的相对表达的热图。

图1. 单细胞转录组学揭示了肠道脉管系统的细胞复杂性。
(a)UMAP可视化。(b) BEC 和 LEC 超聚类的表示(饼图)和超聚类的细分(条形图)。(c) BEC 和 LEC 聚类的 Pagoda2 分析。(d) SCENIC分析后每个聚类的的转录因子网络活动曲线下面积(AUC)得分分布。(e) 每个聚类的前 5 个富集调节子,按调节子特异性评分 (RSS) 排列。
02
AHR配体的内皮感知
将scRNA-seq数据集分为载体(vehicle)处理和AHR配体处理两部分,他们注意到AHR配体处理并没有改变内皮细胞亚型的相对比例(图2a)。在AHR配体处理后,他们观察到AHR特异性靶基因Cyp1a1在所有内皮细胞亚型中都有明显和广泛的诱导,并且除了毛细血管3外,其他AHR靶基因Cyp1b1在所有细胞聚类中都有表达,而在载体处理的小鼠中,毛细血管1、LEC 1、LEC IFN中只有低比例的细胞表达Cyp1a1(图2b)。这表明对AHR配体的敏感性是肠道内皮细胞亚型的普遍特征。
接下来,他们使用Cyp1a1命运报告小鼠品系(通过小鼠Cyp1a1位点中的 Cre 重组酶激活的 eYFP 诱导来报告 AHR 活性的报告基因)进行验证实验。在施加AHR配体3-甲基胆蒽(3-MC)后,BEC (CD31+PDPN−)和LEC (CD31+PDPN+)均表现出AHR反应性(图2c)。配体处理的cyp1a1报告小鼠的全肠道成像显示,AHR配体感知在整个血液和淋巴管中普遍存在(图2d)。
接下来,他们分析了每个 scRNA-seq 聚类内配体处理细胞和载体处理细胞之间的差异表达基因 (DEG)。他们检测到典型AHR通路基因(Cyp1a1、Cyp1b1和Tiparp)的增加,配体处理后deg的变化始终与增殖和血管生成或淋巴管生成过程的负调控相关,其中包括Cdkn1a和Zfp36l1增加,Sox18和Nrp2减少(图2e)。所有内皮细胞聚类共有相同的 12 个 DEG,共有的上调基因包括抗增殖Cdkn1a、氧化应激保护基因Txnip和转录因子基因Klf9,后者与其他细胞类型的静止有关。而共有的下调基因包括关键的内皮运动基因Marcks。在配体处理后,他们观察到BEC聚类中与血管生成、血管生成、内皮细胞增殖和内皮细胞迁移相关的通路下调,而LEC聚类对TGFβ、炎症信号[IL-1β和脂多糖(LPS)]的反应降低,并且对细胞迁移和生长因子信号传导的抑制一致(图2f)。

图2. AHR 激活促进内皮亚型的血管保护反应。
(a)UMAP可视化。(b) Ahr、Cyp1a1和Cyp1b1在聚类中的表达。(c) BEC或LEC中Cyp1a1-eYFP的表达。(d) 3-MC处理后5天cyp1a1报告基因小鼠的代表性全肠道染色。(e) 在配体处理和载体处理条件下六个选定的 scRNA-seq 聚类的前 20 个差异表达基因(DEG)的点图。(f) 配体处理小鼠的前5个富集基因集。
03
AHR 调节内皮增殖并抑制炎症反应
接下来他们构建了可诱导的内皮细胞特异性Ahr缺陷小鼠模型Cdh5(PAC) creERT2 Ahr fl/fl NuTRAP (ECΔAhr),在他莫昔芬治疗期间,小肠固有层的肠道免疫细胞浸润不变。为了了解内皮细胞特异性转录组学变化,他们用FICZ给ECΔAhr和AHR野生型(ECWT)小鼠处理3小时,然后对小肠BEC和LEC进行bulk 转录组分析(bulk RNA-seq)。AHR缺陷BEC显示664个基因的差异表达,包括AHR靶基因(Cyp1a1, Cyp1b1, Tiparp, Nqo1和Ahrr)的显著下调,表明缺乏对AHR配体刺激的反应性(图3a)。Ahr缺陷的BEC显示出与炎症反应、间质转化、血管生成、细胞运动和白细胞募集相关的通路显著富集(图3b-c)。
为了检测ECΔAhr小鼠体内内皮细胞的增殖调节作用,他们首先在ECΔAhr小鼠(使用单剂量他莫昔芬)中敲除Ahr,并在该模型中使用cre诱导的荧光标记来比较同一小鼠中Ahr-充足(eGFP -)和Ahr-缺失(eGFP+)的内皮细胞。在缺失AHR 配体的情况下,肠 BEC 和 LEC 中的内皮细胞显著增加(图3d)。即使在使用重组血管内皮生长因子A (VEGFA)(一种有效的血管有丝分裂原)处理后(图3e),AHR缺失的BEC也保持了更高的增殖能力,这证明了AHR在体内平衡期间促进肠内皮细胞增殖抑制的重要性。
为了检测这种增强的增殖表型是否由于VEGFA增敏性的增加,他们在使用5-乙炔基-2'-脱氧尿苷(EdU)处理的同时还使用了VEGFR2阻断剂(DC101抗体)(图3f)。虽然在DC101处理后,AHR缺陷的LEC的增殖优势得以维持,但AHR-充足和AHR-缺失的BEC之间的差异消失了,这提示了AHR限制VEGFA信号传导的机制。这些数据证明AHR调节肠道内血液内皮细胞稳态增殖。
为了确定内皮 AHR 是否影响肠道感染的结果,他们研究了对肠道病原体假结核耶尔森氏菌(Yptb) 的反应。Ahr种系缺陷小鼠对Yptb感染高度敏感,与野生型对照相比,其存活率显著降低,外周器官细菌负荷增加。相应地,饲喂富含AHR前配体的吲哚甲醇(I3C)饮食的野生型小鼠比饲喂低浓度AHR配体饮食的野生型小鼠存活率更高(图3h)。此外,内皮AHR有助于保护小鼠免受Yptb感染(图3i)。与Ahr -/-小鼠不同,细菌向脾脏或肝脏的传播没有明显差异,派尔斑(Peyer Patch)中的细菌负荷也没有差异(图3j),这表明血管Ahr在促进疾病耐受性方面的作用。ECΔAhr小鼠在感染Yptb3天后显示出肠道固有层中嗜酸性粒细胞、树突状细胞和自然杀伤细胞的丰度增加,而常驻群体(巨噬细胞)和适应性免疫细胞的数量保持不变(图3k)。
这些数据表明内皮AHR通过调节肠道免疫成分来限制炎症,从而促进疾病对肠道感染的耐受性。

图3. AHR 配体直接作用于内皮细胞,促进静止和抗炎过程。
(a) 通过RNA-seq分析来自FICZ处理的EC WT和EC Δ Ahr的分选小肠BEC 。(b)基因集富集分析(GSEA)。(c) 与 EC WT相比,EC ΔAhr中 BEC 前 5 个生物过程 (BP) 和 KEGG 基因集上调。 (d-f) 野生型和ahr缺陷(KO)的BEC在单剂量他莫昔芬处理和EdU喂养后14天内的增殖分析。(g) 用3-MC处理7天后,分析ECΔAhr或ECWT小鼠小肠绒毛血管(CD31细胞)内ESM1的表达。(h-i)小鼠的生存分析。(j) ECΔAhr和ECWT小鼠感染后3、5 天, 4个组织中Yptb CFU数。(k) 每只小鼠感染 5 × 107 CFU Yptb后 3 天,小肠固有层中的免疫细胞分析。
04
AHR 引起人内皮细胞静止
最后,他们用AHR配体FICZ和载体分别处理的人脐静脉内皮细胞(HUVEC)。FICZ处理huvec后会导致短暂的AHR通路激活。RNA-seq揭示了HUVEC中AHR调节基因的全基因谱(图4a),AHR配体处理HUVEC促进了与内皮细胞静止相关的转录特征,同时抑制细胞增殖(图4b)。通过流式细胞分析,他们发现在急性(6小时)配体处理后,G0/G1期细胞的频率增加,并且S期细胞相应减少(图4c)。免疫荧光显示,FICZ刺激的HUVEC含有较少的S期细胞 (EdU+),促进细胞周期进展的E2F蛋白和导致磷酸化视网膜母细胞瘤蛋白(Rb)减少,促进细胞周期抑制因子p27的表达增加(图4d-e)。
最后,在用脂多糖(LPS)刺激后,他们观察到在FICZ存在下诱导的炎症反应显著减弱,这证明了AHR配体的有效抗炎潜力(图4f)。总之,这些结果证明了AHR 配体调控内皮静止。
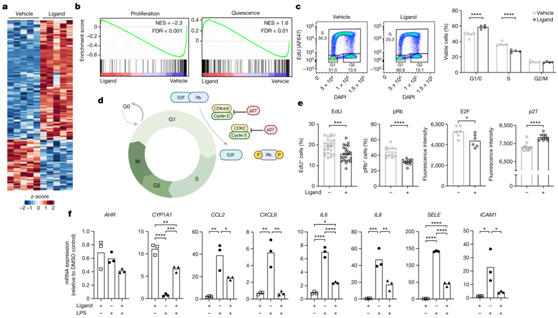
图4. AHR 促进人内皮细胞的血管保护通路。
(a) 热图显示DEG 的无监督分层聚类。(b) 富集图显示使用 HUVEC 特异性增殖和静止基因集的 GSEA。(c)流式细胞分析。(d) 细胞周期调控示意图。(e) 用 100 nM FICZ (+) 或载体 (−) 处理的 HUVEC 中细胞周期调节因子的单细胞成像。(f) 定量PCR(qPCR)分析AHR通路基因和内皮炎症标志物的表达。
+ + + + + + + + + + +
结 论
本项研究首先建立了小鼠小肠的综合单细胞内皮图谱,揭示了血液和淋巴内皮细胞的细胞复杂性和功能异质性。在单细胞分辨率下对 AHR 介导的反应进行分析,确定了组织保护性转录特征和促进稳态下细胞静止和血管正常的调节网络。成年小鼠的内皮 AHR 缺陷导致炎症反应失调和增殖通路的启动。在人内皮细胞中,AHR 信号传导促进静止并抑制炎症介质的激活。总之,本项研究的数据对整个肠内皮细胞范围内环境传感的影响进行了全面剖析,证明内皮 AHR 通过促进内皮细胞静止和血管正常来维持组织稳态。
+ + + + +



 English
English


