文献解读|Nat Microbiol(28.3):短期太空飞行期间宿主微生物组结构和免疫反应的纵向多组学分析
✦ +
+
论文ID
原名:Longitudinal multi-omics analysis of host microbiome architecture and immune responses during short-term spaceflight
译名:短期太空飞行期间宿主微生物组结构和免疫反应的纵向多组学分析
期刊:Nature Microbiology
影响因子:28.3
发表时间:2024.06.11
DOI号:10.1038/s41564-024-01635-8
背 景
航天相关微生物组变化的来源和健康影响是一个开放但重要的研究领域。微生物在人体生理学中发挥着多种作用;了解太空环境和宿主微生物组组成之间复杂的相互作用至关重要。
实验设计

结 果
01
人类微生物组在短期太空飞行中发生改变
为了探究航天飞行中的微生物群落活动,研究者团队最近对 SpaceX Inspiration4 任务 (i4)(首次全民用商业航天飞行)进行了一项纵向、多组学(宏基因组学、宏转录组学、单细胞免疫组学)采样研究。
i4 机组人员收集了涵盖八个时间点的微生物组数据集:飞行前三个,飞行后三个,飞行期间两个。总共,对 385 个宏基因组拭子和 365 个宏转录组拭子进行了测序,包括代表口腔、鼻腔和皮肤微生物组的十个身体部位以及八个粪便样本(图1a)。他们使用了多种短读比对和从头组装方法来估计本研究数据集的微生物群落分类和功能组成(图S1)。通过线性混合效应 (LME) 建模方法,他们进行了微生物组关联研究 (MAS),计算每个分类等级和分类器与飞行与(1)细菌种类、(2)病毒属和非冗余蛋白质的丰度之间的关联。将错误发现率 (FDR) 显著特征分为四类:飞行中暂时增加、飞行中暂时减少、飞行中/后持续增加和飞行中/后持续减少。他们还拟合了广义线性模型 (GLM) 和 LME,并发现这两种方法总体上是一致的。
总的来说,他们观察到口腔、鼻腔和皮肤微生物组在飞行过程中发生了以短暂性为主的重组(图1b-c)。在所有 10 个采样和回归分析的地点中,超过 821337 个关联具有统计学意义,并可归入四个感兴趣的类别之一。这些包括 314701 个不同的微生物特征:792 个是病毒,767 个是细菌,其余是微生物基因。大多数(73.5%)显著且已分类的特征在数量上短暂增加,但 24.6% 在飞行过程中短暂减少,0.6% 和 1.1% 的特征在机组人员返回地球后的多个时间点似乎分别持续增加或减少,短暂性变化比持续性变化更为剧烈。变化的有限持久性表明,虽然微生物群落可能在太空中重组,但改变的生物体的相对丰度及其基因表达通常会在返回地球后重置。
不同的身体部位显示出不同的时间趋势,这些趋势因分子类型(基因表达与相对丰度)和生命领域的不同而有所不同。所有身体部位都出现了随时间而变化的趋势。口腔微生物组显示出相对丰度和细菌基因表达的重组;161 种细菌和病毒分类法暂时增加,173 种暂时减少,62 种持续增加,12 种持续减少(图1c)。

图1. 数据集概览和 alpha 多样性摘要。
(a) 收集和分析方法。(b) 持续/短暂增加/减少的显着发现的时间轨迹。(c) 特定擦拭部位的显著特征。

图S1.数据处理实验流程和汇总统计数据。

图S3. 补充微生物组关联研究。
(a) 在所有测序方法中,发现与飞行前或飞行后时间点具有统计学相关性的特征(细菌种类、病毒属或基因)总数。(b) 按身体部位划分的持续/暂时增加/减少的显著发现的时间轨迹。
02
太空飞行期间和之后的细菌和病毒变化
接下来,他们研究了太空飞行期间细菌变化的分类。影响最强的生物在不同的生物模式下是不同的;换句话说,基因表达的增加并不一定意味着特定物种的 DNA 丰度也有类似的增加。例如,这种不一致在口腔微生物组中很明显(图2),其中相对丰度发生变化的生物与基因表达发生变化的生物之间几乎没有重叠。具体来说,口腔微生物组显示出与蛀牙和生物膜形成相关的细菌的宏转录组表达的飞行依赖性变化(图2)。梭杆菌门(Fusobacterium)的各种成员(之前报道为与太空飞行相关的牙龈和牙齿疾病的祖细胞)在太空飞行中或之后均有所增加。这些包括华氏梭杆菌、具核梭杆菌和霍夫斯塔迪纤毛菌。已知与口腔中的梭杆菌属物种协同聚集的其他口腔生物膜物种也在飞行中和飞行后富集;这些包括戈登链球菌 A、多种弯曲杆菌属和口放线菌属。此外,口腔链球菌和牙龈厌氧菌的表达也持续减少,Veillonella spp.的表达也有短暂的减少,唯一的宏基因组水平持续增加的是Alloscardovia omnicolens。他们将MetaPhlAn4与GTDB数据库中发现的关联进行了比较,发现了相似的结果,特别是关于飞行中梭杆菌的总体富集。
许多最显著的细菌皮肤微生物组改变(图3)主要是宏基因组学的,而不是宏转录组的。他们推测这可能表明从周围环境和机组人员那里获得了新的但不具有转录活性的物种。例如,持续增加的主要是各种肠道微生物(例如,拟杆菌、副拟杆菌、布劳特氏菌、肠球菌)的宏基因组含量;这可能是由于航天飞行期间卫生习惯的改变造成的。
与口腔微生物组一样,宏基因组和宏转录组变化之间几乎没有一致性。另一方面,棒状杆菌属(常见的皮肤共生菌)在飞行过程中经历了宏转录组暂时性耗竭,而不动杆菌属则表现出持续性耗竭。这些“典型”皮肤微生物(例如棒状杆菌、葡萄球菌、贪食菌、不动杆菌)经历了宏转录组活性的变化,而人类皮肤上并不普遍存在的生物(例如中生根瘤菌属、普氏菌属)往往会经历宏基因组转变,这再次表明可能从不同的生态位获得非转录活性生物。然而,病毒活动和耗竭的格局涵盖了区域特异性、原核和真核靶向病毒属(图3b)。可检测到的大多数病毒活动包括皮肤微生物组中的噬菌体(即靶向原核宿主的 DNA 病毒),并且集中在臀沟中,大多数病毒活动在不同谱系的飞行过程中暂时增加。
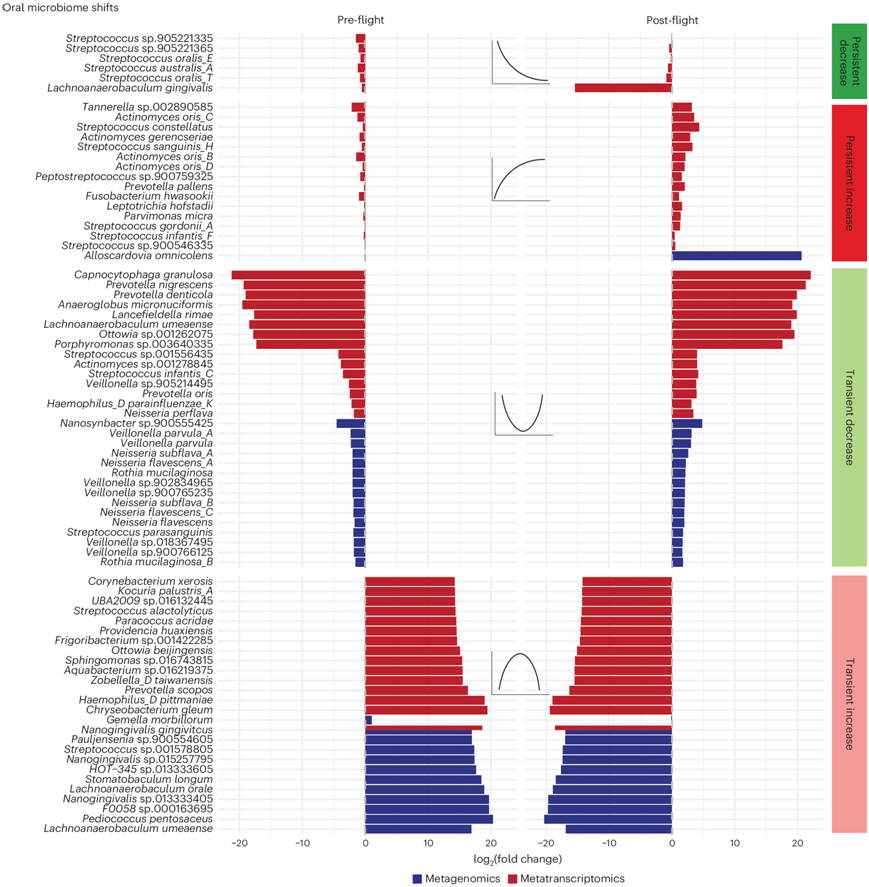
图2. 航天飞行的口腔微生物组结构。口腔微生物组中细菌与飞行之间最强的关联。

图3. 太空飞行的皮肤微生物群和病毒结构。
(a) 皮肤微生物组中细菌与飞行之间关联性最强的细菌。(b) 与飞行相关的病毒属的宿主和分子类型。
03
太空舱和机组人员之间的微生物相似性
细菌的β多样性似乎在飞行后下降(图4a),表明机组人员的微生物组普遍趋同。当按与飞行中太空舱的相似性对地点进行排序时(图4a),β多样性与给定采样地点的环境暴露程度相关。例如,口腔微生物组与太空舱和其他地点的微生物组仍然有很大不同,而前臂微生物组与飞船太空舱壁和其他机组人员的微生物组更加相似,这与该身体部位的暴露程度相匹配。
MAS 还表明,在太空飞行期间,机组人员的微生物群组成发生了变化,最明显的是在皮肤微环境。他们假设,这些群落组成的变化和微生物群相似性的整体增加可能只是由于个体在狭小空间内共同生活所致;然而,口腔微生物群中基因表达的变化可能源于其他生态或其他暴露变化,如饮食或免疫变化,因为口腔微生物群中微生物交换的可能性可能较小。
在飞行过程中,单个微生物菌株的标记基因大多在同一个体的皮肤微生物组样本之间共存(而不是跨个体)。此外,到飞行中的第二次采样时,不同个体之间可能共有的微生物菌株更多(图4c),表明同居时间对迁移有影响。由 StrainPhlAn 鉴定的菌株,例如Mesorhizobium_hungaricum | t__SGB11031,鉴定为在飞行中存在于多个位置(图4d),部分类似于 GTDB 物种。

图4. 微生物在飞船和机组人员体内的传播。
(a) 细菌宏基因组学的 Beta 多样性。(b) 飞行中途时间点期间机组人员和太空舱之间的菌株共有事件。 (c) 随时间推移的菌株共有事件数量,其中事件定义为在两个不同的拭子位置之间检测到相同的菌株。(d) 在给定时间点内检测到至少两次菌株共有事件的生物体。
04
太空飞行微生物组变化与宿主基因表达相关
通过平均单核测序信息,他们估计了9个宿主免疫细胞亚群的基因表达,并使用套索回归计算了飞行后细胞类型内的差异表达基因,以确定飞行相关的、增加的微生物特征和免疫细胞亚群基因表达之间的候选关系,目的是确定元转录组或宏基因组(即同居来源)的变化是否更可能与免疫转录组变化相关。
他们观察到宿主免疫细胞表达、机体部位和微生物特征之间存在许多假定的关系(图5a)。细菌种类,特别是口腔微生物组,在所有细胞类型中都有许多宏转录组关联。就相对丰度而言,口腔微生物与CD4 T细胞、CD8 T细胞和CD16单核细胞有关,这些细胞是已知的针对病原体的先天免疫反应。他们观察到病毒与免疫细胞表达之间的有限联系,其中自然杀伤 (NK) 细胞、CD14 单核细胞、树突状细胞和 CD16 单核细胞表现出最多的病毒关联;这些关联主要存在于皮肤微生物群中,这可能与之前观察到的宇航员病毒脱落增加有关。
接下来,他们研究了一组微生物,这些微生物的表达和丰度变化与多种免疫细胞类型的宿主基因相关(图5b)。一小部分宏基因组学检测到的病毒与许多不同的免疫基因有关;一个属(基因组病毒科)以真菌为目标,与自然杀伤细胞中的 13 个基因相关。鉴于真菌是已知的皮肤共生体,这种病毒出现在皮肤上是有道理的。其他相关病毒有未分类的宿主或以细菌为目标。
在口腔微生物组中,致病菌基因表达与免疫细胞基因表达相关。肺炎链球菌 A具有最多与其相关的基因;32 个基因中有 30 个出现在自然杀伤细胞中。Streptoccocus gordonii A在飞行后持续增加,与许多不同的免疫细胞亚型相关,包括 CD4 T 细胞、CD14 单核细胞、CD16 单核细胞和树突状细胞。飞行期间或飞行后口腔细菌相对丰度增加的唯一与许多免疫细胞亚型相关的是Gemella morbillorum。与口腔关联性最强的其他口腔微生物包括其他相关生物,以及一些典型的共生菌:Pauljensenia hongkongensis、Campylobacter_A concisus_R、Actinomyces massiliensis、Haemophilus_A parahaemolyticus、Leptotrichia_A sp905371725、Porphyromonas catoniae和许多链球菌属。
通过相对丰度(DNA)和表达(RNA)的变化,检测到与大多数人类基因相关的微生物基因(图5c)。它们跨越了许多不同的蛋白质注释,但在与许多免疫细胞亚群相关的蛋白质注释中存在一些共性。

图5. 与太空飞行相关的潜在免疫微生物组关联图。
(a) 与不同免疫细胞亚型基因表达相关的微生物特征总数,按类型划分,其中基因表达在飞行后长期增加(左)或减少(右)。 (b) 与太空飞行相关的(丰度或表达增加)细菌和病毒,与最多数量的宿主基因相关。(c) 与最多数量宿主基因相关的太空飞行相关微生物基因。
+ + + + + + + + + + +
结 论
本项研究进行了一项为期六个月的纵向研究,以量化四个人在轨道上三天的高分辨率人类微生物组反应。使用配对宏基因组学和宏转录组学以及单核免疫细胞分析,在太空飞行前、中、后八个时间点对 750 个样本和 10 个身体部位进行了时间依赖性的多界微生物组变化描述,发现大多数改变都是身体部位的短暂性变化;例如,病毒在皮肤部位增加主要是在飞行期间。然而,在口腔微生物组中观察到了更长期的变化,包括与牙菌斑相关的细菌(例如梭杆菌)的增加,这与免疫细胞基因表达相关。此外,与噬菌体活性、毒素-抗毒素系统和应激反应相关的微生物基因在多个身体部位富集。总的来说,这项研究深入描述了宇航员在短期太空飞行期间经历的微生物组和免疫反应变化以及相关的生活环境变化,这有助于指导未来的任务、航天器设计和太空栖息地规划。
+ + + + +



 English
English


