文献解读|Nat Commun(16.6):前列腺癌重塑分泌和细胞外囊泡尿液蛋白质组
✦ +
+
论文ID
原名:Prostate cancer reshapes the secreted and extracellular vesicle urinary proteomes
译名:前列腺癌重塑分泌和细胞外囊泡尿液蛋白质组
期刊:Nature Communications
影响因子:16.6
发表时间:2024.06.13
DOI号:10.1038/s41467-024-49424-5
背 景
人体尿液是由肾脏过滤血液时产生的。由于尿液在泌尿生殖道内停留时间较长,因此会积累反映这些组织当前状态的生物分析物。蛋白质通过两种方式进入尿液:从肾脏的肾小球漏出以及通过整个泌尿生殖道漏出。泌尿生殖蛋白可以通过细胞死亡的被动释放、主动易位以及作为分泌的细胞外囊泡 (EV) 的一部分进入尿液。EV 在生理学和疾病(包括癌症)的发病机制中都发挥着至关重要的作用。 EV 和分泌蛋白质由环境驱动且具有组织特异性,但它们在尿液中的存在、群体变异性和疾病相关性仍未得到很好的表征。
实验设计
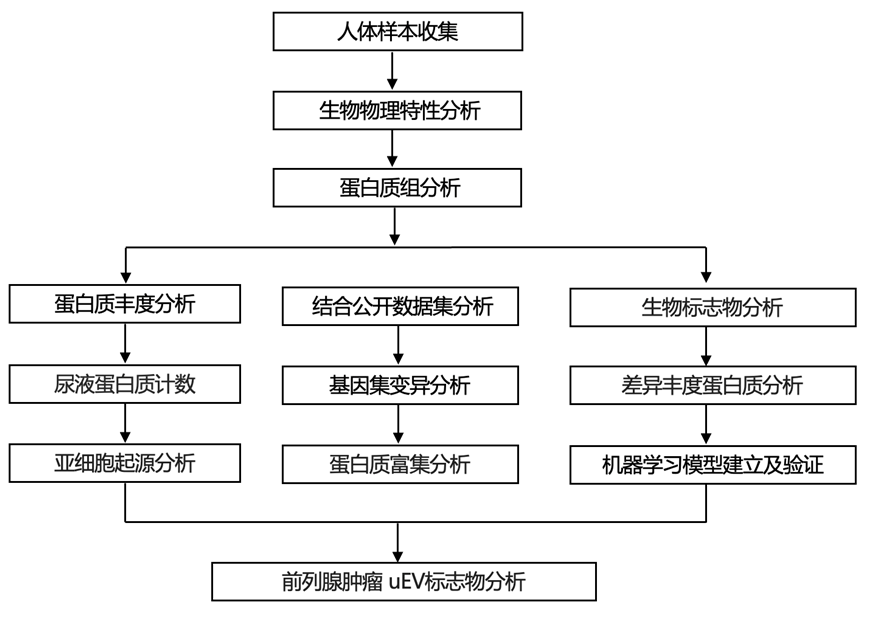
结 果
01
直肠指诊(DRE)分析富集的前列腺蛋白
尿液蛋白质组几乎全部来自泌尿生殖道组织:肾脏、膀胱和(男性)前列腺。直肠指诊(DRE)是肿瘤学家和医生每年进行数百万次的常规、微创物理操作,因此可能提供一种简单的方法来富集尿液中的前列腺衍生蛋白质。因此,研究者团队收集了 10 名男性的 DRE 前后尿液(图 1a),并采用差速超速离心法将尿溶性蛋白 (uSP) 与尿液细胞外囊泡 (uEV) 分离。他们进一步根据大小分离了两个 uEV 种群:一个在 20000 × g(称为 uEV-P20),另一个在 150000 × g(称为uEV-P150)。为了确定 DRE 是否影响 EV 的生物物理特性,他们通过纳米粒子跟踪和透射电子显微镜量化了 EV 的直径、数量和形态(图 1b)。uEV 的生物物理特性在 DRE 之前和之后都没有变化。
为了评估DRE 是否增加了前列腺衍生蛋白的丰度,他们使用质谱法分析了每个尿液部分的蛋白质。从三个独立的组织蛋白质组学数据集中提取前列腺组织衍生蛋白,然后在尿液中进行注释。虽然 DRE 不会改变尿液蛋白质的总数,但 DRE 后尿液中前列腺组织衍生蛋白明显更富集(图1c-e)。其中包括经典的前列腺标志物蛋白,如 PSMA(FOLH1)和 PSA(KLK3)(图1f)。因此,DRE 显著富集了尿液中的前列腺蛋白质,但不会影响 EV 的生物物理特性,这表明后者可能相对不依赖于组织。

图1. 前列腺组织衍生蛋白质分析。
(a) 来自国际泌尿病理学会 (cISUP) 临床 1 级 (GG) 患者的 DRE 前后尿液蛋白质组分析示意图。(b) 从单个个体 DRE 前后尿液中分离的 uEV 的透射电子显微镜图像。(c-e) DRE 前后尿液中 uSP、uEV-P20和 uEV-P150级分的蛋白质组学差异。(f) 选定的前列腺组织特异性蛋白质在DRE 前后尿液中的差异。
02
尿液蛋白质的亚细胞起源
为了研究尿液蛋白质的异质性,他们接下来收集了 190 名男性的 DRE 后尿液:64 名未诊断出癌症的男性和 126 名患有未经治疗的前列腺癌的男性。前列腺癌患者反映了原发病的全部风险谱,活检 ISUP 等级组 (GG) 范围从低 (GG 1) 到高 (GG 5)(图 2a)。他们从 DRE 后尿液中分离了 uSP、uEV-P20 和 uEV-P150,并定量了它们的蛋白质组数据(图 2b)。uEV 生物物理和尿液蛋白质计数在很大程度上独立于疾病状态、年龄或血清 PSA 水平。cISUP GG 1–3 中的 uEV 颗粒计数呈上升趋势,而 cISUP GG 4–5 中的颗粒计数则呈下降趋势,但由于每组患者数量较少,这一发现需要在更大的队列中进一步验证。uEV-P20 和 uEV-P150 级分在大小形态和颗粒计数方面具有生物物理相似性(图 2c-e)。
虽然存在这些生物物理相似性,但不同尿液级分的蛋白质组存在显著差异。uEV-P20 级分具有最多可检测到的蛋白质(图 2f),并且在生物物理和蛋白质组学上最具多样性,表明囊泡类型或来源存在异质性(图 2g)。uEV分离具有高度可重复性,与样品内相比,患者和临床组之间观察到较大的蛋白质组差异(图S3a-b)。在之前的研究中,在uEV中检测到的6518种蛋白质中,有60%鉴定为EV内容物(图S3c-d)。与可溶性蛋白组分相比,uEV组分之间的相似性更大(图S3e-g)。为了确定每个部分所代表的差异起源和生物学,他们进行了差异蛋白质分析(图2h-i)。每个级分由约 50 种蛋白质的存在和约 500 种其他蛋白质的差异丰度定义(图 2j)。级分特异性蛋白质往往来自特定的亚细胞区室。尿溶性蛋白质通常分泌或来源于高尔基体,而 uEV-P20 蛋白质来源于线粒体或内质网,uEV-P150 蛋白质来源于质膜(图 2k)。
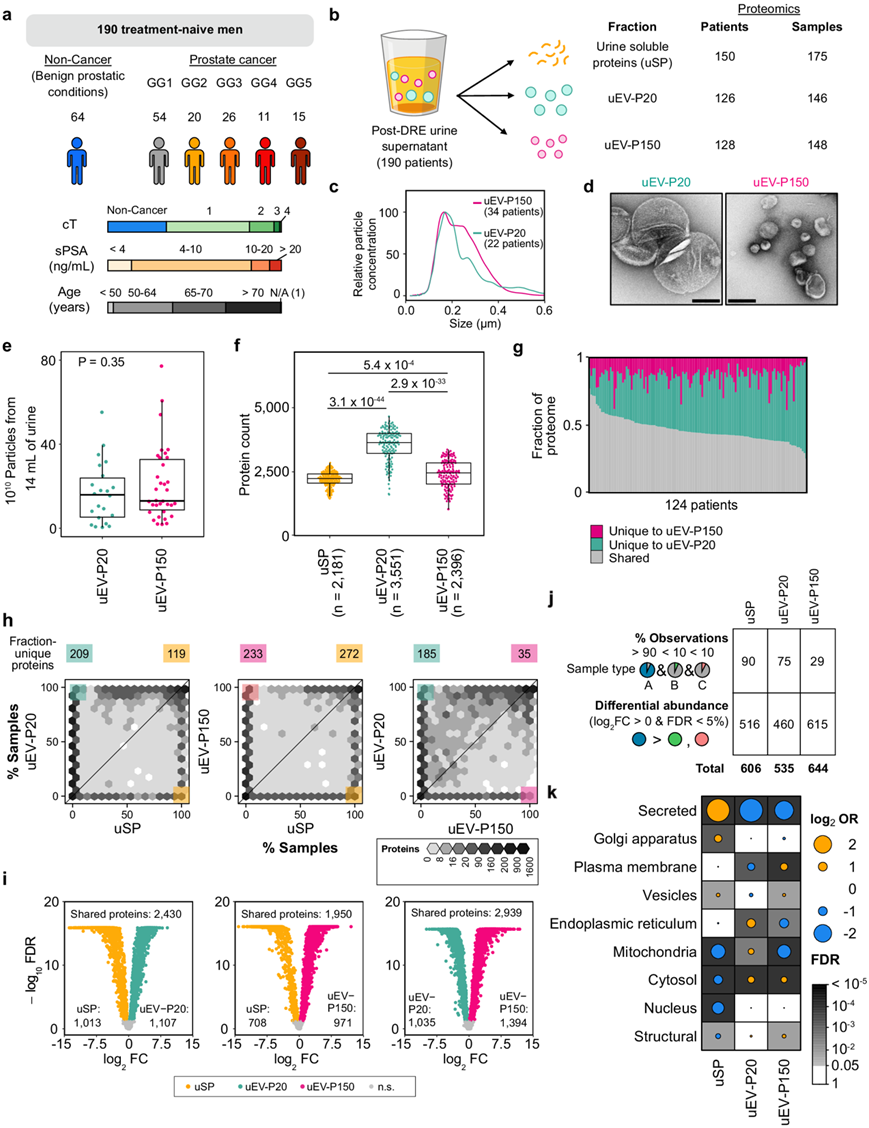
图2. DRE 后的 uEV 级分含有不同的蛋白质。
(a)队列分析示意图。(b) 通过蛋白质组学分析的 DRE 后尿液馏分、总患者数和每馏分的样本数。(c) 通过纳米颗粒跟踪分析确定粒径分布。(d) 来自一名 cISUP GG 1 患者的 uEV 馏分的代表性透射电子显微镜图像。(e) 分别来自 22 名和 34 名患者的 uEV-P20 和 uEV-P150 的颗粒浓度。(f)通过质谱法定量的蛋白质数量。(g) 124例患者uEV- p20和uEV- p150独特蛋白的匹配片段。(h) 每种蛋白质的样品数分析。(i)共有蛋白质丰度的差异。(j) 富集蛋白质分析。(k) 来自(j)的蛋白质的每个亚细胞定位的基因集富集的优势比 (OR) 。
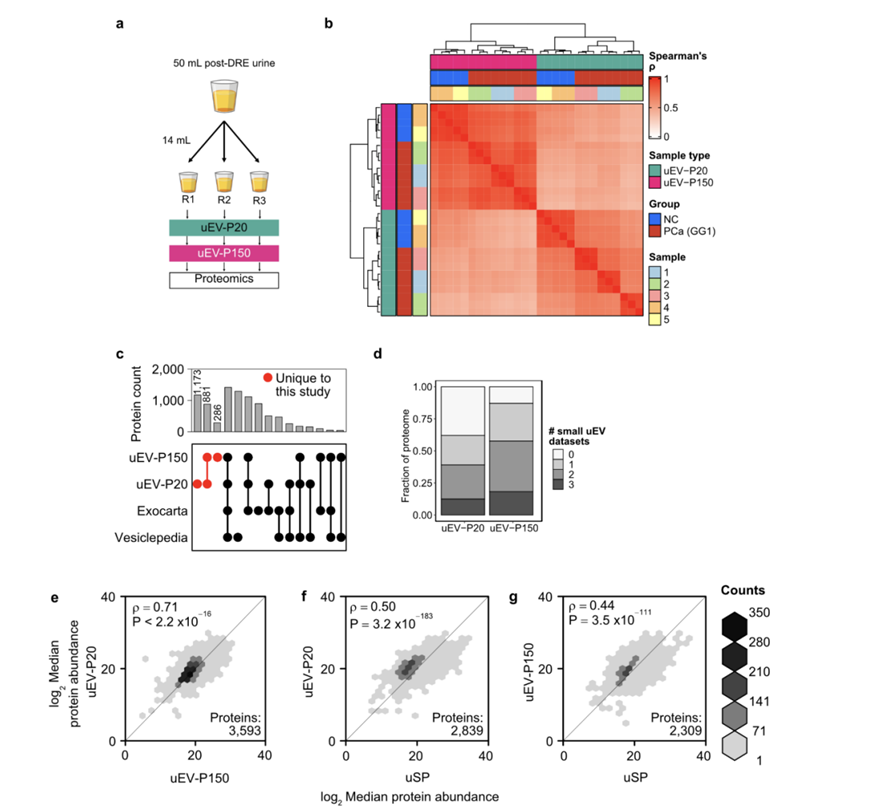
图S3. uEV蛋白质组不同于uSP蛋白质组。
(a)实验设计。(b) 在实验重复、临床组和uEV组分之间的Spearman相关性分析。(c) 本研究中发现的uEV蛋白与ExoCarta1和Vesiclepedia有重叠。(d) 在本研究数据集中检测到的部分uEV蛋白也在其他三个已发表的DRE后尿液小uEV数据集中检测到。 (e-g) 中位蛋白丰度显示样品类型的相关性。
03
uEV反映前列腺组织蛋白质组
接下来,他们定量了三种尿液组分蛋白质组对前列腺组织蛋白质组的反映程度。在前列腺组织中检测到的所有蛋白质中,大多数 (67%) 是在三种尿液组分中的一种或多种中检测到的(图 3a)。在未分馏的尿液中仅鉴定出 116 种前列腺衍生蛋白质,而 2439 种仅在一种或两种 EV 组分中鉴定出,4968 种在 EV 和非 EV 尿液中均鉴定出。尿液和组织蛋白质组之间的蛋白质丰度具有很好的相关性 (图 3b ),其中 uEV-P20 是前列腺组织的最佳替代品。
为了进一步分析尿液蛋白的组织来源,他们使用了正常组织(GTEx)和肿瘤附近正常组织(NAT)(TCGA)的RNA-seq数据来识别在前列腺、肾脏或膀胱中富集的转录本(图3c)。然后使用差异丰度转录本作为组织来源的标志来量化每个组织对每个样本的贡献。在uEV中,前列腺蛋白比非前列腺蛋白明显更富集。相反,可溶性尿液部分(uSP)显示出相反的趋势:前列腺衍生蛋白显著减少(图 3d)。可溶性蛋白质部分(uSP)在与血液(脂蛋白,血液微粒)经典相关的功能中富集(图3e)。可溶性蛋白质组也高度富集于细胞表面蛋白,可能来自细胞外结构域的脱落。参与多泡体生物发生的蛋白质在uEV-P150中过度表达,表明外泌体富集。与单变量蛋白质分析一致,uEV-P20分数更能反映前列腺组织,包含来自线粒体、核糖体和细胞外基质的蛋白质。
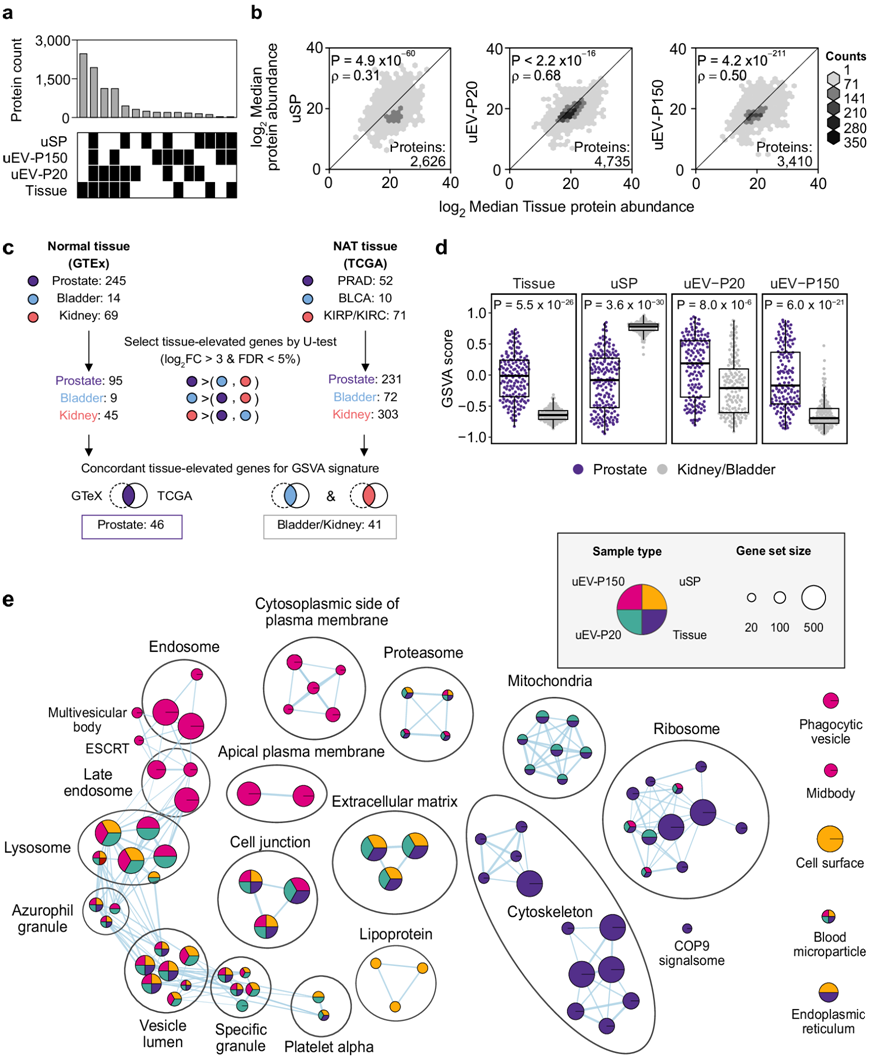
图3. uEV 蛋白质组与前列腺组织蛋白质组密切反映。
(a) 每种样本类型中定量的蛋白质重叠。(b) 蛋白质丰度分析。(c) 采用公开数据集的分析策略。(d) 基于组织特异性特征的样本类型的基因集变异分析得分 (GSVA)。(e) GO网络分析。
细胞系条件培养基已广泛用于研究分泌的细胞成分。为了确定细胞系衍生的 EV(cEV)是否准确反映肿瘤组织,他们从五种前列腺细胞系中分离并进行了蛋白质组学表征(图 4a)。尿液和细胞系条件培养基中的 EV 显示出相似的生物物理特性。细胞的全细胞裂解物在蛋白质组成(图4b)和丰度(图 4c)方面与肿瘤组织非常相似 。相比之下,uEV和cEV不同,尤其是在丰度上(图4d-e)。与细胞系衍生的EV相比,尿液EV是更好的前列腺组织替代物。在细胞系和尿液中,EV- p150中CD9、CD81和CD63等常用EV标志物的含量均高于EV- p20(图4f),而其他EV标志物如FLOT1在细胞系和尿液中不一致(图4f)。在 cEV 中,仅从 LNCaP 分离的 EV 可检测到 PSA。线粒体蛋白在 cEV-P20 中过量表达,而质膜蛋白在 cEV-P150 中过量表达(图 4g)。因此,DRE 后 EV 相关蛋白比前列腺癌细胞系 EV,特别是 DRE 后尿溶性蛋白更准确地反映前列腺组织。
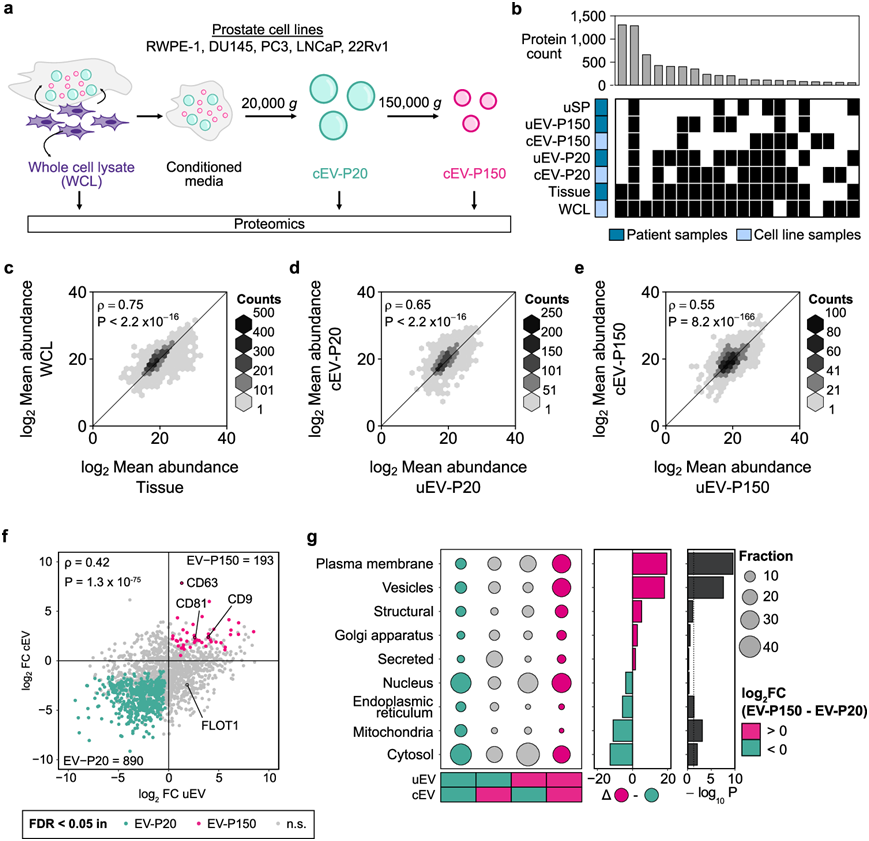
图4. 前列腺癌细胞系 EV 不能完全反映前列腺液 EV。
(a) 从条件培养基中分离细胞系 EV (cEV) 的概览。(b) 不同样品类型中蛋白质的量化重叠。(c-e) 患者和细胞系部分中平均蛋白质丰度之间的 Spearman 相关性。(f) 蛋白质丰度分析。(g) 每个象限的细胞器蛋白质富集情况。
04
尿液蛋白质组的生物标志物潜力
为了量化 DRE 后尿液的时间稳定性,他们评估了五名前列腺癌患者数年来的纵向样本。他们从每位患者的多个时间点收集了 DRE 后的尿液;所有患者均接受主动监测,且无任何临床进展迹象(图 5a)。他们使用方差分析来量化哪些蛋白质在单个患者样本之间(内部)或个体之间(之间)变化更大。对于 EV内容物和尿溶性蛋白质,患者内部的蛋白质组比患者之间更相似(图 5b)。为了识别可能特别适合用作生物标志物的蛋白质,他们使用组内相关系数 (ICC) 识别了纵向稳定的蛋白质。蛋白质的 ICC 越高,其蛋白质丰度的变化由随时间推移的随机波动引起的变化就越小。在每个部分中,有一组蛋白质具有高度的纵向稳定性,它们构成了极好的候选生物标志物,因为它们对数年的生理变化具有很强的稳定性(图S5a)。
接下来,他们试图评估尿溶蛋白和 uEV 蛋白作为预测前列腺疾病的生物标志物潜力。患有良性前列腺疾病(非癌症 [NC])的男性包括血清 PSA 水平升高和良性前列腺增生的个体,以及经直肠超声引导下的活检未诊断出前列腺癌的患者。前列腺癌患者与非前列腺癌患者的血清PSA丰度相似。尽管有上述相似性,但在患癌症和未患癌症的患者之间,数千种可溶性和EV蛋白存在差异(图5c-e)。不同尿液组分的特异性差异蛋白含量不同(图S5b)。在这些在前列腺癌和非癌uEV中差异富集的蛋白质中,与其他来自前列腺疾病患者的DRE后尿液来源的uEV数据相比,541种蛋白质在本项数据集中特异性检测到。此外,只有21种蛋白质是单一疾病亚组(即非癌症或特异性cISUP GG)所特有的。这些结果表明,疾病的差异反映在uEV蛋白质组中蛋白质丰度的差异上。
前列腺组织中与恶性肿瘤相关的通路也不同于尿液中的通路(图S5c)。例如,与 NAT 组织相比,受雄激素反应调节的蛋白质(如 PSA)在肿瘤组织中的丰度增加,但在尿溶性蛋白质和 uEV 中呈现相反的趋势。与未诊断出癌症的男性相比,前列腺癌患者尿液所有组分中的PSA(KLK3)蛋白丰度持续显著降低,在血清和肿瘤区域中有所增加(图 5c-e)。因此,这些数据表明与恶性肿瘤相关的通路反映在前列腺尿液蛋白质组的不同亚群中。

图5. uEV 蛋白质组数据在时间上稳定并反映临床行为。
(a) 一组接受主动监测的 5 名 cISUP 1 级 (GG) 肿瘤患者每次 DRE 后尿液采集的时间点。(b) 个体内和个体间蛋白质丰度相关性。 (c-e) 前列腺癌与非癌症之间显著差异丰度蛋白质。

图S5. 前列腺癌和非癌症的蛋白质组比较。
(a) 采用类内相关系数(ICC)估计每个尿液部分中蛋白质的变异性分布。(b) 在非癌部分和前列腺癌部分中,重叠蛋白显著上调。(c) 基因集富集分析不同样本类型的前列腺癌和非癌症中的hallmark富集基因集。
05
生物标志物分析
为了创建前列腺疾病的生物标志物,他们专注于经常检测到的(在 >50% 的样本中)、在尿液组分中富集的、前列腺衍生的和纵向稳定的蛋白质(ICC > 0.4)(图 6a),这种过滤策略保留了 226 种 uSP 蛋白、280 种 uEV-P20 蛋白和 235 种 uEV-P150 蛋白。他们使用统计机器学习为每个尿液组分独立创建和验证分类器。首先,创建了仅基于尿液蛋白质区分癌症和非癌症的分类器;这些分类器的 AUC 范围为 0.92–1,明显优于血清 PSA(图 6b)。在一个独立的前瞻性验证队列中,蛋白质具有一致的效应大小,验证 AUC 范围为 0.71–0.81(图 6c-d)。接下来,他们将相同的方法应用于区分低级别癌症和高级别癌症。尿液区分低级别和高级别前列腺癌的 AUC 范围为 0.73–0.79,再次匹配或超过血清 PSA(图S6a)。在两个分别有 199 名和 75 名患者的独立验证队列中,发现队列和验证队列之间 uSP 蛋白的效应大小大致一致(图S6b)。有趣的是,等级特征也能反映疾病状态,反映出起始和进展决定因素的重叠,如前列腺癌遗传驱动因素的研究中所见(图S6c)。这些特征中的蛋白质表现出纵向稳定性,并且与疾病状态单变量相关(图S6d)。这些数据表明尿液蛋白质组是泌尿生殖系统疾病生物标志物的尚未开发的来源。
DRE 后尿液可以非侵入性地采集前列腺组织蛋白质组样本,并具有显著的生物标志物潜力。然而,不同大小的 EV 的可溶性部分和蛋白质在来源和与疾病表型的关联上有所不同。例如,癌症患者尿液可溶性部分中的 SPOCK1 蛋白明显较低,但在 uEV 中并非如此,而 PCYOX1 则表现出相反的情况(图S6d)。

图6. 尿液蛋白质的优先排序,用于生物标志物发现。
(a) 尿液蛋白质选择策略和模型构建,用于对前列腺癌 (PCa) 与非癌症 (NC) 进行分类。(b) 用于在发现队列中对 PCa 与 NC 进行分类的多蛋白模型和血清 PSA的 ROC 曲线。(c) 在不同队列中的蛋白质变化。(d) 独立验证队列中,多蛋白模型和血清 PSA 在对 PCa 与 NC 进行分类时的 ROC 曲线。
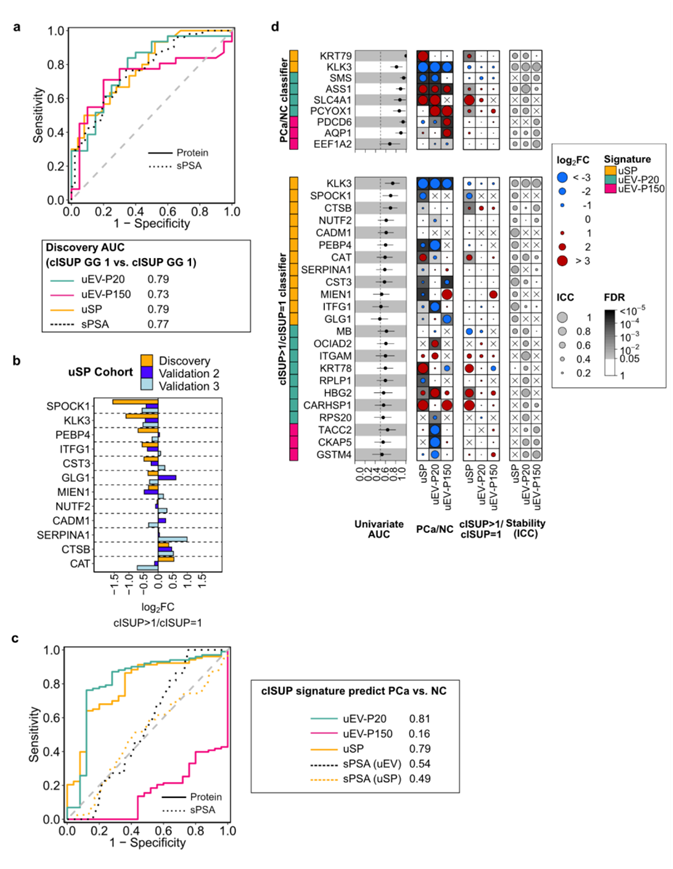
图S6. cISUP分级组分类器的性能。
(a) 受试者工作特征(ROC)曲线分析。(b) uSP多蛋白模型中蛋白质的变化。 (c)所有特征蛋白的性能(AUC)。 (d) cISUP GG蛋白模型性能的ROC曲线。
06
前列腺肿瘤 uEV标志物
DRE 后尿液可以非侵入性地采集前列腺组织蛋白质组样本,并具有显著的生物标志物潜力。然而,不同大小的 EV的可溶性部分和蛋白质在来源和与疾病表型的关联上有所不同。例如,癌症患者尿液可溶性部分中的 SPOCK1 蛋白明显较低,但在 uEV中并非如此,而 PCYOX1 则表现出相反的情况(图S6d)。他们亚细胞起源、临床表型和尿液组分之间存在相互作用,并表明蛋白质在恶性转化过程中失调的过程中选择性地包装到 EV中(图 7a)。
他们评估了 13 种 EV 标记的性能,这些标记存在于多种人类癌症组织和体液中,但尚未在前列腺尿液 EV 中进行评估。其中四种在 uEV-P150 中相对于可溶性尿液蛋白升高,五种在 uEV-P20 中升高。其他的在 uEV 中耗尽,并且没有一个显示出理想的基于亲和力的标记所需的大效应大小或小的样本间变异性(图 7b)。因此,规范的 EV 蛋白标记似乎不是 uEV 识别和分离的最佳选择。
因此,他们试图识别蛋白质标记物以区分前列腺衍生的 uEV,选择了既与一种尿液组分不同又已知存在于前列腺组织中的蛋白质。他们将这些蛋白质分成三个蛋白质亚群:与肿瘤存在相关的蛋白质、与肿瘤等级相关的蛋白质和与疾病无关的“核心”蛋白质(图 7c)。这些亚群在功能上有所不同,前列腺特异性分泌蛋白如 KLK3 和 ACPP(聚类C uSP 8)特定于尿溶性蛋白质组分但不特定于 uEV,而 GTP 结合蛋白特定于 uEV-P150 组分(聚类C P150 8)(图S7b-d)。
最后,为了鉴定可用于uEV亲和力研究的特异性标记物,他们从每个子集中选择了预测的细胞表面蛋白(图7c,图S7e-f)。由此得出的5种uEV-P20和10种uEV-P150肿瘤标志物在癌症和良性疾病患者中存在差异,其中包括经典的EV标志物CD63。
等级标记在uEV-P20部分中包含ITGB2和SLC4A1等标记(图S7e)。uEV-P150的疾病无关的核心标志物包括经典EV标志物CD9和CD81,这些标志物在uEV-P150中经常检出(图S7e-f)。这些数据表明,EV蛋白质组具有环境特异性(图S7g),并且快速、特异性分离EV亚群的方案可能不同于在血浆或其他组织中有用的方案。

图7. EV 与环境相关。
(a) 每种情况和尿液各组分中差异丰度的蛋白质。(b) uEV-P20(绿色)和 uEV-P150(粉色)相对于 uSP 的细胞外囊泡标志物蛋白质丰度差异。(c) 通过差异蛋白质丰度和检测频率确定组分特异性蛋白质。(d) 肿瘤标志物与预测的细胞表面定位。

图S7. 与EV内容物失调有关的通路。
(a) 各通路的log2比值(OR)点图。(b-d) STRING和通路分析。(e) 总结uEV-P20级别标记与预测的细胞表面定位。(f) 预测细胞表面定位的核心uEV蛋白的总结。(g) 对所有部分的所有疾病特异性和核心标志物进行亚细胞注释7。
+ + + + + + + + + + +
结 论
本项研究对 190 名男性(包括前列腺癌患者)的分泌蛋白和 EV 蛋白组进行了量化。分泌蛋白和 EV 蛋白来自不同的亚细胞区室。尿液 EV 是组织蛋白质组的可靠替代品,但尿液或细胞系 EV 中的分泌蛋白则不是。尿液蛋白质组在数年内纵向稳定。它可以准确且无创地区分恶性前列腺病变和良性前列腺病变,并可以对前列腺肿瘤进行风险分层。该研究量化了尿液蛋白质组的复杂性,并揭示了分泌蛋白质组和 EV 蛋白质组对转化和生物标志物研究的协同价值。
+ + + + +



 English
English


