文献解读|Gastroenterology(17.373):结直肠癌组织中微生物群落异质性及其与结直肠癌发生的关系
论文ID
原名:Microbial community heterogeneity within colorectal neoplasia and its correlation with colorectal carcinogenesis
译名:结直肠癌组织中微生物群落异质性及其与结直肠癌发生的关系
期刊:Gastroenterology
IF:17.373
发表时间:2021.2.11
DOI号:https://doi.org/10.1053/j.gastro.2021.02.020
✦ +
+
背景
结直肠癌(CRC)是世界上第四大常见癌症。现在已经确定,肠道微生物群在结肠直肠癌的发生中起着关键作用;饮食模式和生活方式与CRC发病风险增加有关,这些外部因素和宿主遗传背景可以很容易通过改变微生物群的组成和功能特征来影响微生物群。这种改变可以诱导失调和结直肠癌的发展。例如,在多个病例对照定位研究中,物种丰富度和与结直肠癌相关的分类群的丰富度和丰度不断增加,如梭杆菌、拟杆菌、小单胞菌和普雷沃特氏菌。在此之前,作者的团队发现了腺瘤患者出现肠道生态失调的早期迹象,以及在结直肠癌发生的各个阶段中微生物群的一致变化。综上所述,这些发现为异常生物微生物群落与CRC之间的相关性提供了强有力的证据。
✦ +
+
实验设计
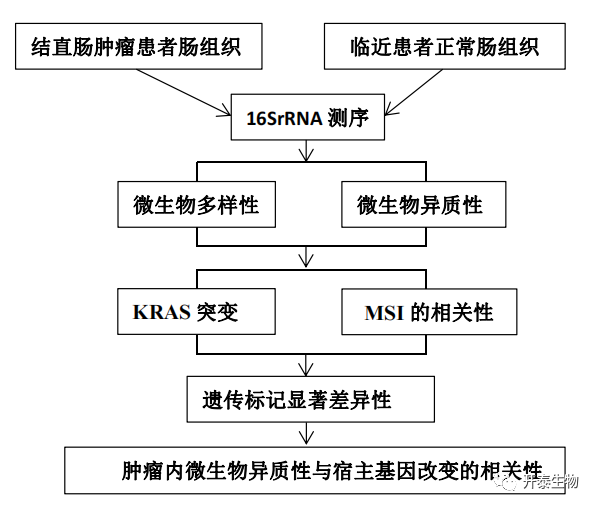
✦ +
+
1 队列建立及微生物群落总体特征
作者收集了来自两个地理位置不同的医院的21名大肠癌患者和20名腺瘤患者的266份组织活检。从每个人身上取4-6个肿瘤组织活检加上2个相邻正常组织活检。为了获得微生物多样性,进行了16S rRNA基因测序,每个活检产生4.94±1.18(平均值±标准差)个读数。作者首先探索了微生物群落的整体表型模式,发现在两个队列中,大肠癌组织的α多样性(Chao1和Shannon指数)低于腺瘤组织(图1A)。两组大肠癌和腺瘤组织的β多样性也存在显著差异(P<0.01,PERMANOVA;图1B)。然而,肿瘤和相应的邻近正常组织之间微生物多样性(α和β多样性)的差异并不显著(图1A和B),这与以前的报道一致。而某些个别微生物,包括消化链球菌属和梭杆菌属,在结直肠癌中明显富集于结直肠癌邻近的正常组织。此外,我们确定肿瘤内微生物群落与肿瘤亚型(典型或粘液腺癌;P=0.033,PERMANOVA)和肿瘤位置(左侧或右侧大肠癌;P=0.029,PERMANOVA)在个体水平上显著相关(队列1和队列2的21名大肠癌患者)。
接着,作者分析了所有41名患者每次活检中的细菌组成,以获得门水平上的单个微生物群概况(图1C)。大多数结直肠癌患者的梭杆菌丰度(平均5.36%)高于腺瘤患者(平均0.11%)。结直肠癌患者黏膜菌群以厚壁菌门主(平均35.68%),其次为变形菌门(平均19.53%)。相比之下,腺瘤患者的微生物群以变形杆菌为主(平均32.16%),其次是厚壁菌门(平均22.21%)。

图1 微生物群落的总体特征2 结直肠肿瘤内异质微生物群落
接下来,作者通过对单个肿瘤不同区域以及相邻正常组织的多个活检来评估结直肠肿瘤内的微生物群落是否具有异质性。根据3个标准(NA≥1,肿瘤相对丰度≥0.1%,CV≥50,详见材料与方法)筛选出具有代表性的属。这些属用于为队列1(n=11)和队列2(n=10)的每个结直肠癌组织(每个组织4-6个活检,共138个活检)创建微生物图谱。值得注意的是,与来自同一结直肠癌患者的其他肿瘤活检相比,作者发现每个肿瘤活检都有自己的微生物群组成。这些观察结果在队列1(图2A)和队列2的所有CRC患者中得到证实。观察到肿瘤内微生物群落具有异质性,并通过绘制CRC患者1的图谱(CV>50;图2B)进行了典型化。网络图分析显示微生物在特定的肿瘤内部位富集(图2C)。作者还评估了第1组(n=10)和第2组(n=10)中20例腺瘤患者(共128例活检)的微生物图谱。同样,所有腺瘤患者的瘤样活检中,微生物群组成彼此之间存在显著差异(%CV>50)。

图2 肿瘤内微生物群落的异质性3 肿瘤内微生物异质性与腺瘤-癌序列
为了验证肿瘤内微生物异质性与结直肠癌发生之间是否存在相关性,作者选择了丰度变化较大的微生物(CV>50),并将其命名为高变异微生物(HVMs)。总的来说,在两个队列的大肠癌组织中鉴定出156个HVMs,在腺瘤组织中鉴定出203个HVMs(图3A)。发现与大肠癌相比,腺瘤中HVMs的数量更高(P<0.05,双尾Mann-Whitney U检验;图3B),表明瘤内HVMs可能沿着腺瘤-癌序列减少。通过将与肿瘤状态相关的肿瘤内丰度变化相似的微生物分组,建立了五个元群落(图3C)。特别是第1组(称为c1-1)的元群落1由大肠癌中富集的HVMs组成;第1组(c1-2)的元群落2由腺瘤中富集的HVMs组成;而第1组(c1-3)的元群落3由大肠癌和腺瘤中富集的HVMs组成。在富含CRC的元群落c1-1中,半数以上的HVM属于厚壁菌(54.00%;包括细小单胞菌和消化链球菌);而富含腺瘤的元群落c1-2以变形杆菌为主(43.14%)。
将队列1和队列2的HVMs结果进行比较。作者发现HVMs在集合群落c1-1(在大肠癌中富集)和c1-3(在大肠癌和腺瘤中富集)中的分布可以分别在队列2中的集合群落c2-1和c2-3中得到验证(图3C)。元群落c1-1和c2-1之间的HVMs相似性为40%;元群落c1-3和c2-3之间的HVMs相似性为63%(Sørensen Dice系数;图3D)。因此,这些结果表明,微生物群落的改变发生在腺瘤-癌序列。
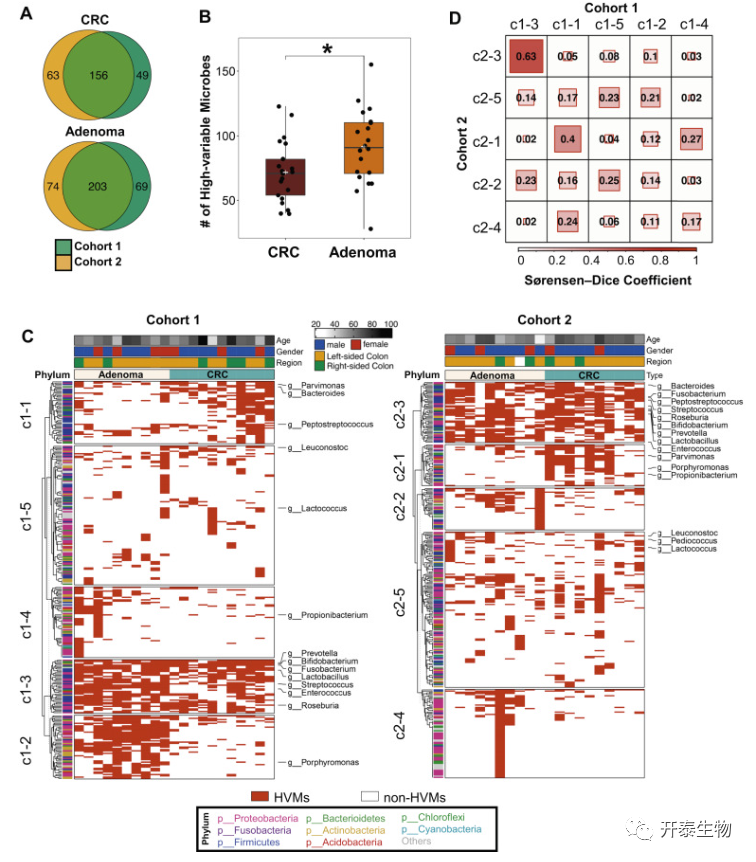
图3 肿瘤内丰度变异与腺瘤-癌序列4 单个HVM与腺瘤-癌序列的相关性
鉴于观察到的变化,作者推测在结直肠癌的发生过程中,每种HVM在瘤内的丰度变化可能是不同的。微生物丰度沿腺瘤-癌序列的变化如图4A所示:在大肠癌的特定瘤内区域富集的一些微生物沿腺瘤-癌序列的丰度变化增加。而在腺瘤特定区域富集的其他微生物则表现出沿腺瘤-癌序列丰度变化的减少。
为了确定个体HVM与大肠癌进展之间的关系,选择了大肠癌相关元社区的HVM。通过比较大肠癌和腺瘤中各HVM丰度的变化,计算各HVM的FDV。如果FDV>1,这意味着肿瘤内这种HVM丰度的变异从腺瘤上升到癌(称为变异增加HVM),FDV<1的HVMs称为变异减少HVMs。方差增加的HVMs总量(n=19)略高于方差减少的HVMs总量(n=16;图4B)。队列1产生的数据与队列2进行了验证(图4B;补充表5)。几个与结直肠癌相关的属,包括拟杆菌属、细小单胞菌属和梭状芽孢杆菌科,被鉴定为变异增加的HVM,而粪杆菌属、玫瑰杆菌属和链球菌属被鉴定为变异减少的HVMs。总的来说,作者的发现揭示了肿瘤内单个微生物丰度的变化可以沿着腺瘤-癌序列改变。
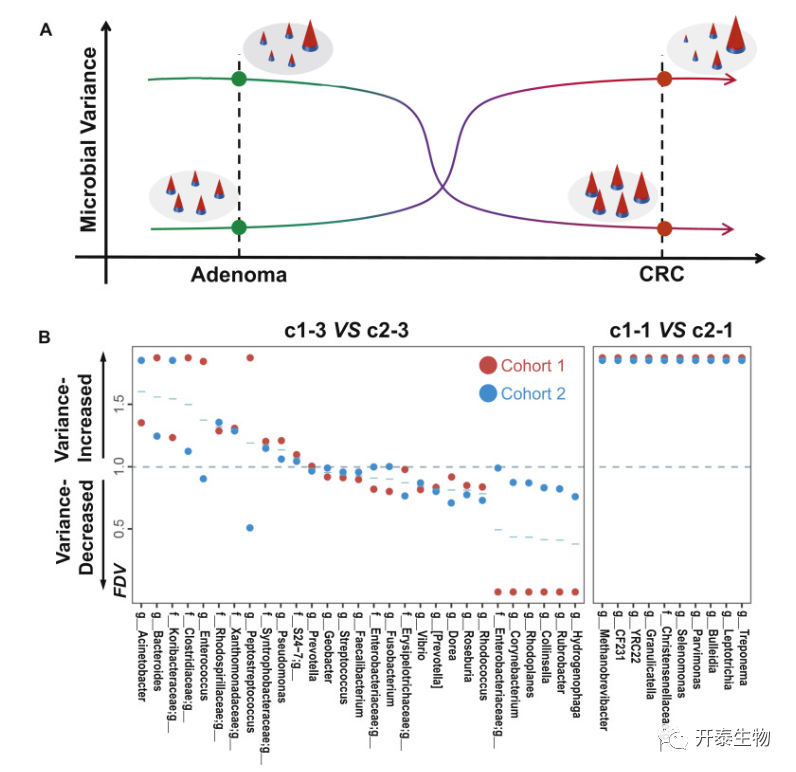
图4 腺瘤-癌序列中高变微生物变异的研究5 肿瘤内微生物群与KRAS突变和MSI的相关性
有和无MSI(MSI阳性:n=14)的大肠癌组织中的微生物群落显著分离(P<0.001,双尾Mann-Whitney U检验;图5A),38种微生物显示出与MSI的强相关性(AUROC=0.90;图5B)。属于变形杆菌的属占了大多数微生物,包括加利奥尼拉菌(DMA=0.0233)和脱氯单胞菌(DMA=0.0198),它们与MSI呈正相关(图5C2)。
总的来说,作者发现在有宿主基因改变的组织中存在明显的瘤内微生物群。随后评估了突变谱与异质性肿瘤内微生物群之间是否存在相关性。KRAS突变阳性的大肠癌患者的细菌图谱显示存在不同的肿瘤内微生物群组成(图6A-B)。基于MSI阳性肿瘤活检的大肠癌患者的细菌图谱,还确定了异质性肿瘤内微生物群落(图7A-B)。就单个微生物而言,26个KRAS相关微生物中的22个(85%)被鉴定为HVMs,38个MSI相关微生物中的28个(74%)被鉴定为HVMs(图5D)。这些发现共同表明,超过70%的突变相关微生物在肿瘤内的丰度有很大的变异。
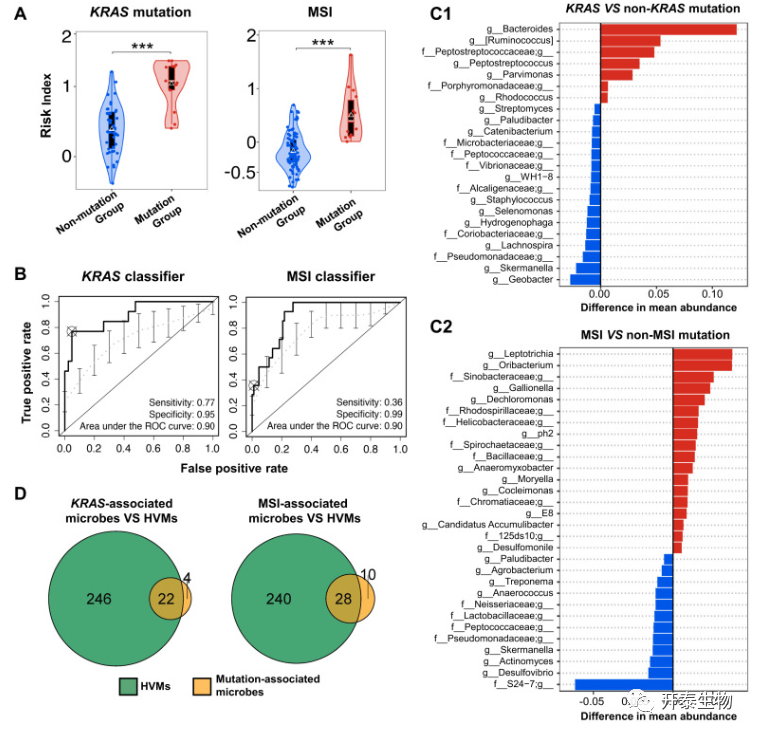
图5 肿瘤内微生物群落与宿主基因突变的关系
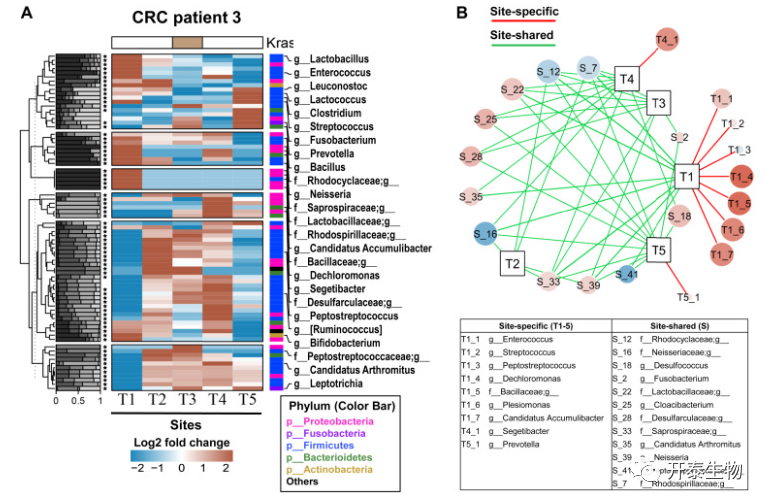
图6 KRAS突变阳性大肠癌患者的细菌定位
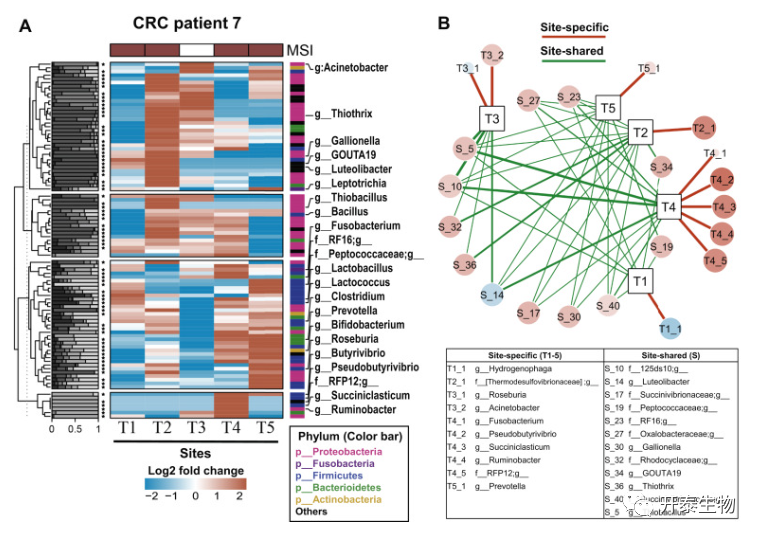
图7 MSI阳性大肠癌患者的细菌定位
✦ +
+
结论
综上所述,作者发现单个肿瘤不同部位的微生物丰度不同,从而形成异质性微生物群落,并将这些发现与大肠癌发展的腺瘤-癌序列联系起来。作者进一步证明了肿瘤内微生物异质性与KRAS突变和MSI的CRC相关基因改变之间的关联。这些发现为破译肠道微生物群在大肠癌进展中的作用提供了新的见解。




 English
English

