文献解读|Cell Metab(29.0):生物性别和性激素对休息时骨骼肌分子特征以及对不同运动训练模式的反应的影响
✦ +
+
论文ID
原名:Impact of biological sex and sex hormones on molecular signatures of skeletal muscle at rest and in response to distinct exercise training modes
译名:生物性别和性激素对休息时骨骼肌分子特征以及对不同运动训练模式的反应的影响
期刊:Cell Metabolism
影响因子:29.0
发表时间:2023.11.07
DOI号:10.1016/j.cmet.2023.10.010
背 景
男性和女性在心脏代谢风险、肌肉大小和表现方面存在显著差异。几个重要的生理和生物过程中基于性别的差异生物过程影响许多心脏代谢疾病和身体机能。例如,男性在中年患 2 型糖尿病的风险更大,但年龄较大时,与男性相比,更年期女性患 2 型糖尿病的风险相同或更高。
目前尚不清楚是性激素的差异还是染色体(如Y染色体或常染色体)中基因的位置导致了代谢和表现的差异。了解骨骼肌中基因转录表达的性别差异非常重要,因为它是调节代谢和身体活动的关键器官,影响心脏代谢健康和身体表现。
实验设计
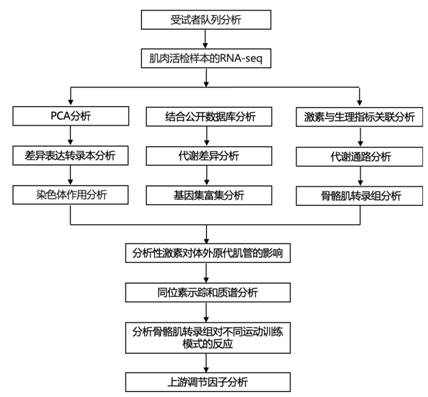
结 果
01
生物性别和年龄强烈影响基线骨骼肌转录组
研究者团队对51名不活跃(每周2次,每次20分钟的有组织运动)、健康(空腹血糖110 mg/dL,体质指数32 kg/m2,不吸烟)、年轻(18-30岁)和老年(65-80岁)的男女参与者(13名年轻女性,15名年轻男性,11名老年女性,12名老年男性)的肌肉活检样本进行了过夜禁食后的转录组分析(RNA-seq)。主成分分析(PCA)显示,生理性别对骨骼肌转录组差异的影响大于年龄(图1A)。从PCA中去除Y染色体基因后,生物性别仍然会导致肌肉转录组的差异(图1B)。在年轻(图1C-D)和老年(图1C-E)队列中,分别有466和503个基因受到性别差异的调节。在受性别调节的基因中,年轻人和老年人分别有414个和446个基因位于常染色体(非性染色体)上。在年轻人和老年人中,分别只有52和57个性别调节差异的基因位于性染色体上(图1C)。因此,肌肉中的大多数性别调节基因不能归因于性染色体上的位置。
在女性(图1C-F)和男性(图1C-G)中,682和707个年龄调节肌肉基因转录本分别显示出年龄的强烈影响。大多数受年龄影响的基因(>96%)不在性染色体上,这表明基因在性染色体上的位置对于年龄对肌肉转录组的影响并不重要。此外,在女性(64.4%)和男性(75.7%)的年轻队列中,年龄调节基因转录本的上调比例更大,这表明肌肉转录本表达的抑制可能会阻碍衰老过程中的代谢和身体表现。
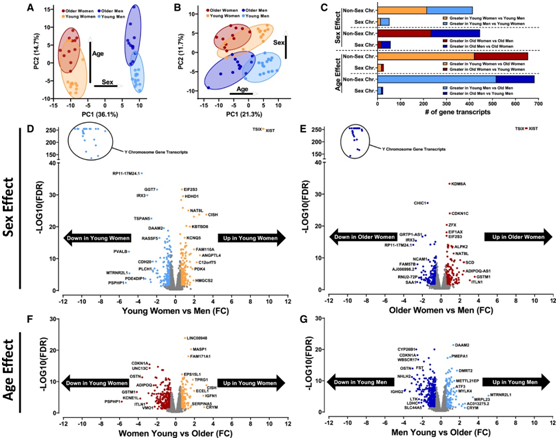
图1. 生物性别和年龄强烈影响基线骨骼肌转录组。
(A-B) 主成分分析 (PCA) 。 (C) 年轻和年长队列中性别之间差异表达转录本的数量。(D-E) 火山图显示年轻群体和老年群体的性别之间差异表达的肌肉转录本。(F-G) 火山图显示女性和男性中的年轻群体和老年群体之间差异表达的肌肉基因转录本。
02
血浆性激素水平影响骨骼肌转录组和基线生理参数
他们确定了性激素对肌肉转录组的影响,并纳入了两项独立研究的数据。正如预期的那样,女性的总血浆睾酮(T) 浓度低于男性(图2A),老年男性的T浓度低于年轻男性(图2A)。E2和雌酮(E1)在老年女性中的含量低于年轻女性(图2B)。肌肉代谢的性别差异导致了代谢性疾病的风险和身体机能的差异。性激素有助于肌肉代谢和表现,因此他们研究了血浆性激素浓度与肌肉转录组之间的关系。多变量回归分析确定了健康男性和女性的肌肉基因转录本。18名年轻女性中有8名使用了激素避孕药。年龄是分析中的一个共同变量,因为性激素浓度随着年龄的增长而下降。他们在男性中发现了491个与血浆T显著相关的肌肉转录本,其中只有13个基因位于性染色体上,表明T对肌肉常染色体转录本的至关重要的作用。
接下来,他们进行了基因集富集分析 (GSEA),以确定与血浆 T 浓度相关的肌肉基因通路。在男性中,T 与代谢相关的多个KEGG通路呈正相关(图 2C)。性腺功能减退与男性代谢综合征相关,而性腺功能减退的男性接受T替代治疗与胰岛素敏感性较高、血浆甘油三酯较低和腰围减小相关。在健康男性中,他们发现T与胰岛素敏感性呈正相关,与身体质量指数(BMI)呈负相关(图2E-G)。女性血浆T和最大氧耗量(VO2max)之间存在显著的正相关(图2H),这是由于少数血浆T水平较高的年轻女性的VO2max较大。没有其他生理/代谢结果与女性血浆T水平相关(图2H),表明男性血浆T的影响大于女性,可能是由于男性血浆T水平较高。
最有效的人类雌激素是E2,它可以转化为E1, E1是E2的前体和代谢物,具有较低的雌激素活性。他们在女性和男性中分别鉴定出1131个和1094个与血浆E2浓度相关的肌肉转录本。在女性和男性中,E2相关基因转录本分别只有36个和31个来自性染色体。GSEA显示E2与女性中许多基因转录途径相关,包括多种代谢相关途径(图2D)。E2在男性中与一些代谢途径相关,但在男性中存在不同的途径,如炎症相关途径,而在女性中与E2无关(图2D)。他们发现E1与女性支链氨基酸(BCAA)降解、赖氨酸降解、丙氨酸、天冬氨酸和谷氨酸代谢、脂肪酸代谢、TCA循环、氧化磷酸化、丙酮酸代谢和PPAR(过氧化物酶体增殖物激活受体)信号通路呈正相关(图2D),E2与这些代谢呈负相关(图2D)。因此,在女性中,更有效的E2可能对代谢基因转录有抑制作用。然而,E2可能对女性肌肉蛋白合成有积极作用,因为E2与核糖体基因呈正相关,而E1与核糖体基因呈负相关。雌激素的丧失与女性肌肉质量和力量的减少有关。在男性中,E2与核糖体基因负相关,与多种炎症途径正相关(图2D),表明高活性雌激素对男性肌肉生长有抑制作用。这些结果强调了体内性激素对男性和女性肌肉基因表达的不同影响,并强调需要进一步了解雌激素在肌肉代谢和质量/力量中的作用,特别是在衰老过程中。
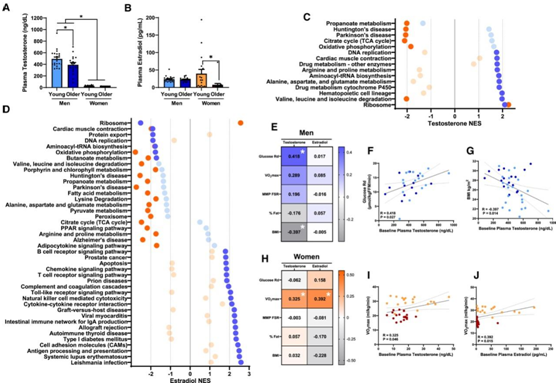
图2. 血浆性激素水平影响骨骼肌转录组和基线生理参数。
(A–D) 年轻男性、老年男性、年轻女性和老年女性的基线血浆睾酮和雌二醇浓度。 (E–J)基线血浆激素与生理指标Pearson相关性分析。
03
E2和T在男性和女性原代肌管中相似地调节基因转录表达
为了分析性激素对肌肉基因转录的影响,研究者将10名(5名男性和5名女性)相对年轻(年龄范围20 ~ 35岁)和健康(BMI范围18.7 ~ 29.2)参与者的骨骼肌活检组织分化为肌管(4 ~ 8天),然后在分化培养基中使用以下3种物质处理96小时:不添加激素(对照)、年轻女性生理范围较高的E2或年轻男性生理范围较高的T(图3A)。分化培养基中含有活性炭/葡聚糖处理的胎牛血清(FBS),以去除胎牛血清中的牛源性激素。处理后,制备细胞,进行免疫细胞化学和荧光成像,以确认分化(图3B)。激素孵育后,各处理间无明显形态学差异。未用于成像的细胞用于RNA-seq。在对照培养基中培养的雄性和雌性细胞呈现出本质上不同的转录组谱(图3C),类似于基线时在肌肉中观察到的基线转录性别差异。然而,他们发现基于性别来源的肌管在对T(图3D)或E2(图3E)的转录反应中几乎没有统计学上的显著差异。基因通路分析也显示,T(图3F)或E2(图3G)处理后,男性和女性肌管发生了相同的变化。
性激素处理对肌肉细胞的整体转录谱有贡献,但T和E2对肌肉转录组的影响与性别无关。
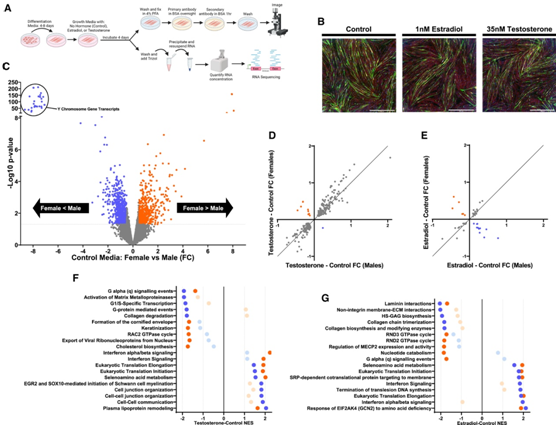
图3. 雌二醇和睾酮在男性和女性肌管中调节基因转录。
(A) 实验流程图。(B)免疫染色分析。 (C-G) 雄性和雌性肌管之间差异表达的转录本分析。
04
分析人类原代肌管中单个蛋白质的合成揭示性激素调节重要的生物过程
接下来,他们使用同位素标记赖氨酸来比较T和E2对雄性和雌性原代肌管中蛋白质合成的影响。完全分化的原代人肌管在没有性激素(对照)或在生理浓度E2或T的情况下孵育96小时,在收获肌管前48小时、24小时或4小时,将培养基替换为含有[13C6]-L-赖氨酸(约98%重赖氨酸)的培养基。对每个样品进行质谱分析,以确定每个肽中(新加入的)[13C6]-L-赖氨酸(重/轻+重)随时间的富集情况(图4A)。随着时间的推移,他们检测到更多含有[13C6]-L-赖氨酸的蛋白质(图4D)。同样,他们观察到,随着时间的推移,收缩蛋白(图4B)和代谢蛋白(图4C)中的[13C6]-L-赖氨酸的掺入增加,表明不同蛋白之间的合成速率不同。由于在4小时时间点期间,含有[13C6]-L-赖氨酸富集蛋白的数量较低且变化率较大(图4B-4D),因此他们使用24小时和48小时时间点之间的差值来计算百分比[13C6]-L-赖氨酸掺入率。
在对照培养基中孵育的男性肌管中,较多蛋白质[13C6]-L-赖氨酸掺入率高于女性(图4E),提示基线时男性肌管中的蛋白质合成率高于女性。与E2相比,T改变了更多的蛋白质合成速率,不同性激素改变的蛋白质重叠最小(图4F),表明T和E2的功能效应不同。与男性肌管相比,T增加了女性肌管中更多蛋白质的合成速率(图4G-H)。E2改变了雄性和雌性肌管中相似数量蛋白质的合成速率(图4I-J)。通路分析显示,性激素改变了多种功能蛋白质的合成速率,主要影响肌浆网中的蛋白质。
这些结果表明,接触性激素会促进男性和女性肌肉细胞中参与重要生物途径的蛋白质的合成。成年队列中分析的性激素浓度的差异可能会影响性别之间转录丰度和蛋白质合成的调节。
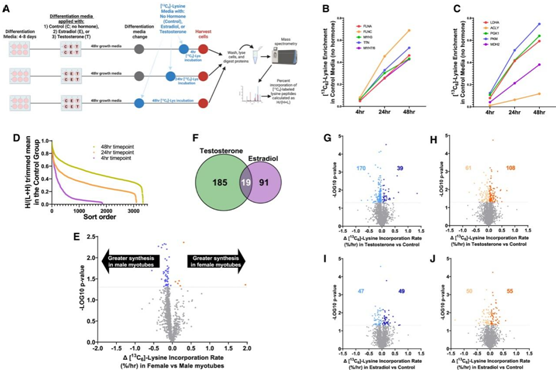
图4. 检测人类原代肌管中单个蛋白质的合成揭示性激素调节重要的生物过程。
(A)实验流程图。 (B-C) [13C6]- L-赖氨酸富集分析。(D)从对照条件下所有10个样品中鉴定的所有具有重肽对和轻肽对的蛋白质的平均值。(E)显示对照培养基中雌性和雄性肌管之间[13C6]-L-赖氨酸掺入率(以 24 小时和 48 小时时间点计算)的差异 (Δ) 。 (F) 维恩图显示由T、雌二醇(E2)或两者改变[13C6]- L-赖氨酸掺入率(包括雄性和雌性肌管)的蛋白质数量。(G-J)与对照培养基孵育的男性和女性和肌管相比,T和E2之间[13C6]-L-赖氨酸的掺入率。
05
生物性别改变骨骼肌转录组对不同运动训练模式的反应
运动训练通常根据所进行的运动类型进行分类,他们研究了三种不同的3个月运动训练计划的转录组反应,包括高强度间歇性训练(HIIT)、抗阻训练 (RT) 和组合训练(CT)。在不同的运动模式下,个体间存在相当大的异质性。
不同年龄组的男性和女性在 HIIT、RT 或 CT 后上调和下调的肌肉转录物数量有所不同。针对所有运动训练模式,年轻男性的差异表达转录本明显多于年轻女性(图 5A)。老年男性对 HIIT 的反应比老年女性有更多差异表达转录本(图 5A),这与在年轻队列中的观察结果一致。与老年男性相比,老年女性在 RT 或 CT 后的差异表达转录本更多(图 5A)。此外,年轻女性中 71.4% 的转录本因 HIIT 反应而改变,而年轻男性中 HIIT 也同样改变了(图 5B)。同样,老年女性 HIIT 改变的转录本中有 67.3% 也因老年男性 HIIT 改变。男性和女性之间 HIIT 后的转录物表达重叠很大,特别是考虑到在年轻和年老队列中,RT 或 CT 后性别之间的转录物表达反应重叠不到 50% (图 5B)。
在不同性别组和不同年龄组中,运动训练后的上调程度最高的基因通路与细胞外基质(ECM)相互作用有关(图5C-D)。ECM中的蛋白质在肌肉力量的产生、生长和修复中发挥重要作用,是多种代谢过程的关键。肌纤维收缩和底物运输依赖于细胞膜的组织、形成和信号传导。由于运动训练后表达的基因转录本数量存在相当大的性别差异,他们评估了这些队列中差异表达的通路。与年轻男性相比,年轻女性中受到RT或CT显著影响的通路较少,但年轻女性中受到RT或CT影响的大多数通路也在年轻男性中受到影响(图5D-E)。
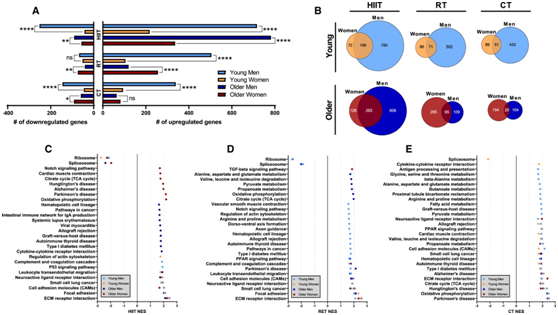
图5. 生物性别改变骨骼肌转录组对不同运动训练模式的反应。
(A)比较不同性别之间每种训练类型后显著上调和下调的转录本总数。(B) 维恩图显示了每种运动模式下男性和女性之间相似和独特的差异表达基因的数量。(C–E) 标准化富集分数 (NES) 显示,通过 HIIT 增加(点向右)或减少(点向左)训练,KEGG 通路显著改变。
06
性激素是男性和女性对不同运动训练模式的转录组反应的上游调节因子
他们进行了上游调节因子分析,以根据 RNA-seq 数据预测哪些性激素相关的上游调节因子负责每组运动训练的转录反应。在所有已确定的运动训练转录组的性激素相关上游调节因子中,大多数是正调节因子(图6A)。他们还发现,多种性激素相关上游调节因子均位于肌肉运动效果的前 10 位调节因子中,尤其是在 CT 组中(图 6B)。因此,性激素似乎是肌肉转录组对运动训练反应的重要因素。因此,性激素似乎是运动训练后肌肉转录组反应的重要因素。
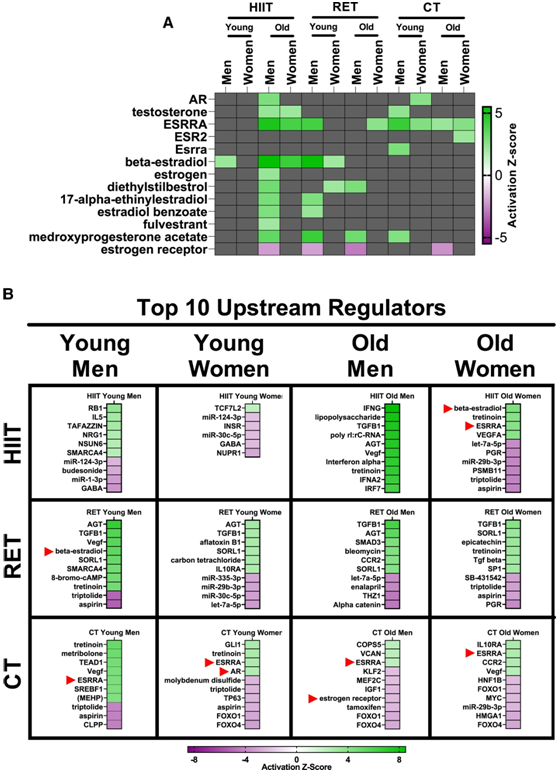
图6. 性激素是男性和女性对不同运动训练模式的转录组反应的上游调节因子。
(A)在 HIIT、RT 或 CT 12 周之前和之后获取肌肉活检样本。进行了 RNA-seq 和上游调控因子分析。(B) 根据预测的激活Z得分,显示每个队列的训练诱导转录本的前 10 个上游调节因子。
07
与骨骼肌运动调节基因相关的基线血浆性激素
他们对基线内源性激素浓度和运动依赖性基因表达的变化进行了回归分析,以确定基线(静息)性激素浓度是否影响男性和女性对运动训练的肌肉转录反应。在所有运动训练模式中,与女性相比,男性与基线 T、E2 或 E1 水平相关(正向或负向)的运动训练响应转录本要多得多(图 7A)。在所有运动训练模式中,与基线T、E2或E1水平相关的运动训练反应的转录本在男性中明显多于女性(图7A-F)。
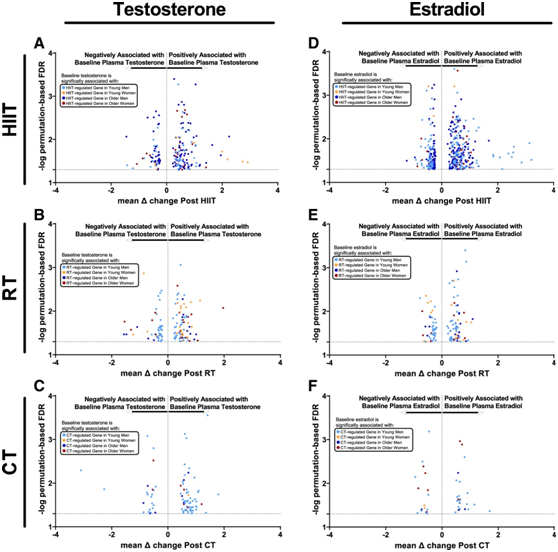
图7. 基线血浆性激素与骨骼肌运动调节基因相关。
(A-F)基线血浆睾酮和雌二醇与 HIIT、RT 和CT后肌肉基因转录表达变化之间的关联。
+ + + + + + + + + + +
结 论
基于RNA-seq,本项研究发现男性和女性之间肌肉转录组的差异主要与睾酮和雌二醇有关,而与位于Y染色体上的基因关系较少。在年轻和老年队列中,肌肉对有氧、阻力和联合运动的转录反应存在固有的、独特的、性别依赖性差异。激素随年龄的变化影响了年龄相关转录本的差异表达。此外,在原代人肌管中,睾酮和雌二醇对多种特定功能的蛋白质的氨基酸掺入具有影响。这些结果强调了为男性和女性量身定制运动计划的意义。
+ + + + +



 English
English


