文献解读|Cell(64.5):蛋白质稳态控制胚胎细胞类型的不同温度敏感性
✦ +
+
论文ID
原名:Proteostasis governs differential temperature sensitivity across embryonic cell types
译名:蛋白质稳态控制胚胎细胞类型的不同温度敏感性
期刊:Cell
影响因子:64.5
发表时间:2023.11.09
DOI号:10.1016/j.cell.2023.10.013
背 景
温度和发育速率在动物发育过程中通常是相关的。较高温度下发育的加速归因于代谢率和蛋白质合成的增加。在物种特异性耐受范围内,在高温下培养的胚胎表型正常,表明发育程序同步加速。
胚胎发育非常迅速,但温度应激会降低其产生具有不变解剖结构的动物的能力。与环境压力相关的表型表明某些细胞类型比其他细胞类型对压力更敏感,但这种敏感性的基础尚不清楚。
实验设计
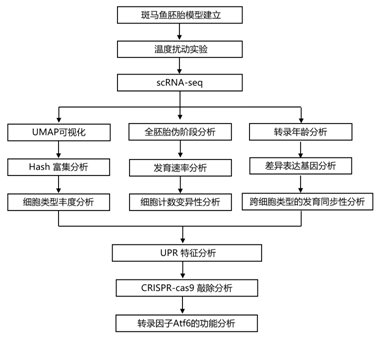
结 果
01
多重scRNA-seq 分析温度应激下发育的单个胚胎
为了分析温度对发育稳健性的影响,研究者团队将斑马鱼胚胎置于一系列压力越来越大的温度下,温度低于热休克的阈值。除了28°C的标准温度外,他们还在标准条件下培养胚胎,以及在32°C和34°C两种高温下培养胚胎。在高温下,胚胎以更快的速度发育,相当一部分个体表现出不同严重程度的轴向缺陷,以及其他的表型(图1A)。因为可以对个体进行分析,他们纳入了在高温下培养的胚胎,这些胚胎要么表型正常,要么具有严重的温度诱导表型。为了鉴定单个胚胎,他们使用“哈希(hash)”方法,在整个胚胎分离后,将每个胚胎具有独特条形码的聚腺苷化DNA寡核苷酸与细胞核一起添加和固定(图1B)。为了探究高温样品的变异性增加,他们在这些条件下采集了额外的胚胎(每个时间点的16个28°C对照,40个32°C和40个34°C胚胎)。三个时间点[受精后(hpf)24、30、36小时]的处理和对照胚胎分别分离和散列,随后使用单细胞组合索引(sci-RNA-seq)方案进行处理,以分离单细胞核(图S1A-B)进行单细胞转录组分析(scRNA-seq)。他们从每个胚胎中回收了5%-10%的细胞(图S1A-D),这足以捕获每个个体的所有主要细胞类型。通过结合288个个体(403992个细胞)的数据,他们建立了一个细胞类型特异性对温度应激反应的综合图谱(图1C)。在32°C和34°C培养的胚胎中,所有预期的细胞类型都表现出来,与高温下的稳健发育一致,没有观察到热休克标记hsp90aa1.1或hsp70L的特异性激活(图S1E-F)或热休克反应(HSR)的整体激活(图S1G),这可以减少细胞类型特异性表达模式。
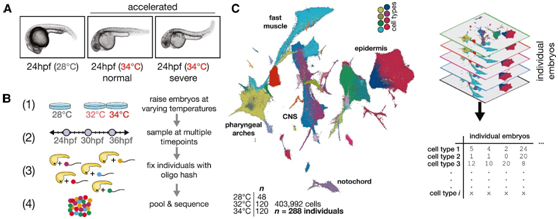
图1. 通过单细胞转录组的个体动物散列捕获应激对表型变异的影响。
(A) 在标准温度和高温下培养的 24 个 hpf 胚胎的代表性图像。(B) 温度扰动实验和个体胚胎散列的实验工作流程。(C) 温度扰动数据集的均匀流形近似和投影 (UMAP)可视化。
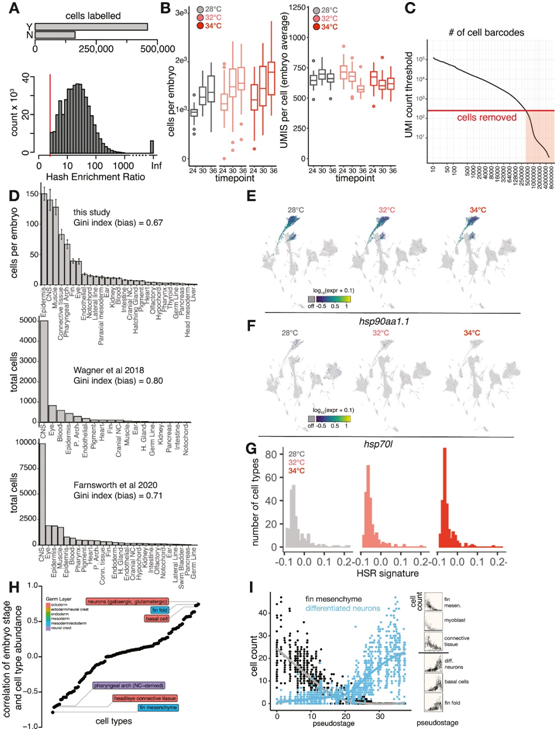
图S1. 高质量单细胞转录组分析。
(A)条形图显示通过的单个细胞数量(Y:是;N:否)哈希富集比(最丰富的哈希相对于第二丰富的哈希的计数)阈值为3。(B) 箱线图显示每个胚胎中的细胞数量(左)和每个胚胎中每个细胞的 UMI 数量(右),按样本时间点划分并按温度处理着色。(C) Knee图显示UMI 计数(红线)的阈值。(D) 条形图显示斑马鱼全胚胎样本的另外两项scRNA-seq 研究中每个胚胎细胞计数的组织成分。(E) 标记图显示在 32°C 或 34°C 下没有诱导 hsp90aa1.1,包括所有时间点的细胞。(F) hsp70L 的标记图,hsp70L 是一种用于斑马鱼热休克转基因报告基因的基因。(G) 直方图显示在任何分析的温度下跨细胞类型的 HSR 没有系统性激活。(H) 每种细胞类型的点图,按该细胞类型丰度与全胚胎伪阶段之间的Pearson相关性排序。(I) (A) 中所示高度相关类型的两个示例,针对强负相关类型(鳍间充质)和强正相关类型(分化神经元)的胚胎阶段绘制原始细胞类型丰度数据;右侧插图显示了更多示例。
02
发育阶段的变化可以根据细胞类型组成来确定
由于发育进程随时间和温度的变化而变化,斑马鱼研究根据标准温度下发育过程中明显的可见标志的“分期系列”对胚胎进行分类。例如,对于在 34°C 下培养至 24 hpf 的胚胎,正确的阶段匹配对照是在 28°C 下培养 31 hpf 的胚胎。他们在二维上分析了单个胚胎:根据细胞类型组成的相似性对胚胎进行分组,这种分组产生了主要由样本时间点定义的轨迹(图2A)。他们将高温胚胎投射到参考胚胎细胞组成空间上,发现经过处理的胚胎比同期对照沿着伪阶段轨迹进展得更远(图2A)。伪阶段值与温度和发育阶段线性模型预测的加速度密切相关(图2B)。他们进一步分析了丰度可预测全胚胎伪阶段的单个细胞类型,发现鳍折叠细胞可用于精确地对胚胎进行分期(图S1H-I)。伪阶段值也与根据个体最近邻平均时间点而不是全胚胎细胞类型组成计算得出的全胚胎阶段值密切相关(图 2C),这些指标的最大偏差出现在早期发育阶段(图 2C,图S2A)。因此,全胚胎细胞类型组成数据捕获了发育阶段的变化,包括在同一时钟时间采样的未经处理的胚胎中发现的变化(图2B)
接下来,他们将相似发育阶段的对照胚胎和处理胚胎分为四个伪阶段箱(图2A)。在考虑了模型中由于不同温度导致的胚胎阶段的差异后,他们确定了 20-30 种细胞类型,这些细胞类型的丰度随着温度的变化而显著增加或减少(图 2 D),34°C 时受影响的细胞类型数量多于 32°C 时(图S2B)。其中,受影响最严重的细胞类型是脊索、背主动脉和头部间充质,这些部位的细胞数量大幅减少。在减少的细胞类型中,有两组在前体(咽弓和周围头部间质)和后体(背主动脉、后脊髓祖细胞、脊索和鳍褶间质)中物理接近。神经祖细胞类型的丰度显著增加,但这并不是由于采样时间点细胞周期激活特征的增加。其他细胞类型,如眼周间充质和红细胞,丰度没有随温度发生显著变化,这表明这些细胞类型对压力不那么敏感(图 2D)。32°C 和 34°C 处理对细胞丰度的影响具有相关性,表明这些亚热休克温度对发育过程的影响类似(图 S2 C)。
为了检测升高的温度是否会增加整体细胞组成的变异性,他们比较了仅由伪阶段或由伪阶段和温度建立的多项模型数据。24 至 36 hpf 之间全胚胎细胞组成的变化有 42% 受到样本时间点变化影响,而温度影响了另外 12%的变化(图 S2 D),证实了解剖变异性的整体增加。为了分离胚胎发生过程中变异性的特定来源,他们确定了细胞类型,其计数显示出高于对照预期的变异增加[显示为相对变异系数(CV)],确定了11种细胞类型在其中一种高温下表现出显著的变异性增加(图2D,图S2E)。后脊髓祖细胞的计数在早期阶段在高温下表现出变异性增加,但在后期稳定(图2D)。在所有细胞类型中,平均而言,在较高温度下的相对 CV 值增加(图 S2 F),在伪阶段 20 和 25 之间达到峰值,证实某些发育阶段可能对温度应激更敏感(图 S2 F)。
他们在高温下培养的胚胎中观察到不同严重程度的表型(图 1 A)。接下来他们试图检测细胞组成的改变是否会导致表型严重程度的差异。表型更严重的胚胎显示几种细胞类型的丰度降低,包括脊索、肌肉、鳍间质、咽弓和脊髓后祖细胞,这表明细胞类型组成的变化导致了整体表型的变化(图2E,图S2G)。
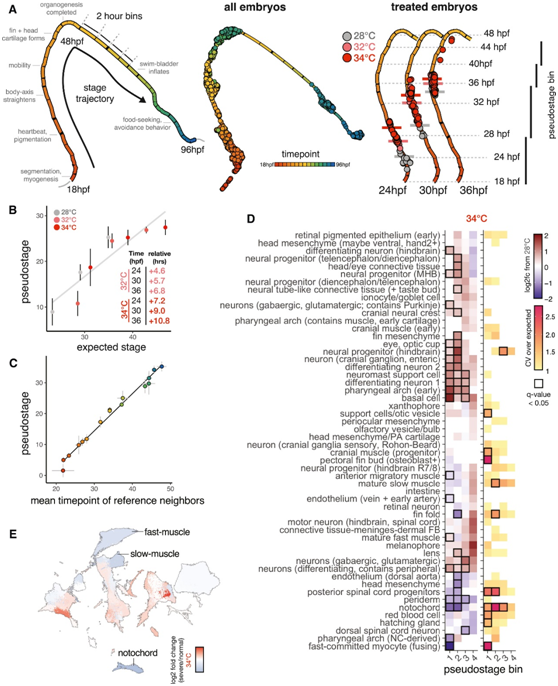
图2. 按细胞类型组成对胚胎进行分期,捕获了温度诱导的发育加速,并可以分离温度依赖性对细胞丰度的影响。
(A) 使用发育参考中的所有单个胚胎生成的胚胎轨迹 UMAP。(B) 散点图显示平均伪阶段值与温度引起的发育速率加速的线性模型的预期相关。(C) 散点图显示参考数据集中所有胚胎的平均伪阶段值与转录组空间中的最近邻标签相比。(D) 热图显示温度对相对于未处理的阶段匹配对照(左)的平均细胞类型丰度和细胞计数变异性(右)的影响。(E) 所有细胞类型的 UMAP。
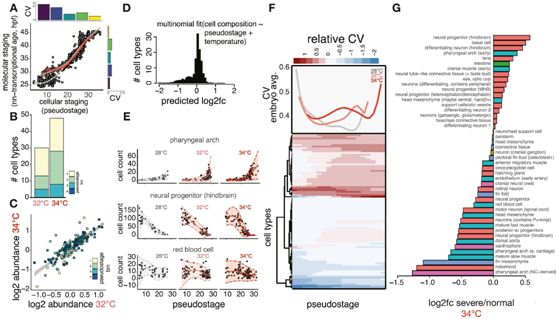
图S2. 温度增加特定细胞类型和发育阶段的变异性。
(A) 比较由细胞组成(x 轴)或转录数据(y 轴)确定的全胚胎分期的散点图。(B) 堆积条形图显示丰度变化显著的细胞类型数量如何随温度增加。(C) 散点图显示两种高温下丰度 log2 差异倍数呈正相关。(D) 直方图显示 34°C 处理导致的细胞组成变化。(E) 散点图显示三种温度敏感细胞类型的原始数据(黑点)以及平均值(实线)和变异性(虚线)的模型输出。(F) 每种细胞类型的热图显示,与野生型发育过程中预期的变异性相比,观察到的变异性在整个发育过程中相对增加。(G) 条形图显示 34°C 胚胎中所有细胞类型相对于表型正常的胚胎,具有严重表型的丰度的 log2 差异倍数。
03
温度导致不同细胞类型的发育速率不同步
接下来,他们探讨了细胞类型组成的温度依赖性变化是否可归因于细胞类型特异性发育速率的变化。为了确定细胞类型特异性发育率是否不同,他们检测了每种细胞类型的转录“年龄”的相对差异(图S3A),取每个胚胎所有细胞的平均年龄,捕获与伪阶段度量相似的全胚胎加速度(图S3B)。例如,在32°C和34°C培养的胚胎中,脊索细胞的转录年龄相对于全胚胎预期分别加速了+1.6 h和+2.2 h(图S3C)。其他几种细胞类型,包括背主动脉、黑素细胞,也显示出类似的相对进展,他们将这些细胞归类为高度加速细胞(图3A-B)。基底细胞、色素祖细胞和鳍状细胞在高温下反应迟钝或减慢(图S3C)。对于大多数细胞类型(85%),与发育阶段相关的显著差异表达基因(DEG)的数量大于与温度相关的数量,这突出了包括发育阶段信息的重要性,以适当地将环境扰动的影响与对发育延迟或加速的影响分离开来(图 S3 D)。此外,发育加速与整个转录组的变化有关,而不是集中在少数敏感基因上。
鉴于某些细胞类型的发育速度比其他细胞类型更快,他们接下来探究跨细胞类型的发育同步性。通过检测每个温度下的伪阶段偏差来评估胚胎水平发育阶段的变化;两种温度都增加了发育阶段的变异性(图 3 C-E)。在所有胚胎的细胞类型年龄的协方差结构中可以观察到细胞类型之间协调的发育时间(图3F)。正如预期的那样,对照胚胎中所有细胞类型与发育时间呈正相关(图 3 G)。然而,细胞类型之间的协方差结构在两种高温条件下都发生了破坏。细胞类型对之间转录年龄的相关性平均降低了 3 倍(图 3G)。此外,许多显示细胞周期相关基因协调激活的细胞类型对在高温条件下也显示出相关性降低,表明协调生长丧失(图S3 G)。总之,这些结果强调了温度如何导致不同细胞类型的发育速率不均匀增加,并破坏细胞类型之间的发育同步性。
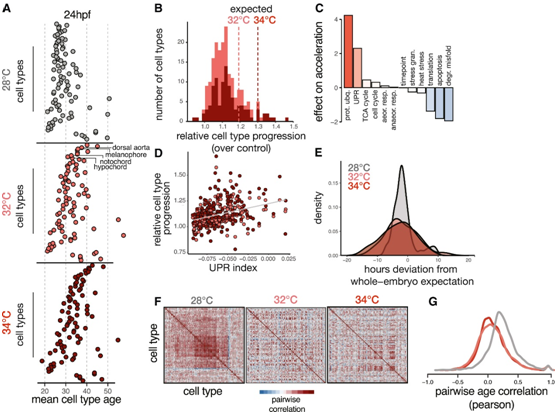
图3. 温度导致不同细胞类型的发育速率不同步。
(A) 点图显示 24 hpf 时所有细胞类型的转录年龄,按温度划分。(B) 直方图显示每个温度下相对细胞类型进展的分布,垂直线显示整个胚胎预期的相对进展。(C) 条形图显示了在预测高温下细胞类型相对进展的加法模型中与代谢、蛋白质折叠、增殖和应激反应相关的几种细胞过程的表达水平的效应大小。(D) 散点图显示每种细胞类型中 UPR 的基础水平与其相对进展的关系,揭示了两种温度的正趋势。(E) 密度直方图显示在高温下培养的胚胎的发育阶段的差异增加。(F) 热图显示胚胎中所有细胞类型的转录年龄的成对相关系数;在 28°C 时,大多数细胞类型对在各个胚胎之间呈正相关,而这种相关结构在温度升高时会减弱。(G) 每个温度下成对相关值的密度直方图。
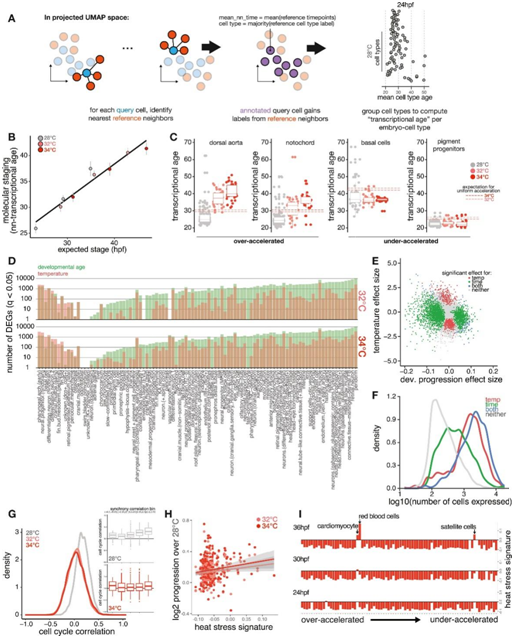
图S3. 温度加速不同细胞类型发育的速度不均匀。
(A) 示意图显示通过参考中时间点标签的最近邻平均来计算每个细胞的转录年龄。(B)如图 2B所示的散点图,但显示了通过转录数据预测温度诱导的发育加速的效果。(C) 箱线图显示加速度大于预期(左)和加速度小于预期(右)的细胞类型的个别示例。(D) 条形图显示每种细胞类型中显著差异表达基因的数量。(E) 散点图显示特定细胞类型(脊索)受发育年龄和温度影响分开的重要基因。(F) 密度直方图显示与温度显著相关的基因往往表现出比发育年龄基因更高的表达水平。(G) 所有细胞类型对的细胞周期特征值的成对Pearson相关性的密度直方图,每个温度都有单独的密度。(H) 散点图显示每种细胞类型中 HSR 特征的基础水平并不是该细胞类型在 32°C 或 34°C 时发育加速的有力预测因子。(I) 条形图显示 34°C 下所有细胞类型的 HSR 特征诱导水平;y 轴上的细胞类型按相对发育加速度排序。
04
未折叠蛋白反应(UPR)缓冲脊索特定的温度敏感性
未折叠蛋白反应(UPR)是温度诱导的加速所必需的。他们生成了单个胚胎中所有细胞类型的翻译和 UPR 的特征评分,发现细胞倾向于表达高水平的一种特征或另一种特征,这与 UPR 在减弱翻译中的作用一致(图3C,图4A)。相比之下,在脊索中观察到 UPR 和翻译同时上调,这是基于高温条件发生的(图 4 B)。在存在 UPR 的情况下,这种异常的翻译上调在下脊索和胸鳍芽中表现得较小。几乎所有其他细胞类型都显示表达这两种特征的细胞数量减少(图 4 B)。值得注意的是,脊索显示出温度依赖于细胞丰度的影响,以及发育年龄的显著加速(图2E,图3A)。
脊索具有独特的机械和信号功能,这些脊索亚型包括液泡内细胞(rab32a+,cav3+),上皮样鞘细胞(col8a1+)和矿化前鞘细胞(entpd5a+)(图4C),这些亚型在发育早期分化(图4D)。为了确定这些类型中的哪一种可能对其温度敏感性影响最大,他们比较了来自高温培养胚胎的脊索细胞和来自野生型参考数据集的脊索细胞(图4E)。
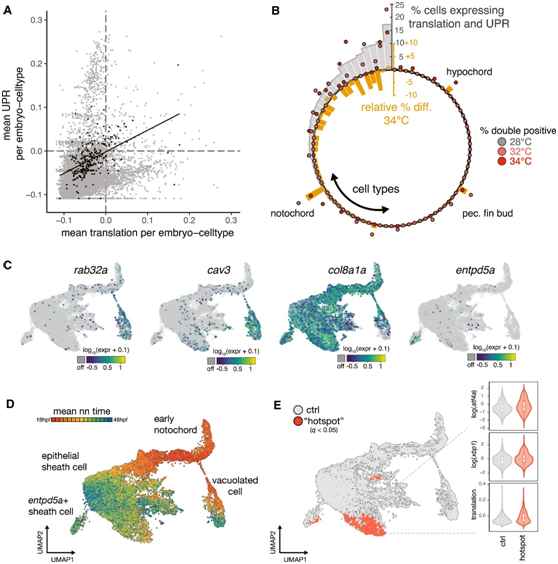
图4. UPR 的特殊调节是脊索温度敏感性的基础。
(A) 散点图显示所有胚胎细胞类型的翻译特征和 UPR 特征水平。(B) 圆形条形图,显示翻译 + UPR 共表达的发生,显示为每种细胞类型中双阳性的百分比(灰色条)。(C) 标记基因图显示定义脊索亚型的基因的表达。(D-E) UMAP可视化。
他们检测到脊索 UMAP 焦点区域高温条件下的细胞显著富集,包括上皮样鞘细胞中的“热点”,其表达翻译和 UPR 基因的水平高于其他脊索亚型(图 5 A)。上皮样鞘细胞的主要功能是产生、加工和包装大量胶原蛋白和细胞外基质蛋白,这些蛋白和细胞外基质蛋白最终分泌以产生细胞外脊索鞘,这对于脊索的刚性和适当的功能至关重要。
为了检测 UPR 是否缓冲发育中的脊索中温度介导的内质网应激,他们在 F0 胚胎中使用 CRISPR 敲除内质网应激感应转录因子 Atf6 (atf6 crispants),并使用阿尔新蓝染色(Alcian blue stain)分析脊索形态。当斑马鱼模型在标准温度下饲养时,在24 hpf和48 hpf下都观察到轻微的脊索缺陷(图5A)。
接下来,他们检测了当这些胚胎在高温下升高时,atf6 crispants是否会加剧温度依赖性的蛋白质静态应激。在高温下升高的对照鱼的脊索显示正常,而atf6 crispants组的脊索鞘则出现扭结、弯曲或变形(图5A)。
为了进一步检测Atf6在激活脊索UPR中的作用如何影响其耐受温度应激的能力,他们在正常和高温下分别对96个atf6 crispants组和注射剂对照的个体胚胎进行了额外的sci-Plex实验。当atf6 crispants组的胚胎在高温下培养时,整个胚胎和脊索特异性发育年龄都低于预期(图 5 B)。此外,在高温培养的胚胎中,用集成应激反应抑制剂(ISRIB)对 UPR 进行药理学抑制,可防止脊索鞘细胞进入应激诱导的热点转录状态(图4D)。虽然atf6 crispants组表现出温度依赖性发育加速降低,但当突变体在正常温度下培养时,脊索特异性和胚胎范围的发育年龄均不受影响(图 5 B)。因此,atf6 crispants组没有表现出普遍的发育延迟,而是在响应温度升高而加速发育方面存在缺陷,证明了每种细胞类型的基础 UPR 水平与其发育的温度依赖性加速相关(图 3 C),强调了 UPR 在协调细胞类型特异性胚胎发育时间变化中的作用。
使用透射电子显微镜(TEM)检测了鞘细胞和鞘的超微结构,他们发现与标准温度下饲养的对照相比,野生型和atf6 crispants组的脊索鞘在 35°C 下表现出更多的紊乱(图 5 C),提示在高温下胶原蛋白的适当修饰和组织受到阻碍。在高温下培养的atf6突变体最显著的差异是鞘细胞本身中错误折叠、非分泌的胶原纤维的积累(图 5 B)。
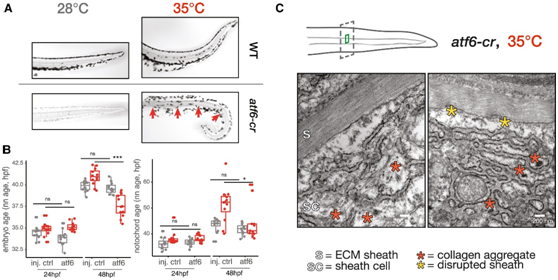
图5. Atf6 的缺失限制了温度引起的发育速率加速并增加了脊索的温度敏感性。
(A)在 28°C 和 35°C 下培养的野生型和atf6 crispants胚胎尾部的阿尔新蓝染色脊索图像(黑白相机图像) 。(B) 箱线图显示整个胚胎(左)和脊索(右)在 34°C 时加速发育的能力降低,而在 28°C 时没有明显的发育延迟。(C) atf6 crispants组中脊索鞘细胞在高温下升高的 TEM 结果,显示内质网结构破坏和胶原原纤维聚集(红色星号)。
+ + + + + + + + + + +
结 论
本项研究全动物scRNA-seq来表征温度应激下的数百个斑马鱼胚胎,以识别驱动表型变异的细胞类型和分子程序。温度扰乱了多种细胞类型的正常比例和基因表达程序,并且还引入了发育时间的异步性。脊索对温度特别敏感,将其映射到一种特殊的细胞类型:鞘细胞。这些细胞在高温下积累错误折叠的蛋白质,导致脊索的级联结构故障和解剖缺陷。本项研究表明,全动物scRNA-seq 可以识别发育稳健性的机制,并分析构成关键失败点的细胞类型。
+ + + + +



 English
English


