文献解读|Nature(64.8):肠道微生物碳水化合物代谢导致胰岛素抵抗
✦ +
+
论文ID
原名:Gut microbial carbohydrate metabolism contributes to insulin resistance
译名:肠道微生物碳水化合物代谢导致胰岛素抵抗
期刊:Nature
影响因子:64.8
发表时间:2023.08.30
DOI号:10.1038/s41586-023-06466-x
背 景
胰岛素抵抗是代谢综合征和2型糖尿病的主要病理特征,肠道微生物群在胰岛素抵抗中具有重要作用。共生体的碳水化合物代谢物占宿主总能量提取的 10%,从而在肥胖和糖尿病前期的发病机制中发挥作用,然而其根本机制仍不清楚。
实验设计
结 果
01
IR 中粪便碳水化合物含量增加
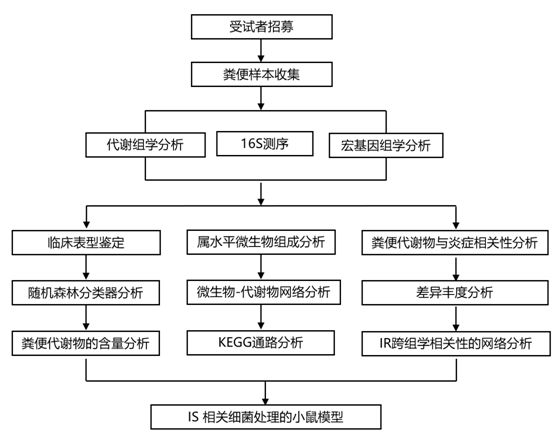
研究者团队分析了306名年龄在20至75岁(中位年龄61岁)的个体(71%为男性)(图S1a)。本研究分析的主要临床表型是胰岛素抵抗(IR),他们将其定义为IR (HOMA-IR)评分至少为2.5的稳态模型评估。他们还分析了粪便代谢物与代谢综合征 (MetS)(一种与 IR 相关的病理学)之间的关联。除血压和性别比例之外,IR 和 MetS 的临床特征在很大程度上重叠,其中 IR 个体与正常胰岛素敏感性 (IS) 个体之间没有差异。他们使用两个基于质谱 (MS) 的分析平台进行的非靶向代谢组学分析分别鉴定了 195 种和 100 种带注释的粪便和血浆亲水性代谢物,以及 2654 种和 635 种带注释的粪便和血浆脂l质代谢物(图S1a)。为了确定微生物功能的总体差异,将粪便代谢物和预测基因分别归纳为共丰度组(CAG)和KEGG类。采用基因表达帽分析(CAGE)方法获得外周血单个核细胞(PBMC)的转录组学信息,该方法可以在转录起始位点分辨率上测量基因的表达。
图S1. 多组学分析和数据概述。
(a) 纳入先前未诊断出糖尿病、糖尿病药物或肠道疾病的个体。胰岛素抵抗(IR)和代谢综合征(MetS)是主要的临床表型。 (b) 多组学分析工作流程。
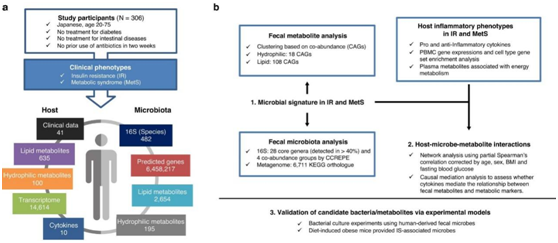
为了研究粪便样本的组学数据如何预测 IR,他们首先基于随机森林分类器比较了受试者操作特征 (ROC) 曲线的曲线下面积 (AUC)。粪便代谢组学数据的选定特征在预测 IR 方面通常优于 16S分析 和宏基因组学的特征(图1a),这表明粪便代谢组学可用于研究 IR 发病机制。
接下来他们寻找临床表型和粪便代谢物 CAG 之间的关联(图1b)。主要的混杂因素,即性别和年龄,在与临床标志物的相关和回归分析中进行了调整。在亲水性代谢物中,与IR显著相关的cag多为碳水化合物代谢物,主要为单糖(亲水性cag 5、12和15)(图1b)。短链脂肪酸 (SCFA),即碳水化合物发酵产物,在 IR(亲水性 CAG 8)中也有所增加。对这些 IR 相关亲水性 CAG 中代谢物的 KEGG 通路富集分析表明,这些代谢物确实参与了碳水化合物代谢。具体来说,他们发现主要的单糖如果糖、半乳糖、甘露糖和木糖与IR显著相关(图1c)。粪便单糖在 MetS、肥胖和糖尿病前期也同样增加(图1d)。这些发现表明,碳水化合物降解的最终产物(例如易于被宿主吸收和利用的单糖)在 IR 和 MetS 患者的粪便中尤其增多。

图1. 粪便碳水化合物代谢物在 IR 中发生明显改变。
(a) 左:随机森林分类器的 AUC 用于基于属水平16S、KEGG 直系同源 (KO) 水平的宏基因组、粪便代谢组和宏基因组 (KEGG 直系同源)来预测 IR + 粪便代谢组数据。右:箱线图显示了所选特征获得的 AUC。(b) 粪便亲水代谢物(hydroCAG)和脂质代谢物(lipidCAG)的cag,以及临床表型和标志物。 (c) 粪便中单糖水平与HOMA-IR之间的pSC关系。(d) 粪便中 MetS 中单糖的水平。
02
IR 中微生物与代谢物的关系
接下来他们研究了肠道微生物群的变化以及与 IR 相关的肠道微生物群的功能,使用 16S rRNA 测序分析了研究参与者的属水平微生物组成,并确定了四个细菌聚组。第1组以毛菌属(Blautia和Dorea)为主,第2组以拟杆菌属(bacteroidides、Parabacteroides和Alistipes)和粪杆菌属为主,第3组为放线菌属,第4组没有形成明显的网络。他们进一步将研究这些细菌分为四个聚类,从A到D(图2a)。值得注意的是,IR的比例在聚类C中明显较低(图2a)。其他与IR和MetS相关的代谢参数,如HOMA-IR、BMI、甘油三酯、高密度脂蛋白胆固醇(HDL-C)和脂联素在聚类C(IR比例最低)和其他三个聚类之间也不同(图2b)。
接下来,他们根据显著的正相关或负相关构建了微生物-代谢物网络。尽管粪便 SCFA 和脂质(例如 DGDG)与 IR 和 IS 相关细菌群相关,但 IR 相关粪便碳水化合物主要与第 1 组和第 4 组中的属相关,其中最突出的是毛螺科的Dorea(图 2c -d)。相比之下,大多数碳水化合物与2组细菌中is相关属呈负相关,如拟杆菌属、Alistipes 和 Flavonifractor(图2d)。
IR相关的粪便碳水化合物还与碳水化合物代谢和运输相关的KEGG通路相关,例如磷酸转移酶系统(PTS)、淀粉和蔗糖代谢以及半乳糖代谢,而与碳水化合物分解代谢相关的通路(例如糖酵解和丙酮酸代谢)负相关(图2e)。细胞外葡萄糖苷酶,如β-果糖糠醛苷酶、淀粉蔗糖和低聚1,6-葡萄糖苷酶可以将蔗糖和糊精降解为葡萄糖和果糖,显示出最高的正相关性,特别是与粪便葡萄糖。相比之下,与淀粉使用相关的葡萄糖苷酶,如α-淀粉酶与粪便碳水化合物呈负相关。重要的是,这些糖苷酶基因的丰度在参与聚类C和其他三个聚类之间存在显著差异,这表明分类谱在很大程度发生糖苷酶的变化(图2f)。
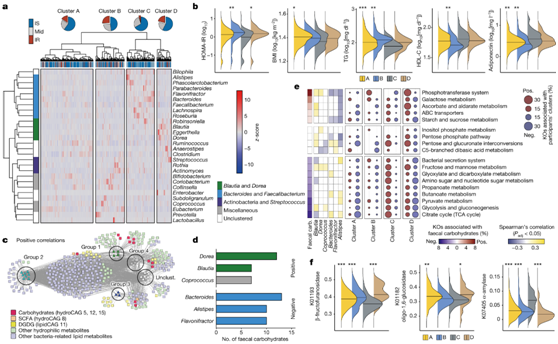
图2. IR 相关粪便代谢物与肠道微生物群和微生物遗传功能的改变有关。
(a) 属水平上细菌的共丰度聚类及其丰度。(b) 聚类中的HOMA-IR、BMI、甘油三酯(TG)和HDL-C水平。 (c) 细菌-代谢物网络。(d) 细菌属与粪便碳水化合物之间显著正相关和负相关的数量。 (e) 与碳水化合物代谢和膜运输相关的KEGG通路、粪便碳水化合物、与粪便碳水化合物正相关或负相关的前三个属以及聚类。 (f) 聚类中参与糖苷酶的代表性 KEGG 直系同源物的丰度。
03
粪便碳水化合物和 IR 中的炎症
多项研究表明,脂多糖等微生物成分在促进代谢性疾病炎症中发挥作用。然而,目前尚不清楚微生物代谢是否与低度炎症有关。因此,他们试图分析 IR 的宿主炎症特征与粪便碳水化合物之间可能存在的关联。首先,基于跨组学相关性的网络,涉及与 IR 相关的各个代谢物、细菌、转录本和细胞因子,结果表明粪便碳水化合物与细菌和宿主 IR 相关特征(尤其是细胞因子)密切相关,表明这些代谢物是 IR 相关特征的中心(图3a)。差异丰度(按 IR 和 IS 丰度之比计算)在粪便碳水化合物和细胞因子之间的关联中最为明显。值得注意的是,IL-10(一种血浆细胞因子)显示出与粪便碳水化合物最显著的关联,并与 PBMC 衍生的转录本有一定的关联。粪便碳水化合物的分析证明了IL-10的变化,以及脂联素、瘦素和serpin E1的变化,这表明粪便碳水化合物与这些细胞因子特别相关(图3b)。尽管粪便碳水化合物的差异比例低于血浆代谢物,但它们远高于属水平丰度,突出了粪便代谢物在肠道微生物群和宿主炎症反应之间的作用。IL-10、serpin E1、脂联素和瘦素在计算机模拟中介导了粪便碳水化合物与宿主 IR 标记物(例如 HOMA-IR)之间的因果关系(图 3c)。值得注意的是,代谢物和细胞因子之间存在独特的对应关系。例如,IL-10 介导果糖、甘露糖、木糖和鼠李糖的作用,但不介导其他代谢物的作用。
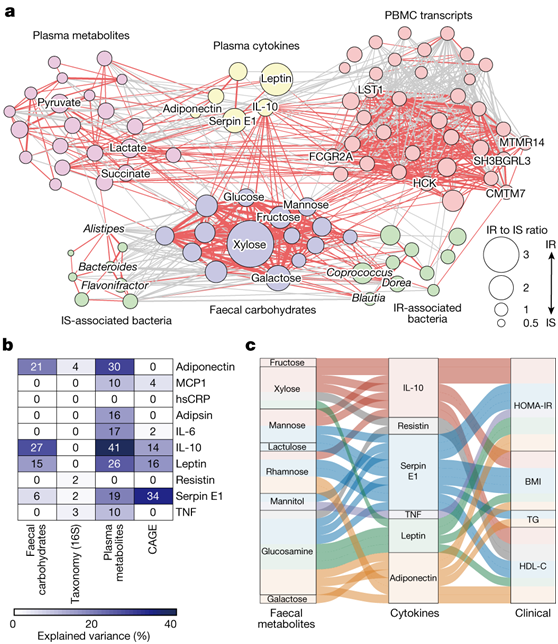
图3. 粪便碳水化合物代谢物与 IR 中的细胞因子水平相关。
(a) 粪便碳水化合物代谢物(紫色)、粪便细菌(绿色)、血浆亲水性代谢物(粉色)、细胞因子(黄色)和PBMC基因(红色)之间的网络分析。 (b) 每个组学数据集使用随机森林分类器预测的十种血浆细胞因子的方差。 (c) 冲积图显示血浆细胞因子显著介导粪便碳水化合物对宿主代谢标志物的影响。
04
实验模型中的 IS 相关细菌
接下来,他们检测了7种候选细菌的潜在治疗效果,这些细菌在人类队列研究中显示与IS相关。在喂食高脂肪饮食的、并且给予A. indistinctus、Alistipes Finegoldii 和 Bacteroides thetaiotaomicron处理的小鼠中,餐后血糖水平尤其降低(图4a)。胰岛素耐量试验也显示,这些菌株改善了IR,最显著的是A. indistinctus处理(图4b-c)。A. indistinctus处理可改善体重增加、肝脏异位甘油三酯积累和葡萄糖耐受不良。代谢测量显示,在接受了A. indistinctus处理的小鼠中,碳水化合物氧化显著减少,这意味着碳水化合物的使用是有限的。饮食摄入和运动活动保持不变,用A. indistinctus处理后,肠道中宿主可利用的碳水化合物减少了。在这方面,A. indistinctus处理实质上改变了盲肠代谢物,其特征是几种碳水化合物(包括果糖,一种脂质单糖)的减少。血清中的果糖也同样减少。重要的是,胰岛素耐量试验的AUC与盲肠单糖果糖、葡萄糖和甘露糖呈正相关(图4d)。这些发现表明,A. indistinctus可改善小鼠的 IR 并影响肠道碳水化合物代谢。

图4. IS 相关细菌在实验模型中改善 IR。
(a) 细菌给药4周后高脂肪饮食小鼠餐后血糖的变化。 (b-c) 胰岛素耐量试验期间的血糖水平和 AUC。(d) 胰岛素耐量试验AUC与盲肠中果糖、葡萄糖和甘露糖水平的相关性分析
+ + + + + + + + + + +
结 论
本项研究将粪便代谢组学与宿主代谢组学和宏基因组学数据相结合,以分析微生物组在胰岛素抵抗中的左右。这些数据表明,粪便碳水化合物,特别是宿主的单糖,在胰岛素抵抗个体中增加,并且与微生物碳水化合物代谢和宿主炎症细胞因子相关。本项研究鉴定了与胰岛素抵抗和胰岛素敏感性相关的肠道细菌,这些细菌表现出独特的碳水化合物代谢模式,并证明与胰岛素敏感性相关的细菌可以改善小鼠模型中胰岛素抵抗的宿主表型。
+ + + + +



 English
English


