文献解读|Cancer Cell(50.4):多发性骨髓瘤前体疾病的单细胞克隆型和转录进化
✦ +
+
论文ID
原名:Single cell clonotypic and transcriptional evolution of multiple myeloma precursor disease
译名:多发性骨髓瘤前体疾病的单细胞克隆型和转录进化
期刊:Cancer Cell
影响因子:50.4
发表时间:2023.06.12
DOI号:10.1016/j.ccell.2023.05.007
背 景
多发性骨髓瘤(MM)是一种起源于浆细胞(PC)的骨髓(BM)癌,MM仍然是一种不可治愈的疾病,其先兆条件(包括意义未明的单克隆丙种球蛋白病和阴燃性多发性骨髓瘤)的细胞和分子进化尚不完全清楚。
细胞遗传学异常将MM病例分为两种主要亚型:超二倍体(HY)和非HY (non-HY),这两种亚型几乎是相互排斥的。
实验设计
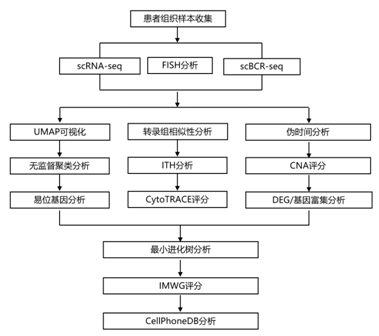
结 果
01
单细胞分析表明,在早期和新诊断的MM中,转录异质性都很高
研究者团队对64例新鲜骨髓标本进行单细胞转录组分析(scRNA-seq)和单细胞B细胞受体序列测定(scBCR-seq),这些样本包括包括21例单克隆丙种球蛋白病(MGUS) 、32例阴燃性多发性骨髓瘤(SMM)、7例初诊MM (NDMM)、1例难治性复发MM (RRMM)和4例健康供者正常骨髓标本(图1A),并采用荧光原位杂交(FISH)作为标准临床检查的一部分来确定基因亚型(图1B)。他们保留了183928个细胞,并进一步将这些细胞分为PC和肿瘤微环境(TME)细胞,用于后续分析(图1C)。正如预期的那样,他们观察到意义未明的MGUS / SMM / MM轴的PC的分数增加(图1D)。通过整合来自推断的拷贝数变异(CNA),他们鉴定了59992个克隆性PC(cPC)(图1E)。MGUS、SMM和NDMM患者的大部分cPC形成了样本特异性的聚类,与疾病分期和细胞遗传学异常无关(图1E)。具有相同诊断(如SMM)和/或细胞遗传学改变[如t(11;14)和t(4;14)]的聚类更接近,表明总体上更相似的转录组谱。在这些多种形态中,所有样本特异性聚类都是由显性BCR克隆型驱动的,这表明每个聚类的细胞都是从单个祖先细胞克隆扩增而来的(图1E)。

图1. 本研究的工作流程、样本信息和单细胞转录组图。
(A)研究工作流程示意图。(B)本研究65份样品的荧光原位杂交(FISH)结果。(C) UMAP可视化。(D)箱形图显示了nBM、MGUS、SMM和NDMM未分选样品中PC比例的比较。(E) 44个R49个样本中所有cPC的无监督聚类分析的UMAP可视化。(F)小提琴图显示了44例R49型cPC患者和1例健康供体的cPC中易位相关基因的表达。
02
cPC的基因组异常导致转录异质性
聚类结果主要是由基因组改变,来自相同细胞遗传学组的样本聚集在一起(图2A)。此外,他们使用Bhattacharyya配对距离(BPD)测量样本转录组相似性,BPD来自排名最高的主成分(图2B)。总的来说,易位和/或SMM的样本在转录上更相似,显示出较小的BPD。他们观察到MGUS样本之间的距离更大,特别是HY和其他样本,这表明,在MGUS阶段,cPC已经表现出与晚期相当的高度转录组肿瘤内异质性(ITH),而在SMM阶段,异质性降低。此外,在MM的不同阶段,HY比易位具有更多的异质性(图2B)。
接下来,他们比较了样本水平的ITH评分、非整倍性水平和细胞增殖特性,发现这些特性在不同诊断之间没有显著差异,尽管有增加的趋势。在比较非HY和HY两种遗传亚型的这些特性时,他们观察到,与低/中风险易位t(11;14)相比,高风险易位t(4;14)和t(14;16)的欧氏距离测量的ITH程度更高(11;14)(图2C)。与此同时,HY亚型的样本与不同易位亚组相比显示出中等水平的ITH。在HY亚型的样本中观察到较高的CNA评分和较低的增殖细胞比例,而在非HY患者中则相反,不同的易位亚组显示出相似水平的这些特性。他们还研究了chr 1q增益(一种与高风险相关的基因组改变)对ITH水平的影响(图2D),具有chr 1q增益的样品具有显著更高的ITH水平,表明更具异质性。BCR克隆性和样本内亚聚类表明,非HY和HY之间克隆复杂性的总体程度相似(图2E)。
这些结果表明,尽管骨髓瘤细胞由不同的驱动事件启动,具有不同的特性,但在其进化和进展过程中,骨髓瘤细胞获得了相似程度的克隆复杂性,并且具有高风险基因组事件,如chr 1q增益会增加转录组ITH。
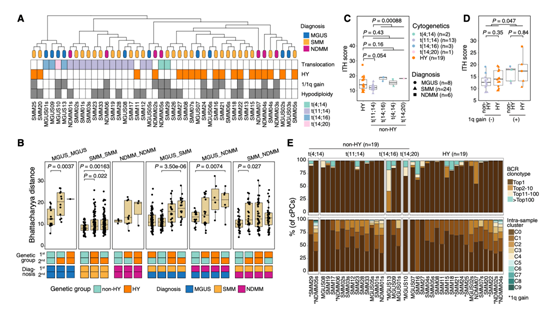
图2. cPC的表征。
(A)层次聚类分析显示不同患者的cPC转录组具有相似性。 (B)箱线图显示不同诊断-细胞遗传学组间Bhattacharyya距离的比较。(C)箱形图显示了HY和不同易位亚组样本之间ITH评分的比较。(D)箱形图显示了chr1q增益的样本和没有chr1q增益的样本之间ITH评分的比较。(E)堆叠条形图显示每个非HY 和HY患者的BCR克隆型(上)和样本内亚群(下)分布。
03
关键致癌特征表达的样本内亚聚类异质性
为了更好地了解cPC亚群的转录ITH,特别是在关键致癌特征的表达方面,他们量化了在130个cPC亚群和正常PC(nPC)中的基因表达水平(图3A)。在前体和NDMM中观察到个体样本的cPC亚群中存在大量ITH(图3A)。例如,LAMP5在MGUS06s、SMM08、SMM15、SMM22、NDMM03s、NDMM04s、NDMM05s等亚群中存在差异表达。CKS1B在MGUS05s、MGUS06s、SMM01、SMM02、NDMM02s、NDMM03s、NDMM05s等亚群中存在差异表达。其中一个t(4;14)相关基因NSD2在SMM29中C1高表达,而C0不表达;该基因在ndmm05亚群中也有差异表达。MYC在MGUS06s的C3、C6、C7和C8中表达,而在MGUS06s的其他细胞群中不表达。然后,他们分别分析了正常、非HY和HY PC中基因表达水平与CytoTRACE评分的spearman相关性,在此基础上,无监督聚类识别出这三组中共享和独特的模式(图3B)。
虽然大多数关键基因与CytoTRACE评分呈正相关,但他们发现一些基因具有不同的趋势(图3B-C)。例如,聚类2中的TNFRSF17 (BCMA)与正常和HY患者的细胞追踪评分有很强的相关性,而在非HY患者中则没有。聚类4中的LAPTM5和CD38仅在nPC中表现出较强的相关性,而在cPC中则没有。聚类8中SDC1仅在HY中呈正相关,聚类中HLA-A和HLA-B在非HY中呈高相关性,而聚类8中HLA-C仅在HY中呈正相关。
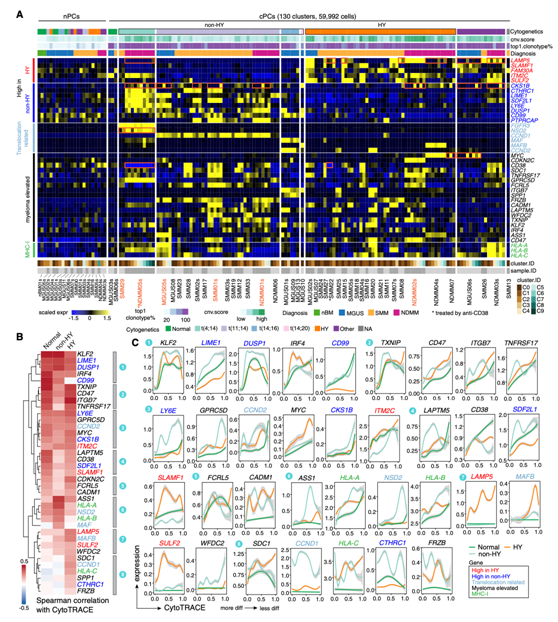
图3. 骨髓瘤相关关键基因样本内亚聚类异质性与基因组异常和肿瘤进化相关。
(A)热图显示骨髓瘤相关关键基因在样本内亚聚类水平上在PC中按比例平均表达。(B)按行层次聚类的热图,分别显示正常、非HY和HY细胞中基因表达水平与CytoTRACE评分的spearman相关性。(C)二维图显示了沿CytoTRACE评分的基因表达水平的动态变化。
04
恶性转化的伪时间重建揭示了不同的进化模式
对MGUS01s中所有B细胞和PC细胞进行无监督聚类分析,鉴定出3个B细胞聚类(即CD34+前B细胞,MKI67+增殖前B细胞和前/未成熟B细胞)和5个PC细胞聚类(图4A)。根据CD19/CD24/CD81/IGHM的表达和重排相关基因如DNTT和VPREB1的下调来鉴定前/未成熟B细胞。五个PC聚类(C0-C4)(图4A)高度表达PC特征基因,如SDC1(CD138)和MZB1以及聚类特异性表达特征。伪时间分析显示,沿Monocle3推断的细胞分化轨迹,从pro-B细胞到前B细胞、未成熟B细胞和PCs C0、C1、C2、C3和C4存在一条路径(图4A),非整倍体水平逐渐增加(图4B), BCR克隆扩增逐渐增加(图4C)。
值得注意的是,C0和C1细胞是多克隆的,具有不同的BCR克隆型,而C2、C3和C4细胞是克隆的,具有相同的BCR克隆型(图4A),这表明这3个细胞聚类的细胞是从同一个祖细胞扩增而来的。然而,在这3个聚类中观察到不同的CNA(图4D)和表达谱(图4E)。例如,C3与C4具有相似的CNA,与C2相比,两个聚类的细胞都获得了额外的CNA(图4D)。一致地,C4与C3比C2共享更多的聚类特异性差异表达基因(DEG)(图4E)。C4和C3之间的DEG分析发现,在“终末”差异聚类C4中,ASS1、PTP4A3和PRPSAP2等基因表达上调(图4F),在本研究的独立队列中,这3个基因在晚期也出现上调(图4G)。
沿着细胞分化轨迹的表达动态分析揭示了有趣的聚类特异性表达特征(图4H -J)。例如,ITGB7和CCND2在C2、C3和C4细胞中高表达,KLF2在C3和C4细胞中高表达,而ASS1在C4细胞中特异性富集(图4I)。此外,他们在C3和C4细胞中发现了高度富集的通路,包括缺氧、凋亡、糖酵解、TGF-B信号传导、NF-kB和P53通路(图4K)。
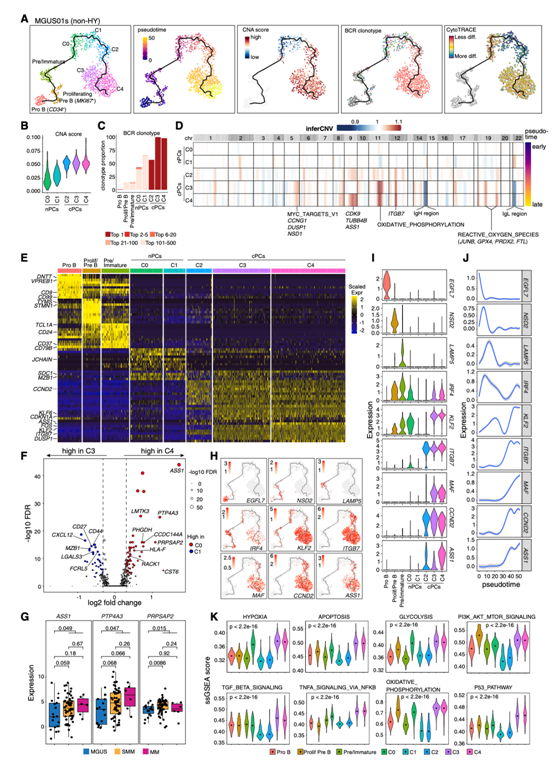
图4. MGUS01s患者B/血浆亚群的异质性和进化。
(A) MGUS01s的B细胞和PC的无监督聚类分析的均匀流形近似和投影(UMAP)可视化,推断轨迹和聚类特征、伪时间、CNA评分、BCR克隆型和CytoTRACE评分(从左到右)。(B)小提琴图显示了5个PC亚群的CNA分数差异。(C)显示每个B细胞和PC亚群中BCR克隆型分布的堆叠条形图。(D)热图显示了患者MGUS01的5个PC集群的全基因组推断CNA谱(上)以及富集的标志通路或与5个聚类之间CNA最显著差异相关的重要基因(下)。(E)热图显示B细胞和PC集群前10个DEG的缩放表达,左侧标记了选定的集群特异性DEG。(F) PC聚类C3和C4差异表达基因的火山图。(G)箱线图显示了验证队列中MGUS、SMM和MM中ASS1、PTP4A3和PRPSAP2表达水平的比较。(H)如图(A)所示的UMAP,表示代表性基因的表达。(I)小提琴图显示了不同B细胞和PC集群中代表性基因的表达。(J) (H)和(I)所示的代表性基因表达水平沿伪时间的动态变化二维图。(K)小提琴图显示基因集富集。
然而,他们仍然能够在早期阶段观察到分支进化模式,如MGUS和SMM。MGUS06s和SMM07s是代表性案例(图5)。在MGUS06s中,他们鉴定了9个PC聚类,每个聚类都具有独特的转录组和/或CNA谱(图5A-C)。C5未检出CNA,其余8个聚类为cPC。C2细胞是多克隆的,是分支进化模型的基础。6个cPC聚类从同一个祖先细胞扩增而来,但分成3个主要分支(C1、C0/C4和C3/C6/C8)(图5A),并进一步分化成6个具有不同CNA和表达谱的克隆(图5B-D)。3个分支的细胞均高表达CCND2,但只有C3/C6/C8分支细胞特异性表达LAMP5。同样,样品SMM07s也显示出类似的进化模式(图5E-H)。
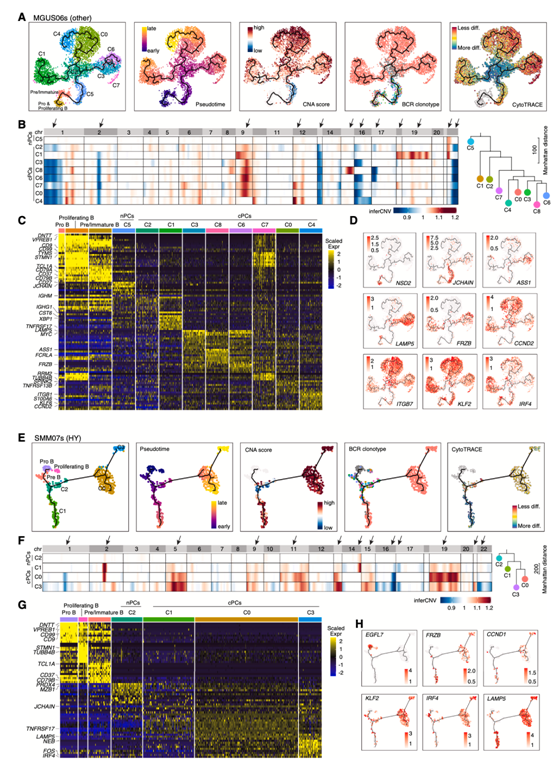
图5. MGUS06s和SMM07s患者B/血浆亚群的内部异质性和进化。
(A) UMAP可视化显示来自MGUS06s的B细胞和PC的无监督聚类分析,推断轨迹和聚类特征、伪时间、CNA评分、BCR克隆型和CytoTRACE评分(从左到右)。(B)左侧热图显示患者MGUS06s的9个PC聚类的全基因组推断CNA图谱。右侧的系统发育树显示了MGUS06s亚聚类群的平均/共识CNA图谱生成的最小进化树,并以中性节点为根。(C)热图显示B细胞和PC聚类前10个DEG的表达,左侧标记了选定的聚类特异性DEG。(D)如图(A)所示的UMAP,表示代表性基因的表达。(E)来自SMM07s的B细胞和PC的无监督聚类分析的UMAP可视化,推断轨迹和聚类标特征、伪时间、CNA评分、BCR克隆型和CytoTRACE评分(从左到右)。(F)左侧热图显示了SMM07s患者4个PC聚类的全基因组推断CNA图谱。右侧的系统发育树显示了SMM07s亚群群的平均/共识CNA图谱生成的最小进化树,并以中性节点为根。(G)热图显示B细胞和PC聚类前10个DEG的表达,左侧标记了选定的聚类特异性DEG。(H)如图(A)所示的UMAP,表示代表性基因的表达。
05
非HY和HY样品中TME的差异重构
然后他们分析了TME细胞并鉴定了15种主要的细胞类型(图6A)。他们通过国际骨髓瘤工作组(IMWG)20/2/20评分对SMM患者进行了分层,观察到在不同的疾病阶段,这些主要细胞类型的细胞组成(图6B)和具有相同基因组变化的样本组(图6C)中存在巨大变化。他们观察到成熟B细胞、自然杀伤(NK)细胞和CD14+单核细胞比例下降,CD8+比例增加的趋势。当疾病负担增加时,T细胞、CD16+单核细胞、肿瘤相关巨噬细胞(TAM)、内皮细胞和成纤维细胞含量也增加。值得注意的是,他们注意到具有不同基因组异常的样本之间TME景观的实质性差异(图6C)。尽管不同易位亚组之间存在很大差异,但他们观察到,与HY样品相比,非HY样品中CD8+ T细胞比例显著降低,CD14+和CD16+单核细胞和树突状细胞(DC)比例显著增加(图6C)。对非HY和HY之间的CD8+ T细胞进行DEG分析,发现HY样品中的细胞溶解活性(如颗粒酶、NKG7、PRF1和GNLY)上调(图6D)。无监督聚类分析鉴定出10个CD8+ T细胞聚类(图6E),但均未出现衰竭表型(图6F)。一致地,HY样品中的CD8+ T细胞倾向于具有较高的细胞毒性评分和较低的幼稚样评分(图6G),HY样品中C0的比例显著增加,C3和C9的比例降低。
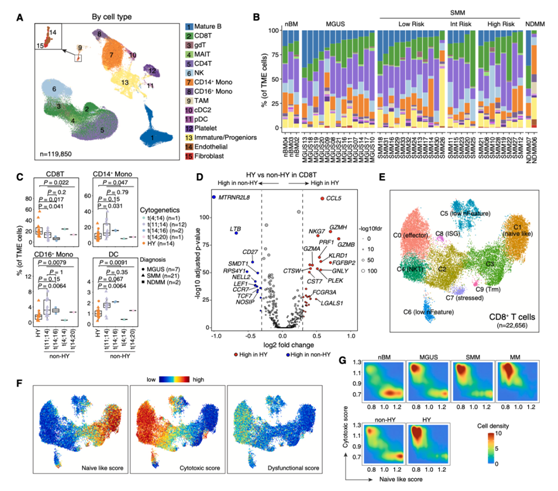
图6. 肿瘤微环境景观。(A)所有TME细胞的无监督聚类分析的UMAP可视化。
(B)堆叠条形图显示按诊断分组的每个未分类样本中相应的细胞类型组成百分比。(C)箱形图显示了HY和不同易位亚组样品间肿瘤微环境中CD8 T细胞、CD14+单核细胞、CD16+单核细胞和DC比例的比较。(D)非HY和HY样品中CD8 T细胞差异表达基因的火山图。(E) CD8 T细胞无监督亚聚类分析的UMAP可视化。(F)如图(E)所示的UMAP,使用ssGSEA方法计算的细胞用幼稚样评分、细胞毒性评分和功能障碍评分(从左到右)着色。(G) CD8 T细胞在不同疾病阶段(第一行)或不同细胞遗传学异常(第二行)的分布(基于其幼稚样评分和细胞毒性评分)。
最后,他们利用CellPhoneDB基于配体受体(L-R)共表达推断了cPCs与TME细胞之间的细胞相互作用。cPC与骨髓细胞(包括单核细胞和DC)的相互作用最强,特别是在HY样品中(图7A)。进一步的研究发现,cPC和TME细胞之间通过CD74-MIF、ICAM1-AREG、TNFRSF1A/B-GRN、CCL3-CR1和LGALS9-CD47的相互作用增强(图7B)。有趣的是,他们发现非HY和HY之间的大部分差异相互作用是由细胞间细胞粘附分子(ICAM、F11R)和CD74来自cPC及其受体的TME(图7B)。
ICAM1在本研究中的cPC中差异表达(图7C),以及在非HY和HY样本之间的较大验证队列中差异表达,而这种差异在肿瘤细胞分化的相对较晚阶段观察到(图7D)。
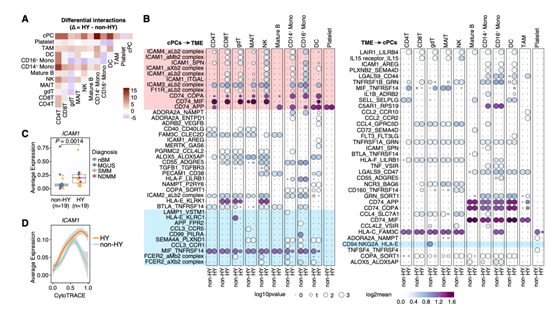
图7. cPC与TME细胞间的相互作用。
(A)热图显示了非HY和HY样品之间通过CellPhoneDB推断的每种主要细胞类型之间相互作用的不同数量。(B)气泡图显示cPC和TME细胞之间配体-受体对的平均表达量和显著性。(C)箱形图显示非HY和HY在样本水平上cPC中ICAM1平均表达的比较。(D)二维图显示ICAM1表达水平沿着CytoTRACE评分的动态变化。
+ + + + + + + + + + +
结 论
本项研究结合了 52 名骨髓瘤前期患者的单细胞 RNA 和 B 细胞受体测序,并与骨髓瘤和正常供体进行了比较,揭示了超二倍体与非超二倍体样本中恶性转化的早期基因组驱动因素、独特的转录特征以及不同的克隆扩增。此外,分析了具有潜在治疗意义的患者内部异质性,并确定了从骨髓瘤前驱疾病到骨髓瘤的不同演变模式。本项研究证明了与骨髓瘤细胞特定基因组变化相关的微环境的独特特征,这些发现增加了对骨髓瘤前驱疾病进展的理解,为患者风险分层、生物标志物发现和可能的临床应用提供了新的理论依据。
+ + + + +



 English
English


