文献解读|Cell Discov(33.5):通过单细胞核转录组分析分析跨物种杏仁核的分子和细胞进化
✦ +
+
论文ID
原名:Molecular and cellular evolution of the amygdala across species analyzed by single-nucleus transcriptome profiling
译名:通过单细胞核转录组分析分析跨物种杏仁核的分子和细胞进化
期刊:Cell Discovery
影响因子:33.5
发表时间:2023.02.14
DOI号:10.1038/s41421-022-00506-y
背 景
杏仁核或类似杏仁核的结构存在于所有脊椎动物的大脑中,在生存和繁殖中发挥着关键作用。除了皮质和纹状体(外侧神经节隆起;LGE)衍生物外,杏仁核还包含源自内侧神经节隆起(MGE)、尾部神经节隆起(CGE)、视前区(POA)甚至视上室旁下丘脑域的神经元细胞类型(SPV)。然而,杏仁核的细胞结构及其进化方式仍然难以捉摸。
实验设计

结 果
01
人类、猕猴和小鼠杏仁核细胞类型的分类
为了在转录组水平上表征哺乳动物和蜥脚类动物(最多样化和最成功的陆生脊椎动物)的杏仁核细胞类型,研究者团队使用人类、猕猴、小鼠和鸡的样本进行单细胞核转录组分析(snRNA-seq) (图1a)。他们对总共 17 个样本进行了分析,包括 3 个人类杏仁核样本、3 个猕猴杏仁核样本、4 个小鼠杏仁核样本、3 个小鼠 BLA[包含外侧核 (LA)、基底核 (BA)、基底内侧核 (BM) 和后核 (PA)]样本、两个小鼠 CEA 样本和两个鸡杏仁核同源样本。
为了评估跨物种的保守性和分歧,他们首先使用 Seurat (v4.0.5) 整合了哺乳动物的杏仁核 snRNA-seq 数据。根据已知细胞类别标记的表达,鉴定了七种细胞类别:即兴奋性神经元(ExN)、抑制性神经元(InN)、少突胶质细胞前体细胞(OPC)、少突胶质细胞(Oligo)、星形胶质细胞(Astro)、内皮细胞/周细胞(Endo/Peri)和小胶质细胞(Micro)(图1b-c)。
在本项研究的数据集中捕获了庞大数量的哺乳动物杏仁核神经元和非神经元细胞。绝大多数是神经元细胞(人类数据集中有52650个细胞核,猕猴数据集中有32525个细胞核,小鼠数据集中有43654个细胞核),其中ExN和InN各占50%左右(图1d)。
无监督聚类分别在人类、猕猴和小鼠的杏仁核中鉴定出45、38和39种不同的转录组细胞类型(图1e-g)。他们根据该聚类中显示最具体表达的标记基因为每个聚类命名(图1e-g)。
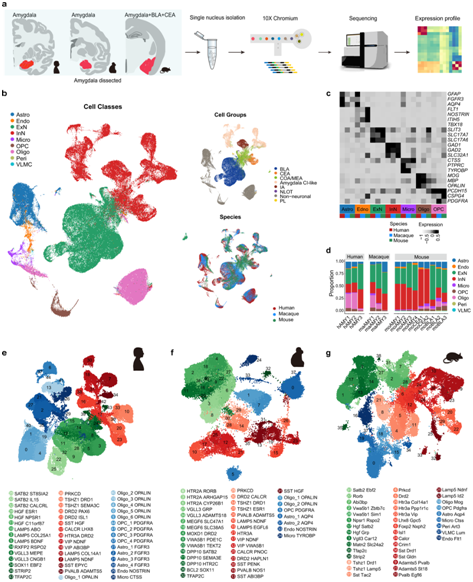
图1. 通过 snRNA-seq 对哺乳动物的杏仁核细胞类型进行分析。
(a) 总体研究设计的示意图。 (b) 人类、猕猴和小鼠综合数据集的UMAP图。(c) 热图显示典型标记基因在细胞类别中的平均表达。(d) 人类、猕猴和小鼠的细胞种类百分比。(e-g) UMAP 图,其中包含来自小鼠数据集的 39 个聚类、来自猕猴数据集的 38 个聚类和来自人类数据集的 45 个聚类。
02
哺乳动物杏仁核亚核的进化保守和分化
杏仁核由多个亚核组成,这些亚核具有源自不同皮质和皮质下区域的各种神经元细胞类型。从解剖学上讲,哺乳动物的杏仁核亚核有明确的定义(图2a)。
为了确定每种神经元细胞类型的亚核定位,他们首先应用来自 Allen Brian Atlas (ABA) 39的原位杂交 (ISH) 数据,并进行 RNAscope 多重荧光 ISH (mFISH) 来验证最特异性标记基因的表达模式小鼠杏仁核中的每个聚类(图2b)。此外,利用ABA中基因的协调信息和表达水平,他们进一步分析了小鼠杏仁核每个聚类中前五个标记基因的平均表达水平和模式(图2c)。他们将小鼠神经元细胞类型分为六组:BLA 来源的兴奋性神经元(BLA 组)、CEA 来源的抑制性神经元(CEA 组)、IA 来源的抑制性神经元。神经元(IA组),皮质杏仁核区/内侧杏仁核来源的兴奋性和抑制性神经元(COA/MEA组),杏仁核皮质中间神经元样抑制性神经元(杏仁核CI样组),以及外侧嗅束来源的核兴奋性神经元(NLOT 组)。除猕猴数据集中的NLOT组神经元外,他们在预测和手动调整后捕获了哺乳动物杏仁核中的所有亚核衍生细胞类型,包括灵长类特异性PL衍生细胞类型(PL组),其显示出未成熟标记的高表达基因。
值得注意的是,来自同一细胞组的细胞核在均匀流形近似和投影(UMAP)图中聚集在一起,表明来自同一细胞组的神经元之间的基因表达相似(图2d)。层次聚类揭示了哺乳动物杏仁核的普遍保守性,尽管COA/MEA组神经元表现出相对较高的分化(图2e)。CEA 组、IA 组和杏仁核 CI 样组神经元在不同物种的杏仁核中表现出相似的比例和多样性。然而,灵长类杏仁核中 BLA 组神经元的比例大约是小鼠杏仁核的两倍,并且在灵长类动物中捕获了更多的细胞类型。相反,小鼠表现出更高的 COA/MEA 组神经元比例和多样性(图2f)。
接下来,他们鉴定了细胞组水平的标记。几个标记基因在物种间保守,包括一些转录因子和离子通道编码基因,但大多数标记仅在一个物种中富集(图2g)。与层次聚类结果一致,COA/MEA组具有较少的保守标记基因(图2g)。此外,还鉴定了每个细胞组中特异性激活的调节子,这对于发育过程中的亚核特化可能很重要(图2h)。例如,NEUROD2是神经元的基本螺旋-环-螺旋转录因子,是神经源性分化和突触成熟所必需的。NEUROD2对于发育过程中 LA 和 BA 的形成以及正常杏仁核功能(如情绪控制、学习能力)至关重要。本研究的结果表明,NEUROD2 调节子活性在 BLA 兴奋性神经元中富集,进一步强调了NEUROD2和相关调节基因对 BLA 形成和功能的重要性。许多主要的调节子基因,如LHX2、TBR1、PAX6、FOXP1、MEIS1、MEIS2和FOXP2与杏仁核的亚核特化和正常生理功能有关,从而证明了本研究的调节子分析的可靠性。重要的是,他们发现了许多新的主要基因和调节子,它们可能在特定细胞群的特化中发挥关键作用(图2h)。
为了评估杏仁核亚核进化保守性的差异,他们进行了无监督的 MetaNeighbor 分析。结果显示,IA和CEA组神经元在进化上最保守,而BLA和COA/MEA组神经元在进化上相对趋异(图2i)。
人类和猕猴含有高表达未成熟标记的神经元聚类,例如SOX11和BCL2,这些标记可能源自 PL。PL 在灵长类动物中扩增,甚至在成人中也包含大量未成熟的神经元,并且在成人大脑的神经可塑性中发挥重要作用。PAGA发育轨迹分析表明,人类和猕猴中PL衍生聚类的成熟轨迹可能朝向VGLL3和TFAP2C聚类(图2j-k)。

图2. 哺乳动物杏仁核亚核的进化保守性和分化。
(a) 每个物种杏仁核亚核的解剖定位。 (b) 通过 mFISH 分析证实小鼠杏仁核中小鼠细胞类型标记基因的空间表达模式。(c) 所选小鼠杏仁核聚类中前五个差异表达基因(DEG)的空间表达模式。(d) UMAP嵌入来自人类、猕猴和小鼠杏仁核的数据集,根据标记基因的表达模式、Ro/e分析和预测算法,细胞核按细胞组着色。(e) 根据 MetaNeighbor 报告的接受者算子特征曲线 (AUROC) 评分下的面积,对不同物种的杏仁核细胞群进行无监督层次聚类。 (f) 条形图显示每个物种中每个细胞组的细胞核比例。(g) 热图显示每个杏仁核细胞组的保守特征基因。(h) 每个杏仁核细胞组的 TF 调节子活性热图。 (i) 箱线图显示按细胞组起源分组的每个基于表达的聚类的总 AUROC 分数。(j) PAGA 图显示人类兴奋性神经元聚类的推断发育轨迹。(k) 条形图显示 PAGA 与人类数据集中的 聚类24 (C24 SOX11 EBF2) 的连接性。
03
哺乳动物抑制性神经元的同源性
在CEA、IA和COA/MEA中富集了抑制性神经元(以MEA为主),而CI样抑制性神经元在杏仁核中分布稀疏。为了进一步评估杏仁核中的神经元同源性,他们整合了哺乳动物的抑制神经元数据集。抑制性神经元在不同物种之间充分混合,并且来自相同细胞组的细胞核在 UMAP 图中聚集在一起(图3a)。他们鉴定了 12 种主要细胞类型,它们在不同物种之间具有良好的一致性,但一种主要细胞类型的细胞核主要来自小鼠 MEA(称为 Mix-cluster)(图 3b)。与运动皮层一致,每种主要细胞类型中几个标记基因的表达在物种间是保守的,但大多数标记基因仅在一个物种中富集(图3c)。MetaNeighbor 分析进一步揭示了抑制性神经元的跨物种保守性,尽管物种间确实存在差异(图 3d-e)。人类和猕猴之间的抑制性神经元同源性高于人类和小鼠之间的同源性,反映了进化距离的差异。
CEA 和 IA 衍生的抑制性神经元很有特点,因为它们的 LGE 起源与其他杏仁核抑制性神经元和皮质中间神经元不同,后者主要衍生自 MGE 和 CGE,构成杏仁核的主要输出和抑制控制中心。本项研究的 snRNA-seq 数据集证实了哺乳动物中 CEA 和 IA 亚核在细胞类型水平上的保守性。值得注意的是,IA 亚核高度保守,并且本项研究数据集中的所有哺乳动物都包含两种类型的TSHZ1+神经元,它们在物种之间一对一匹配(图3d)。
IA 衍生的抑制性神经元高度表达DRD1,并受到多巴胺能传入神经的密集支配,提供 BLA 和 CEA 的前馈抑制。有趣的是,在本项研究的数据集中,只有一种类型的TSHZ1聚类高度表达DRD1,这在物种间是一致的(图3f)。因此,他们推测IA中存在两种类型的神经元,即Tshz1+ Drd1+和Tshz1+ Drd1−神经元。Tshz1+ Drd1−神经元主要分布在IA主岛,Tshz1+ Drd1+神经元主要分布在内膜内侧囊旁岛(图3g-h)。总体而言,mFISH 结果显示小鼠中有两种 IA 细胞类型,一种表达Drd1,另一种不表达,这在哺乳动物中可能非常保守。
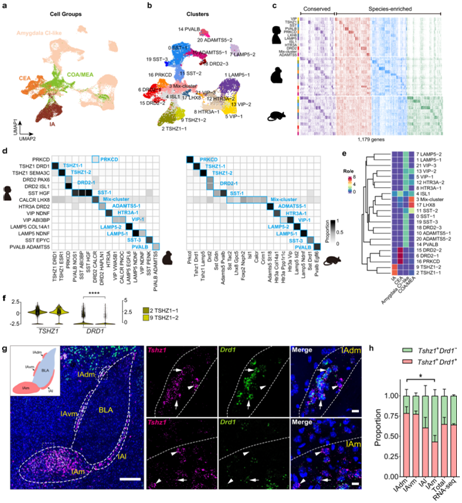
图3. 哺乳动物抑制性神经元的同源性。
(a-b) 来自人类、猕猴和小鼠 snRNA-seq 数据集(使用 Seurat)的集成抑制神经元的 UMAP 可视化。(c) 热图显示保守(171 个基因)和物种丰富(1008 个基因)DEG 的表达。 (d) 综合数据集中人类和猕猴聚类之间或人类和小鼠聚类之间细胞核重叠的比例。 (e) 树状图显示基于高度可变基因 (HVG) 平均表达的抑制性神经元细胞类型的层次聚类。 (f) 小提琴图显示TSHZ1-1和TSHZ1-2聚类中选定基因的表达。(g) IA标记基因Tshz1和的mFISH分析小鼠杏仁核中的Drd1 。(h) Tshz1+的比例+ Drd1 +和Tshz1 + Drd1- IA 和小鼠 snRNA-seq 数据集中不同部分的神经元。
04
哺乳动物 BLA 兴奋性神经元的共同和独特特征
BLA 是杏仁核中最大的亚核,包含最兴奋的神经元,并广泛连接到皮质和皮质下区域,尤其是初级感觉区域。因此,BLA是接收信息输入并将解码信息传输到杏仁核或其他下游大脑区域的输出亚核。从进化角度来看,BLA 与其他亚核相比的相对增大表明它可能经历了最显著的进化变化。为了评估 BLA 同源性,他们整合了哺乳动物 BLA 衍生的兴奋性神经元,并鉴定了 14 种跨物种细胞类型(图4a-b)。BLA 兴奋性神经元表现出比抑制性神经元更高的种间异质性(图 4c)。
尽管物种之间存在差异,但在 BLA 兴奋性神经元中也发现了同源的主要细胞类型。MetaNeighbor 分析和集成数据集中聚类之间重叠核的比例表明 SATB2、HGF 和 VGLL3 神经元细胞类型在哺乳动物中高度保守(图 4d)。其中,VGLL3细胞是最保守的BLA兴奋性神经元,在每个物种中至少发现一种相应的细胞类型(图4d)。
与抑制性神经元富集的保守亚核相比,他们在BLA 兴奋性神经元数据集中观察到广泛的进化差异。LAMP5 +和SATB2 +兴奋性神经元在人类 BLA 中更加富集(图4e-f)。有趣的是,LAMP5+和SATB2+兴奋性神经元显示外侧和背侧大脑皮层标记物EMX1的高表达,但不显示腹侧大脑皮层标记物LHX9的高表达(图4g)。
为了确认杏仁核中LAMP5+ 和SATB2+ 兴奋性神经元的存在和空间分布,他们进行了 mFISH 分析。结果表明,大量SATB2+ 神经元驻留在人类 BLA 的 LA 部分,但在小鼠 LA 中观察到很少的Satb2+ 神经元(图4h-i),表明 SATB2-2神经元主要来源于人类(图4f)。另一方面,LAMP5+ 兴奋性神经元(SCL17A7+) 广泛分布在人和小鼠的 BLA 中,包括 LA、BA 和 BM 亚区。然而,在人类中,表达LAMP5的兴奋性神经元的比例在 LA 中较高,但在 BA 和 BM 中相似(图4j-k)。由于人类细胞在这些整合细胞类型中占主导地位,其中许多基因在人类细胞中高度特异性表达。有趣的是,许多与这两个神经元聚类相关的模式基因与精神疾病有关(图41)。
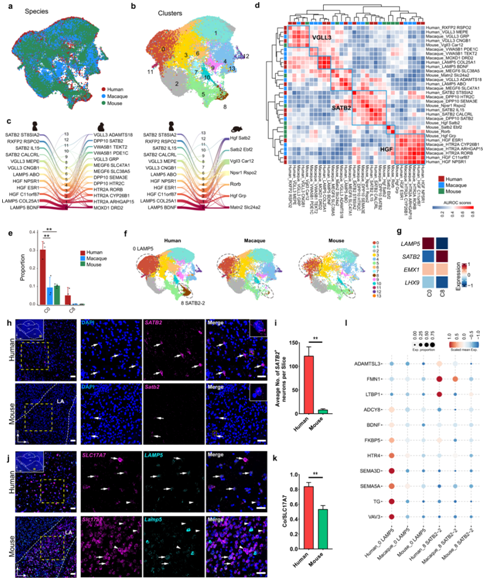
图4.哺乳动物 BLA 兴奋性神经元的共有和独特特征。
(a-b) 整合BLA兴奋性神经元数据集的UMAP的可视化。(c) 显示整合细胞类型起源的河流图。(d) 热图显示了三种哺乳动物BLA兴奋性神经元细胞类型的AUROC评分。(e) 选定细胞类型中细胞核的相对比例。(f) UMAP 集成了 BLA 兴奋性神经元数据集。(g) 热图显示了 C0 (LAMP5) 和 C8 (SATB2-2) 聚类中基因的表达。(h) 人和小鼠 LA 中SATB2基因的 mFISH 分析。(i) 人类和小鼠 LA 中SATB2 +细胞的定量。 (j) 对人类和小鼠 LA 中的SLC17A7和LAMP5基因进行 mFISH 分析。(k) 人和小鼠LA中SLC17A7和LAMP5双阳性细胞占SLC17A7阳性细胞总数的比例。 (l) 气泡图显示与精神疾病相关的基因在人类优势细胞类型LAMP5和SATB2-2中高表达。
05
鸡杏仁核细胞类型的多样性和进化
最近的研究表明,所有蜥脚类动物中都存在背室脊 (DVR) 的尾部,以及周围的皮质下区域是哺乳动物杏仁核的同源对应物。为了在单细胞水平上表征蜥蜴类杏仁核同源物并比较进化保守性和与哺乳动物杏仁核的分歧,他们解剖了鸡尾部DVR [包括arcopalium (APall)和尾部nidopallium(NPall)]和扩展杏仁核(EA)以获取snRNA -seq(图5a)。在鸡杏仁核同系物中定义了 7 个类别和 46 种细胞类型(图5b-c)。层次聚类揭示了跨物种细胞类别的普遍保守性(图5d)。然后他们进行了跨物种表达相关性分析,发现哺乳动物之间的表达比哺乳动物和鸡之间的表达更加一致(图5e),强调了动物类别之间的差异。另一方面,鸡细胞类型与小鼠的相似性高于与人类和猕猴的相似性(图5f)。
他们还根据转录组相似性探索了鸡细胞类型可能的亚核起源。应用Seurat和SingleR方法,显示出对抑制性神经元的亚核起源预测一致,但对兴奋性神经元的预测相对不同(图5g)。值得注意的是,假设的 CEA 和 IA 鸡细胞类型表达与小鼠相似的标记基因。例如,DRD2和PRKCD在预测的CEA细胞中高表达,TSHZ1在预测的IA细胞中高表达。此外,LHX8 CALCR聚类可能起源于鸡杏仁核的MEA(图5c-g)。这些结果强烈表明,抑制性神经元富集的亚核在羊膜动物中高度保守。mFISH分析结果显示,EA区域存在大量PRKCD + DRD2 +和PRKCD + DRD2 -神经元,与本项研究的snRNA-seq数据中的表达模式一致(图5h)。
本项研究的结果证实,EA 至少在单细胞水平上是 CEA 的一部分,并且包含与哺乳动物具有相似基因表达模式的细胞类型。然而,PRKCD+神经元不仅位于 EA 中,而且广泛分布于 APall 和 NPall 中(图5h)。
鸡的杏仁核中含有更多的 LGE 衍生神经元,而哺乳动物则在杏仁核中含有更多的 MGE/CGE 衍生神经元(图 5i-j)。基于上述观察,他们假设由于 LGE 衍生的中间神经元的广泛分布,鸡的杏仁核亚核特化可能是不完整的。另一方面,哺乳动物中MGE/CGE衍生神经元的急剧增加可能是杏仁核亚核特化的驱动力,在进化过程中取代了大脑皮层杏仁核中LGE衍生神经元的功能(图5k)。尽管PRKCD和DRD2神经元在哺乳动物和鸡之间的分布不同,但他们发现鸡PRKCD和DRD2神经元还表达相应哺乳动物聚类中保守的大多数基因(图3c),这表明PRKCD和DRD2神经元在基因表达水平上非常保守,即使在鸡等远亲物种中也是如此。
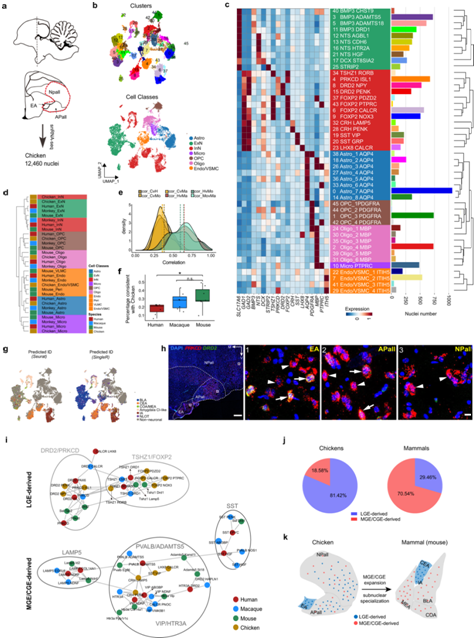
图5. LGE 衍生的抑制性神经元在鸡大脑皮层杏仁核中的广泛分布。
(a) snRNA-seq 的工作流程。 (b) 鸡数据集的 UMAP 可视化。(c) 基于 HVG 聚类表达中值的 23 个神经元聚类和 23 个非神经元聚类的分类。(d) 对不同物种的细胞类别进行无监督层次聚类。 (e) 密度直方图显示物种对间HVG的Pearson相关分布。(f) 箱形图显示人类、猕猴和小鼠细胞类别中DEG的百分比与鸡的模式一致。(g) 鸡数据集的 UMAP 可视化,细胞核根据 Seurat 和 SingleR 方法预测的细胞组 ID 进行着色。(h) CEA 标记基因PRKCD和DRD2的 mFISH 分析在鸡杏仁核中。(i) 来自四个物种的抑制性神经元的网络图。(j) 鸡和哺乳动物中源自 LGE 或 MGE/CGE 的细胞核百分比。(k) 进化过程中MGE/CGE扩展和亚核特化模型示意图。
+ + + + + + + + + + +
结 论
本项研究生成了人类、猕猴、小鼠和鸡杏仁核中超过 200000 个细胞的snRNA-seq 数据。在所有数据集中都鉴定出了来自不同杏仁核亚核的丰富神经元细胞类型。跨物种分析表明,杏仁核的抑制性神经元和富含抑制性神经元的亚核在细胞组成和标记基因表达方面非常保守,而富含兴奋性神经元的亚核则相对不同。此外,LAMP5+中间神经元在灵长类动物中更为富集,而DRD2 +抑制性神经元和LAMP5 + SATB2 +兴奋性神经元分别在人中央杏仁核 (CEA) 和基底外侧杏仁复合体 (BLA) 中占主导地位。本项研究鉴定了鸡中的 CEA 样神经元及其物种特异性分布模式。这项研究强调了杏仁核中极端的细胞类型多样性,并揭示了跨物种细胞类型和基因表达模式的保守性和差异性,这可能有助于物种特异性的适应。
+ + + + +



 English
English


