文献解读|Proteomics(5.393):COVID - 19患者血清乳酸脱氢酶升高的蛋白质组学和代谢组学研究
✦ +
+
论文ID
原名:Proteomic and metabolomic investigation of serum lactate dehydrogenase elevation in COVID-19 patients
译名:COVID - 19患者血清乳酸脱氢酶升高的蛋白质组学和代谢组学研究
期刊:Proteomics
影响因子:5.393
发表时间:2021.5.13
DOI号:10.1002/pmic.202100002
背 景
COVID-19是由严重急性呼吸道综合征冠状病毒2(SARS-CoV-2)引起的一场全球流行性传染病。目前,人们已将多个分子作为COVID-19的预后指标,以此更好地诊断COVID-19并监测疾病的进展。乳酸脱氢酶(LDH)是一种细胞内酶,催化丙酮酸发酵并促进糖酵解。LDH在细胞死亡后释放到血液中,据报道,在包括严重急性呼吸综合征(SARS)、糖尿病和癌症在内的多种疾病中LDH增加。研究发现, LDH在COVID-19患者血清中高表达,尤其是在重症和危重患者中。然而,LDH与COVID-19疾病进展相关的分子机制仍知之甚少,大多数研究认为血清LDH升高是由于病毒攻击或炎症引起体组织和器官的损伤,从而释放LDH,但这些临床假设缺乏分子证据。本研究系统地探索了不同水平LDH的COVID-19患者血清的蛋白质组和代谢物组,并确定了特异性宿主反应,这有助于阐明COVID-19的发病机制。
实验设计
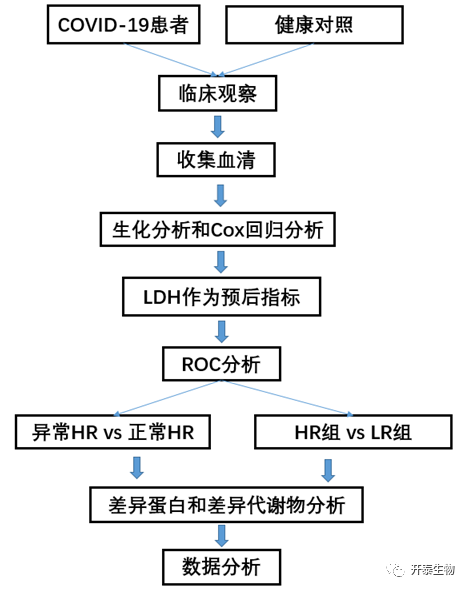
结 果
01

COVID-19患者临床和实验室特征
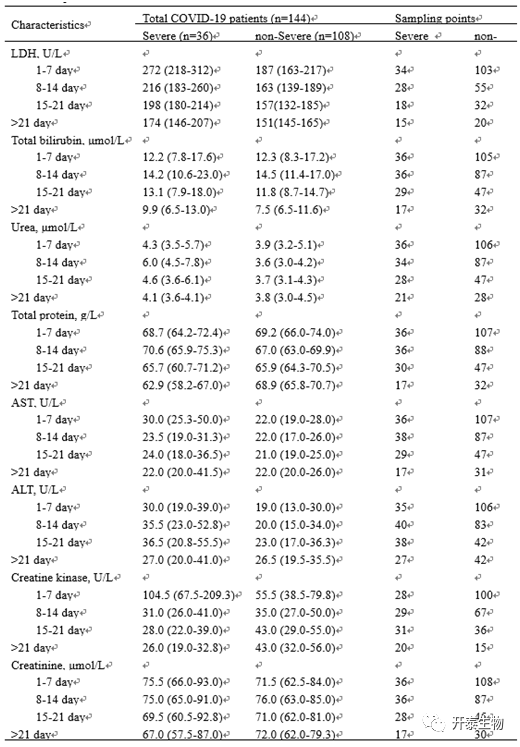
144名COVID-19患者的临床数据和实验室特征见表1。患者平均年龄47岁,男性占53.5%。重症患者占25%(36/144),重症患者平均年龄比非重症患者大10岁,且入院时更可能出现发热症状。重症患者接受吸氧、抗生素、糖皮质激素和静脉注射γ免疫球蛋白治疗的比例高于非重症患者。
根据实验室检查结果,重度患者血清LDH水平高于正常值上限的百分比显著高于非重度患者(58.3% vs 7.4%)。同样,病情越严重的患者,血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、尿素、肌酐和肌酸激酶(CK)的水平也越高。以7天为一次间隔,比较了它们的时间变化(表2)。重症患者血清LDH、CK、肌酐持续下降,非重症患者仅血清LDH持续下降。采用Cox回归模型评价这些指标的预后价值,结果表明,LDH是多变量分析中唯一具有区分能力的指标,表明血清LDH可能是有用的预后生物标志物。
表1 COVID-19患者的临床数据和实验室指标

表2 重症和非重症COVID - 19患者临床实验室检查结果的动态变化
02

COVID-19患者血清LDH的时间特征
作者评估了年龄和性别对血清LDH表达的影响。大于60岁的COVID-19患者显示出较高的血清LDH表达 (图1A),这可能是由于老龄和潜在的疾病导致。在最初住院阶段 (一周内),男性患者血清LDH水平高于女性 (图1 B)。3周后,COVID-19患者和健康对照组的血清LDH水平相当(平均值:60岁以上177 U/L,60岁以下152 U/L;男性154 U/L,女性158.5 U/L)。
作者比较了住院初期(住院后1-3天)和出院前1-3天的重症和非重症患者血清LDH水平,结果发现重症患者血清LDH水平显著升高,尤其是住院初期(图1 C)。此外,在住院的32例患者中(重症22例,非重度11例),重症患者血清中LDH-2、LDH-4和LDH-5水平显著高于非重症患者,而LDH-1和LDH-3差异不显著(图1D)。LDH-4和LDH-5主要有助于低氧条件下的丙酮酸发酵,而LDH-1有利于可逆反应的反向进行。这表明重症患者存在无氧糖酵解代谢。
为了更好的理解血清LDH水平随时间的动态变化,作者以3天为一次间隔,检测了从住院第1天到第21天的血清LDH 水平(图1E)。对于非重症患者组而言,在入院时血清LDH水平略高,但在住院期间缓慢下降。随着治疗时间延长,重症患者血清LDH水平从第3天到第9天显著下降,到第21天时降至非重症患者的初始水平。
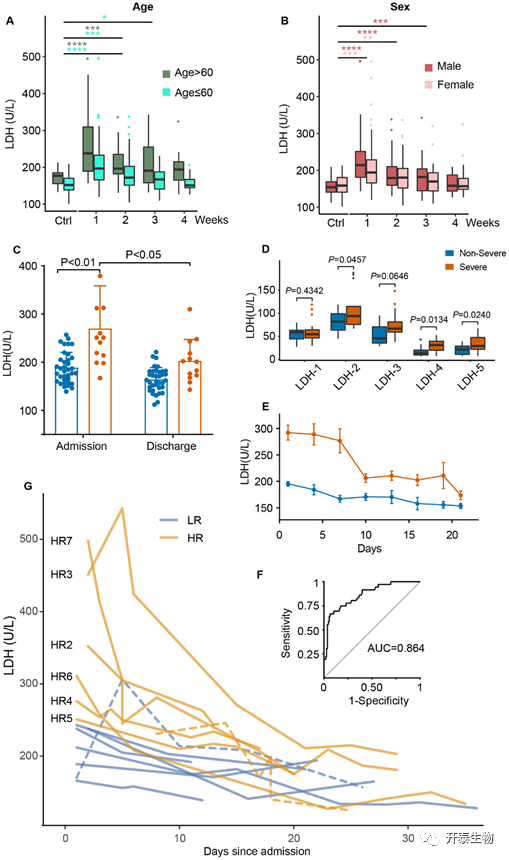
图1 血清LDH表达水平
03

基于血清LDH水平的低风险和高风险患者分类
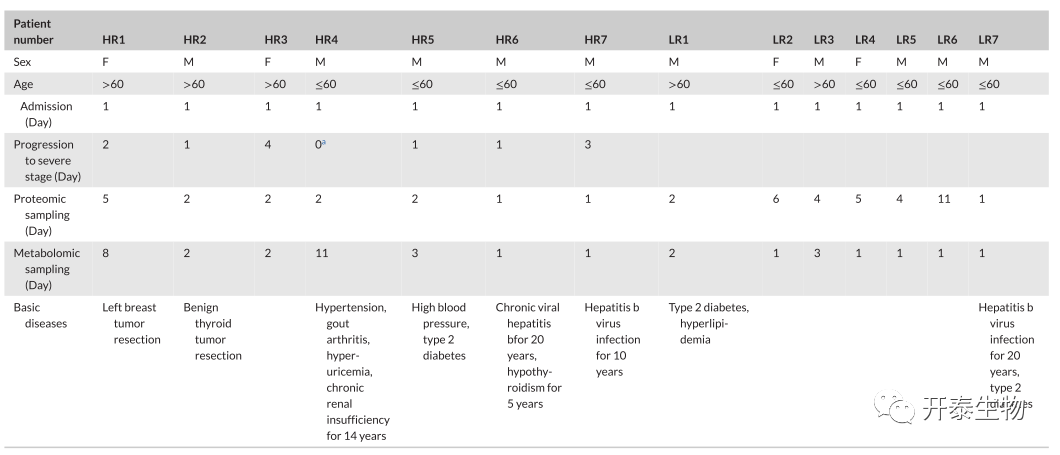
将患者的严重程度(重症vs非重症)作为二分变量,对血清LDH水平进行ROC分析。曲线下面积 ( AUC ) 为0.864 (图1F ),证实了血清LDH的诊断效能。最大约登指数对应的血清LDH水平为247 U/L,而已有的研究报道血清LDH异常的阈值为 240~253.2 U/L。基于以上数据,将14名患者分为2组,低风险组(LR)包含7例患者,自住院以来血清LDH含量低于247 U/L;高风险(HR)组也包含7例患者,其中6例为入院时血清LDH水平高于247 U/L的重症患者,1例为住院期间血清LDH水平低于阈值的重症患者。
由于所有患者的血清LDH水平均以相对较高的水平开始并随时间下降,我们将其归因于首次采样时间点相对较晚(第8天)。患者HR 3和患者HR 7在住院时具有异常高的血清LDH水平(大于450 U/L),但在10天内急剧下降(图1G)。我们检查了14例患者的详细病历(表3)。合并高血压、慢性HBV感染和糖尿病的COVID-19患者在HR组中倾向于发展为重症患者。
表3 时间变化相关的重症患者病历资料
04

定量蛋白质组学和代谢组学揭示与血清LDH升高相关的异常调节分子
在LR组和HR组间一共鉴定到34个差异表达蛋白(DEPs)。与LR组相比,HR组中26个蛋白显著上调,8个蛋白显著下调(图2A)。这些DEPs显著富集到免疫相关通路,如急性炎症应答,血小板脱粒和补体级联调节(图2A)。数据显示HR组中急性期蛋白(SAA1、ORM1、AGT和SERPINA3)、补体亚基(C9、C6和CFI)和LDH亚型(LDHA和LDHB)表达上调(图2B)。将差异蛋白绘制成互作网络,促炎细胞因子IL-6位于网络中心,其被认为是COVID-19的风险因素,临床数据表明IL-6与血清LDH水平呈正相关(图2C)。此外,IL-6可激活TP53,促进细胞凋亡,并提高血液中LDHA的含量。
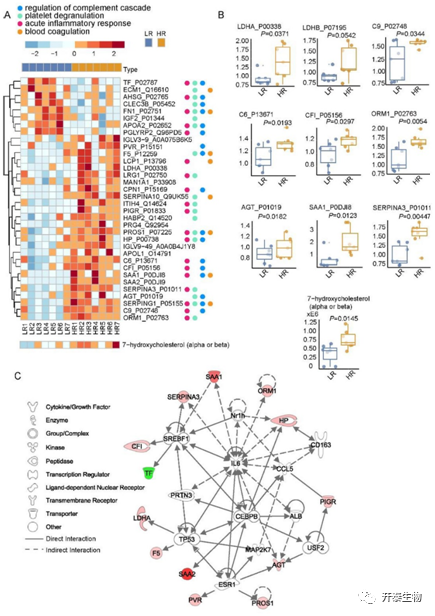
图2 低、高风险患者之间的分子差异
图3列出的34种差异表达代谢物中,和LR相比,HR组中有30种上调,52.9%的代谢物为脂质。其中,7-羟基胆固醇(β)介导氧化应激并诱导细胞凋亡(图3A和图3B),研究表明其在乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)感染期间升高。蛋白质-代谢物联合网络(图3B)提出了两种上游分子来调节LDHA表达,包括介导缺氧和炎症微环境的缺氧诱导因子1(HIF1)和涉及COVID-19肺纤维化的纤维连接蛋白1(FN1)。

图3 低、高风险患者血清差异表达代谢物分析
05

血清LDH异常升高患者的蛋白质和代谢物变化
作者分析了入院时血清LDH水平异常高的2例患者(HR3和HR7,定义为异常HR组),并将其与其他正常HR患者进行差异蛋白分析(图4A)。结果发现,包括LDHA和LDHB在内的38种蛋白质差异表达(图4A)。对于异常HR组中的特征蛋白,数据显示包括5个上调的蛋白酶体亚基蛋白,即PSMA 3、PSMA 4、PSMA 5、PSMB 1和PSMB 3在异常HR组升高(图4B),这可能是由于器官/组织损伤导致的细胞凋亡。对于异常HR组中的其他上调蛋白(图4B),CES1是一种肝脏蛋白,其在血液中的释放提示肝损伤;P4HB在缺氧时升高;GAPDH可通过在缺氧中激活NF-κB诱导增强HIF活性,这有助于热休克蛋白90-α(HSP90AA1)上调,与Hif 1 α形成蛋白复合物;DPP 4为感染易感性的潜在标志物,抑制DPP 4可降低COVID-19患者的严重程度。CPB2在异常HR组中下调,它是一种碱性羧肽酶,可抑制补体系统介导的炎症。此外,在异常HR组中,6个免疫球蛋白残基(IGHV343、IGHV3 - 30 - 5、IGKV1 - 5、IGLV1 - 36、IGKV1 - 17和IGKV2 - 24)表达上调(图5A)。代谢组分析表明,异常HR组中84.6%的失调代谢物为脂质(图5B),表明脂质代谢紊乱伴随着血清LDH变化。网络分析(图5C)进一步表明LDH升高与HSP90AA1和蛋白酶体相关。
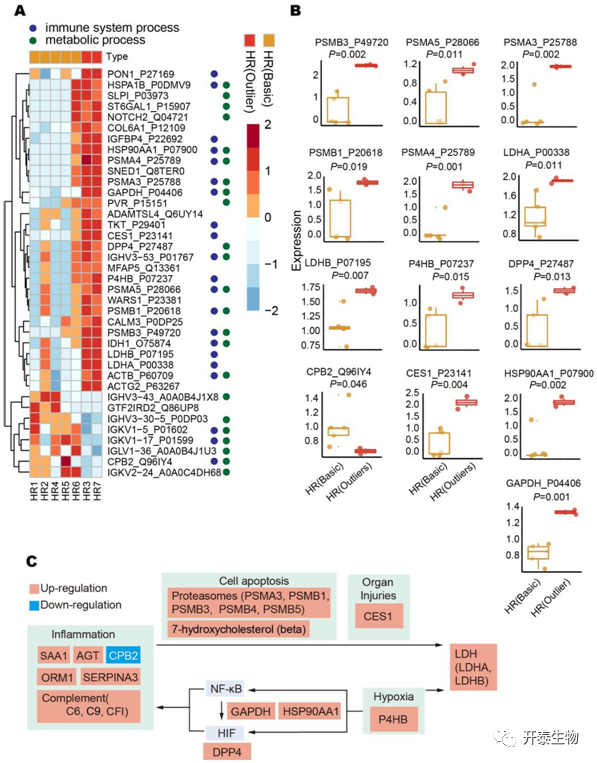
图4 异常HR和正常HR组之间的蛋白差异
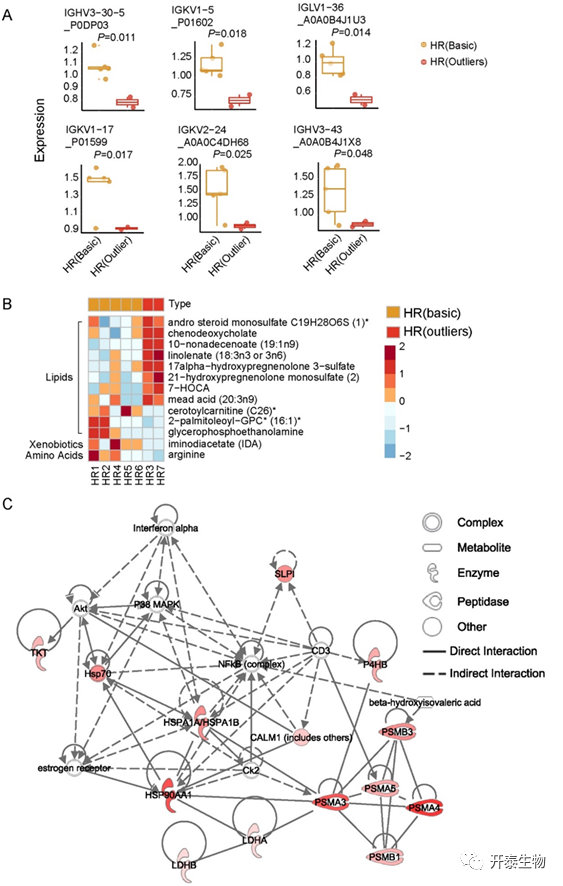
图5 异常HR和正常HR组之间的代谢物差异
06

血清LDH升高可能是由组织损伤和缺氧造成
作者最后总结了COVID-19患者血清LDH升高的调节模式(图3C)。一方面,由宿主免疫系统引发的炎症过程诱导受感染细胞的凋亡,导致细胞内LDH释放到血液中。在HR病例中,这些免疫活性导致过度的炎症反应(如“细胞因子风暴”),诱发多个器官/组织损伤,从而释放LDH;另一方面,研究表明严重COVID-19患者会发生缺氧反应,通过糖酵解积累乳酸。LDH可通过丙酮酸发酵和一系列代谢调节来平衡乳酸分泌,以维持细胞内稳态。此外,在缺氧条件下激活的NFκB和HIF通路也可诱导炎症反应。
+ + + + + + + + + + +
结 论
本研究使用蛋白组和代谢组学分析,从血清LDH水平差异的COVID-19患者中筛选出来一系列与免疫和缺氧相关的蛋白和代谢物,结果表明血清LDH水平与COVID-19严重程度相关,且血清LDH升高可能是由于炎症相关的组织损伤和缺氧相关的代谢异常造成。研究结果将有助于进一步理解COVID-19的发病机制以及优化诊断、治疗和预后方案。
+ + + + +



 English
English

