文献解读|Cells(6.600):分化相关基因建立预后模型用于评估肝细胞癌患者的预后和免疫治疗效果
论文ID
原名:A Differentiation-Related Gene Prognostic Index Contributes to Prognosis and Immunotherapy Evaluation in Patients with Hepatocellular Carcinoma
译名:分化相关基因建立预后模型用于评估肝细胞癌患者的预后和免疫治疗效果
期刊:Cells
IF:6.600
发表时间:2022.07.28
DOI:10.3390/cells11152302
背景
肝细胞癌(Hepatocellular carcinoma,HCC)是世界上最常见的恶性肿瘤之一,目前对于早期肝癌患者最有效的治疗方法是手术切除,但HCC患者术后5年复发率仍高达50-70%,整体预后较差。但是,随着肿瘤免疫治疗出现在大众视野中,以免疫检查点抑制剂(immune checkpoint inhibitor,ICI)疗法为代表的治疗方式给肝癌患者带来了新的希望。在索拉非尼不耐受或未接受索拉非尼治疗的晚期HCC患者中,ICI可在一定程度上延长总生存期。另有证据表明,使用ICI治疗的HCC患者客观缓解率可以达到17-20%。但是,由于肿瘤组织免疫微环境的复杂性和多样性,免疫治疗或联合免疫治疗并非适用于所有患者。因此,了解HCC免疫微环境特征,判断HCC患者是否从ICI治疗中获益,都是HCC治疗中需要解决的关键问题。
单细胞RNA测序(single cell RNA sequencing,scRNA-seq)可以深度揭示细胞的复杂功能和机制,并且通过分析细胞分化轨迹来获得细胞间的差异。本文基于对scRNA-seq中细胞分化轨迹的分析,确定HCC不同组织亚型并做细致描述其特征。同时,利用加权基因共表达网络分析(Weighted Gene Co-Expression Network Analysis ,WGCNA)从癌症数据库(TCGA)的多细胞测序数据,寻找与细胞分化相关的“枢纽”基因,构建分化相关基因预后指数和列线图,预测 HCC患者的免疫治疗后的反应。本文通过结合已有单细胞和多细胞测序,找到能够预测HCC患者对ICI治疗反应的生物标志,表明分化相关基因预后评分(differentiation-related gene prognostic index,DRGPI)可能是一种有前途的预后生物标志物。
实验设计

结果
01

scRNA-Seq预处理并做拟时序分析
对GSE146115单细胞测序数据集进行标准流程质控制(过滤线粒体表达基因≥5%的细胞,过滤基因数<100的细胞,过滤测序数<50的细胞),从4个HCC患者的样本中获得3200个细胞可以用于后续分化相关基因的分析。对基因进行注释和差异分析,共获得18354个差异基因,筛选出细胞间差异最大的1500个基因用于后续讨论(图1)。

(图1:展示了18354个基因和1500个高度可变基因)
主成分分析显示不同患者细胞之间无显著差异(图2),因此选取所有患者前14个差异显著的主成分进行进一步分析。使用t-SNE将3200个细胞分为13个细胞簇,计算细胞簇之间的差异表基因,筛选出3883个表达差异显著的标记基因。其中Cluster0、Cluster1、Cluster2、Cluster3、Cluster4、Cluster8、Cluster11、Cluster12、Cluster13为肝细胞癌细胞;Cluster5为巨噬细胞;Cluster13组为NK细胞;Cluster6、Cluster7、Cluster9为t细胞(图2)。对不同细胞簇进行拟时序分析,将细胞分为7个亚群,II、IV、V、VI、VII亚群主要由HCC肿瘤细胞组成;III亚群主要由巨噬细胞和NK细胞组成;I亚群主要由T细胞组成,详见图2。
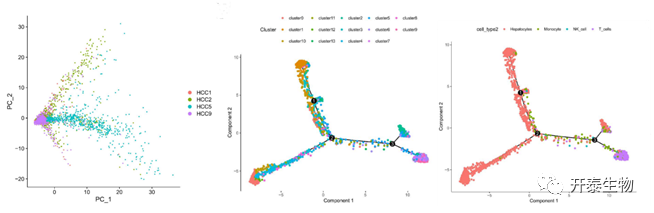
(图2:主成分分析显示不同患者之间差异;拟时序分析按细胞簇分组;拟时序分析按亚型分组)
02

根据肝癌分化相关基因(HCC Differentiation-Related Gene,HDRG)给HCC患者分型并分析不同分型差异
对ICGC队列的HCC患者基于HDRG进行聚类分析,根据参数判断最佳聚类数为4。根据4种分型进行生存分析,发现基于HDRG分出的亚型在具有不同的预后结局(见图3),其中I亚型(C1)患者的预后最好,IV亚型(C4)的预后最差。

(图3:ICGC队列4种亚型的生存分析)
通过CIBERSORT计算ICGC队列每个HCC组织中22种免疫细胞的比例,C1亚型中CD8+ T细胞和M1巨噬细胞,单核细胞比例较高,在C4亚型中M0巨噬细胞和活化NK 比例较高。然后,计算所有样本的免疫评分、基质评分和ESTIMATE评分,根据计算发现 C1、C2、C3和C4亚型的中免疫评分较高者同时有较高的基质评分和ESTIMATE评分,并伴有更低的肿瘤纯度。差异表达分析显示4种分子亚型的33个免疫检查点相关基因有显着差异,其中CD40LG、CD274、IL12B、PDCD1LG2、CD8A和PTPRC的高表达与更好的预后相关。IL12A和YTHDF1的高表达提示可能存在较差的预后。
03

基于DRGPI的预后风险模型的构建、评估和验证
计算GEO和TCGA数据集中交集基因并且筛选其中的分化相关基因,共获得553个与HCC分化相关的差异表达基因。同时,WGCNA分析产生5个模块,其中3个模块中158个差异表达的HDRG与HCC的病理分级显着相关。生存分析证实25个分化相关枢纽基因的表达与HCC患者的预后密切相。采用单变量Cox回归分析、Lasso回归分析、多变量 Cox 回归分析最终构建了包含5个预测基因(PON1、ADH4、SQSTM1、HSP90AA1 和 STMN1)的预后指数(表 1)。
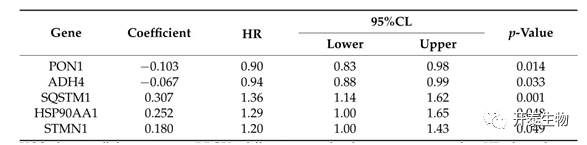
(表1:多变量 Cox 比例风险回归模型)
将TCGA数据库作为训练集,以中位数分为高低得分组,低得分组的患者有更好的预后,并且在验证数据集ICGC中呈现了一致的结果。此外,ROC 分析表明,训练数据集和验证数据集1年、3年和4 年的预测AUC曲线下面积均大于0.65。
为了进一步确定DRGPI在13个簇中的基因表达,我们发现PON1在Cluster10中上调,ADH4在Cluster11中上调,SQSTM1在Cluster4中上调,HSP90AA1和STNM1在Cluster5中上调。
04

模型中关键基因验证与模型效率评估
收集10例HCC患者肝癌组织和癌旁配对组织,提取RNA后使用RT-qPCR检测5种基因表达水平。结果显示STMN1、SQSTM1和HSP90AA1在肿瘤组织中上调, ADH4和PON1在肿瘤组织中下调。这些结果与TCGA数据库结果具有一致性。
单变量Cox回归分析显示,肿瘤分期、DRGPI评分与HCC患者的预后显着相关。多变量Cox回归分析证实,DRGPI评分是一个独立的预后因素。分别使用TCGA和ICGC队列中的5个指标构建了列线图来预测患者在1年、3年、5年生存状态。
05

DRGPI分组的分子特征与免疫特征
GSEA分析表明, DRGPI高得分组富集了细胞增殖和分化相关的通路;DRGPI低得分组富集了免疫反应和细胞凋亡抑制相关的途径(图5)。基因突变分析显示(图6),DRGPI高得分组的突变数量高,最常见的突变类型为错义突变,其次是无意义缺失。无论在那个分组突变率最高的前4个基因相同,分别为TP53、CTNNB1、TTN和MUC16,4个基因的突变率均超过15%。DRGPI高得分组中MUC4和FAT3的突变更常见,DRGPI低得分组中ALB突变更为常见。此外, DRGPI评分与PD-L1表达正相关,与但与肿瘤突变负荷无关。
采用Wilcoxon检验比较不同DRGPI亚组免疫细胞分布,发现DRGPI高得分组中M0巨噬细胞更丰富,肿瘤转移和免疫逃逸发现信号也更高;低DRGPI亚组中静息记忆性CD4+T细胞和CD8 T细胞更丰富,干扰素反应性的肥大细胞、NK细胞也较多。基于肿瘤和间质免疫情况,分类四种免疫亚型:伤口愈合(免疫 C1)、炎症(免疫 C3)、TL 淋巴细胞耗竭(免疫 C4)和 IFN-γ 显性(免疫 C2) , 并发现四种免疫亚型在 DRGPI 亚组之间存在显着差异。

(图5:高得分组GSEA富集分析;低得分组GSEA富集分析)

(图6:高得分组基因突变分析;低得分组基因突变分析)
06

ICI 治疗在不同基于 DRGPI 的风险亚组中的益处
我们的研究发现,DRGPI低得分组的TIDE评分较低,这表明低DRGPI评分患者以从 ICI治疗中获益更多、预后更好。同时,DRGPI低得分组具有较高的微卫星不稳定性评分,较低的T细胞排斥评分。ROC分析证明,DRGPI评分在ICI免疫治疗反应中的预后价值,高于TIDE和TIS。
+ + + + + + + + + + +
结论
随着对肿瘤免疫微环境的认识,以ICIs或新辅助疗法为代表的免疫疗法在多种肿瘤中均显示出良好的治疗效果,并在肿瘤免疫治疗领域具有广阔的前景。然而,肿瘤免疫微环境的异质性等诸多因素限制了HCC的治疗效果,疗效远未达到我们的预期。随着单细胞测序技术的发展,为探索肿瘤组织微环境特征、研究瘤内细胞分化状态、分析不同细胞差异基因等方面带来技术突破。本文基于HCC的scRNA-seq数据,通过细胞分化轨迹筛选影响HCC免疫微环境异质性的分化相关基因。并通过Cox回归分析构建了包含5个基因(PON1、ADH4、SQSTM1、HSP90AA1和STMN1)的预测模型。在单细胞和多细胞数据支持下,在测试集和验证集中均取得较好结果,并且进一步设计验证实验证明候选基因的有效性。
DRGPI评分是一种与HCC细胞分化轨迹相关的有预后生物标志物。DRGPI 亚型分型可能有助于识别HCC患者的免疫微环境和分子特征,并预测 ICI 治疗是否有益。DRGPI评分有望成为筛选ICI治疗患者的潜在方式。
+ + + + +



 English
English

