文献解读|J Nanobiotechnology(9.429)仿生型GBM靶向给药系统促进细胞铁死亡用于原位耐药GBM的免疫治疗
✦ +
+
论文ID
原名:Biomimetic GBM‑targeted drug delivery system boosting ferroptosis for immunotherapy of orthotopic drug‑resistant GBM
译名:生物仿生型脑胶质瘤靶向给药系统促进细胞铁死亡用于原位耐药脑胶质瘤的免疫治疗
期刊:Journal of Nanobiotechnology
影响因子:9.429
发表时间:2022.3.27
DOI号:10.1186/s12951-022-01360-6
背 景
临床研究显示,胶质母细胞瘤(GBM)的免疫原性较低,PD-1/PD-L1抑制剂对GBM的疗效远低于预期。现有研究发现,癌细胞铁死亡可诱导树突状细胞(DC细胞)成熟,增加T细胞活性,激活的T细胞释放IFN-γ,继而诱导癌细胞的铁死亡。鉴
该文章提出一种仿生型的GBM靶向给药系统(Fe3O4-siPD-L1@M-BV2),该药物递送系统使用二硫键连接硫代siPD-L1和硫代Fe3O4纳米颗粒,以增加siPD-L1在血液循环中的稳定性。纳米Fe3O4与siPD-L1 (Fe3O4-siPD-L1)使用微胶质膜(M-BV2)形成仿生脑肿瘤靶向纳米颗粒Fe3O4-siPD-L1@M-BV2。该纳米颗粒被原位耐药GBM细胞吸收后,其中二硫键被肿瘤细胞内的还原性谷胱甘肽破坏,从而释放siPD-L1,抑制PD-L1蛋白表达,激活效应T细胞增强对肿瘤细胞的杀伤能力;同时释放的Fe2+能诱导脑胶质瘤细胞铁死亡,通过刺激DC细胞成熟而激活效应T细胞分泌大量IFN-γ,因而反过来促进脑胶质瘤细胞铁死亡。这种肿瘤细胞铁死亡和免疫细胞激活的级联放大效应能显著抑制小鼠原位耐药脑胶质瘤的生长,而延长其生存期。
实验设计

结 果
01

仿生型纳米颗粒的表征
首先,作者对该纳米颗粒进行表征,通过琼脂糖凝胶电泳实验来优化siPD-L1与Fe3O4的质量比,结果显示当二者比例为1:15时,siPD-L1与Fe3O4能完全连接;通过元素映射分析了该纳米颗粒中含有O、Fe、S、N、P元素,表明siPD-L1与Fe3O4成功连接。接着作者通过透射电镜(TEM)、动态光散射(DLS)、蛋白质免疫印迹(WB)等一系列手段对纳米颗粒进行表征。结果显示了该纳米颗粒球形结构,验证了该纳米颗粒能保护负载物免于核酸酶的降解,并在谷胱甘肽的作用下,以浓度依赖性的方式释放siPD-L1和Fe3O4,如图1所示。
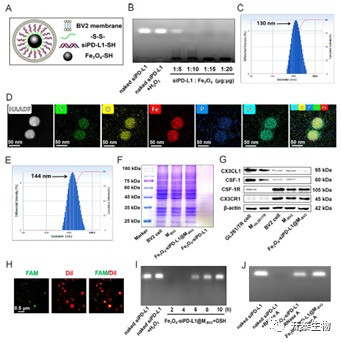
图1 仿生型纳米颗粒的表征
02

仿生型纳米颗粒的细胞摄取
作者分别研究了仿生型纳米颗粒被不同细胞(GL261/TR、HT-22、BV2和RAW264.7)摄取情况。如图2所示,BV2细胞和RAW264.7细胞摄取Fe3O4-FAM比Fe3O4-FAM@M-BV2更多,而GL261/TR细胞比HT-22细胞摄取Fe3O4-FAM@M-BV2更多,这表明M-BV2包裹的纳米颗粒能明显降低BV2细胞和RAW264.7细胞的摄取。为了研究纳米颗粒的摄取机制,作者使用不同摄取抑制剂分别研究,结果显示秋水仙碱能抑制细胞摄取,说明该纳米颗粒主要通过大胞饮的摄取方式;而CX3CR1抗体和CX3CL1抗体也显著降低了Fe3O4-FAM@M-BV2的吸收,说明CX3CR1和CX3CL1参与了Fe3O4-FAM@M-BV2的摄取(图2G)。
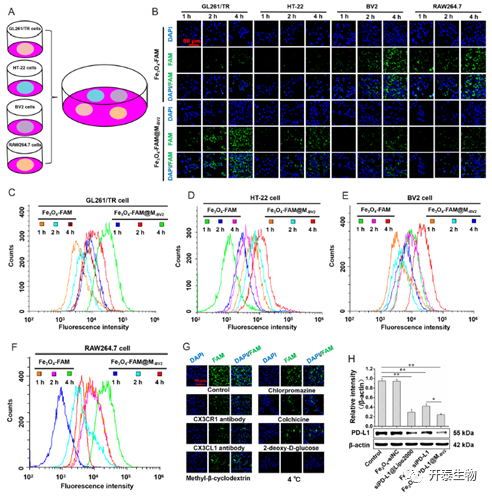
图2 仿生型纳米颗粒的细胞摄取
03

仿生型纳米颗粒体外诱导肿瘤细胞铁死亡
为了证明Fe3O4-siPD-L1@M-BV2诱导肿瘤细胞铁死亡,作者分别通过MTT实验验证纳米颗粒对GL261/TR细胞的细胞活性影响;分别测定纳米颗粒处理后细胞中GSH、ROS、LPD、H2O2的水平,MTT实验显示Fe3O4-siPD-L1和Fe3O4-siPD-L1@M-BV2显著降低GL261/TR细胞活性,且呈浓度依赖性。与 Fe3O4-siPD-L1相比,Fe3O4-siPD-L1@M-BV2对GL261/TR细胞活性的抑制作用更强。在IFN-γ的存在下,Fe3O4-siPD-L1@M-BV2对GL261/TR细胞的细胞毒性显著增强(图3B-C)。然而,在铁死亡抑制剂Fer-1和DFO存在的情况下,Fe3O4-siPD-L1@M-BV2对GL261/TR细胞的细胞毒性明显减弱。Fe3O4-siPD-L1@M-BV2能明显降低细胞中GSH的含量,能显著提高ROS、LPO和H2O2水平(图3D-J)。以上结果均证明纳米颗粒能诱导肿瘤细胞铁死亡。

图3 仿生型纳米颗粒体外诱导肿瘤细胞铁死亡
04

仿生型纳米颗粒体外诱导DC成熟
为了证明纳米颗粒能在体外诱导DC成熟,使用流式细胞仪分别检测了Fe3O4、Fe3O4-siPD-L1、Fe3O4-siPD-L1@M-BV2处理后CD11c+CD80+CD86+DC细胞比例,结果显示Fe3O4-siPD-L1@M-BV2组的细胞比例为68.2%,能显著促进DC细胞体外成熟。当额外添加IFN-γ时,纳米颗粒处理后的CD11c+CD80+CD86+DC细胞比例增加至77.31%,表明IFN-γ能进一步促进Fe3O4-siPD-L1@M-BV2诱导DC细胞成熟。
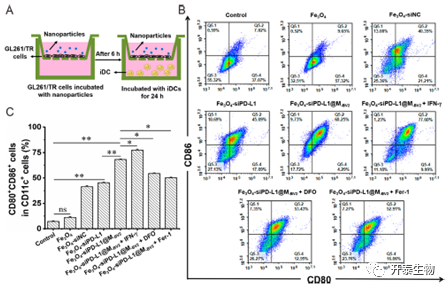
图4 仿生型纳米颗粒体外诱导DC成熟
05

仿生型纳米颗粒体外穿透血脑屏障的能力
为了验证纳米颗粒在体外穿透血脑屏障的能力,文章使用Transwell构建体外血脑屏障模型,与相比Fe3O4-FAM,Fe3O4-siPD-L1@M-BV2体外穿透血脑屏障能力显著升高,并在外加磁场的作用下进一步提高。此外,当受体腔中培养GL261/TR细胞时,Fe3O4-siPD-L1@M-BV2的转运能力比未在受体腔中培养GL261/TR细胞的体外血脑屏障穿透能力显著增加。这表明GL261/TR细胞促进了Fe3O4-siPD-L1@M-BV2的穿透体外血脑屏障。当受体腔中无GL261/TR细胞,但添加了CSF-1和CX3CL1时,也能显著提高了Fe3O4-siPD-L1@M-BV2穿透体外血脑屏障。当在受体腔中加入CSF-1抗体和CX3CL1抗体后,Fe3O4-siPD-L1@M-BV2跨体外血脑屏障显著降低。这说明CSF-1和CX3CL1时,能显著提高了Fe3O4-siPD-L1@M-BV2穿透体外血脑屏障。
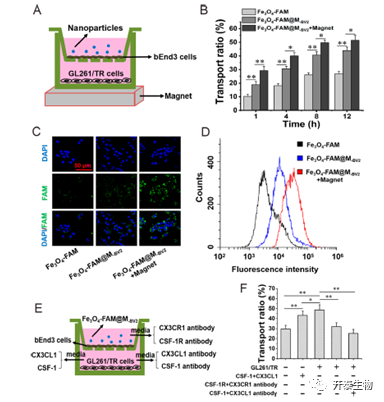
图5 仿生型纳米颗粒体外穿透血脑屏障的能力
最后,作者建立原位耐药脑胶质瘤小鼠模型,分别研究了该纳米颗粒在小鼠中的分布情况、药动学参数及肿瘤治疗效果,结果表明该仿生型纳米颗粒具有优越的肿瘤靶向能力,能实现肿瘤药物靶向递送,有效发挥抗肿瘤效果。
+ + + + + + + + + + +
结 论
Fe3O4-siPD-L1@M-BV2通过小胶质细胞膜与GBM细胞的相互作用主动靶向原位耐药GBM细胞。该纳米颗粒中的siPD-L1通过阻断PD-1/PD-L1信号通路,激活效应T细胞释放IFN-γ,从而促进GBM细胞的铁死亡,进而促进原位耐药GBM肿瘤部位的DC细胞成熟。成熟DC细胞又向T淋巴细胞呈递GBM抗原,进而激活效应T细胞。同时,原位耐药GBM组织中,通过效应T细胞分泌的IFN-γ将M2型小胶质细胞极化为M1型小胶质细胞。最后,肿瘤细胞铁死亡与免疫细胞激活之间形成了良性循环,对原位耐药脑胶质瘤细胞的治疗具有协同作用。
+ + + + +



 English
English

