文献解读|EBioMedicine(8.143):人类少突胶质瘤的免疫学特征定义了两种不同的分子亚型
+ 论文ID 原名:Immunological profiles of human oligodendrogliomas define two distinct molecular subtypes 译名:人类少突胶质瘤的免疫学特征定义了两种不同的分子亚型 期刊:EBioMedicine. 影响因子:8.143 发表时间:2023.01 DOI号:10.1016/j.ebiom.2022.104410.
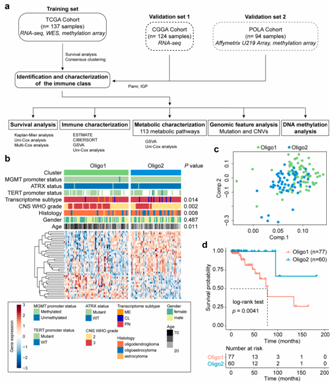
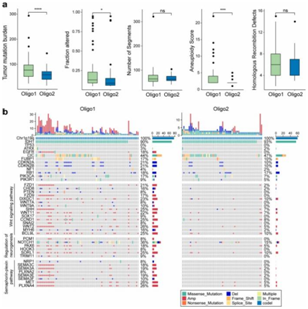
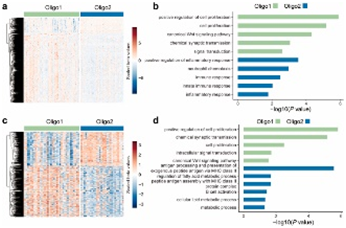
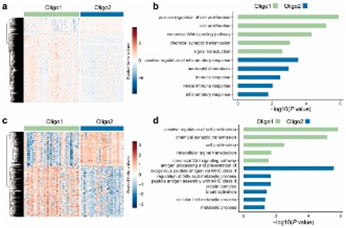
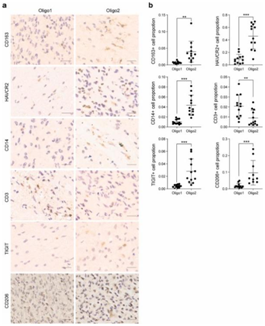
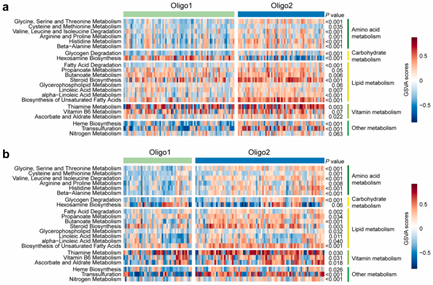
背 景 人类少突胶质瘤是一种异质性疾病,主要以异柠檬酸脱氢酶(IDH)突变和1p/19q共缺失为特征。这种肿瘤的治疗发展受到对体细胞驱动改变和次优疾病分类的不完全了解的阻碍。 在这里,使用基于免疫相关基因表达谱的无监督聚类分析,将少突胶质瘤分为两种不同的亚型,在另外两个独立的数据集中证明了这种分类的稳定性和可重复性。每种亚型都与不同的体细胞改变、免疫细胞、代谢特征以及临床结果有关。本研究的分析揭示了少突胶质瘤在免疫方面的异质性,为患者合理调整免疫疗法奠定了基础。 实验设计 结 果 01 一致性聚类揭示了少突胶质细胞瘤中两个不同的肿瘤亚群 作者收集了之前报道的782个免疫相关基因进行聚类分析。图1a显示了本研究的工作流程。首先进行了生存分析,以确定具有预后意义的基因,共获得84个候选基因,用于TCGA队列中的后续聚类分析。通过无监督一致性聚类分析,确定了两种免疫亚型:Oligo1和Oligo2(图1b)。之后进行了主成分分析来评估亚型的分配,并进一步证实了亚型之间表达模式的显著差异(图1c)。接下来确定了亚型与分子和病理特征的相关性,统计分析(卡方检验)发现,组织学分级3与Oligo1亚型相关,Oligi1的患者往往比Oligi2的患者年龄大(图1b)。生存分析显示,与Oligo2亚型相比,Oligo1亚型可能具有更差的结果(图1d),并且由此产生的分类与总生存率显著相关。 图1在TCGA队列中,少突胶质瘤的免疫基因图谱产生两种亚型。 a 本研究的流程图。本研究共使用355个少突胶质瘤样本。TCGA队列被用作训练集,CGGA和POLA队列被收集作为验证集。b TCGA队列中定义的两种免疫亚型的热图。从PAM分类器中筛选出40个质心基因。根据亚型对患者进行排列。分子和临床信息也被注释为每个患者。C 使用全转录组数据对两种亚型进行主成分分析(PCA)。d基于OS的免疫亚型的生存分析。 02 跨数据集的免疫亚型验证 作者在另外两个队列中评估了免疫亚型的再现性和稳健性。计算每个免疫亚型的质心,并根据质心的Pearson相关性将验证队列中的每个样本分配给一个亚型(图2a和d)。PCA还证实了获得性免疫亚型之间的表达谱差异(图2b和e),Oligo1主要由CNS世界卫生组织3级和老年患者组成,与CGGA队列的总体生存期较短有关(图2c)。由于随访有限,未达到中位总生存率(图2f),很难评估获得性分类与患者结果之间的相关性。作者还对TCGA和CGGA队列中的2级和3级肿瘤进行了分型,发现此分类可能会区分CNS世界卫生组织2级(TCGA队列)、2级和3级(CGGA队列)患者的结果。 图2 公开可用的CGGA和POLA数据集中免疫类的外部验证。 a热图显示了由在TCGA队列上训练的PAM分类器预测的CGGA队列的免疫亚型。b使用CGGA队列中的全转录组数据对两种亚型进行主成分分析(PCA)。c基于OS的免疫亚型的Kaplan–Meier分析。 03 免疫亚型的体细胞变异 作者进一步探索了可能驱动免疫亚型的体细胞变异。查询TCGA队列的基因组改变数据,并检验免疫亚型与体细胞驱动因子的相关性。Oligo1肿瘤表现出更高的非整倍体、肿瘤突变负荷和拷贝数负荷评分(图3a )。采用Fisher检验进行统计分析,突变频率较高的基因见图3b。EGFR突变在Oligo1样本中显著富集,而大多数常见的基因变异在亚型之间显示非特异性关联,如CIC,FUBP1和RB1。 随后通过GO分析对差异富集的基因进行功能注释,Oligo1肿瘤特异性改变的基因主要富集在Wnt信号通路、神经发生调节和信号蛋白丛蛋白通路中(图3b )。与此一致,扩增基因(EGFR和MET)在Oligo1中的表达高于Oligo2肿瘤。 图3 TCGA队列中免疫亚型之间DNA改变的比较。 a箱线图显示了TCGA队列亚型之间DNA损伤测量的差异(Wilcon秩和检验)。b免疫亚型之间突变状态和拷贝数变化的肿瘤学图谱。采用Fisher检验进行对比分析。显示了Wnt信号传导、神经发生调节和信号蛋白丛蛋白途径的差异改变基因。 04 免疫亚型的DNA甲基化变化 作者研究了TCGA队列中这些样本的差异甲基化CpG位点。1601个CpG探针在不同亚型之间被不同地甲基化,通过降低β值差异对探针列表进行排名,以确定差异最大的CpG探针(图4a)。Oligo1肿瘤中发生甲基化变化的基因在细胞增殖、Wnt信号通路、化学突触传递和信号转导方面高度富集,Oligo2肿瘤中的差异甲基化基因在参与免疫反应和炎症反应的功能类别中高度富集(图4b)。为了扩展这些发现,还查询了POLA队列的DNA甲基化数据,得到了类似的结果(图4c和d)。Oligo2肿瘤中的差异甲基化基因与抗原处理和呈递、代谢过程和B细胞活化有关(图4d)。 图4 TCGA和POLA亚型DNA甲基化的比较。 a使用由Wilcoxon检验定义的顶部差异637探针根据亚型排序的TCGA样品的热图。b TCGA队列中亚型之间差异甲基化基因的GO分析。c根据亚型使用Wilcoxon检验定义的顶部差异500探针排序的POLA样品的热图。d POLA队列中亚型之间差异甲基化基因的功能注释。 05 免疫亚型的细胞和分子特征 首先通过计算ESTIMATE算法来确定基质和免疫评分。与Oligo1相比,Oligo2亚型显示出更高的免疫和基质评分(图5a)。然后通过CIBERSORT方法探讨了各组之间浸润免疫细胞的组成。Oligo1的淋巴细胞和浆细胞百分比增加,而Oligo2的巨噬细胞和单核细胞水平更高(图5b和c)。此外,采用ssGSVA评分来量化免疫细胞和功能的富集水平。Oligio2显示APC和T细胞共同抑制的功能增加(图5d),还检测了几个抑制性检查点基因的表达水平,大多数检查点基因,如TIGIT,HAVCR2,LAIR1,LGALS9,PDCD1LG2,和C10orf54,在寡核苷酸2肿瘤中高度表达(图5e)。来自CGGA队列的组织的免疫组织化学染色也证实了上述发现(图6)。总之,这些结果表明Oligo2的TME具有较强的免疫抑制性,而Oligo1的TME具有相对温和的免疫微环境 图5 TCGA队列中两种亚型的肿瘤免疫浸润解剖。 a免疫亚型的免疫、基质和肿瘤纯度评分的比较(Wilcon秩和检验)。b免疫亚型( Wilcon秩和检验)的淋巴细胞和巨噬细胞比例(来自CIBERSORT )比较。淋巴细胞包括B细胞、CD4细胞、CD8细胞、滤泡辅助性T细胞、Treg细胞、γδT细胞、NK细胞和浆细胞。c 使用CIBERSORT工具分析两种亚型中免疫细胞群的相对丰度分数。d Heatmap显示两种免疫亚型中免疫相关标签的富集。e 箱线图显示抑制检查点基因的表达水平。 图6 免疫细胞的免疫染色分析和亚型之间的检查点。 a从CGGA队列中收集12例Oligo1和12例Ologi2病例。NOTCH1、TIGIT、HAVCR2、CD206、CD163、CD14和CD3抗体用于评估细胞比例。B箱线图显示了通过免疫染色评估的阳性细胞比例。 06 获得性免疫亚型的代谢谱,基因改变与免疫特性之间的关联 首先GSVA用于评估先前报道的115个代谢相关基因特征的富集水平。结果显示,Oligo2亚型显示出与氨基酸、脂质和维生素相关的更高水平的代谢过程。相反,Oligo1肿瘤显示出很少的代谢特征富集,如己糖胺生物合成,这表明代谢活性低(图7a)。接下来进一步查询了CGGA和POLA队列,并计算了代谢评分,观察到了一致的结果(图7b)。 之后还进行了体内测定,以验证MET和EGFR的免疫相关功能。脑内注射GL261,并在肿瘤形成后用抑制剂治疗小鼠。结果表明EGFR和MET抑制抑制了肿瘤生长并延长了小鼠的生存期。这些结果表明,EGFR和MET的抑制作用可能影响胶质瘤的免疫细胞浸润。 图7 获得性免疫亚型与代谢相关特征之间的关联。 a和b热图显示了TCGA和CGGA队列中代谢相关特征的差异富集。介绍了氨基酸、碳水化合物、脂质、维生素和其他代谢特征。 + + + + + + + + + + + 结 论 本研究鉴定并独立验证了两种与不同分子特征和临床结果相关的可重复亚型。名为Oligo1的增殖亚型的特征是CNS世界卫生组织3级肿瘤较多,与Oligo2亚型相比预后较差。总之,本研究介绍了少突胶质瘤的一种新的免疫分类,该分类包括两个具有不同预后、体细胞变异、免疫浸润和代谢表型的强大簇。需要在更大的患者队列中对这种免疫分类器进行进一步研究,以确定其作为预测生物标志物的潜在用途。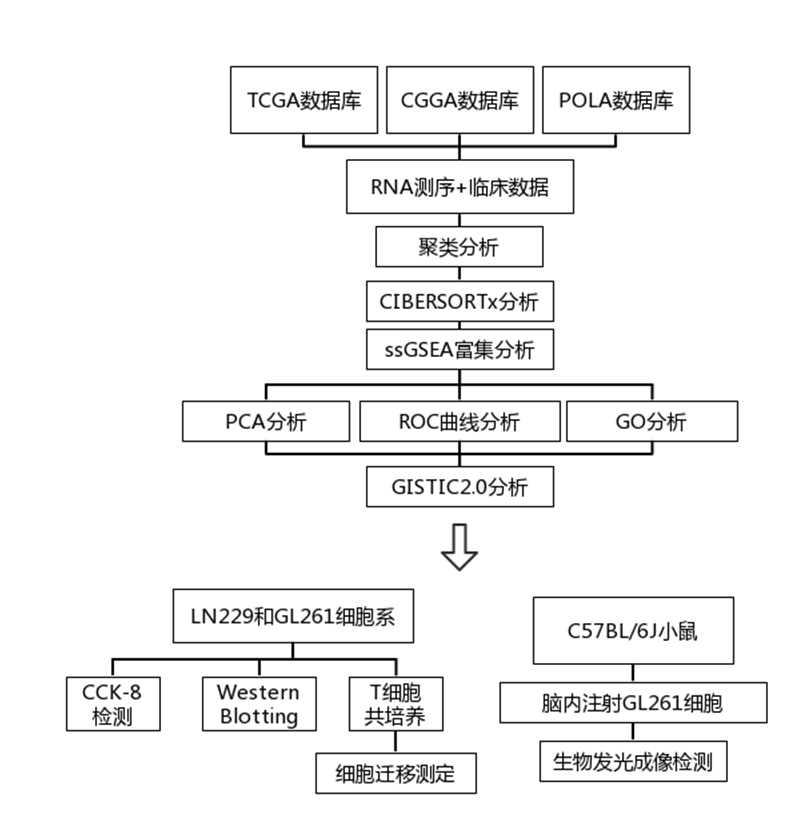



 English
English


