文献解读|Protein Cell(21.10):时空转录组学揭示灵长类动物卵巢的衰老特征
✦ +
+
论文ID
原名:Aging hallmarks of the primate ovary revealed by spatiotemporal transcriptomics
译名:时空转录组学揭示灵长类动物卵巢的衰老特征
期刊:Protein & Cell
影响因子:21.10
发表时间:2023.12.21
DOI号:10.1093/procel/pwad063
背 景
卵巢对于女性生殖至关重要,其随年龄增长的功能衰退是导致不孕的主要原因。然而,高等脊椎动物卵巢衰老的分子基础仍然知之甚少。
实验设计
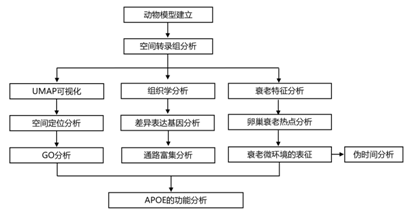
结 果
01
非人类灵长类动物(NHP)卵巢衰老时空转录组图谱的构建
在这项研究中,研究者团队对从四名年轻(4-5岁)和四名老年(16-18岁)NHP中采集的卵巢进行了空间转录组测序(图1A)。在对所有样本中的斑点进行无监督聚类后,他们确定了九个转录上不同的组,并且使用均匀流形近似和投影(UMAP)以及组织的物理空间来呈现这些斑点的空间分布(图1B-I)。基于几个典型标记基因并对不同卵巢细胞类型标记基因集合进行评分,结合卵巢组织的结构特征,确定了位于斑点的主要细胞类型,并将其分为两个区域:(i)卵泡区域,包括卵母细胞(OO)(用DDX4和GDF9标记)、颗粒细胞(GC)(用INHBB和AMH标记)、卵泡膜细胞(TC)(用STAR和CYP17A标记)以及原始卵泡和初级卵泡混合斑点(PPF)(用卵母细胞和GC标记);(ii)非卵泡区,包括卵巢表面上皮细胞(OSE)(用ALDH1A1和KRT19标记)、基质细胞(SC)(用TCF21和ARID5B标记)、平滑肌细胞(SMC)(用TAGLN标记和ACTG2)和免疫细胞(IM)(用CD68和LYZ标记)(图1C-D)。细胞类型特异性标记基因的功能注释富集分析揭示了转录特征和生理功能的一致性(图1E)。此外,他们还发现了一个位点上的MT2(金属硫蛋白2)和TIMP1(TIMP金属肽酶抑制剂1)高表达。具体来说,该位点的基因表达在功能上与激素反应(AREG、FOS、INHBA)、血管发育(ACTG1、ENG、VEGFC)、炎症反应(SERPINA3、C3、S100A9)和细胞外基质组织(COL1A1、LUM、FN1)相关(图1F-G),因此他们将其命名为mt2high位点。更重要的是,所有细胞类型都分布在相应的空间位置,表明空间转录组数据很好地描绘了卵巢的空间结构。例如,OSE主要局限于卵巢皮层的外围。例如,OSE主要定位于卵巢皮质的外围(图1H-I),而在卵巢卵泡内,OO由GC包围,而GC又与次级和窦卵泡的TC相邻(图1H-I)。此外,SMC和IM遍布整个卵巢组织,部分位于血管周围(图1H-I)。
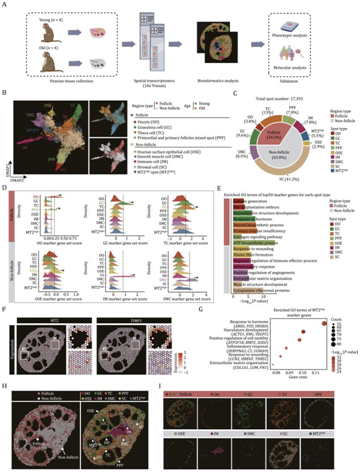
图1. 食蟹猴卵巢衰老空间转录组图谱的构建。
(A) 显示幼龄猴和老年猴卵巢空间转录组图谱建立以及与衰老相关的核心因素变化的验证的工作流程。(B) 均匀流形近似和投影 (UMAP) 图显示来自卵泡和非卵泡区域以及两个年龄组的九种斑点类型。(C) 饼图显示猴卵巢不同斑点类型和区域类型的比例。(D) 岭图显示多种主要卵巢斑点类型的已知标记基因的分数。(E) 每种斑点类型前 50 个标记基因的通路富集分析。(F) 幼龄猴的MT2高点的两个标记基因(MT2和TIMP1)的空间表达。(G) GO分析。(H) 来自幼龄猴卵巢的空间转录组数据的代表性点分布。(I) 幼龄猴卵巢组织中不同斑型的空间分布具有代表性。
02
NHP 卵巢中与年龄相关的空间结构紊乱
接下来,他们试图分析与卵巢衰老相关的空间特征。在整体范围内,观察到老年卵巢相对于年轻卵巢,卵泡区域萎缩,非卵泡区域扩张(图2A-C)。这些变化反映在卵泡区域内斑点数量显著减少和非卵泡区域内斑点数量增加(图2A-C)。一致地,H&E结果证明了卵泡区域中每个发育阶段(原始卵泡、初级卵泡、次级卵泡和窦卵泡)的卵泡广泛丧失(图 2D)。
此外,当他们统计比较年轻和老年个体之间注释斑点类型的比例及其空间分布时,发现在老年组的卵巢中与 OO 和 PPF 相关的斑点数量减少,以及支持卵泡的体细胞(例如 GC 和 TC)的减少(图2E-H)。加上在衰老卵巢中观察到的闭锁卵泡数量增加(图2D),这些发现描绘了与衰老相关的卵巢卵泡储备的下降。此外,填充老化组织中非卵泡区域的其他斑点类型的数量,包括OSE、SC和SMC,呈增加趋势(图2F)。衰老卵巢中 E-钙粘蛋白阳性区域的厚度增加(图 2I-J),这证明了与卵巢衰老相关的组织硬度升高。此外,衰老卵巢中 SMA 阳性 SMC 数量的增加和 CD31-阳性内皮细胞数量的减少支持中膜增厚,而血管内的内膜受到损害,表型与血管老化和营养供应抑制一致(图2K-L)。
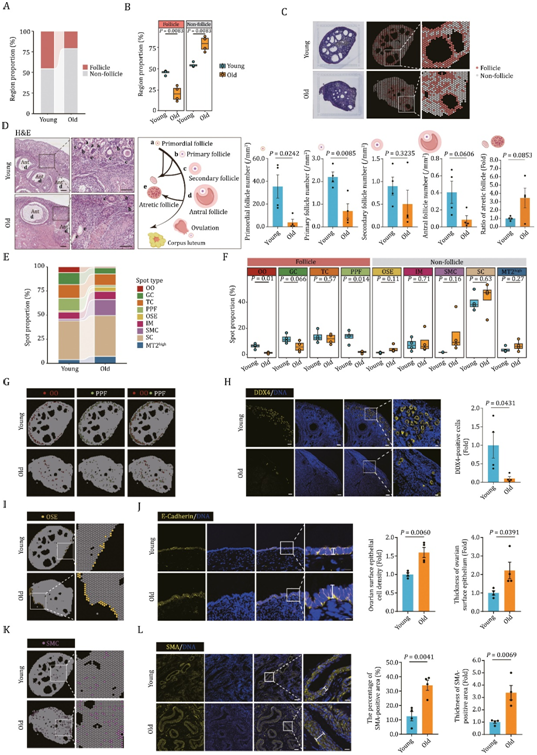
图2. NHP 卵巢中与年龄相关的结构紊乱。
(A) 条形图显示年轻和猴子卵巢卵泡和非卵泡区域的比例分布。(B) 箱线图显示年轻和老年猴子卵巢中指定区域的比例。(C) 分配到年轻和老年猴子卵巢切片上的卵泡和非卵泡区域的分布。(D) 代表性 H&E 染色图像,显示年轻和老年猴子卵巢中不同发育阶段的卵泡。(E) 条形图显示年轻和老年组卵巢中的斑点类型比例。(F) 箱线图显示年轻和老年组卵巢中每种斑点类型的比例。(G) UMAP 图显示了 OO 和 PPF 点在空间上分配到年轻和老年猴子卵巢切片上的分布。(H) 年轻和老年猴子卵巢的 DDX4 免疫荧光染色。(I) OSE 点在年轻和老年组卵巢切片上的空间分布。(J)年轻和老年组卵巢的E-钙粘蛋白免疫荧光染色。(K) SMC 位点在空间上分配到年轻和老年组卵巢切片上的分布。(L) 年轻和老年猴子卵巢的 SMA 免疫荧光染色。
03
非人类灵长类动物卵巢衰老的空间分辨转录组谱的整体视图
为了从空间上解析非人灵长类动物卵巢衰老的转录组学特征,他们首先在老年(O)和年轻(Y)个体之间的不同位点鉴定了年龄相关的差异表达基因(DEG)(简称衰老DEG)。结果表明,SMC、OSE和MT2high是DEG上调最多的3个位点(分别为146、90和87个基因),而SMC、PPF和OSE位点DEG下调最多的3个位点(分别为99、94和61个基因)(图3A-C)。这些发现强调,体细胞更容易衰老,可能会因卵泡发育受损而形成失调的微环境,并导致卵巢衰老。
通过对两个主要区域和所有位点的DEG 进行功能注释富集分析,与卵泡区域内的卵巢体细胞相比,非卵泡区域内的卵巢体细胞DEG改变的通路显著富集(图3D)。
值得注意的是,在属于非卵泡区域的大多数斑点中检测到衰老的经典标志的特征,包括(i)炎症反应通路加重(即免疫反应和补体激活),(ii)细胞外基质(ECM)积累增加(即弹性纤维组装和细胞外基质组装),(iii)脂质代谢失调(即上调的基因集中在调节脂质生物合成过程和调节胆固醇酯化),(iv)蛋白质稳态丧失(即参与蛋白水解负调控的基因上调,以及与泛素蛋白转移酶活性负调控相关的基因下调)(图3D)。
尽管卵泡区域斑点中衰老的deg数量较低,特别是对于OO,可能表明生殖细胞中受衰老影响的转录状态相对稳定,但他们发现了主要存在于卵泡区域斑点中的分子特征(图3D),例如与电子传递链相关的deg下调(图3D),这可能会损害能量供应并导致与年龄相关的卵泡变性。卵巢功能的一些特定通路在卵巢的各个部位发生了广泛的改变,包括卵泡和非卵泡区域。例如下调的deg包括与生殖功能(即生殖系统发育和对肽激素的反应)广泛相关的基因(图3D),以及排卵后卵巢组织修复的关键机制——伤口愈合,这与卵巢功能随着年龄的增长而下降相一致。
总而言之,这些发现揭示了卵巢体细胞可能会导致不利于卵巢功能的不利微环境,以及定向细胞和分子线索如何在空间分辨率上针对卵巢衰老。
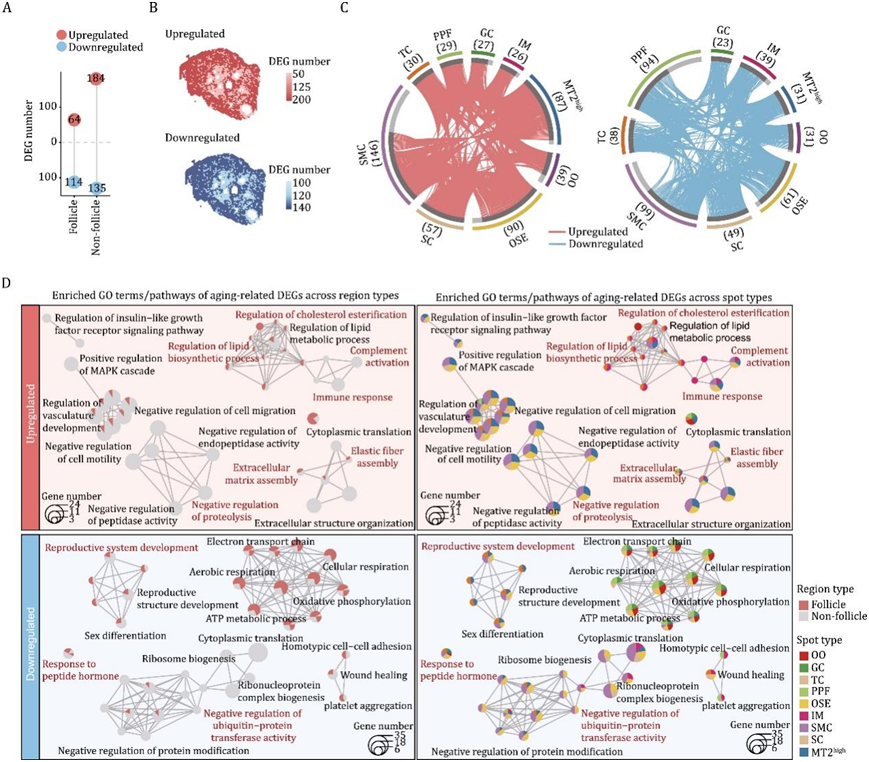
图3. NHP 卵巢空间转录组谱的年龄相关变化。
(A) Lollipop图显示卵泡和非卵泡区域中与衰老相关的差异表达基因(衰老 DEG)的数量。(B) 卵泡和非卵泡区域上调和下调的衰老 DEG 数量的空间分布。(C) Circos 图显示每种斑点类型的老化 DEG。每条连接曲线代表两种点类型共享的一种常见老化 DEG。(D) 网络可视化猴卵巢不同斑点类型的通路。
04
空间转录组学揭示了NHP卵巢衰老的衰老特征
基于上述分析,他们接下来对衰老 NHP 卵巢中与一系列经典衰老标志相对应的基因组的表达变化进行了深入分析(图4A)。他们首先计算了与炎症反应和衰老相关分泌表型 (SASP) 相关的基因评分,这两者都会引发慢性炎症并促进衰老,并检测了它们在年轻和老年 NHP 卵巢中的空间分布。在卵泡和非卵泡区域内的卵巢斑点中,这两个基因组中的基因存在年龄依赖性上调(图4B-C)。一致地,在衰老的卵巢中,发现大量 CD163+巨噬细胞浸润,以及 NF-κB p65+细胞和 S100A9 阳性细胞的积累(S100A9 是一种与细胞衰老有关的炎症因子)(图4D-E)。同样,他们观察到与纤维化密切相关的基因和TGF-β-信号通路在老年斑中相对于年轻组出现上调,并通过Masson染色证实了富含胶原纤维的纤维化区域的升高,证明了与年龄相关的细胞外基质积累(图4F-G)。此外,与年轻组相比,老年组中与脂质储存相关的一组基因得分更高,这与油红O (ORO)染色显示的脂质沉积增加的数据一致(图4H-I)。值得注意的是,凋亡通路中,PERK信号的主要下游级联也随着年龄的增长而激活(图4J),这表明细胞未能恢复持续异常的错误折叠蛋白重折叠和未折叠蛋白清除之间的平衡,最终导致细胞死亡。与这些分析一致,与年轻组织相比,老年卵巢中tunel-阳性和裂解的caspase-3阳性凋亡细胞的比例显著增加(图4K)。此外,负责产生活性氧(ROS)的基因表达水平升高,老年卵巢中4-HNE标记的脂质过氧化损伤发生显著积累(图4L-M)。由于基因组不稳定往往会引发DNA损伤,他们进一步分析了与DNA修复相关的基因表达改变,发现DNA修复能力受损与年龄增长有关(图4N)。相应的,他们在衰老卵巢中观察到γ-h2a.X-阳性细胞含量升高(图4O)。最后,他们发现衰老卵巢细胞在衰老过程中具有衰老特征,并持续注意到衰老卵巢中SA-β- gal阳性和p21阳性的衰老细胞增加(图4P-Q)。总的来说,这些发现显示了一个广泛的与衰老相关的转录程序,与衰老的NHP卵巢组织结构退化的级联相一致。
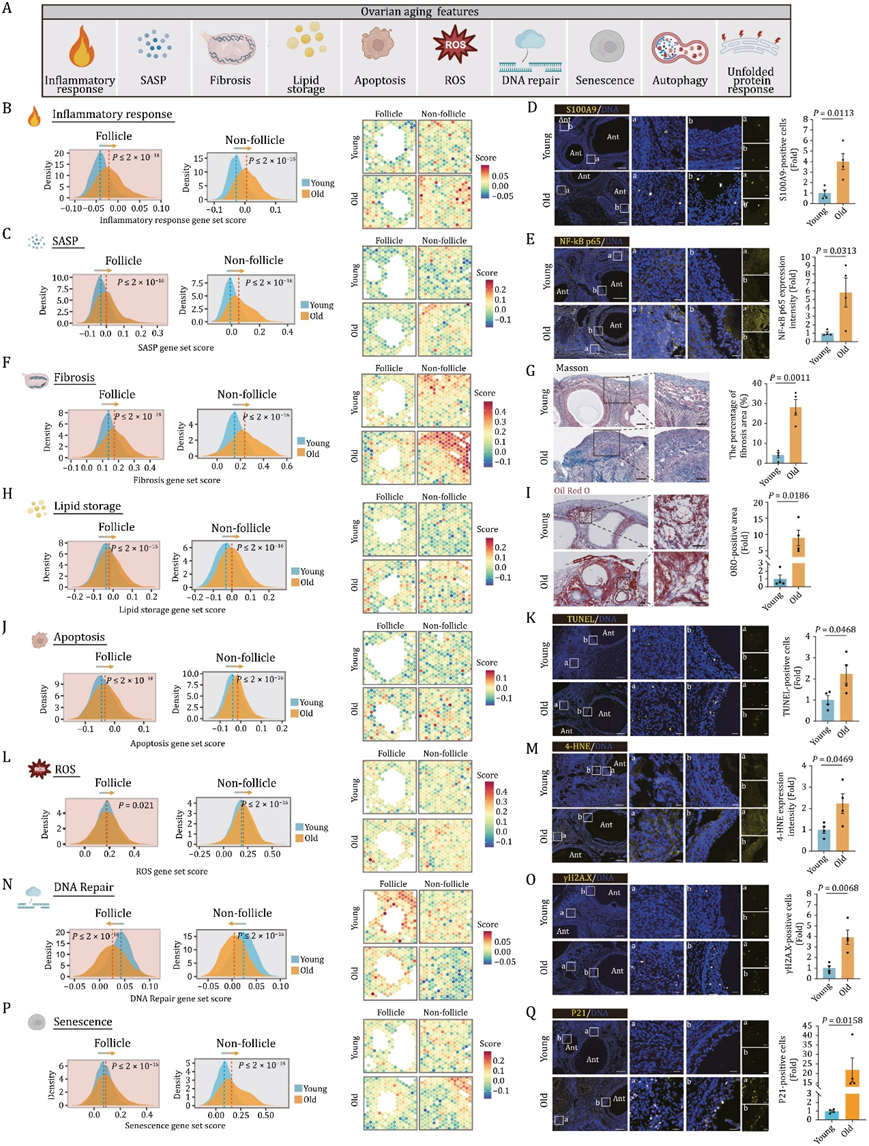
图4. NHP 卵巢衰老中几个典型衰老标志的转录变化。
(A) 空间转录组学揭示的卵巢衰老特征示意图。(B) 岭图(左)和空间可视化(右)显示年轻组和老年组炎症反应相关基因的基因集评分的整体分布密度。(C) 岭图(左)和空间可视化(右)显示年轻组和老年组中 SASP 相关基因的基因集评分的整体分布密度。(D) 年轻和老年组卵巢的 S100A9 免疫荧光染色。(E) 年轻和老年组卵巢的 NF-κB p65 免疫荧光染色。(F) 岭图(左)和空间可视化(右)显示年轻组和老年组中纤维化相关基因的基因集评分的整体分布密度。(G)年轻和老年组卵巢的Masson染色。(H) 岭图(左)和空间可视化(右)显示年轻组和老年组中脂质储存相关基因的基因集得分的整体分布密度。(I)年轻和老年组卵巢的ORO染色。(J) 岭图(左)和空间可视化(右)显示年轻组和老年组中凋亡相关基因的基因集评分的整体分布密度。(K)年轻和老年猴子卵巢组织的 TUNEL 染色。(L) 岭图(左)和空间可视化(右)显示年轻组和老年组中 ROS 相关基因的基因集评分的整体分布密度。(M) 年轻和老年组卵巢组织的 4-HNE 染色。(N) 岭图(左)和空间可视化(右)显示年轻组和老年组中 DNA 修复相关基因的基因集评分的整体分布密度。(O) 年轻和老年组卵巢组织的 γH2A.X 染色。(P) 岭图(左)和空间可视化(右)显示年轻组和老年组中衰老相关基因的基因集得分的整体分布密度。(Q) 年轻和老年组卵巢组织的 P21 染色。
05
从空间角度识别NHP卵巢衰老病灶
接下来,他们对所有卵巢斑点的衰老deg和衰老图谱数据库中的基因进行了综合分析,生成了一组卵巢特异性衰老基因(OSAG)(图5A)。OSAG上调可能加速卵巢衰老,而OSAG下调可能延缓卵巢衰老。正如预期的那样,当分别对上调和下调的基因组进行评分时,老年组中所有点都出现了一系列显著的变化(图5B)。他们计算了 OSAG 和其他可能明显导致卵巢功能损伤的基因集之间的基因集评分的相关指数。上调的 OSAG 与一组其他基因集(包括 SASP、纤维化、衰老、炎症反应等)之间的分数呈正相关(图 5C),以及下调的OSAG与参与自噬和DNA修复的基因之间的分数呈正相关(图5C)。其中,他们观察到OSAG与SASP评分、纤维化、衰老和炎症反应评分之间存在较高的相关性(图5C),表明这些通路是导致卵巢衰老(PCOA)的主要因素。事实上,在考虑空间分布方面时,他们观察到OSAG得分较高的点与SASP得分较高的点之间存在明显的共定位(图5D),其他PCOA得分也是如此。
特别重要的是,他们发现MT2high、SMC和OSE在转录谱方面与PCOA的相关性较高,排名前三(图5E),这意味着它们对衰老的易感性更高。在此基础上,他们试图在空间水平上确定NHP卵巢的衰老热点。于是,他们通过整合上调和下调的osag来计算空间老化评分。接下来,通过联合分析衰老评分最高的点和其他PCOA评分,他们定义了NHP卵巢的衰老热点,其特征是高水平的SASP、纤维化、衰老和炎症反应(图5F)。
通过计算在总共532个共定位点中获得PCOA转录性状的每种点类型的比例,发现MT2high占据了约20.47%的共定位点(图5G),SC和OSE分别占据14.91%和13.16%,这意味着MT2high可能是整个卵巢组织的主要衰老病灶。由于MT2high具有高水平的炎症和SASP的特征(图5E),这些发现进一步表明,MT2high位点可能是衰老信号在整个卵巢组织中传播和扩散的主要衰老病灶。他们注意到卵巢特异性老化分数与距离热点的距离呈明显的负相关,即老化分数从热点向附近区域逐渐下降(图5H),SASP分数也是如此(图5H)。
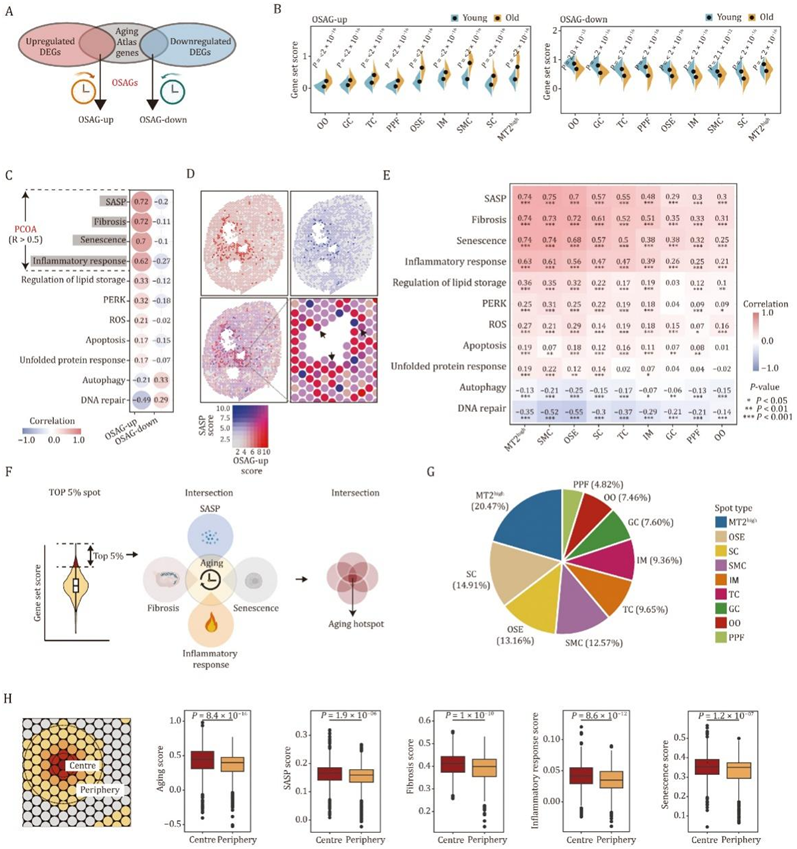
图5. 从空间角度识别NHP卵巢衰老病灶。
(A) OSAG 基因组生成示意图。(B) 小提琴图,显示老年猴和年轻组卵巢不同斑点类型中 OSAG 上调和 OSAG 下调基因的基因组得分。(C) 猴卵巢中 OSAG 上调或 OSAG 下调基因集评分与 11 个年龄相关信号通路基因集评分之间的 Pearson 相关性分析。(D) 具有 OSAG 上调基因集评分或 SASP 相关基因集评分的斑点的空间分布和共定位可视化。(E) 猴卵巢中不同斑点类型的 OSAG 上调集合评分与 11 个年龄相关信号通路的基因集评分之间的相关性分析。(F) 示意图显示根据卵巢衰老的主要因素 (PCOA) 评分识别衰老热点的程序。(G) 不同斑点类型在已识别老化热点总数中的比例分析。(H) 老化斑周围中心和外围区域的示意图(左)。条形图显示距热点的空间距离与老化或 PCOA 评分之间的负相关性(右)。
06
衰老卵巢衰老热点及其微环境的表征
有趣的是,当他们仔细检测MT2high位点的空间位置时,发现它们有的集中在卵泡腔附近区域,有的则分散分布在卵巢间质区域(图1H-I)。为了跟踪MT2high状态并探索其如何影响卵巢衰老,他们使用参与卵泡发生的主要体细胞组合进行了伪时间分析(图6A)。结果显示,MT2high大部分位于GC和TC之后的后期(图6A),这意味着MT2high可能包含GC或TC的细胞分化。有趣的是,MT2high可分为三种状态,与其他两种状态相比,其中一种状态在老年组中积累(状态2)(图6A)。通过基于轨迹的差异表达分析,他们确定了370个促进MT2high状态的上调基因(基因聚类1)(图6B)。聚类1中基因的功能注释表明,与细胞外基质组织(ACTN1、COL6A2、COL8A1)、血管生成(ECM1、EGR3、ENG)、凋亡过程的正调控(ALDH1A3、TSPO、CTNNB1)和炎症反应(SERPINA3、C3、CD68)相关的基因表达升高(图6B)。
接下来,他们分析了MT2high位点的年龄相关基因表达变化,发现上调的deg与细胞外基质组织(COL6A2、DCN、THBS1),血管生成(ENG、CCN1、ITGA5),免疫效应过程(SERPING1、C3、CD74)和细胞衰老(IGFBP3、SERPINE1、MAP2K2)密切相关,而下调的deg与生殖系统发育(INHA、INSL3、SERPINE2)和激素应答(CRHBP、GRB14、PLA2G1B)功能相关(图6C)。当他们对MT2high位点和基因聚类1中与年龄相关的上调deg进行综合分析时,发现它们之间存在大量重叠,表现为与细胞外基质组织、凋亡、血管生成、炎症和细胞衰老相关的通路富集(图6D)。前10位重叠基因包括SERPINA3、C3、COL6A2、LTBP4、MGP、APOE、MT2、ITGA5、THBS1和IGFBP4,其中大部分与炎症反应和纤维化有关(图6E),并通过免疫染色验证了老年卵巢中MT2的表达水平上调(图6F)。
为了分析NHP卵巢热点及其微环境的年龄相关变化,他们对MT2high与周围斑点之间的细胞-细胞相互作用进行分析,发现MT2high与其他斑点类型之间的细胞-细胞相互作用明显失调(图6G)。具体来说,老年的MT2high和其他卵巢斑点之间的配体-受体对增加与纤维化高度相关(图6G)。这些数据表明,MT2high是老年卵巢不良微环境的主要因素之一。
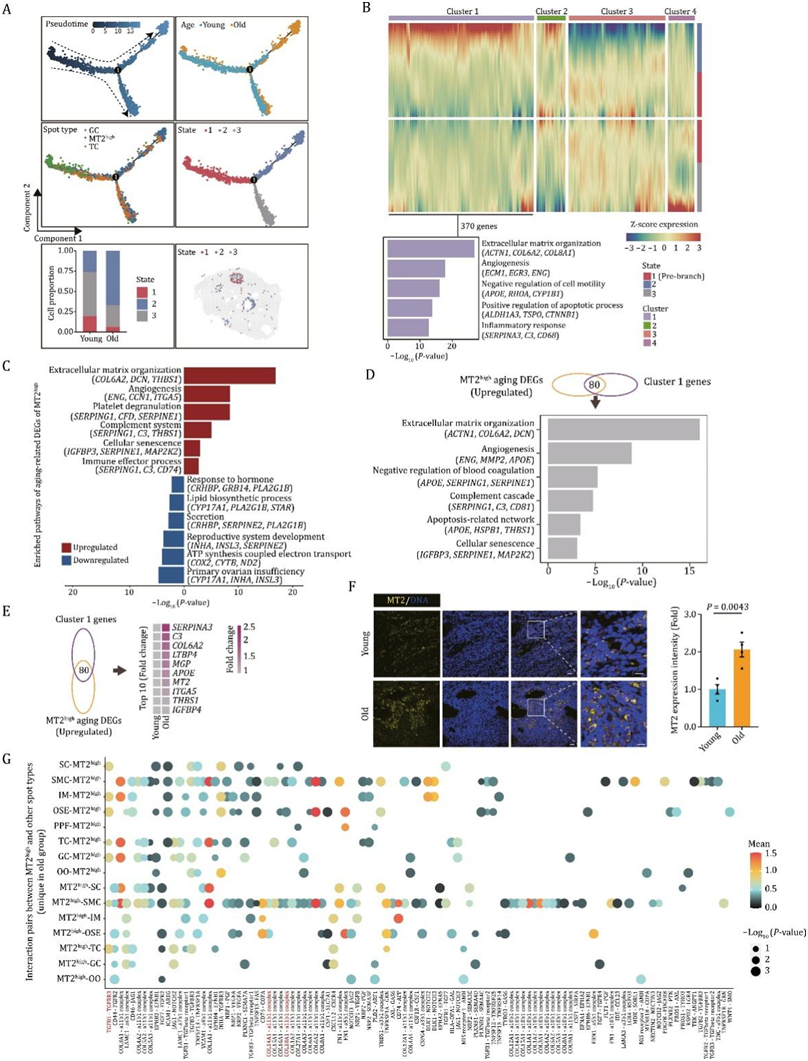
图6. 衰老卵巢衰老热点及其微环境的表征。
(A) NHP卵巢GC、TC和mt2high的伪时间分析。(B)基于分支表达分析模型(BEAM)分析的沿伪时间轨迹的四种不同表达模式的热图和显示聚类1基因富集通路的条形图。(C)GO分析。(D)条形图显示mt2high上调的衰老deg与聚类1基因之间重叠基因的通路富集分析。(E)热图显示了mt2high和聚类1基因中上调的衰老deg之间的前10个重叠基因的表达水平。(F)年轻组和老年组卵巢MT2免疫染色。(G)点图显示MT2high与其他斑点类型之间的相互作用对。
07
时空转录组学揭示了APOE作为灵长类动物卵巢衰老的标志
为了进一步描绘所有斑点类型的年龄依赖性基因表达变化,他们鉴定了至少三种斑点类型中总共88个持续上调的DEG,以及至少三种斑点类型中持续下调的61个DEG(图7A) 。其中,他们发现所有斑点类型中APOE、COL6A2、FKBP8、HDAC5、LTBP3、LTBP4、MAP2K2、MFAP4和RPL28的表达增加,而CYP17A1、APOC1B和COL1A1的表达减少(图7A)。此外,他们进行了一项综合分析,将衰老 DEG 与从衰老图谱数据库中获得的基因相结合,以检测与衰老相关的基因表达模式的变化。最重要的是,他们还发现APOE在所有斑点类型中表现出最主要的上调(图 7B)。
他们注意到与炎症反应相关的重叠上调基因显著富集,包括丝氨酸蛋白酶抑制剂(SERPINE1和serinf1)和补体系统成分(C3和C1QA)(图7C),这表明炎症升高在调节NHP卵巢衰老和女性生殖疾病中可能发挥共同作用。相反,一些对卵泡形成至关重要的下调基因与卵巢疾病有关,这些基因包括性激素生物合成基因(如STAR、CYP17A1和ALDH1A1),以及卵泡发育所需的基因(如INHA)(图7C)。
此外,通过联合分析NHP卵巢组织和人血清中与衰老相关的上调蛋白谱,他们发现了一组分泌因子APOE、CHI3L1、SERPING1等(图7D),表明它们有可能作为卵巢衰老程度的生物标志物。其中载脂蛋白E (APOE)是一种对脂质代谢至关重要的蛋白质,参与神经退行性疾病等多种退行性疾病的病理生理过程。事实上,随着APOE蛋白水平在老年卵巢中的增加,APOE转录本也发生了上调(7E-F)。
有趣的是,鉴于APOE是一种分泌蛋白,他们接下来探索了其在人类个体中分泌形式的水平是否随着年龄的增长而增加(图7G)。正如预期的那样,与年轻组相比,老年组的卵泡液中的APOE水平显著增加(图7H)。这些结果表明了APOE作为人类卵巢衰老的一种新的生物标志物的潜力。
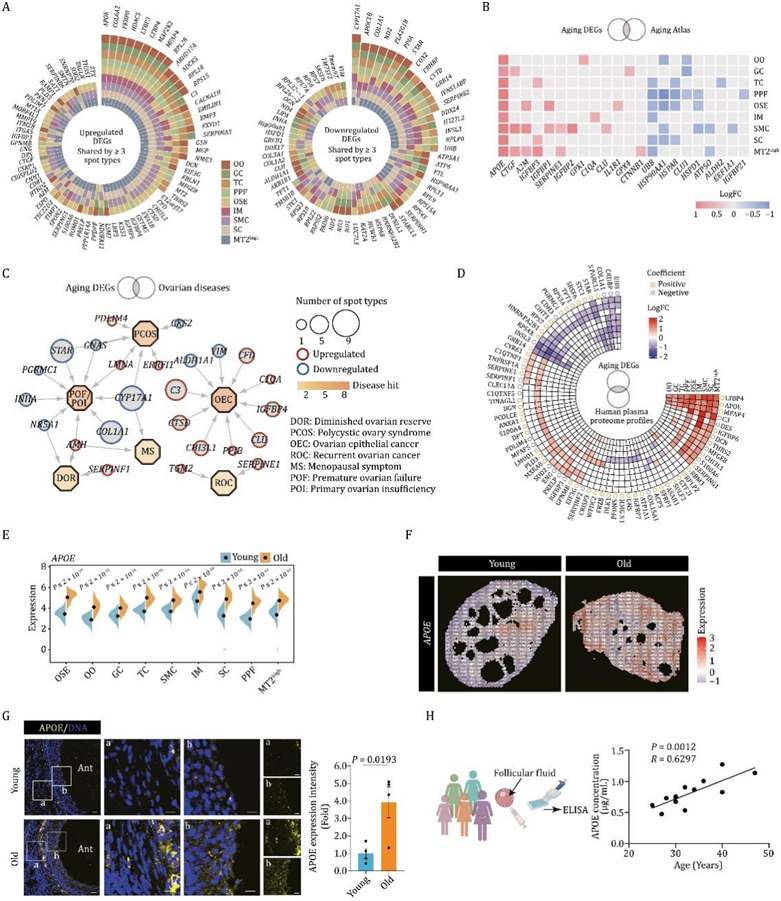
图7. 基于空间转录组的 NHP 卵巢衰老特征。
(A) 显示至少三种斑点类型共享的上调和下调老化 DEG 的图。(B) 热图显示上调和下调的衰老 DEG 与不同斑点类型的衰老图谱数据库中注释的基因重叠。(C) 卵巢疾病中 11 种不同卵巢斑点类型上调和下调 DEG 的网络可视化。(D) 圆形热图显示在整个生命周期中上调和下调的衰老 DEG 与人血浆蛋白质组谱中的蛋白质重叠。(E) 小提琴图显示年轻和老年组卵巢中APOE的表达水平。(F) APOE的空间基因表达空间分配到年轻和老年组卵巢切片上。(G) 年轻和老年组卵巢的 APOE 免疫荧光染色。
+ + + + + + + + + + +
结 论
在这里,本项研究将时空转录组学应用于年轻灵长类动物卵巢的基准结构组织以及细胞和分子决定因素,并将其与老年灵长类动物卵巢进行比较。从整体来看,非卵泡区域内的体细胞相对于卵泡区域内的体细胞经历更明显的转录波动,可能构成促进卵巢衰老的不利微环境。此外,炎症、衰老相关的分泌表型、衰老和纤维化可能是PCOA的主要原因。值得注意的是,本项研究发现了 PCOA 特征位点和MT2high位点之间的空间共定位,该位点以高水平炎症为特征,可能是灵长类卵巢中的衰老热点。此外,随着年龄的增长,MT2high亚群会积累,可能向外传播和放大衰老信号。本项研究建立了第一个灵长类动物时空转录组图谱,增进了对灵长类动物卵巢衰老机制决定因素的理解,并揭示了衰老和与年龄相关的人类卵巢疾病的潜在生物标志物和治疗靶点。
+ + + + +



 English
English


