文献解读|Cell(64.5):妊娠中晚期及糖尿病妊娠胎儿代谢图谱
✦ +
+
论文ID
原名:Atlas of fetal metabolism during mid-to-late gestation and diabetic pregnancy
译名:妊娠中晚期及糖尿病妊娠胎儿代谢图谱
期刊:Cell
影响因子:64.5
发表时间:2024.01.04
DOI号:10.1016/j.cell.2023.11.011
背 景
越来越多的证据表明新陈代谢指导干细胞的命运决定。然而,胎儿代谢在发育过程中如何变化以及母体代谢的改变如何影响胎儿代谢仍有待探索。
实验设计
结 果
01
正常血糖和高血糖中的胎儿代谢组学
为了模拟糖尿病妊娠,研究者团队使用了高血糖秋田小鼠,该小鼠在妊娠中期和晚期产生了轻度缺陷但存活的后代。这些小鼠的 Ins2 基因存在杂合突变,导致成人发病的糖尿病。秋田母鼠的后代表现出一些心脏和神经管缺陷;然而,大多数缺陷都很轻微,其中大多数适合基于 LC-MS 的代谢组学分析(图 1 A)。
他们着手绘制从怀孕的秋田母鼠与野生型母鼠在整个发育过程中收集的胎儿组织的代谢组图谱,特别是在妊娠中后期。为了实现这一目标,将定时小鼠妊娠设定为胚胎日(E)10.5、E12.5、E15.5 和 E18.5 阶段。野生型和糖尿病(秋田)母鼠均禁食过夜,并在收集胎儿组织之前注入[U-13C]葡萄糖,以通过代谢途径追踪13C。示踪剂输注 3 小时后,从解剖的胎儿胎盘、大脑、心脏和肝脏中提取代谢物(图 1 B)。该实验设置产生了高质量的数据集,提供了发育背景下的三个分析维度:(1) 发育阶段,(2) 胎儿组织起源,以及 (3) 母体血糖状态。本项研究数据分析流程涉及靶向和非靶向代谢组学以及 [U- 13C] 葡萄糖的同位素追踪,以提供有关途径利用和营养来源的见解(图 1 C)。在所有组织、妊娠阶段和母体血糖状态中,他们对代谢物水平进行了全面量化,以供进一步分析(图 1D)。13C分数富集分析显示不同发育阶段和代谢途径的活性不同(图1E)。在所有胎儿组织中,糖酵解代谢物大多在E10.5和E15.5之间标记,但在E18.5胎儿组织中糖酵解代谢物标记急剧减少。来自野生型母鼠的 E18.5 胎儿的肝脏和大脑中的糖酵解代谢物明显低于来自秋田母鼠的标记,这表明这些中间体的来源差异越来越大,具体取决于母体血糖状态。
磷酸戊糖途径(PPP) 13C 富集表明不同组织在不同发育阶段有峰值活性:胎盘和肝脏中的 PPP 活性在 E10.5 处达到峰值,而在心脏和大脑中,PPP 活性在 E12.5 处达到峰值和E15.5。多种营养素有助于三羧酸 (TCA) 循环代谢物库。因此,其13C富集表明葡萄糖对 TCA 循环的直接和间接贡献。野生型母鼠的胎儿组织在 E10.5 和 E12.5 早期阶段的标记明显更多,但秋田母鼠胎儿组织中的标记在 E18.5 时超过了野生型对应物,表明秋田母鼠的胎儿组织中存在持续的葡萄糖分解代谢。
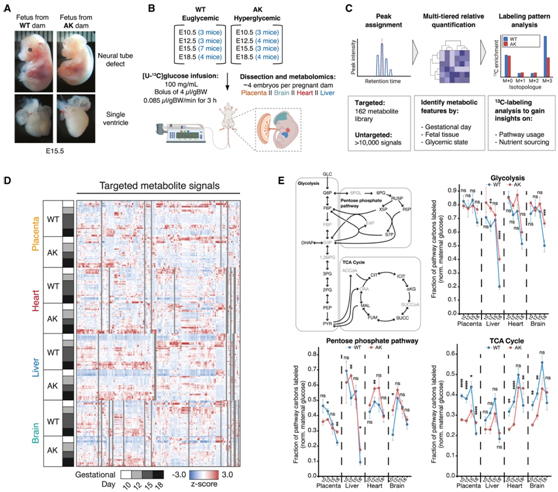
图1. 用于评估妊娠中晚期和糖尿病妊娠期间胎儿代谢的代谢组学平台。
(A) 在胚胎第 15.5 天从野生型 (WT) 和秋田型 (AK) 母鼠收获的胎儿图像。(B) 实验设置示意图。(C) 基于 LC-MS 的代谢组数据分析方法示意图。(D) 发育过程中多个时间点从 WT 和 AK 母鼠分离的胎儿组织中胎盘、心脏、肝脏和大脑的靶向代谢物分析的热图表示。(E) 标记的途径碳的预期分数标准化为母体葡萄糖标记的水平。
02
母体高血糖导致山梨醇在胎儿组织中积聚
与野生型相比,从秋田小鼠组收获的胎儿组织中山梨醇水平显著升高(图 2A)。作为多元醇途径的一部分,山梨醇是通过醛糖还原酶的作用从葡萄糖生成的(图 2 B)。为了评估从秋田母鼠与野生型母鼠收获的胎儿组织中山梨醇积累的程度,他们确定了相对于来自野生型母鼠的 E10.5 胎儿组织山梨醇水平的增加,母体高血糖的胎儿胎盘、心脏、肝脏和大脑中山梨醇水平升高。特别是在 E15.5 和 E18.5 期间从秋田母鼠分离的胎儿大脑显示出相对于从野生型母鼠分离的 E10.5 胎儿大脑最大的山梨醇积累(图 2 C)。
成年糖尿病动物体内山梨醇的积累会导致组织渗透压,并导致视网膜、肾脏和神经等不依赖胰岛素的组织发生损伤。本项研究的数据显示,因母体高血糖的胎儿无法免受山梨醇积累的影响,并表明胎儿发育过程中山梨醇的积累可能导致糖尿病妊娠期间观察到的发育缺陷发生率较高。
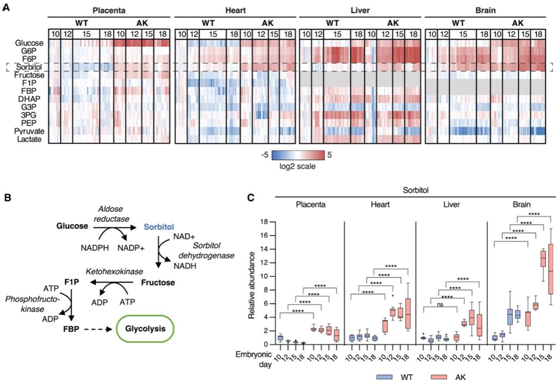
图2. 母体高血糖导致山梨醇在胎儿组织中积聚。
(A) 热图表示相对于野生型 (WT) 母鼠的 E10.5 胎儿组织,糖酵解和多元醇途径中间体的差异倍数。(B) 多元醇途径及其与糖酵解交叉的示意图。(C) 从 WT 和秋田 (AK) 母鼠中分离出的胎儿组织中的山梨醇水平。
03
母亲高血糖改变胎儿大脑的氨基酸代谢
他们观察到从野生型与秋田母鼠收获的胎儿组织中氨基酸水平的变化(图3A)。在发育阶段,与从野生型母鼠收获的胎儿心脏相比,从秋田母鼠收获的胎儿心脏中的大多数氨基酸水平下降幅度较小,而秋田小鼠胎儿肝脏和大脑中的氨基酸水平则呈更强烈的上升趋势。最值得注意的是,在从野生型与秋田母鼠收获的胎儿中评估的发育时间范围内,胎儿脑天冬氨酸水平呈现出不同的趋势(图3B)。在从野生型母鼠中分离出的胎儿大脑中,天冬氨酸水平从 E10.5 增加到 E12.5 大约 2 倍;然而,在从秋田县母鼠分离的胎儿大脑中,天冬氨酸水平从 E10.5 到 E12.5 保持不变,而在 E12.5 和 E15.5 之间增加了大约 2 倍(图 3 B)。这些变化与胎儿脑天冬酰胺水平形成鲜明对比,胎儿脑天冬酰胺水平在整个发育时间范围和评估条件下保持不变(图 3 B)。从野生型与秋田母鼠中收获的胎儿大脑中谷氨酸和谷氨酸衍生的γ-氨基丁酸(GABA)的水平也不同(图3C)。与从野生型母鼠分离的 E10.5 和 E12.5 胎儿脑相比,从秋田母鼠分离的 E10.5 和 E12.5 胎儿脑中谷氨酸和 GABA 水平较低。
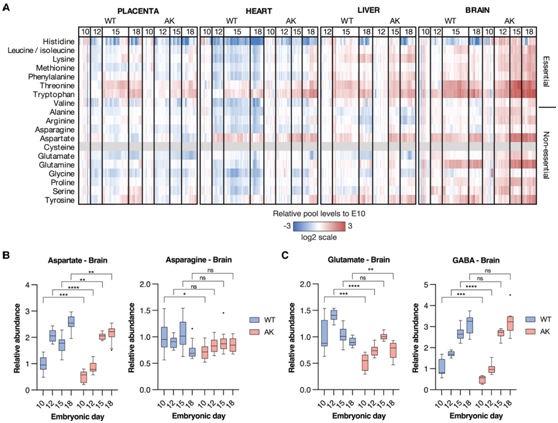
图3. 母亲高血糖会改变妊娠中晚期胎儿大脑中的天冬氨酸和谷氨酸水平。
(A) 热图代表相对于从野生型 (WT) 和秋田 (AK) 母鼠分离的 E10.5 胎儿组织的氨基酸水平的变化。(B)胎儿脑组织中的相对天冬氨酸和天冬酰胺水平。(C) 胎儿脑组织中谷氨酸和 GABA 的相对水平。
04
同位素追踪揭示胎儿生长策略
通过中心碳代谢追踪[U- 13C]葡萄糖揭示了胎儿组织如何获取生物量构建模块。在整体水平上,他们认为胎儿循环系统通过从胎盘到肝脏、心脏和大脑的路径与母体循环相连(图4A)。他们观察到,胎儿中有 7 种非必需氨基酸(Asp、Asn、Glu、Gln、Pro、Ser 和 Gly)由13C 标记,而这 7 种中,天冬氨酸和甘氨酸在母体血浆中未标记(图 4B)。因此,天冬氨酸和甘氨酸完全由胎儿组织合成。母体和胎儿的代谢为胎儿贡献了 5 种氨基酸(Asn、Glu、Gln、Pro 和 Ser),其他 13 种氨基酸完全来自母体。
在组织水平上,13C 示踪揭示了负责氨基酸标记的代谢途径(图 4 C)。组织代谢物可以通过母胎 [U-13C] 葡萄糖通过胎盘的转运以及母体从 [U-13C] 葡萄糖产生的其他循环代谢物的转运而获得。胎儿天冬氨酸标记与苹果酸相似或更少,苹果酸是草酰乙酸的替代品,是天冬氨酸的直接前体,但比血浆天冬氨酸的标记更多(图4D)。胎儿谷氨酸标记始终高于血浆谷氨酸标记和胎儿谷氨酰胺标记,但与组织 α-酮戊二酸标记相当(图 4 E)。
由于循环乳酸是另一种高通量碳源,他们考虑了产生不同13C 标记的三种情况:主要碳源是 (1) 血浆葡萄糖,(2) 血浆葡萄糖和乳酸,以及 (3)血浆乳酸(图 4 F)。此外,他们考虑了通过糖原分解引入未标记的磷酸己糖的可能性。在胎盘中,糖酵解标记反映了血浆葡萄糖和血浆乳酸的贡献,这些物质在妊娠中后期在母体中标记(图 4 G)。另一方面,野生型和秋田母鼠的胎儿的肝脏显示出不同的糖酵解标记特征。在E10.5和E12.5中,野生型母鼠的胎肝在糖酵解过程中显示出上升的标记梯度,表明13C标记的乳酸进行糖异生,并且可能通过糖原分解稀释己糖13C标记(图4G)。
然而,在妊娠中后期从秋田小鼠采集的胎儿肝脏中,13 C 葡萄糖标记较高,并且与母体循环中的葡萄糖标记水平更相似。总而言之,母体高血糖不仅改变胎儿碳主链的来源,而且还维持妊娠后期葡萄糖对氨基酸生物合成。
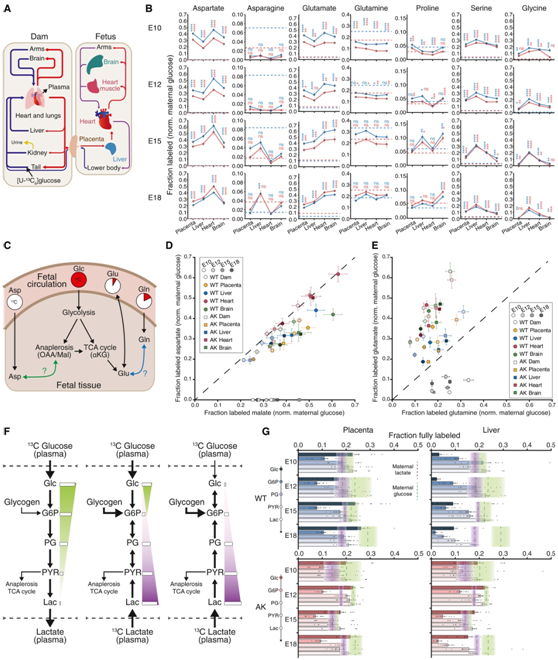
图4. 胎儿组织中的同位素示踪阐明胎儿营养的来源和利用。
(A)从母体到胎儿的胎儿循环示意图。(B) 通过胎儿循环追踪胎儿组织中标记的七种氨基酸。(C) 非必需氨基酸来源示意图。(D) 胎儿组织和母体血浆中天冬氨酸和苹果酸的标记。(E) 胎儿组织和母体血浆中谷氨酸和谷氨酰胺的标记。(F) 糖酵解中间体和生物质构建块的三种主要碳源的描述。(G) WT 和 AK 胎盘和肝脏中完全标记的糖酵解中间体。
05
妊娠中晚期胎儿核苷酸合成减慢
细胞快速分裂过程中对核苷酸的需求量很大,但它们无法通过循环获得。因此,他们研究了胎儿组织如何调控核苷酸生物合成。相对于 E10.5,在 E12.5、E15.5 和 E18.5 时,心脏、肝脏和大脑(但不是胎盘)中胎儿组织特异性的核苷酸增加(图5 A)。相对于 E10.5,E15.5 和 E18.5胎儿脑组织中的单磷酸核苷和二磷酸核苷升高,但三磷酸核苷不升高。然而,相对于 E10.5,E12.5–E18.5 胎儿肝组织中几乎所有测量的核苷酸均升高。特定核苷酸,例如肌苷单磷酸 (IMP)、腺苷二磷酸 (ADP) 和腺苷三磷酸 (ATP),但不包括腺苷单磷酸 (AMP)、胞苷单磷酸(CMP)、鸟苷单磷酸(GMP) 或尿苷单磷酸(UMP)相对于 E10.5,在 E15.5 和 E18.5 的胎儿心脏组织中明显升高。在胎盘和胎儿心脏中,AMP 和 UMP 水平在发育阶段没有增加(图 5B-C)。然而,在胎儿肝脏和大脑中,AMP 和 UMP 水平增加(图 5B-C)。此外,随着胚胎日的推进,胎儿组织中 AMP 和 UMP 的13C 富集持续减少(图 5D-E)。
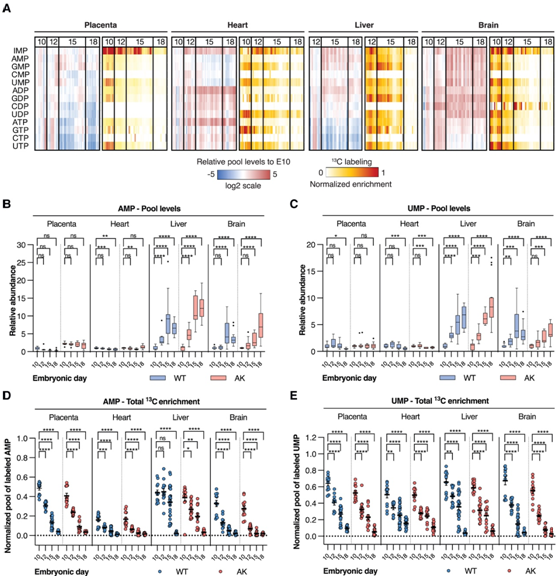
图5. 胎儿发育过程中核苷酸从头合成逐渐减少。
(A) 蓝色到红色刻度:热图代表相对于 E10.5 胎儿组织(胎盘、心脏和大脑)或来自野生型 (WT) 母鼠的胎儿肝脏的 E12.5 核苷酸库水平。(B-C)胎儿组织中的相对 AMP 和UMP水平。 (D-E) 胎儿组织中 AMP和 UMP的标准化总13C 富集
06
组氨酸衍生的代谢物在晚期胎儿中积累
他们使用 MetaboAnalyst 平台比较了从野生型和秋田母鼠采集的 E18.5 和 E10.5 胎盘的非靶向数据,发现组氨酸代谢是在从野生型母鼠收获的 E18.5 与 E10.5 胎盘中具有最高归一化富集分数和显著性的代谢途径(图 6 A)。鉴于与 E10.5 胎盘相比,晚期组氨酸代谢显著富集,他们决定更仔细地研究跨胎儿组织和整个妊娠中后期的这条途径。组胺衍生自组氨酸,组氨酸可分解代谢为尿刊酸盐以及组胺(图 6 B)。从野生型母鼠中分离出的胎儿心脏和大脑中组氨酸水平有所下降(图 6 C)。然而,在 E18.5 阶段观察到组氨酸衍生代谢物在胎儿胎盘、心脏、肝脏和脑组织中积累(图 6D-F)。特别是,组氨酸衍生的代谢物、组胺和咪唑-4-乙酸盐的明显积累(图6E-F)。
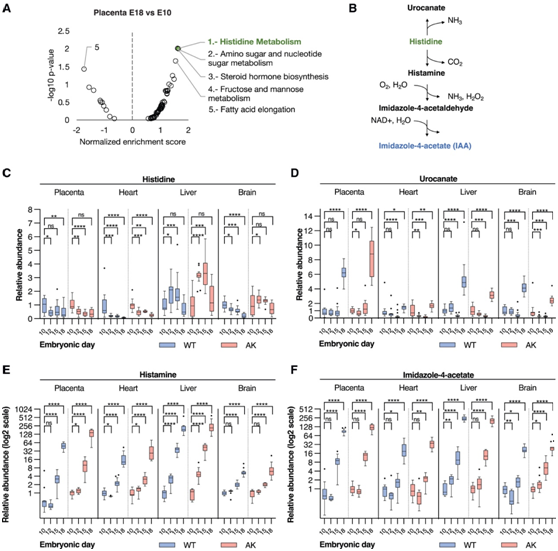
图6. 组氨酸衍生的代谢物在发育后期在胎儿组织中积累。
(A) 使用正离子模式非靶向数据的 MetaboAnalyst 通路分析突出显示了胎盘 E18.5 组织中组氨酸代谢相对于野生型母鼠 E10.5 的变化。(B) 组氨酸代谢途径示意图。(C-F)组氨酸及其衍生代谢物、尿酸盐、组胺和咪唑-4-醋酸酯在野生型(WT)和秋田(AK)胎鼠组织中的相对水平。
+ + + + + + + + + + +
结 论
本项研究使用13C-葡萄糖和液相色谱-质谱 (LC-MS),分析了胚胎 (E)10.5 至 18.5 天期间从怀孕母鼠采集的胎儿大脑、心脏、肝脏和胎盘的代谢情况,揭示了高血糖环境特有的代谢特征和可能表示正常血糖发育过程中发育转变的特征,观察到山梨醇在胎儿组织中的积累,以及从高血糖母鼠中分离出来的胎儿大脑中神经递质水平的改变。胎儿营养来源的不同,具体取决于母体血糖状态。无论血糖状态如何,组氨酸衍生的代谢物都会在晚期胎儿组织中积累。本项研究的数据集全面分析了由于母体高血糖引起的体内胎儿组织代谢和变化。
+ + + + +



 English
English


