文献解读|Nat Genet(31.7):阿尔茨海默病的遗传性和散发性形式的空间和单细胞核转录组分析
✦ +
+
论文ID
原名:Spatial and single-nucleus transcriptomic analysis of genetic and sporadic forms of Alzheimer’s disease
译名:阿尔茨海默病的遗传性和散发性形式的空间和单细胞核转录组分析
期刊:Nature Genetics
影响因子:31.7
发表时间:2024.11.22
DOI号:10.1038/s41588-024-01961-x
背 景
圣地亚哥·拉蒙·卡哈尔 (Santiago Ramón y Cajal) 等先驱者的基础性工作揭示了人类大脑在宏观和微观层面的空间组织,其中大脑回路和功能是结构组织的基础。单细胞核转录组分析(snRNA-seq)揭示了脑细胞群在分子水平上是异质性的。在阿尔茨海默病(AD)患者的大脑中,特定细胞群确定为相对于认知健康的大脑而言代表性不足或代表性过高,揭示了神经退行性疾病中选择性脆弱性的轴,并提供了有关AD中改变的基因、顺式调控元件和网络的基础知识。疾病相关细胞群转录组变化的功能后果仍然难以捉摸,而空间背景对于解决这个难题至关重要。
实验设计
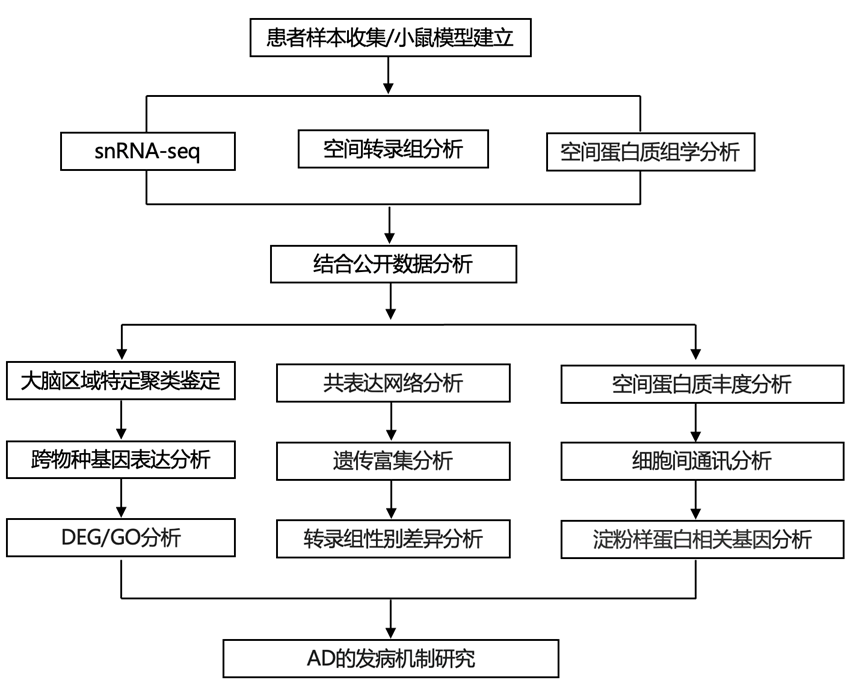
结 果
01
AD 的空间转录组学分析
研究团队收集了人类前额叶皮质 (FCX) 和 5xFAD 和野生型 (WT) 小鼠大脑进行了空间转录组分析(ST) (图1a-c),对 AD 进行了 空间分辨的跨物种基因表达研究。无偏聚类分析在人类数据集中确定了 9 个聚类——三个白质 (WM) 聚类和六个灰质 (GM) 聚类,涵盖皮质层——以及在小鼠数据集中确定了 15 个大脑区域特定聚类。他们根据已知的标记基因表达、组织定位和无偏聚类标记基因检测对这些聚类进行了注释。
他们还对认知健康对照和唐氏综合症 AD (DSAD)进行了 snRNA-seq。他们使用 scANVI 方法将该数据集与之前的三项 AD 研究进行基于参考的整合, 经过质量控制后共获得 585042 个细胞核(图1d)。聚类分析确定了所有主要的脑细胞类型,包括稀有的血管细胞群(图1e)。差异丰度分析揭示了细胞状态组成的广泛变化,尤其是在小胶质细胞、星形胶质细胞和血管细胞中,既包括选择性易损状态,也包括疾病反应状态。
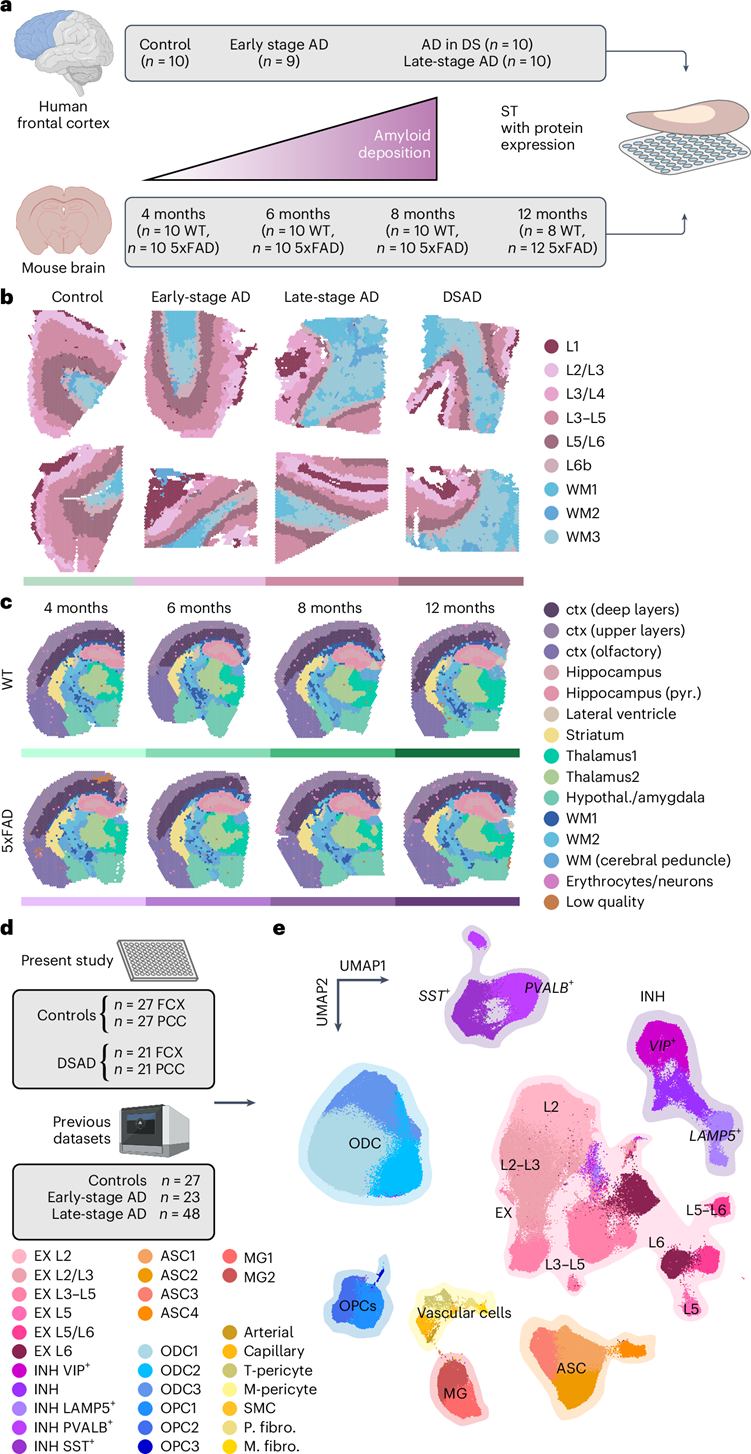
图1. 遗传性和散发性 AD 的 ST 和snRNA-seq。
(a)ST 实验流程。(b) 每种疾病条件下的两个代表性人类 ST 样本。(c) 每个时间点来自WT和 5xFAD 的一个代表性小鼠 ST 样本。(d) 对认知正常对照供体和 DSAD 供体的额叶皮质和 PCC 进行了 snRNA-seq 。(e) UMAP可视化。
02
区域和细胞类型特异性基因表达变化
为了识别与疾病相关的基因表达变化,他们对每个疾病组进行了差异表达 (DE) 分析,并与人类 ST 和 snRNA-seq 数据集的对照进行了比较。三体性表明DSAD 样本中 chr21 基因过表达,因此他们检测了染色体上的差异表达基因 (DEG),发现 chr21 基因过表达取决于区域或细胞类型(图2a-b)。例如APP在 DSAD 样本中上调,但有趣的是,在空间聚类 L3/L4 中与对照样本没有显著差异。他们发现聚类 L3/L4 中的基因在不同诊断中均显著下调,这可能反映了 L3 中的优先病理积累。L3/L4 层是认知过程的核心,其特征是密集的突触连接;这些 DEG 可能反映了对影响认知的病理变化的分子反应。使用 snRNA-seq 数据集对空间 DEG 进行反卷积表明,所有空间区域中上调的许多基因来自神经胶质细胞和血管细胞(图2c-d)。
他们还发现, 在大多数空间聚类中,诊断之间的 DE 效应大小具有高度相关性,而在大多数 snRNA-seq 聚类中具有中等相关性(图2e-f)。与 WM 聚类相比,这些趋势在 GM 聚类中更强,这与 snRNA-seq 数据一致,其中神经元聚类与神经胶质聚类之间的相关性更强。GO分析揭示了 AD 相关生物学途径的区域特异性富集,例如 L3-L5 中与长期增强相关的基因上调以及 L3/L4 和 L3-L5 中与淀粉样蛋白原纤维形成相关的基因下调(图2g-l)。类似地,他们将人类 ST DE 效应大小与 5xFAD 与 WT DEG 进行了比较,结果显示 5xFAD 模型重现了一些临床 AD 变化。

图2. AD 亚型中改变的基因表达特征。
(a) 按 DSAD 与对照差异基因表达分析的效应大小着色的热图,基因按染色体和空间区域分层。(b) 堆叠条形图显示按染色体分层的每个空间区域中 DSAD 与对照 DEG 的数量。(c) 热图显示 DSAD 和晚期 AD 之间共有的空间 DEG 的 snRNA-seq 数据集中的基因表达值。(d) 对空间 DEG 进行反卷积,条形图显示每个空间聚类中疾病增加或减少的 DEG 数量。(e) 早期 AD 与对照组以及 DSAD 与对照组的 效应大小比较。(f) 晚期 AD 与对照组以及 DSAD 与对照组的 DE 效应大小比较。(g-h) 与对照组相比,晚期 AD 和 DSAD 中均上调或下调的DEG 的选定通路富集结果。(i-j) 选定的通路富集结果仅来自在晚期 AD 中上调或下调的DEG。(k-l) 选定的通路富集结果仅来自在 DSAD 中上调或下调的DEG。
03
空间基因表达程序的系统级分析
他们在每个皮质层聚类和 WM 的 ST 数据集中进行了高维加权基因共表达网络分析 (hdWGCNA),从 7 个网络中产生了 166 个基因模块(图3a)。这些模块的层次聚类基于表达模式[模块特征基因 (ME)]及其组成基因集的相似性定义了 15 个皮质范围的“元模块”(图3a)。他们通过差异 ME (DME) 分析探究疾病组和对照之间的系统级差异(图3a)。比较不同诊断的 DME 效应大小,他们发现许多 DSAD 变化反映了AD 中的变化,以及每个组中唯一调节的模块(图3b-c)。早期 AD 中有几个模块在 WM 和 L3/L4 网络中专门下调(图3c),通路富集将这些模块与神经传递、神经发育和淀粉样蛋白-β 形成联系起来。或者,晚期 AD 中特定上调的大多数模块源自 L6b 网络,而 DSAD 中特定上调的模块主要来自 L1 和 L3/L4 网络。
接下来,他们试图在更广泛的 15 个元模块中比较疾病亚型。这些元模块富含参与髓鞘形成(M1)和化学突触传递(M3、M4、M7、M10 和 M13)的基因,以及之前涉及的过程,如谷氨酸信号传导(M6)、炎症反应(M11)和淀粉样蛋白原纤维形成(M14)(图3d)。这些元模块的 DME 分析显示,包含APP、SCN2A和CPE等枢纽基因的 M6在所有诊断中的 L1 中均上调(图3e)。虽然 L1 的神经元密度低于其他皮质层,但 M6 主要在神经元中表达,表明 APP 代谢、巨自噬和 RNA 剪接等过程在 AD L1 神经元中发生了改变。M11 在非神经元细胞中表达,并在皮质上层聚类中上调。M11 包含与免疫反应和神经元死亡相关的基因,其枢纽基因包括补体途径基因(C1QB和C3)和与疾病相关的星形胶质细胞基因(SERPINA3、VIM和CD44)。他们检测了小鼠 ST 数据集中的这些模块,发现 M1、M6 和 M11 的表达水平仅在5xFAD小鼠中与年龄相关,因此代表与疾病进展和淀粉样蛋白积累相关的变化(图3f)。模块保存分析表明,几乎所有元模块都在小鼠数据集中保存(图3g),但是M1、M6 和 M11 的保存程度中等到较弱。
他们还使用单细胞疾病相关性评分 (scDRS) 进行了遗传富集分析,以研究 AD 风险基因的细胞和区域富集,并确定疾病风险特征与共表达模块之间的联系。他们发现 DSAD 中的 L1、L3/L4 和 WM 聚类与 AD 遗传风险显著相关(图3h)。ST 点包含多个细胞,之前的研究表明 AD 遗传风险仅在髓系细胞中富集。5xFAD 小鼠的 AD 风险评分随着年龄的增长而增加,12 个月时几个区域的区域水平关联显著,包括深层皮质层和 WM(图3i)。此外,在所有四个 snRNA-seq 数据集中发现小胶质细胞聚类 MG1 和 MG2 存在显著的聚类级关联(图3j)。
接下来,他们将每个聚类中的元模块表达和 AD 风险评分与显著的 scDRS 组级关联进行关联(图3k)。虽然这些相关性很小,但在人类 ST 数据集中,他们发现 L3/L4 聚类与 DSAD 中的 M13、M10、M7 和 M11 的相关性最强。此外,他们发现 M11 与 5xFAD 小鼠的 AD 遗传风险相关,并且随着年龄的增长而增强。在 snRNA-seq 数据集中,M11 在小胶质细胞中高度表达,并且与所有数据集和疾病亚型中的 AD 遗传风险相关,与 MG1相比,活化的小胶质细胞聚类 MG2中的相关性更强。最后,通过全基因组关联研究 (GWAS),几个元模块成员基因与 AD 遗传风险相关联,例如M1中的BIN1 、M6 中的APP和APOE以及 M11 中的 clusterin (CLU)和ADAMTS1。

图3. 空间基因表达程序的系统级分析。
(a) 树状图显示 166 个共表达模块分为 15 个元模块。网络图代表一致的共表达网络;每个点是一个按元模块分配着色的基因。热图显示来自 DME 测试的效应大小。三角热图显示模块之间基因集和表达的距离。(b) 不同疾病组之间 DME 测试的效应大小比较。(c) 线图显示特定于疾病组的差异表达模块。(d) 每个元模块的选定通路富集结果。(e) 与对照组相比,每个疾病组元模块 DME 的热图。(f) 小提琴图显示小鼠 ST 中选定元模块的 ME。(g) 棒棒糖图显示投射到 5xFAD 小鼠数据集中的元模块的模块保存分析。(h) 人类 ST 聚类中 AD 的 st-DRS。(i) 在小鼠 ST 聚类中计算的 AD 的 st-DRS。(j) snRNA-seq 数据集中小胶质细胞中 AD 的单细胞疾病相关性分数。(k) 点图显示每组中 ST 点的百分比(以大小表示)和 ME 与 scDRS AD 富集的相关性。
04
不同 AD 亚型的转录组性别差异
先前的研究已经描述了 AD 临床表现、风险因素和基因表达的性别差异。他们发现了转录组范围内的差异,与雄性相比,雌性在空间聚类和所有染色体上基因普遍上调(图4a-c)。反卷积分析显示,雌性中上调的许多基因是神经胶质和血管基因,而雄性中上调的更多是神经元或少突胶质细胞基因(图4d)。GO 富集显示,与炎症、氧化应激和葡萄糖代谢有关的基因在雌性中上调,与大脑区域无关,而雄性的 DEG 与可变剪接、染色质组织和细胞骨架组织和运输有关(图4e-f)。他们发现小胶质细胞活化在雌性的 L6b 和 WM 中特异性富集,但淀粉样蛋白 β 相关过程在雌性和雄性特异性 DEG 中均富集。这种富集仅限于雄性的 L3-L5,表明与淀粉样蛋白加工相关的转录组性别差异具有区域特异性。基因集重叠分析表明,许多具有最大效应大小的 DEG 在多个区域之间共存(图4g)。C1QB (M11) 在 DSAD 雌性的所有空间区域中均上调,其中 WM 中的效应大小最高,他们使用免疫荧光在蛋白质水平上验证了这一点(图4h-j)。
为了研究 AD 中系统水平的性别相关转录组变化,他们在每个疾病组的雌性和雄性之间进行了 DME 分析(图4k-l)。在聚类L1 中,M11 在早期 AD 的雄性中上调,但在晚期 AD 和 DSAD 的雌性中上调,揭示了病理负荷高的雌性具有更强的神经炎症特征。sAD 中的许多区域特异性模块来自 L1 网络,但影响方向在早期和晚期之间转换(图 4l)。例如,模块 L1-M1 和 L1-M8 是雌性晚期 AD 中排名靠前的模块,也是雄性早期 AD 中排名靠前的模块之一,表明两性之间疾病相关基因表达变化的关键时间差异。总体而言,雌性晚期 AD上调的模块更多,而雄性早期 AD上调的模块更多。他们还比较了性别 DME 和诊断 DME 之间的 DME 效应大小(图4m),发现对照和疾病之间许多非 DE 的模块表现出性别差异。
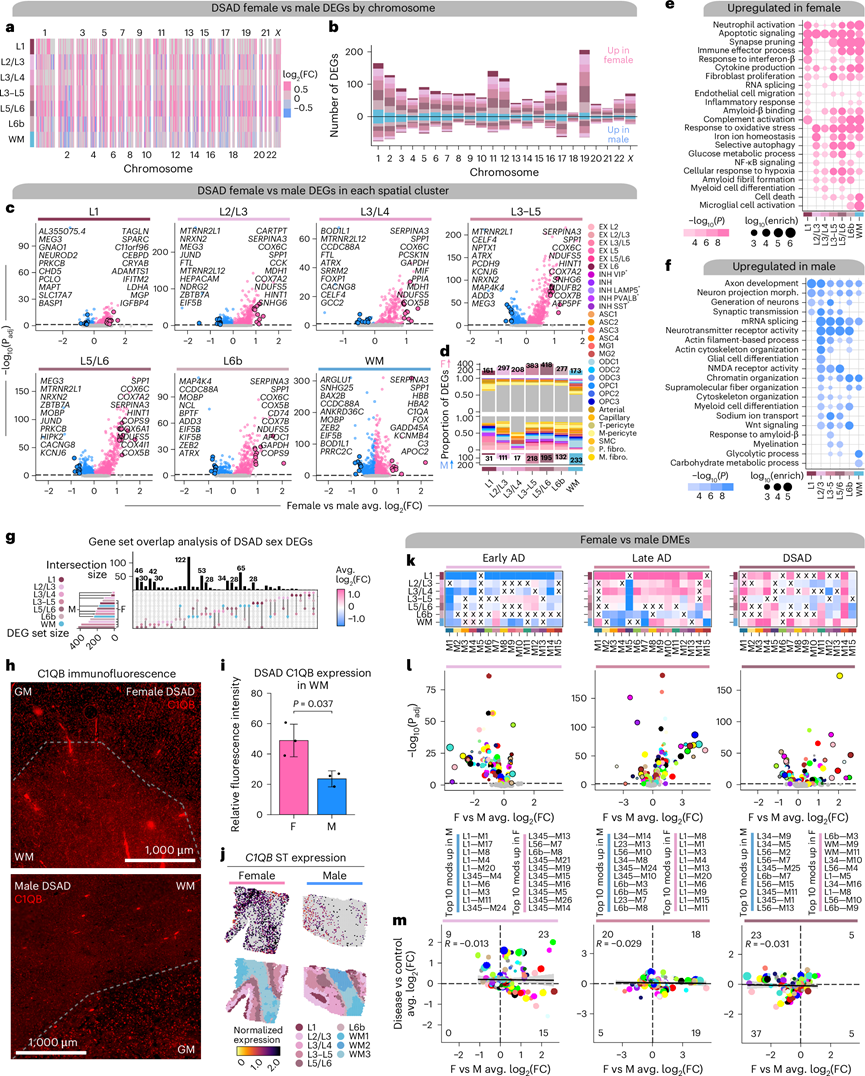
图4. AD 亚型中与性别相关的转录组差异。
(a) DSAD 雌性与雄性差异基因表达的效应大小,按染色体和空间区域分层的基因。(b) 堆积条形图显示按染色体分层的空间区域划分的 DSAD 雌性与雄性 DEG 的数量。(c) 火山图显示 DSAD 雌性与雄性 DE 的效应大小和显著性水平。(d) 每个聚类中雌性中上调或雄性中上调的 DEG 数量。比例条形图显示作为 snRNA-seq 标记基因的 DEG 的比例。(e-f) 通路富集分析。(g) 空间聚类中DEG 组之间的重叠。(h) 年龄匹配的雄性和雌性 DSAD 的前额叶皮质 (PFC) 的代表性图像。(i) 平均荧光强度。(j) 上:空间特征图显示代表性雌性(左)和雄性(右)DSAD 样本中的C1QB表达。下:按区域注释着色的样本。(k) 热图显示元模块 DSAD 雌性与雄性 DME 结果。(l) 火山图显示 DSAD 雌性与雄性 DME 分析的效应大小和显著性水平。(m) 性别和诊断测试之间的 DME 效应大小比较。
05
成像质谱流式细胞术 (IMC) 揭示蛋白质表达变化
接下来,他们使用 IMC 对 23 种蛋白质进行多重成像,包括细胞类型标志物、转录组分析的目的基因编码的蛋白质以及来自 AD 蛋白质组学研究的目的蛋白质(图5a-c)。他们分析了来自 ST 队列的 FCX 样本中的空间蛋白质表达模式,聚类显示 11 个群体(图5d)。他们建立了星形胶质细胞(GFAP +和 S100b +)、神经元(微管相关蛋白 2(Map2 +)和 NeuN +)、小胶质细胞(Iba1+)和富含细胞外基质蛋白或磷酸化 tau 的群体的空间蛋白质组学谱(图5e-f)。
他们比较了这些细胞群中不同疾病组的蛋白质丰度(图5g-l)。正如预期的那样,淀粉样蛋白 β 和磷酸化 tau 在 AD 神经元中显著增加,但 Map2 减少,表明神经退行性变(图5g)。与晚期 AD 相比,DSAD 神经元表现出磷酸化 tau 负担增加,星形胶质细胞聚类以高磷酸化 tau 为标志,可能吞噬了这些含有磷酸化 tau 的神经元并表明 DSAD 中的 tau 病理增加(图5j)。已知与淀粉样蛋白共定位的胱抑素 C (CST3) 在晚期 AD 和 DSAD 的小胶质细胞和星形胶质细胞中发生了显著变化(图5i)。在本研究的 ST 数据中,CST3在空间聚类 L3-L5 和 L5/L6 中的两个组均上调。他们还发现,在晚期 AD 和 DSAD 中,小胶质细胞和星形胶质细胞亚群中的CLU均显著上调, CD44表达增加(图5j-k)。CD44和CLU是元模块 M11 的中心基因,它在 5xFAD 和临床 AD 样本中均上调,表明在基因和蛋白质水平上均存在共调节作用。

图5. IMC 揭示 AD 中的单细胞空间蛋白质组学变化。
(a) 使用 Hyperion 成像系统在死后人类皮质组织中进行 IMC。(b-c) 来自对照、晚期AD和 DSAD 样本的代表性 IMC 图像。(d) UMAP图显示基于蛋白质强度值的 IMC 数据集中分割核的无偏聚类。(e) 堆叠条形图显示按疾病组分层的每个聚类中分配的分割核的比例。(f) 热图显示每个 IMC 聚类中每种蛋白质的相对蛋白质强度。(g-l) 小提琴图显示 IMC 聚类中选定蛋白质的蛋白质强度分布。
06
综合分析揭示细胞信号失调
他们通过使用 CellTrek 预测每个 snRNA-seq 细胞的空间坐标,并在将 snRNA-seq 群体按上皮质、下皮质或 WM 分层后使用 CellChat分析了疾病中的细胞间通讯 (CCC) (图6a)。这揭示了 CCC 景观的变化,根据 DSAD 和对照之间的相对信息流阐明了失调的通路(图6b)。他们重点研究了以下三种信号通路:NECTIN、ANGTPL 和 CD99。NECTIN 信号在 DSAD 中下调(图6c-f)。 Nectins 参与突触的维持,而NECTIN2与 AD 遗传风险有关。他们发现神经元 NECTIN 信号减弱(图6c-d),并且通过免疫荧光发现,在晚期 AD 和 DSAD 的神经元中 Nectin2 下调(图6g-h)。在对照样本中,ANGPTL 信号的特点是下皮质层中的星形胶质细胞聚类和 WM(分别为 ASC1 和 ASC3)通过配体ANGPTL4 与神经元、周细胞和少突胶质细胞前体细胞 (OPC) 进行通讯(图6i-l)。然而,在 DSAD 中,皮质上层的其他星形胶质细胞,如 ASC1 和 ASC3,表现出由ANGPTL4介导的显著相互作用。此前已观察到血管改变的 AD 患者的星形胶质细胞中 ANGPTL4 表达增加,ANGPTL4 和 GFAP 的共同免疫荧光证实了 DSAD 中的星形胶质细胞 ANGPTL4 上调(图6m-n)。他们注意到星形胶质细胞抑制神经元 ANGPTL 与疾病的通讯丢失,ANGPTL4是元模块 M11 的枢纽基因。此外,CD99也是 M11 的枢纽基因,但 CD99 信号在 DSAD 中下调,这通过免疫荧光得到证实。

图6. DSAD 中改变的细胞间通讯信号网络。
(a) CCC 分析的示意图。(b) 条形图显示 DSAD 和对照之间具有显著差异的信号通路。(c-d) 网络图显示对照和 DSAD中不同细胞群之间NECTIN 信号的 CCC 信号强度。(e) 对于选定的 NECTIN 信号基因,一个对照样本(左)和一个 DSAD 样本(右)的预测空间坐标中的 snRNA-seq 空间特征图。(f) 点图显示对照(上)和 DSAD(下)中具有显著 CCC 相互作用的 NECTIN 信号基因的基因表达。(g) 代表性双重免疫荧光图像。(h) 共定位分析的结果。(i-j) 对照和 DSAD中 ANGPTL 信号的网络图。(k) 空间特征图。(l) 具有显著 CCC 相互作用的 ANGPTL 信号基因的基因表达。(m) 代表性双重免疫荧光图像。(n) 共定位分析的结果。
07
构象特异性淀粉样蛋白基因表达特征
深入表征淀粉样蛋白病理和相关分子变化对于了解 AD 发病机制至关重要。因此,他们用 Amylo-Glo 对人类和小鼠 ST 组织进行染色以检测致密的淀粉样蛋白-β斑块,用抗淀粉样蛋白原纤维 OC 抗体 (OC) 检测弥漫性淀粉样蛋白原纤维(图7a-b)。在人类数据集中,他们发现淀粉样蛋白病理分布与神经病理斑块分期一致(图7c),并且他们观察到 5xFAD 中皮质和皮质下区域的淀粉样蛋白沉积随年龄增长而增加。通过整合淀粉样蛋白成像和转录组数据,他们在人类数据集中确定了淀粉样蛋白热点以及这些热点附近的 65 个斑块相关基因和 215 个原纤维相关基因(图7d-f)。与斑块和原纤维相关的基因包括诊断 DEG 和 M11 枢纽基因、CLU和VIM,并在中间丝组装、长期增强和血脑屏障转运等过程中富集(图7g-h),原纤维特异性基因与突触功能和造血有关(图7i)。
在小鼠数据集中,他们在每个空间聚类内鉴定了淀粉样蛋白相关基因,发现了 1829 个斑块相关基因和 1759 个纤维相关基因,其中海马锥体和上皮质层聚类中的重叠最大(图7f)。 GO 富集将这些基因集与炎症和神经退行性过程联系起来(图7j),并且它们与之前报道的在 AD 小鼠模型中鉴定的基因特征重叠。纤维特异性基因包括Itgb2、Cd53和Il33,表明斑块形成之前存在独特的免疫特征。他们发现人类和小鼠淀粉样蛋白相关基因之间存在适度但显著的重叠,特别是斑块相关基因和小胶质细胞基因在小鼠中更常见(图7k)。皮质中共有的纤维相关基因包括NEFH、NEFM、ALDOC和MAFB。值得注意的是,元模块 M11 的枢纽基因VIM和CLU是共有的淀粉样蛋白相关基因之一,并且 M11 的表达与淀粉样蛋白热点弱相关,暗示它参与了跨物种淀粉样蛋白相关过程。此外,5xFAD ST 数据集中的共表达网络分析发现了一个淀粉样蛋白相关基因模块 (SM6),它与之前发现的一组“斑块诱导”基因共有相似的基因和表达模式(图7l-m)。

图7. 淀粉样蛋白相关基因表达特征。
(a-b) 代表性荧光图像。(c) 箱线图和晶须图显示人类 ST 数据集中淀粉样蛋白定量的分布。(d-e) 人类和小鼠的淀粉样蛋白热点结果。(f) 小鼠聚类中 Amylo-Glo、共有和 OC 的淀粉样蛋白相关基因数量。(g) 与疾病 DEG 重叠的 Amylo-Glo 和 OC 相关基因数量。(h-i) 通路富集结果。(j)通路富集结果。(k) 热图显示小鼠和人类淀粉样蛋白相关基因以及其他基因集的基因集重叠结果。(l) SM6 和 PIG模块在代表性小鼠 ST 样本中的表达。(m) 欧拉图显示 SM6 和 PIG的重叠。(n) 概述了整个研究的实验、数据分析和选定的结论。
+ + + + + + + + + + +
结 论
本项研究确定了可能导致皮质层优先病理积累的转录组变化,空间共表达网络分析揭示了短暂和区域限制的疾病过程,包括在皮质上层失调并与 AD 遗传风险和淀粉样蛋白相关过程有关的神经胶质炎症程序。细胞间通讯分析进一步将该基因程序置于失调的信号网络中。最后,本研究从淀粉样蛋白 AD 小鼠模型生成了 ST 数据,以识别具有构象背景的跨物种淀粉样蛋白近端转录组变化。
+ + + + +



 English
English


