文献解读|Genome Biol(10.1):癌症和微环境细胞的perturb-seq分析胶质母细胞瘤的肿瘤驱动因素和放射处理反应
✦ +
+
论文ID
原名:In vivo perturb-seq of cancer and microenvironment cells dissects oncologic drivers and radiotherapy responses in glioblastoma
译名:癌症和微环境细胞的perturb-seq分析胶质母细胞瘤的肿瘤驱动因素和放射处理反应
期刊:Genome Biology
影响因子:10.1
发表时间:2024.10.07
DOI号:10.1186/s13059-024-03404-6
背 景
由于缺乏在单细胞分辨率下进行多重遗传扰动的方法,对体内生理和疾病状态下基因功能的理解受到限制。CRISPR 功能基因组学彻底改变了对遗传和表观遗传扰动如何影响细胞类型和细胞状态的理解。然而,现有的体内功能基因组学方法主要集中于群体平均表型,掩盖了对多细胞生物学、疾病和对刺激的反应至关重要的细胞异质性和细胞间相互作用。将 CRISPR 筛选结合单细胞转录组学技术 (Perturb-seq) ,可以使用单细胞水平上的高维基因表达读数对基因功能进行表型分析。Perturb-seq 表型已用于根据共同功能将基因聚类到通路中,从而可以识别和表征具有以前未知功能的基因,也可以绘制基因之间的上位关系。perturb-seq 的单细胞特性还可以测量细胞异质性、反卷积细胞周期效应,并且适用于分析稀有细胞类型。然而,这些研究大多集中在体外基因功能,利用离体扰动,或仅限于发育障碍。由于组织和器官由多种具有共同物理和旁分泌相互作用的细胞类型组成,同时受到免疫系统、脉管系统和组织结构的影响,因此使用 perturb-seq 进行单细胞转录组筛选在体内尤其有必要。
实验设计
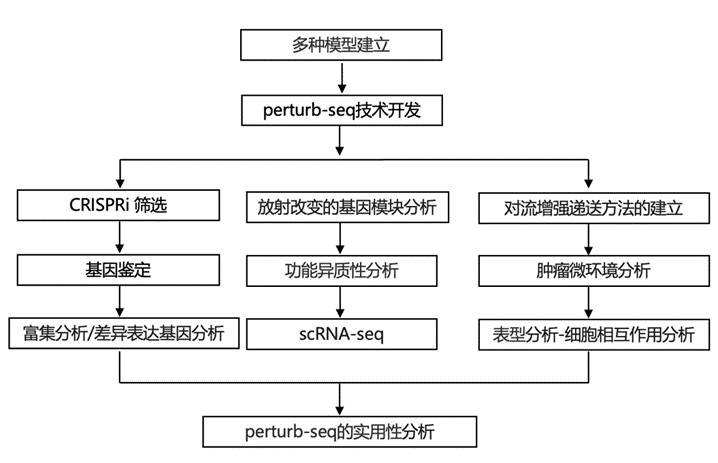
结 果
01
同源胶质母细胞瘤能够模拟放射处理反应并识别致癌驱动因素
为了在具有完整肿瘤免疫微环境的肿瘤模型中进行体内perturb-seq,研究团队首先利用了胶质母细胞瘤 (GBM)模型 GL261,该模型可以模拟人类肿瘤,也可以开发 CRISPRi 功能丧失筛选模型,以便使用perturb-seq进行进一步研究(图 1 A)。GL261 同种异体移植是一种成熟的模型,可模拟侵袭性人类 GBM,其肿瘤特征包括侵袭性生长、新血管形成和原位肿瘤形成,且免疫系统完整。移植到 C57BL/6 小鼠纹状体中的 GL261 细胞建立了肿瘤,用分次放射处理(RT)(2 Gy × 每日 5 次)延长了 GL261 同种异体移植物的存活期(图 1B),这与放射处理在此模型中已知的疗效但非治愈性性质相一致,并且更广泛地用于 GBM。然后,他们生成了表达 CRISPRi (dCas9-KRAB) GL261 细胞系。为了鉴定调节 GBM 肿瘤发生和细胞对放射处理反应的基因,他们随后在这些细胞中针对 5234 个癌症相关和/或可用药基因进行了大规模 CRISPRi 筛选,并进行放射处理(2 Gy × 每日 5 次),确定了 230 个在控制条件下改变细胞生长的基因和 49 个改变辐射抗性/敏感性的基因(图 1 C)。GO分析显示细胞周期、蛋白酶体和 DNA 复制基因的富集,而辐射敏感分析显示非同源末端连接、同源重组和范可尼贫血通路的富集(图 1 D),CRISPRi 筛选数据有效地鉴定了 GL261 GBM 模型中感兴趣的基因。
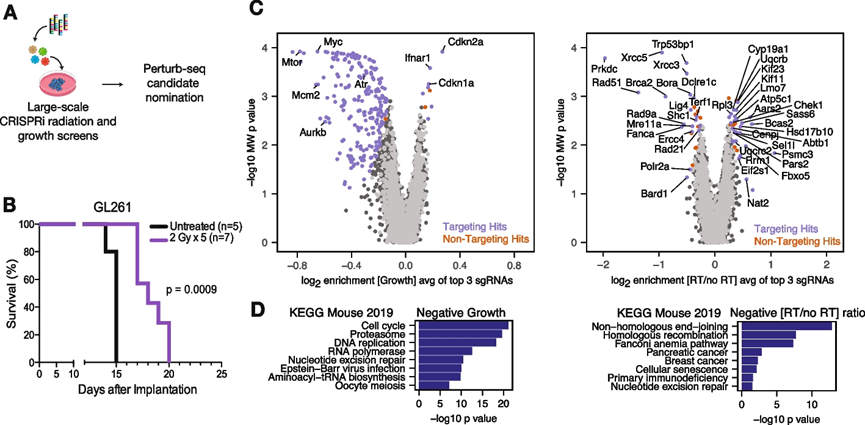
图1. CRISPRi 筛选可确定 GBM 中的致癌驱动因素和放射处理反应的修饰因子。
(A) 体外筛选工作流程示意图,用于perturb-seq的候选基因。(B)生存曲线。(C) GL261细胞中生长(左)或辐射生长比(右)表型中每个基因靶标对应的前 3 个 sgRNA 的富集火山图。(D) GO富集分析。
02
体外perturb-seq对抗致癌驱动因素和放射处理反应的修饰因素
为了进一步鉴定 CRISPRi 筛选中发现的调节细胞生长和放射处理反应的基因的功能,他们选择了 48 个基因,在体外生长的 GL261 细胞中通过perturb-seq进一步鉴定(图 2 A)。将针对每个基因的前两个 sgRNA(基于 CRISPRi 筛选表型)克隆到双 sgRNA 慢病毒载体中,并将包含此文库和阴性对照 sgRNA 的慢病毒转导到稳定表达 dCas9-KRAB 的 GL261 细胞中。对于体外perturb-seq,培养物通过 FACS 分选出 sgRNA+ 细胞,用分次放射处理(2 Gy × 5)或不处理(0 Gy)处理,然后收获用于直接捕获 sgRNA 标签的单细胞转录组分析(scRNA-seq)。正如预期的那样,sgRNA+ 细胞主要表达两种 sgRNA,一小部分细胞表达四种 sgRNA,这反映了由两次慢病毒感染事件或细胞双联体感染的细胞。由于 CRISPRi 通过转录抑制使基因沉默,他们定量了细胞中基因沉默的强度,并分别显示在无处理和放射处理条件下中位靶基因抑制率为 88.2% 和 83.3%(图 2 B)。
然后,他们使用差异基因表达分析和基因集富集分析定量了每个 CRISPRi 遗传扰动的转录组表型(图 2C)。在没有放射处理的情况下,35 个靶基因的扰动导致至少一个基因模块发生显著改变(图2C)。他们观察到已知与特定基因模块密切或因果注释的遗传扰动的预期变化。例如,MTORC1 信号基因模块因Mtor的扰动而下调最多,而Myc的扰动显著下调了 MYC 靶标 V1 和 V2(图 2C)。层次聚类揭示了按筛选表型和模块改变分组。例如,阳性生长突变Cdkn1a、Cdkn2a和Rad21聚集在一起,并以 MYC 靶点、G2M 检查点和 E2F 靶点基因表达增加为特征(图 2C)。线粒体定位的复合物 III 成分Uqcrb和Uqcrc2聚集在一起,Atr及其下游靶点Chek1也是如此。尽管分子功能不同,但Kif11和Ifnar1基于干扰素 α、干扰素 γ 和 TNFα 信号的显著下调而聚集在一起,揭示了来自不同人群筛选表型的趋同炎症反应(图 2C)。
为了确定放射处理背景下基因扰动引起的分子改变,他们定量了用分次放射处理(2 Gy × 5)处理的 GL261 细胞培养物中相同扰动的转录组表型(图 2 D)。当内部标准化为表达非靶向对照 sgRNA 的受辐照细胞时,DNA 损伤反应相关的调节因子(例如Brca2、Ercc4、Lig4、Mre11a、Prkdc)、有丝分裂(例如Bora)和代谢(例如Hsd17b10、Cyp19a1)与没有放射处理的情况下的相同扰动相比表现出更多的通路改变(图 2 D)。与单独的 CRISPRi 扰动相比,放射处理背景下的某些扰动(例如Myc、Atr和Chek1)不会在干扰素/炎症反应或 p53 通路中产生高强度的表达变化(图 2 D)。这些基因表达变化显示炎症反应的均质上调、细胞凋亡和 MYC 靶标的下调,因此体外放射处理可能掩盖了改变放射处理反应的基因的分子功能的异质性。与这一发现一致的是,线性判别分析 (LDA) 揭示了单个细胞在 UMAP 空间中因扰动而聚集,且具有不同的表型,而随着放射处理的增加,单个细胞的分布更加广泛(图 2 E)。即使在通过对每个扰动进行下采样以在放射处理和无放射处理条件下将细胞覆盖率标准化后,扰动细胞的 UMAP 密度仍然较低(图 2 F)。
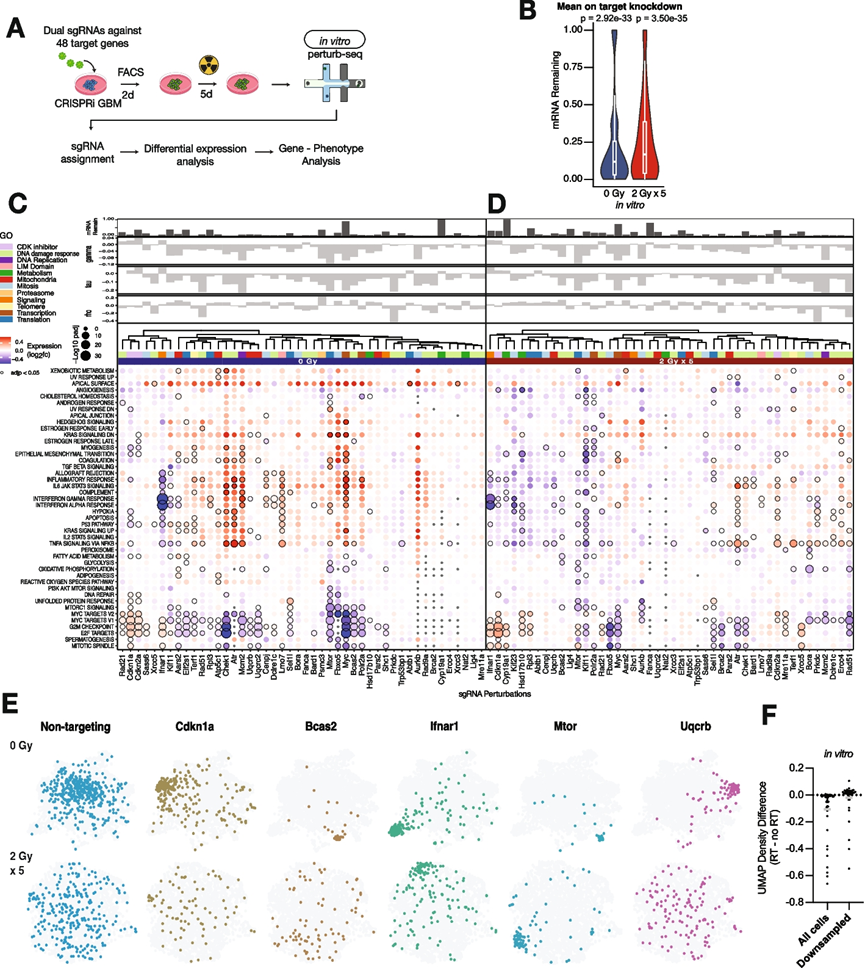
图2. 体外perturb-seq针对 GBM 细胞中的致癌驱动因素和放射处理反应的修饰因素。
(A)实验流程示意图。(B) 在任一处理条件下,所有体外扰动的平均靶向敲低水平分布。(C) 在没有放射处理的情况下,sgRNA 扰动(列)后基因表达模块(行)的基因集富集分析的气泡图。(D) 与(C)相同,但在放射处理条件下。扰动表型标准化为表达非靶向 sgRNA 的辐照细胞。(E) LDA UMAP 图显示在无放射处理或放射处理条件下表达指示 sgRNA 的单个细胞的分布。(F) 放射处理 (RT) 和无处理 (no RT) 条件下的扰动之间的 UMAP 高斯核密度差异。
03
对抗致癌驱动因素和放射处理反应的相关因子
胶质母细胞瘤细胞在体内对放射处理的抵抗力通常比在体外更强,这可能是因为多种肿瘤特异性因素在体外无法轻易重现。为了确定 GBM 中致癌驱动因素和放射处理反应背后的分子途径,他们通过在体内肿瘤发生之前用 sgRNA 文库离体转导细胞(以下称为体内预感染的 perturb-seq),在 GL261 细胞中建立了体内 perturb-seq 平台(图 3 A)。将针对体外 perturb-seq 中的相同 48 个基因的 GFP 标记的双 sgRNA 慢病毒文库转导到 GL261 dCas9-KRAB 细胞培养物中,用嘌呤霉素选择 sgRNA 表达,然后移植到 C57BL/6 小鼠颅内。让肿瘤生长 5 天,然后用分次放射处理 (2 Gy × 5) 或不处理 (0 Gy) 进行处理,然后进行单细胞解离和scRNA-seq,直接捕获 sgRNA 标签。处理 GFP 分选的细胞以及未分类的组织解离物,以捕获细胞异质性的全部范围。除了 GL261 恶性细胞外,还根据转录组谱鉴定了 20 种不同的基质或免疫微环境细胞类型,这些细胞可通过mRNA 表达识别(图 3 B-C)。CRISPRi 敲低分析显示,在无处理和放疗条件下,中位靶基因抑制分别为 96.5% 和 92.2%(图 3 D)。
然后,他们使用差异表达基因分析生成了扰动-表型图,揭示了在没有放射处理的情况下有 24 个靶基因具有超过 100 个差异表达基因,有放射处理的情况下有 34 个靶基因。在对每个扰动的 sgRNA 覆盖率进行标准化后,观察到放射处理条件下差异表达基因的数量增加。通过质量控制过滤器的 40 个和 30 个靶基因的扰动分别导致在没有或有放射处理的情况下至少一个基因模块发生显著改变(图3 E-F)。他们对没有辐射的情况下基因模块改变的分析证明了预期的生物学特性。例如V2基因模块因Myc的扰动而下调幅度最大,而干扰素和炎症通路因Ifnar1的扰动而下调幅度最大(图 3 E)。令人惊讶的是,某些具有放射增敏 CRISPRi 筛选表型的基因(如Mre11a、Fanca和Ercc4)的扰动即使在没有体内放射处理的情况下也表现出显著的基因模块改变(图 3 E),这是体外perturb-seq所未见的现象(图 2 C)。
然后,他们分析了在接受放射处理的 GL261 体内肿瘤中遗传扰动引起的基因模块改变。一组针对参与 DNA 损伤反应的基因的扰动(Xrcc5、Lig4、Prkdc、Brca2、Mre11a、Rad51)表现出放射处理依赖性的缺氧和炎症反应上调(图 3 F),而其他具有放射处理敏感表型的基因(如Bard1)则表现出干扰素 α 和干扰素 γ 反应的降低。与这些结果一致的是,通过体外细胞因子分析测定, Bard1的干扰减少了多种细胞因子的分泌,包括 MCP-1、MIP-1α、 MIP-1β和 TNFα。同样,Ifnar1的干扰除了影响 VEGF 之外,还减少了这些细胞因子的分泌。相反,Atr的干扰导致 IFNγ 和 VEGF 的分泌增加。在放射处理的背景下,15 个扰动中的胆固醇代谢显著上调(调整后的p值 < 0.05),而无放射处理的情况下只有 3 个扰动(图3 E-F)。这些通路改变表明放射处理重塑了转录反应,以应对调节致癌功能或 GBM 中放射反应的基因的丢失(图 3 F)。这些放射处理依赖性表型在 LDA UMAP 空间中也很明显(图 3 G)。虽然在放射处理条件下表达针对 DNA 修复因子(例如Mre11a或Rad9a)的 sgRNA 的细胞预计会耗竭,但即使在控制细胞计数后,在放射处理背景下受到扰动的细胞中观察到的 UMAP 密度增加仍然保持不变(图 3 H)。虽然体内预感染的 perturb-seq 揭示了许多体内和放射处理依赖性表型,但这种方法的一个局限性是对具有强烈负生长表型的扰动的覆盖率相对较低,这阻碍了对放射处理条件下的关键基因靶标(如Mtor或Aars2)的分析。

图3. 使用预感染的 GL261 细胞对致癌驱动因素和放射处理反应修饰因子进行体内perturb-seq。
(A) 示意图。(B) 含有预感染的 GL261 细胞(包括分选和未分类的细胞)的原位肿瘤的恶性和基质/微环境细胞的整合 scRNA-seq UMAP。(C) 来自 B 的整合 scRNA-seq UMAP与BFP(dCas9-KRAB 的标记;左)或 sgRNA(右)表达水平叠加。(D) 在任一处理条件下所有体内预感染扰动的平均靶向敲低水平分布。(E) 在未进行放射处理的情况下,对体内预感染的扰动序列进行 sgRNA 扰动(列)后,基因表达模块(行)的基因集富集分析的气泡图。(F) 与(E)相同,但在放射处理条件下。扰动表型标准化为表达非靶向 sgRNA 的受辐照肿瘤的细胞。(G) LDA UMAP 图显示在无放射处理或放射处理条件下表达指示 sgRNA 的体内预感染实验中单细胞的分布。
04
对流增强递送可在肿瘤建立后实现体内perturb-seq
为了在天然生理环境下发生遗传干扰的肿瘤细胞中进行单细胞 CRISPR 筛选,他们进行了体内perturb-seq,使用对流增强递送 (CED) 将 sgRNA 慢病毒直接递送到原位 GBM(图 4 A)。将稳定表达 CRISPRi 机制 (dCas9-KRAB) 的 GL261 GBM 细胞移植到 C57BL/6 小鼠的纹状体中。肿瘤建立后,使用 CED 将靶向体外 CRISPRi 筛选中的 48 个基因(图 1)以及体外/预感染干扰测序中靶向的慢病毒双 sgRNA 文库(图 2 A、图3 A)以及非靶向对照递送到颅内肿瘤。动物接受颅脑分次放射处理(2 Gy × 5 次每日分次)或不接受处理(0 Gy)。然后将肿瘤显微切割、分离、分选 sgRNA+ 细胞,并收获肿瘤用于scRNA-seq并直接捕获 sgRNA 标签。FACS 分选的 sgRNA 阳性细胞和 sgRNA 阴性细胞从未分类的群体中整合,揭示了整个 UMAP 空间中的 22 个免疫、基质和恶性细胞群(图 4 B)。sgRNA UMI 计数分析证实了单个慢病毒载体整合事件,因为总 sgRNA UMI 计数与来自 sgRNA A 和 sgRNA B 的 sgRNA UMI 计数总和高度相关。几乎所有 sgRNA 阳性细胞都是 GL261 恶性细胞,保留了 2153 个仅表达预期的双 sgRNA 载体的体内 GL261 细胞(图 4 C-D)。与使用预感染细胞的体内perturb-seq实验相比,CED perturb-seq可以更好地恢复靶向Myc和Mtor等必需基因的 sgRNA ,从而能够对肿瘤维持中的重要基因进行转录表型分析。CRISPRi 敲低功效分析显示,在无处理和放疗条件下,中位靶基因抑制率分别为 95.5% 和 95.6%(图 4 E)。
然后,他们使用差异表达分析定量了 CED 后每个 CRISPRi 遗传扰动的转录组表型,在没有放射处理的情况下,8 个靶标通过了质量和覆盖率过滤器,具有超过 100 个差异表达基因,在有放射处理的情况下,有 15 个靶标。在对每个扰动的 sgRNA 覆盖率进行标准化后,观察到放射处理条件下差异表达基因的数量增加。在没有或有放射处理的情况下,通过质量控制过滤器的 38 个和 26 个靶基因的扰动分别导致至少一个基因模块发生显著改变(图 4 F-G)。在没有放射处理的情况下MTORC1 信号传导通过 CED对Mtor的扰动下调最多,而Myc的扰动显著下调了 MYC 靶标 V1 和 V2(图 4 F)。由扰动引起的基因表达变化的层次聚类显示出多个聚类,这些聚类可通过改变的基因模块或已知的靶基因功能来区分(图 4 F)。虽然在没有放射处理的情况下的体外生长筛选表型与许多扰动的聚类相关,但体内转录反应在某些情况下是相同的,尽管体外筛选表型相反(图 4 F)。例如,Ifnar1扰动下调了干扰素和炎症信号, Lig4或Rad21的扰动也是如此,它们在 DNA 损伤反应中发挥作用,并且在生长筛选中表现出与Ifnar1相反的表型(图 4 F)。相反,Atr的扰动导致干扰素反应上调,而Myc的扰动在 CED 实验中上调了 STAT3/5 信号(图 4 F)。Atr 、Myc和Mtor 的扰动也以氧化磷酸化基因的共同下调为特征(图 4 F)。线粒体成分(Uqcrb、Uqcrc2、Pars2、Atp5c1)也聚集在一起。
然后,他们在体内颅脑放射处理的背景下分析了 CED 扰动。在放射处理条件下,归一化为非靶向 sgRNA,在放射处理条件下观察到基因表达模块的异质性改变(图 4G)。与没有放射处理的扰动相比,在有放射处理的情况下,CED 扰动表现出炎症/干扰素信号的上调,以及 p53 通路的激活,即使在标准化为表达非靶向 sgRNA 的相同受照射肿瘤的细胞后也是如此(图 4G)。转录死亡程序分析表明,除了 p53 激活之外,铁死亡驱动因子 在Trp53bp1受到干扰后也显著上调,并且凋亡基因表达模块在 7 种干扰-处理组合中显著失调。
鉴于体内扰动在放射处理后重塑了转录反应,他们想知道扰动与放射处理相结合是否可以建模为无放射处理情况下扰动效应和单独放射处理效应的线性组合,并具有协同作用的潜力。于是,他们使用 CINEMA-OT(具有最佳传输的因果独立效应模块归因)来评估协同得分,协同得分定义为联合处理的观察到的表型与假设遗传扰动和放射处理之间存在线性加法关系的预测表型之间的差异。与体外或感染前环境相比,大多数带有 CED 的扰动的协同得分更高(图 4 H)。体外 CRISPRi 筛选辐射表型与协同指标叠加显示出很小的相关性(图 4 H),证明了体内 CED perturb-seq在揭示体内放射增敏和抗性基因靶点的作用方面的效用。

图4. 使用对流增强递送在肿瘤建立后进行体内perturb-seq。
(A) 体内CED perturb-seq工作流程示意图,针对由基因组规模 CRISPRi 筛选的靶基因,结合或不结合 2 Gy × 5 次放射处理。(B) CED后原位 GL261 肿瘤的恶性和基质/微环境细胞的整合 scRNA-seq UMAP,包括已分选和未分类的细胞。(C) 用标记有EGFP的 sgRNA 文库转导的 GL261 原位肿瘤的共聚焦图像。(D) 恶性和基质/微环境细胞的整合 scRNA-seq UMAP与 BFP(dCas9-KRAB 的标记;左)或 sgRNA(右)表达水平叠加。 (E) 在任一处理条件下所有体内 CED 扰动的平均靶向敲低水平分布。(F-G)对 sgRNA 干扰(列)后的基因表达模块(行)的基因集富集分析的气泡图,用于体内 CED perturb-seq。
05
对流增强输送可实现肿瘤微环境内的体内perturb-seq
由于癌症包括基质或免疫微环境的恶性和非恶性宿主细胞他们想知道体内 CED perturb-seq 是否可以应用于 GBM 肿瘤中的基质或免疫微环境细胞。为此,他们使用了 SB28 同源小鼠 GBM 模型,该模型由Nras过表达驱动,并建立了类似于人类 GBM 的富含髓细胞的肿瘤免疫微环境。虽然 GL261 和 SB28 都在免疫功能正常的动物中形成原位肿瘤,但 SB28 肿瘤缺乏 T 细胞并对免疫疗法产生抵抗力,这更能反映人类 GBM。将不表达 CRISPRi 机制的 SB28 细胞颅内移植到组成性表达 dCas9-KRAB 的免疫活性小鼠中,从而实现细胞类型选择性 sgRNA 稳定化和微环境细胞中基因敲除,但恶性细胞中则不然(图 5 A)。鉴于靶基因(Apoe、C1qa、Cd44、Cd74、Lyz2、Ptprc )在 GBM 发病机制中的重要性和处理干预的潜力,根据髓系中细胞类型特异性表达或功能选择进行扰动。他们通过 CED 将慢病毒 sgRNA 文库(3 个单独的 sgRNA 分别靶向 6 个靶基因,包括一个非靶向 sgRNA)注射进 SB28 肿瘤,在 CED 后 5 天解剖肿瘤,并对 FACS 分类和未分类的肿瘤进行 scRNA-seq,直接捕获 sgRNA。分析显示,肿瘤微环境中存在多种非癌细胞类型(例如巨噬细胞、星形胶质细胞、内皮细胞),与 SB28 癌细胞共存,可通过Nras过表达轻松区分(图 5 B-D)。与 SB28 同种异体移植中的高丰度一致,巨噬细胞、小胶质细胞和神经胶质细胞代表了这些肿瘤中 sgRNA 表达细胞的绝大部分,涵盖来自四次重复实验的 6909 个 FACS 分选细胞(图 5 C-D)。来自 CED perturb-seq 实验的未分类的 SB28 和 GL261 肿瘤的综合 UMAP 分析表明,总共有 27 种细胞类型聚类,并且 SB28 原位肿瘤含有更大比例的巨噬细胞和小胶质细胞,而与 GL261 肿瘤相比 CD4 + T 细胞较少。对CRISPRi敲低水平的分析表明,在本实验中分析的不同细胞类型中,靶基因抑制存在异质性,并且只有敲低率超过30%(mRNA剩余量少于70%)的sgRNA才会保留下来,以便在每种细胞类型中进行后续分析。
在具有足够 sgRNA 覆盖的细胞类型[巨噬细胞、小胶质细胞、星形胶质细胞、少突胶质细胞、少突胶质细胞祖细胞 (OPC)]中,对 CED 后每种 CRISPRi 遗传扰动的转录组表型进行量化,结果显示存在细胞类型依赖性的基因模块改变(图 5 E)。然后,他们研究了在体内巨噬细胞中 扰动磷酸酶Ptprc的后果,因为其促炎表型跨越多个基因模块,而在其他细胞类型中扰动同一靶标后未观察到这种现象(图5 E)。Ptprc敲低导致与干扰素 α 和干扰素 γ 反应以及 IL2/STAT5 和 TNFα 信号传导相关的基因上调(图 5 E),这与Ptprc在先天免疫和细胞因子信号传导中的作用一致。为了确定遗传扰动是否会影响 SB28 颅内肿瘤内的细胞间相互作用,他们使用 CellChat识别了假定的细胞间相互作用。Ptprc、Lyz2、C1qa或Cd44的扰动导致先天性(即巨噬细胞和小胶质细胞)和适应性免疫细胞(即 T 细胞和 NK 细胞)之间的细胞间相互作用频率发生改变,这表明遗传扰动可能会影响不同细胞类型之间的相互作用。然后,他们定量了Ptprc抑制后巨噬细胞和其他细胞类型与表达非靶向对照 sgRNA 的巨噬细胞和其他细胞类型的通讯概率的成对差异。Ptprc敲低后,Ccl5-Ccr1/3/5与免疫细胞和基质细胞类型的相互作用增加(图 5 F),反映了Ptprc在巨噬细胞中敲低的整体促炎表型(图 5 E)。相反,巨噬细胞中的Ptprc敲低也通过抑制Thbs1、Ccl6、Ccl9和Ptprc本身来消除细胞间相互作用,从而降低巨噬细胞与树突状细胞、小胶质细胞、SB28 恶性细胞等细胞类型之间的通讯概率(图 5 F)。
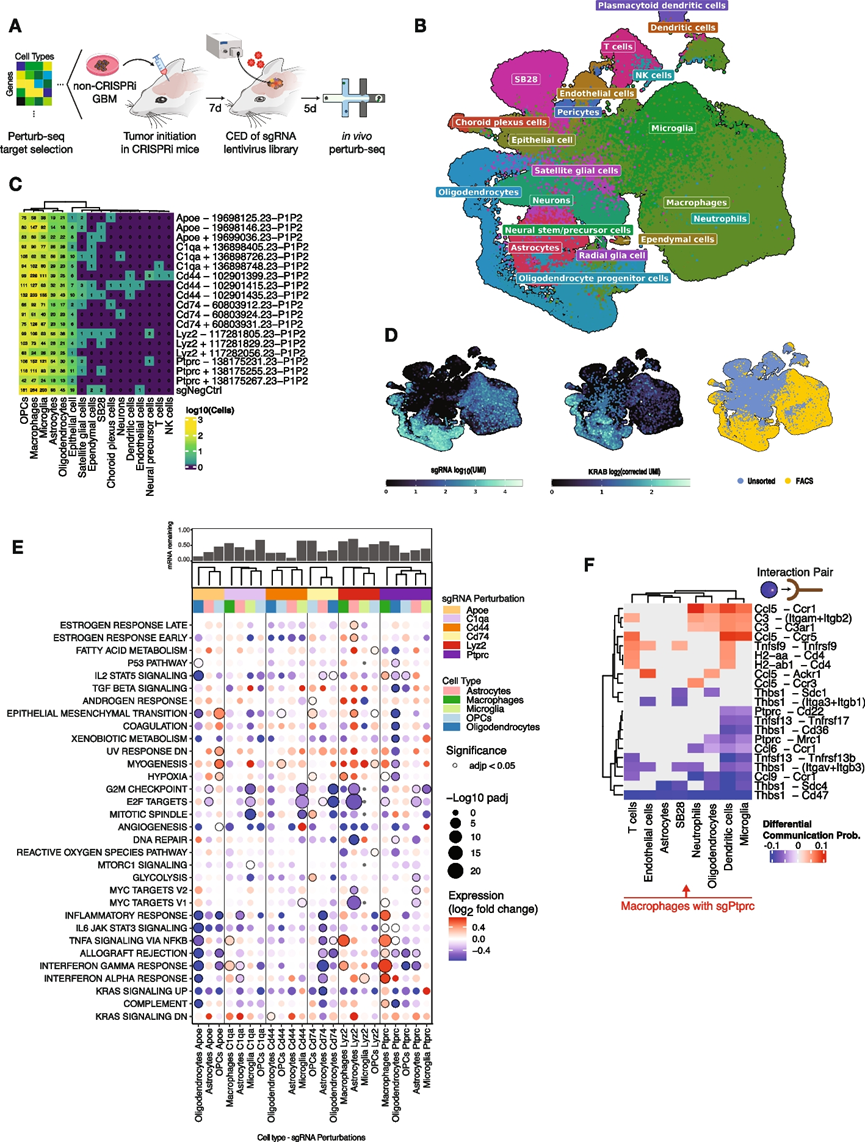
图5. 肿瘤微环境细胞中的体内perturb-seq。
(A) 针对靶基因的原位 SB28 GBM 同种异体移植模型中的体内 CED perturb-seq示意图。(B) 使用CED递送 sgRNA 后,原位 SB28 肿瘤的恶性和基质/微环境细胞的整合 scRNA-seq UMAP。(C) 每种 sgRNA 扰动的 sgRNA 阳性细胞数量。(D)恶性和基质/微环境细胞的整合 scRNA-seq UMAP与 sgRNA UMI(左)、KRAB 表达水平(中)或单个细胞是否经过 FACS 分类(右)叠加。(E) sgRNA 扰动(列)后基因表达模块(行)的基因集富集分析的气泡图。(F) 配体-受体相互作用的差异通讯概率。
为了检测巨噬细胞中Ptprc缺失是否影响关键的免疫细胞功能,他们通过将Ptprc Cas9功能缺失的巨噬细胞与Ramos淋巴瘤细胞(一种对抗体依赖性细胞吞噬作用敏感的癌细胞)共培养,进行了体外延时显微镜试验(图 6 A-B)。J774巨噬细胞中的Ptprc敲低显著降低了恶性细胞的抗体依赖性细胞吞噬作用程度,与Ptprc抑制程度成正比(图 6 C-D)。这些结果不仅揭示了Ptprc作为肿瘤内旁分泌和直接相互作用的调节因子的作用,而且还证明了肿瘤微环境中存在的非癌细胞类型可以发生扰动。
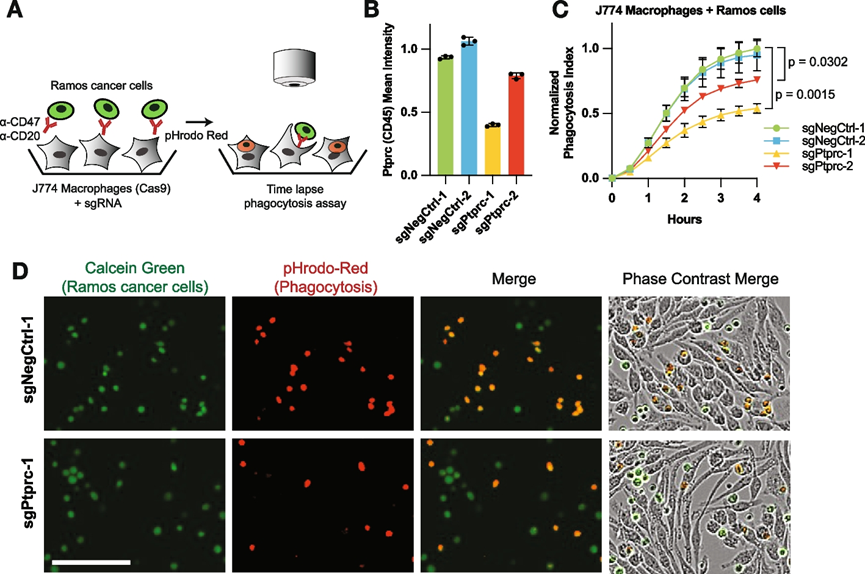
图6. Ptprc丢失会减弱巨噬细胞对恶性细胞的吞噬作用。
(A) 共培养的 J774 巨噬细胞(Ptprc敲低或对照)和 Ramos 淋巴瘤细胞的延时显微镜分析示意图。(B) 平均Ptprc (CD45)表达分布。(C) J774巨噬细胞对Ramos癌细胞摄取的吞噬延时显微镜分析。(D) 标记基因型的J774巨噬细胞与pHrodo红色标记的恶性Ramos细胞共培养4小时后的图像。
+ + + + + + + + + + +
结 论
本项研究迭代开发了一个多重体内perturb-seq CRISPRi 平台,用于在癌症和肿瘤微环境细胞中进行单细胞遗传筛选,该平台利用颅内对流增强将 sgRNA 文库递送到 GBM 小鼠模型中,能够高效沉默驱动体内肿瘤生长和维持的关键基因,以及使GBM对放疗敏感的基因。本项研究发现放射疗法以体内依赖的方式重塑对遗传扰动的转录反应,揭示了 GBM 中放射敏感敏感或抗性的异质模式。此外,本研究展示了在肿瘤微环境中发挥作用的基因的靶向性,从而能够在体内 CRISPRi 扰动后改变免疫细胞和基质细胞之间的配体-受体相互作用,从而影响肿瘤细胞的吞噬作用。
+ + + + +



 English
English


