文献解读|Nat Commun(14.7):炎症期间 NK 细胞介导的免疫反应中 TNFR1 和 TNFR2 信号传导的双重作用结果
✦ +
+
论文ID
原名:Dichotomous outcomes of TNFR1 and TNFR2 signaling in NK cell-mediated immune responses during inflammation
译名:炎症期间 NK 细胞介导的免疫反应中 TNFR1 和 TNFR2 信号传导的双重作用结果
期刊:Nature Communications
影响因子:14.7
发表时间:2024.11.14
DOI号:10.1038/s41467-024-54232-y
背 景
自然杀伤 (NK) 细胞是循环中的先天淋巴细胞,通过促进对病毒感染和癌症的免疫力,在宿主防御中发挥重要作用。NK 细胞还可以通过直接杀死细菌或受感染细胞的能力促进抗菌免疫,以及产生重要的细胞因子,如干扰素-γ (IFN-γ)、肿瘤坏死因子 (TNF) 和粒细胞巨噬细胞克隆刺激因子 (GM-CSF) 等。例如,NK 细胞已证明是鼠伤寒沙门氏菌感染期间保护性 IFN-γ 产生的重要贡献者。此外,侵袭性细菌感染、细菌性脓毒症和细菌性肺炎在 NK 细胞缺乏的患者中更常见,表明 NK 细胞起着保护作用。然而,最近的研究表明,某些抑制性受体和/或细胞因子可能会损害 NK 细胞的效应功能,促进疾病的进展和持续。
实验设计
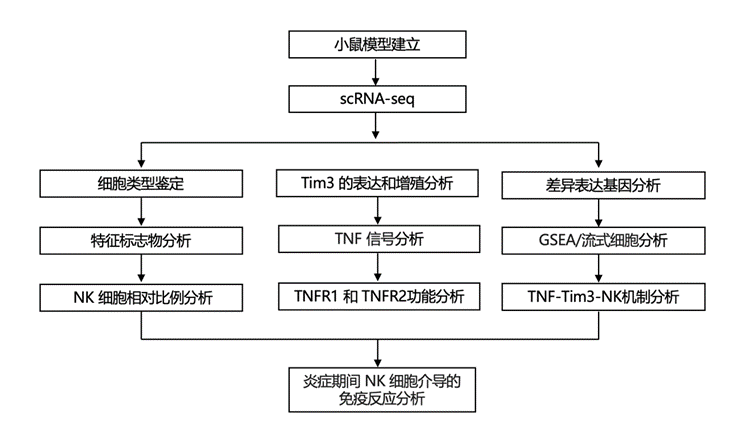
结 果
01
在细菌感染期间,检查点抑制因子粘蛋白结构域(Tim)3在效应 NK 细胞上上调
NK 细胞在细菌感染过程中会严重受损,包括分化为 ILC1 样细胞和器官特异性耗竭。研究团队通过用减毒S . Typhimurium SL3261 感染 C57BL/6 小鼠(引起慢性亚致死感染)并使用流式细胞技术对来自脾脏和肝脏的 NK 细胞进行表型分析,发现细菌感染还会在两个器官中诱导成熟和增殖。然而,目前尚不清楚细菌感染过程中 NK 细胞的确切调控机制。为了进一步研究细菌感染过程中 NK 细胞的调控,他们对从 S . Typhimurium脾脏中分离出的 NK 细胞进行了单细胞转录组分析 (scRNA-seq),根据效应功能、成熟亚群和增殖阶段鉴定出六个不同的 NK 细胞聚类(图 1a)。利用特征基因表达,他们鉴定出表达Itgam和Klrg1 的成熟 NK 细胞(聚类 0),表达细胞毒性基因(如Gzma、Gzmb、Gzmc和Prf1以及Ifng)的活化/效应 NK 细胞(聚类 3),表达Cd7、Tcf7和Tox 的未成熟的 NK 细胞(聚类5) ,以及表达Mki67和各种细胞周期基因的增殖 NK 细胞(聚类1、2 和 4)(图 1b)。细胞周期评分预测不同的增殖聚类处于细胞周期的不同阶段,其中聚类2 主要处于 S 期,聚类1 和 4 主要处于 G2/M 期。有趣的是,表达高水平Ifng、Gzmc和Il12rb1的活化/效应 NK 细胞(聚类3)也显示Havcr2表达增加, Havcr2编码抑制检查点分子 Tim3(图 1c)。Havcr2 的表达似乎与效应分子(包括Ifng以及Thy1和Zbtb32)的表达有很好的相关性(图 1d)。Thy1编码 Thy1,它是效应 NK 细胞群的标志物,有助于对S . Typhimurium 感染产生免疫力,而Zbtb32编码转录因子 Zbtb32,它对于 NK 细胞在感染后迅速增殖至关重要。通过流式细胞分析验证了 Tim3 的上调,并观察到与未感染的对照组相比,S.Typhimurium 感染小鼠的脾脏和肝脏中的 NK 细胞中Tim3 均升高(图1e-f)。此外,Tim3 的表达在感染后第 4 天达到最高,并随着感染在第 28 天消退而逐渐下降(图 1g)。未发现Tim 家族另一成员 Tim4(由Timd4编码)的表达在基因或蛋白质水平上在 NK 细胞中上调,表明这种上调是 Tim3 特有的。综上所述,这些结果表明,在S期,活化/效应 NK 细胞中 Tim3 的上调。鼠伤寒沙门氏菌感染可能是调节 NK 细胞效应功能并阻碍抗菌免疫的一种机制。
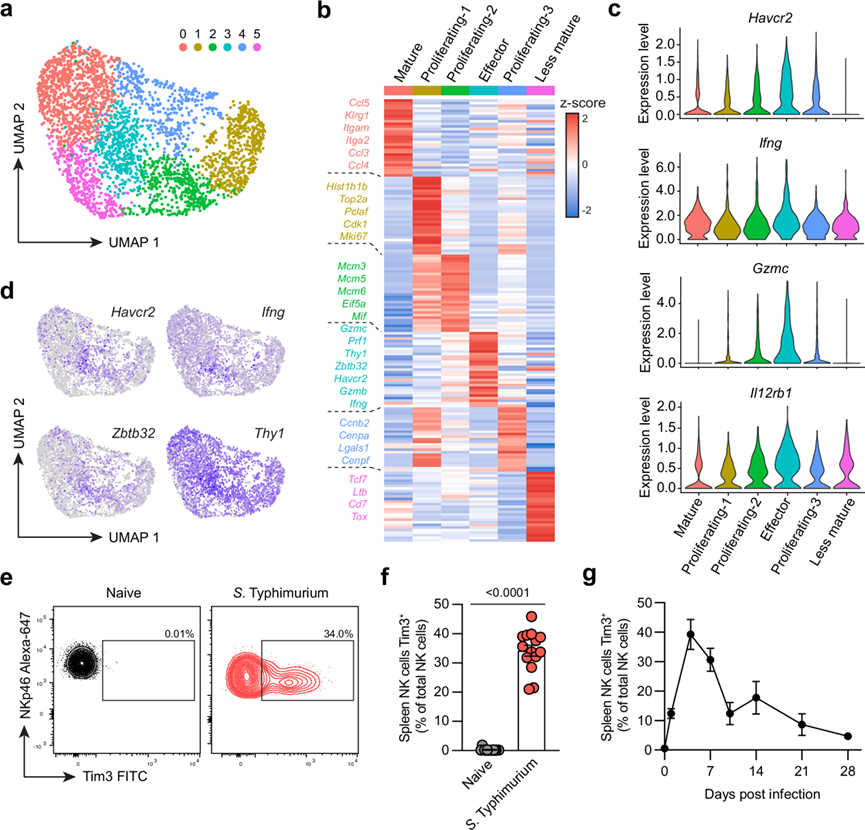
图1. scRNA-seq鉴定鼠伤寒沙门氏菌感染期间效应NK细胞中Tim3上调。
(a) 按 Seurat 聚类着色的 NK 细胞 UMAP图,其中每个点代表一个细胞。(b) 热图显示识别 Seurat 聚类的前 20 个特征基因。(c) 小提琴图显示指示基因在 Seurat 聚类中的表达。(d) UMAP图显示Ifng、Zbtb32、Havcr2和Thy1的标准化表达。(e) 代表性流式细胞图显示幼稚小鼠或鼠伤寒沙门氏菌感染后第四天脾脏 NK 细胞中 Tim3 的表达。(f) 幼稚或鼠伤寒沙门氏菌感染小鼠脾脏中表达 Tim3 的 NK 细胞百分比。(g) 不同时间点小鼠脾脏中表达 Tim3 的 NK 细胞百分比。
02
Tim3 的生理水平不会影响鼠伤寒沙门氏菌感染期间的 NK 细胞功能
为了研究 Tim3 表达对 NK 细胞的影响,他们生成了转基因小鼠系,该小鼠在 NK 细胞内有条件敲除(Ncr1 cre Tim3 fl/fl)或过表达(Ncr1cre FSF-Tim3)。每种品系中 NK 细胞和 ILC1 的发育似乎大多正常,除了所有受检器官中中间 M1 成熟阶段的 NK 细胞百分比略有下降。然而,在转基因小鼠之间观察到功能差异。与野生型对照相比,当用板结合抗 NK1.1 抗体刺激时,Tim3 的过表达导致 NK 细胞 IFN-γ 表达和脱颗粒(通过 CD107a 染色测量)显著降低(图 2a-b)。在 IL-12/IL-18 刺激的细胞中也观察到了 IFN-γ 的减少(图 2a)。在过继转移实验中,通过转移 50:50 的 Tim3 缺陷和 Tim3 过表达 NK 细胞混合物(图 2c),与 Tim3 过表达细胞相比,Tim3 的缺失导致脾脏和肝脏中 NK 细胞的积累显著改善,无论是在幼稚小鼠还是在S . Typhimurium 感染的情况下都是如此(图 2d)。为了评估 Tim3 表达如何调节体内 NK 细胞功能,Ncr1 cre Tim3 fl/fl、Ncr1 cre FSF-Tim3和野生型Ncr1 cre对照感染了S . Typhimurium,并在感染后第四天取脾脏和肝脏以观察免疫参数和细菌负担。通过流式细胞分析证实了该模型中 Tim3 的缺失和过表达。虽然Ncr1cre FSF-Tim3降低了 NK 细胞数量(图 2e-f)、NK 细胞活化(图 2g-h)并增加了脾脏中的细菌负担(图 2i-j),但与对照组相比,在Ncr1 cre Tim3 fl/fl小鼠中没有观察到 NK 细胞数量的预期增加(图 2e-f)、细菌负担的变化(图 2i-j)或 IFN-γ 的差异(图 2k) 。事实上, Ncr1cre Tim3 fl/fl小鼠肝脏中的 NK 细胞显著减少了(图 2f)。综上所述,这些数据表明,虽然 Tim3 的过度表达会影响 NK 细胞的积累和功能,但生理水平的 Tim3 不会显著影响 NK 细胞介导的对鼠伤寒沙门氏菌感染的控制。
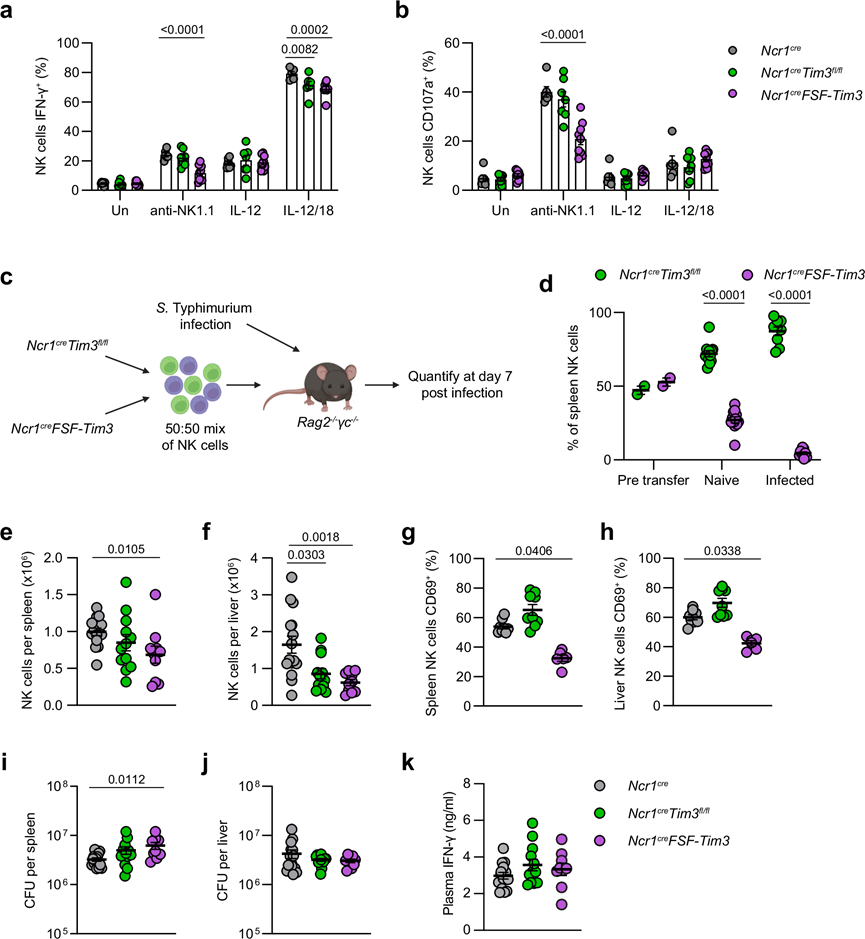
图2. Tim3 的过度表达限制了 NK 细胞的功能和积累。
(a-b) 表达细胞内 IFN-γ或细胞表面 CD107a的 NK 细胞百分比。(c) 显示实验过程的示意图。(d) 感染或未感染的过继移植小鼠移植前和脾脏中的 NK 细胞相对比例。(e-f) 从脾脏或肝脏中分离的 NK 细胞总数。 (g-h) 脾脏或肝脏NK 细胞上 CD69 的表达。(i-j) 每个脾脏或肝脏的细菌负担。(k) 感染小鼠血浆中的 IFN-γ 滴度。
03
TNF 诱导 Tim3 表达和增殖,但抑制 NK 细胞存活
先前的报告显示,在 TNF 的作用下, Tim3 可以在人类 NK 细胞和鼠 T 细胞中上调。同样,I 型干扰素 (IFN) 和转化生长因子 (TGF)-β 也已证实可分别驱动 T 细胞和巨噬细胞中的 Tim3上调。因此,他们预测 Tim3 表达可能是影响本研究模型中 NK 细胞功能的其他因素的生物标志物。为了研究小鼠 NK 细胞中 Tim3 表达的潜在细胞因子驱动因素,他们用重组 IL-15 和不同浓度的 TNF、IFN-α 和 TGF-β(单独或组合)培养小鼠 NK 细胞。TNF 水平的增加会逐步增加 Tim3 的表达,类似于在人类 NK 细胞中观察到的情况(图 3a)。相反,IFN-α 对 Tim3 表达没有影响。添加 TGF-β 可降低 Tim3 表达,与 TNF 联合添加时可完全阻止 TNF 诱导的 Tim3 上调(图 3a)。他们还观察到 NK 细胞相关的活化细胞因子 IL-12 和 IL-18 能够上调 Tim3。TNF 通过其受体作用可激活多种不同的信号通路,包括经典核因子 κ 轻链增强子 (NF-κB)、非经典 NF-κB 和丝裂原活化蛋白激酶 (MAPK)。为了评估哪些通路是 Tim3 上调所必需的,在存在各种 TNF 通路抑制剂的情况下将 NK 细胞与 TNF 一起培养。以核因子 κB 激酶β (IKK-β) 抑制剂 (BI605906) 为靶点,能够(以剂量依赖性方式)阻止 TNF 诱导的 Tim3 上调。相反,以 MAPK c-Jun N 末端激酶 (JNK)(由SP600125抑制)和 p38 (由Losmapimod抑制)为靶点没有效果。因此,这些数据表明 TNF 通过典型的 NF-κB 通路诱导 Tim3 上调。他们还使用 CTV 染料稀释来量化 NK 细胞增殖和存活率。5 或 10 ng/ml 的 TNF 能够促进 NK 细胞分裂,表明增殖增强。加入 TGF-β 后,这种效果消失,因为 TGF-β 完全抑制了增殖。与仅加入 IL-15 的培养相比,增加 TNF 水平也导致 NK 细胞存活率显著降低,而 IFN-α 再次没有影响(图 3b)。有趣的是,加入 TGF-β 不能阻止 TNF 诱导的细胞死亡,这表明与 Tim3 上调和增殖相比,这是一种独立的途径。
为了研究 TNF 是否也能促进 NK 细胞效应功能,他们在存在或不存在重组鼠 TNF 的情况下,用板结合抗 NK1.1 抗体、IL-12 或 IL-12 和 IL-18 刺激脾细胞 4 小时,并测量脱颗粒和 IFN-γ 产生(图 3c)。在所有培养条件下,特别是在 IL-12 刺激的培养物中,TNF 的添加显著增强了 NK 细胞中的 CD107a 染色和 IFN-γ 表达(图 3d-e)。总之,这些数据表明 TNF 可以诱导 NK 细胞功能障碍并促进其效应功能。
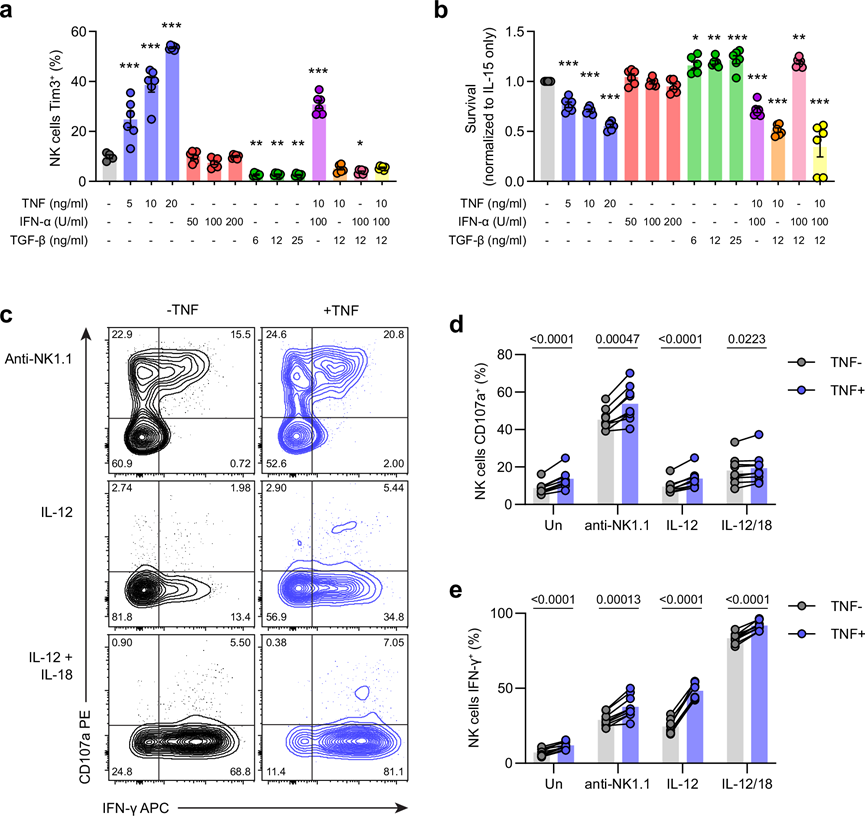
图3. TNF上调Tim3并影响体外NK细胞功能和存活。(a) NK 细胞上 Tim3 的表达。(b) NK细胞的总体存活率。(c) N
K 细胞中 CD107a 和 IFN-γ 的表达。(d-e) 表达 IFN-γ或 CD107a的 NK 细胞百分比。
04
TNF 信号在细菌感染期间改变 NK 细胞表型
为了进一步研究 TNF 如何影响体内 NK 细胞,他们构建了一种新型 TNF 信号缺陷小鼠模型,特别是 NK 细胞 (Ncr1cre Tnfr1 fl/fl Tnfr2 fl/fl)。这些小鼠感染后,TNF 信号缺失显著降低脾脏和肝脏中 NK 细胞中 Tim3 的表达(图 4a-c),证实 TNF 是鼠伤寒沙门氏菌感染期间 Tim3 上调的驱动因素。虽然小鼠的 NK 细胞数量没有差异(图 4d),但他们发现增殖标志物 Ki67 的表达减少(图 4e)。TNF 受体的缺失还导致 NK 细胞终末成熟度降低 (图 4f ) 以及活化降低,这取决于 CD69 表达(图 4g)。然而,虽然NK 细胞的表型发生了这些变化,他们发现条件性敲除组的脾脏或肝脏中的细菌负担与野生型对照组相比没有差异(图 4h-i)。因此,虽然 TNF 受体信号传导会影响体内 NK 表型,但它们对 NK 细胞效应功能和抗菌能力的影响尚不清楚。
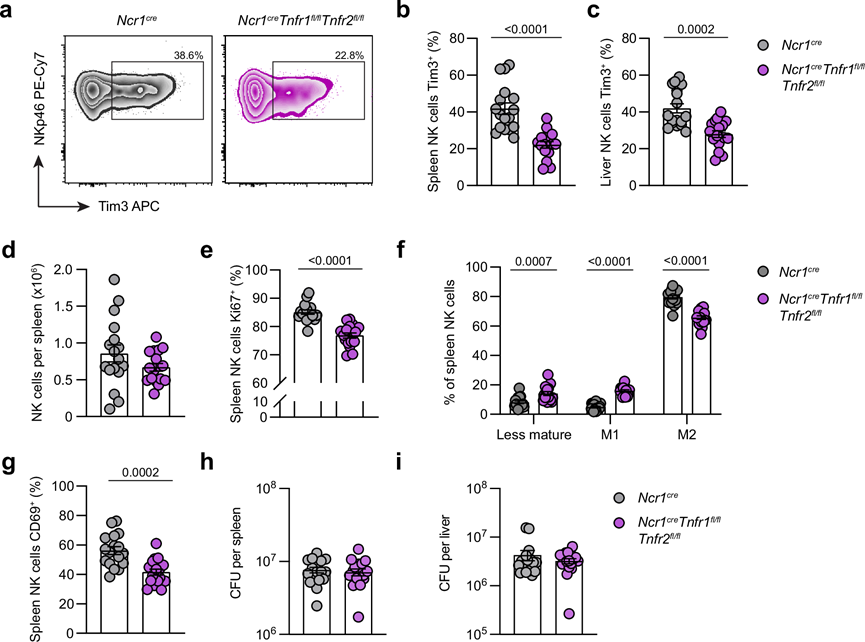
图4. 抑制 NK 细胞中的 TNF 信号传导会影响其在感染期间的表型。
(a) 代表性流式细胞图显示脾脏 NK 细胞上 Tim3 的表达。(b-c) 表达Tim3 的脾脏或肝脏NK 细胞的百分比。(d) 感染小鼠脾脏中 NK 细胞总数。(e) 表达Ki67 的 NK 细胞百分比。(f) 基于CD11b 和 KLRG1 表达的每个成熟阶段脾脏 NK 细胞的百分比。(g) 表达 CD69 的 NK 细胞百分比。(h-i) 每个脾脏或肝脏的细菌负担。
05
TNFR1 和 TNFR2 有助于 NK 细胞成熟
为了研究这些缺失如何影响感染期间的 NK 细胞功能,用S . Typhimurium感染Ncr1cre Tnfr1fl/fl、Ncr1cre Tnfr2 fl/fl或Ncr1 cre对照,并在感染后第四天分离脾脏 NK 细胞进行 scRNA-seq。与图 1中的 WT scRNA-seq 一样,他们能够识别出六个独立的 NK 细胞聚类(图 5a)。这些聚类与野生型 scRNA-seq 的特征相似,其中聚类0 为成熟特征,聚类 1 不成熟特征,聚类4 为效应/激活特征,聚类 2、3 和 5 为增殖性特征(图 5b)。与图1中的scRNA-seq一样 ,不同的增殖聚类处于细胞周期的不同阶段,其中聚类3主要分配到S期,而聚类2和聚类5主要分配到G2/M期。
为了检测TNF 受体 1 (TNFR1) 或 TNF 受体 2 (TNFR2) 敲除后 NK 细胞表型的组成变化,他们使用 Milo 方法比较了细胞邻域的差异丰度(图 5c-f)。与 WT 相比,成熟度较低的聚类1中的大多数邻域均显著富含Ncr1 cre Tnfr1 fl/fl(图 5c-d)和Ncr1cre Tnfr2 fl/fl(图 5e-f )NK 细胞,这表明敲除TNFR1 或 TNFR2 会限制 NK 细胞成熟。与Ncr1cre Tnfr2 fl/fl相比,WT NK 细胞增殖聚类中的邻域代表性增加,这表明 TNFR2 可能有助于 NK 细胞增殖(图 5e-f)。当按基因型比较每个聚类内细胞的相对频率时,他们发现在 TNFR1 和 TNFR2 缺陷的 NK 细胞中,成熟度较低的聚类有所增加,而合并增殖聚类有所减少。他们还观察到终末成熟基因(如Klrg1)表达的减少,以及与成熟度较低的 NK 细胞相关的基因(如Cd7)表达的增加。通过感染小鼠的流式细胞分析证实了这种表型,其中在 TNFR1 和 TNFR2 floxed 小鼠的脾脏和肝脏中,M1 NK 细胞显著增加,M2 NK 细胞减少。有趣的是,在幼稚 NK 细胞中也观察到了这些终末成熟度的降低,这表明 TNF 在发育过程中作用于 NK 细胞,而这些变化并非完全是由于感染引起的 TNF。在 TNF 存在下培养 NK 细胞会导致终末成熟度略有增加,而敲除 TNFR 后,这种增加就会消失。这些数据表明 TNF 对 NK 细胞的终末成熟和增殖非常重要,无论是在体内平衡状态还是在感染期间。
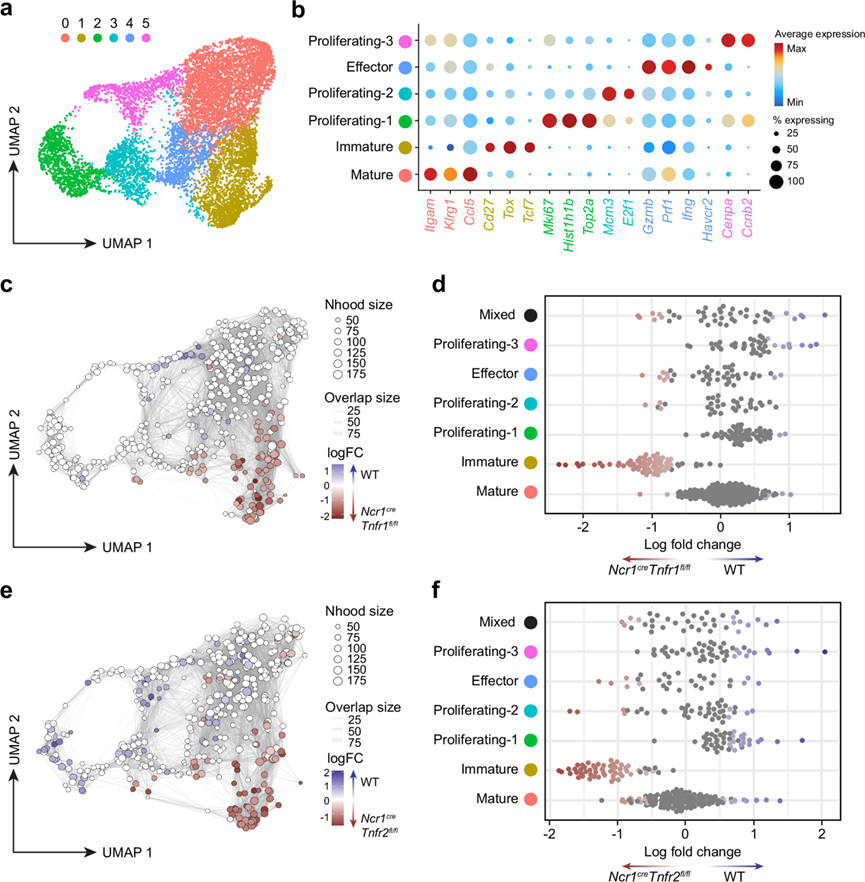
图5. 敲除TNFR1 或 TNFR2 会抑制 NK 细胞终末成熟。
(a) 按 Seurat 聚类着色的 NK 细胞 UMAP图。(b) 点图显示来自每个聚类的特征基因的相对丰度。(c) Milo绘制的 WT 和Ncr1 cre Tnfr1 fl/fl之间差异丰度的 UMAP 图。(d) Beeswarm图显示了Seurat 聚类分隔的邻域中 WT 和Ncr1creTnfr1fl/fl之间的分布。(e) Milo 绘制的 WT 和Ncr1creTnfr1fl/fl之间的差异丰度的 UMAP 图。(f) Beeswarm 图显示了 WT 和Ncr1creTnfr1fl/fl之间在由 Seurat 聚类分隔的邻域中的分布。
06
TNFR 1 和 2 差异调节 NK 细胞结果
对野生型和条件性 KO NK 细胞之间的基因表达进行比较分析发现,野生型和Ncr1 cre Tnfr1 fl/fl NK 细胞之间存在 449 个差异表达基因 (DEG)(239 个上调,210 个下调)(图 6a),野生型和Ncr1cre Tnfr2fl/fl-NK 细胞之间存在 568 个差异表达基因(278 个上调,290 个下调)(图 6b)。在这些 DEG 中,155 个是Ncr1cre Tnfr1 fl/fl所特有的,274 个是Ncr1cre Tnfr2 fl/fl所特有的,294 个是两者共有的。这些共有的 DEG 中许多是与不太成熟的 NK 细胞相关的基因的上调(Cxcr3、Cd7、Tcf7、Cd27、Foxo3),以及效应基因的下调(Gzmc、Gzmf)(图 6a-b)。两种条件敲除也都下调了编码 Tim3 的Havcr2,进一步证实了 TNF 在本研究模型中驱动 Tim3 的表达(图 6a-b)。值得注意的是,TNFR1 缺陷的 NK 细胞凋亡和细胞死亡相关基因(Uba52、Tmsb10、Lgals1、Anxa8、Larp1)的表达也显著降低,抗凋亡基因(Bcl2a1b、Klf4)的表达也显著上调。相反,TNFR2 的缺失导致与增殖/细胞周期(Hist1h1a、Hist1h3f、Mki67)以及终末成熟(Klrg1)相关的基因减少(图 6a-b)。
为了进一步研究这些机制,他们对相关通路进行了基因集富集分析 (GSEA)。与野生型相比,两种敲除的 Mtorc1 信号、凋亡和 E2F 靶标的标志性通路均显著减少(图 6c-e)。与Tnfr2 fl/fl细胞相比,Ncr1 cre Tnfr1 fl/fl NK 细胞的凋亡信号也显著减少,进一步表明凋亡是 TNFR1 触发的主要通路。两种敲除的 E2F 靶标均减少表明两种 TNFR 均可促进增殖。总之,这些数据表明 TNFR1 和 TNFR2 可以发挥重叠和不同的作用,即两种受体均促进 NK 细胞的增殖和效应功能,但 TNFR1 同时促进细胞死亡。
他们利用流式细胞技术证实了 scRNA-seq 的结果,并研究了 TNFR1 和 TNFR2 信号传导可能产生的重叠和相反结果。小鼠感染了鼠伤寒沙门氏菌,并在感染后第四天取其脾脏和肝脏,以研究免疫参数和细菌负担。他们发现 TNFR1 或 TNFR2 的缺失导致脾脏 NK 细胞中 Tim3 的表达显著降低(图 6f)。在敲除每个受体后 TIGIT 发生上调(图 6g),I 型干扰素会增加 T 细胞中的 Tim3 表达但会降低 TIGIT 。当定量 NK 细胞的总数时,与野生型相比,TNFR1 的缺失增加了脾脏中的 NK 细胞数量,而 TNFR2 的缺失减少了细胞数量(图 6h),这表明 TNFR1 导致细胞死亡/凋亡,而 TNFR2 可能有助于增殖/积累。然而,在肝脏中没有观察到差异(图 6i)。他们使用 AnnexinV 染色进一步证实 TNFR1 而不是 TNFR2 导致S . Typhimurium 感染期间细胞死亡(图 6j-k)。他们还研究了受感染小鼠血清中的细胞因子水平,发现 TNFR2 的缺失会降低循环 IFN-γ 的滴度(图 6l)。最后,为了确定这些表型如何影响 NK 细胞参与免疫的能力,他们定量了每个器官的细菌负担,TNFR1 缺陷小鼠脾脏中的细菌负担减少(图 6m),而 TNFR2 缺陷小鼠肝脏中的细菌负担增加(图 6n)。综上所述,这些数据表明 TNFR1 和 TNFR2 对 NK 细胞表型及其应对细菌感染的能力具有重叠和不同的功能。TNFR1 主要起抑制作用并通过细胞死亡防止 NK 细胞积聚,而 TNFR2 起保护作用并促进 NK 细胞积聚。
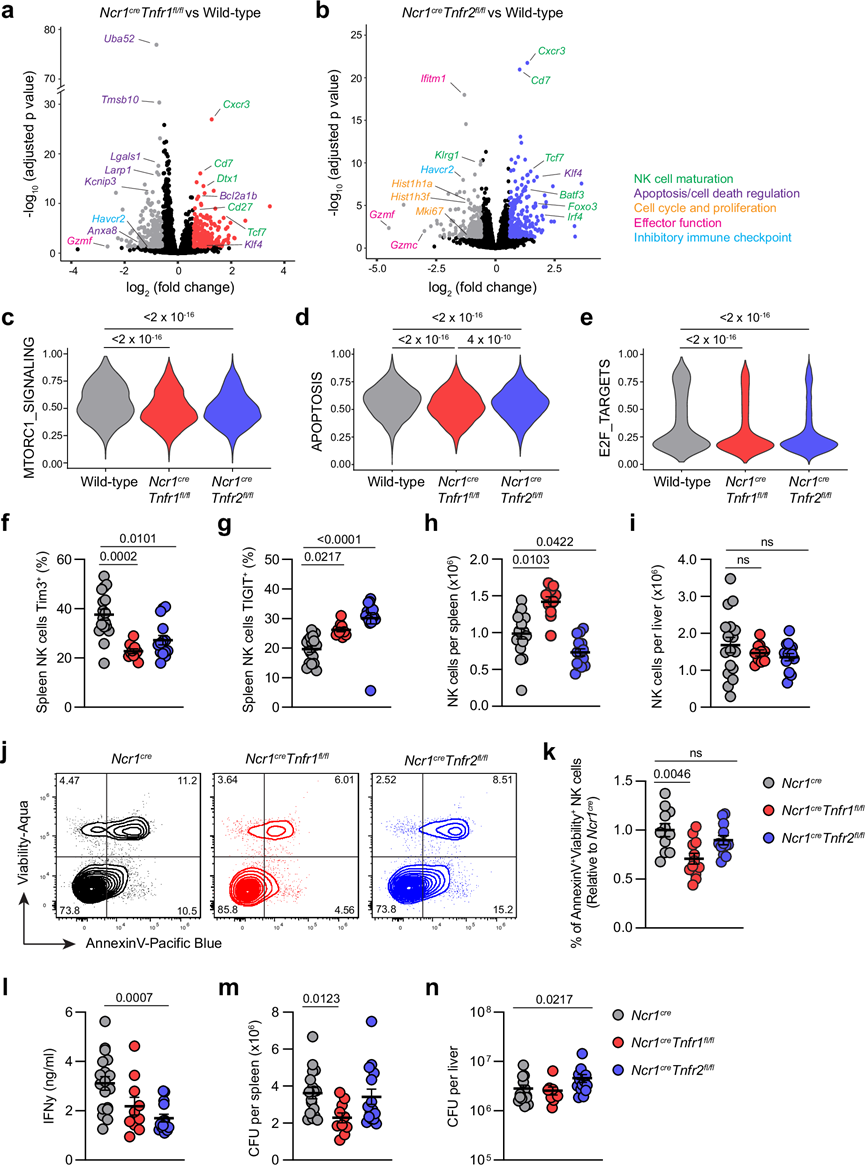
图6. TNFR1和TNFR2对NK细胞有重叠和相反的作用。
(a-b) 差异表达基因分析。(c-e) Hallmark基因集的相对富集分析。(f) 脾脏 NK 细胞上 Tim3 的表达。(g) 脾脏NK 细胞上 TIGIT 的表达。(h-i) 脾脏和肝脏中的总 NK 细胞数量。(j) 流式细胞分析。(k) 凋亡NK 细胞的百分比。(l) 感染后第四天感染小鼠血清中的 IFN-γ 滴度。(m-n) 每个脾脏或肝脏的细菌负担。
07
TNF 信号与细菌感染期间人体免疫细胞中的 NK 功能障碍有关
到目前为止,这项研究表明 TNF 会在小鼠细菌感染期间调节 NK 细胞功能。接下来,他们利用已发表的来自用鼠伤寒沙门氏菌31脉冲处理的人类供体外周血单核细胞 (PBMC) 的 scRNA-seq 数据集,研究了这是否也可能存在于人类疾病中。他们可以在此数据集中识别出一个 NK 细胞群(图 7a),该细胞群具有高表达的HAVCR2,从而编码 Tim3(图 7b)。将幼稚的 PBMC 与暴露于鼠伤寒沙门氏菌的 PBMC 进行比较,发现暴露于鼠伤寒沙门氏菌会增加NK 细胞上HAVCR2的表达(图 7c)。这些数据表明鼠伤寒沙门氏菌可以诱导人类 NK 细胞上 Tim3 的表达,这可能是通过诱导其他细胞类型的 TNF 表达来实现的。
细菌感染的一个严重并发症是脓毒症,其特征是高水平的炎性细胞因子,包括 TNF。他们使用了另一个之前发布过的来自细菌性尿路感染和/或脓毒症患者的 PBMC 的 scRNA-seq 数据集。该数据集包括健康对照(Control),以及患有白细胞增多但无脓毒症迹象的尿路感染 (UTI) 患者 (Leuk-UTI)、伴有轻度脓毒症的 UTI (Int-URO) 和伴有明显或持续性脓毒症的 UTI (URO)。该数据集还包括有或无脓毒症的重症监护病房 (ICU) 患者(分别为 ICU-SEP 和 ICU-NoSEP),以及来自医院病房的菌血症和脓毒症患者 (Bac-SEP)。使用原始出版物中的细胞类型注释来识别各种免疫细胞群(图 7d),他们分离了 NK 细胞并发现它们可以分成两个聚类,从而识别出不太成熟的 NK 细胞和成熟的 NK 细胞(图 7e)。HAVCR2的表达主要在成熟 NK 细胞聚类中观察到(图 7f)。值得注意的是,与非脓毒症(Leuk-UTI、ICU-NoSEP)相比,一些脓毒症患者(Int-URO、URO、ICU-SEP)中表达 HAVCR2 的 NK细胞百分比有所增加(图7g)。其他免疫检查点,例如 TIGIT,在各组之间没有变化(图 7h)。检测分别编码TNFR1和 TNFR2 的 TNFRSF1A 和TNFRSF1B,发现虽然表达水平没有变化,但 URO 组中表达TNFRSF1A的 NK 细胞百分比增加(图 7i),而在 Int-URO 和 URO 组中表达TNFRSF1B的 NK 细胞百分比增加(图 7j),进一步支持 TNF 信号传导的潜在作用。对与 TNF 信号传导和细胞凋亡的 Hallmark 基因组相关的基因的分析发现,与非脓毒症对照相比,脓毒症病例中的许多基因更丰富(图 7k),这表明 Tim3 的这种上调可能是脓毒症期间 TNF 诱导的人类 NK 细胞功能障碍和凋亡的生物标志物。总之,这些结果表明 Tim3 表达和 TNF 信号传导也可能与人类疾病(包括脓毒症)中的 NK 细胞有关。
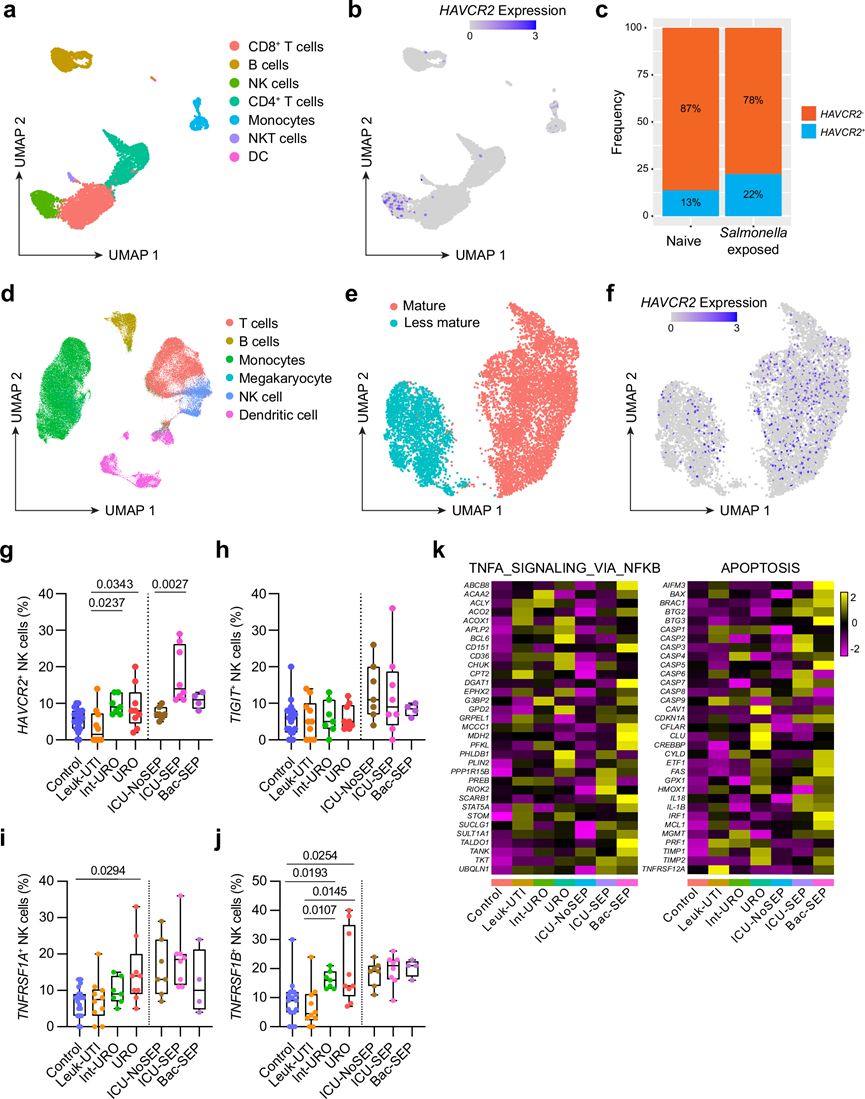
图7. scRNA-seq 揭示人类 PBMC 中 NK 细胞中的 Tim3 和 TNF 信号传导。
(a) UMAP显示来自 PBMC 培养物的总细胞。(b) UMAP显示PBMC中的HAVCR2表达。(c) PBMC 的HAVCR2- 或HAVCR2 + NK 细胞的相对比例。(d) UMAP显示脓毒症患者和健康对照的 PBMC 总细胞,分为细胞类型。(e) NK细胞划分了 Seurat 聚类。(f) UMAP 显示NK 细胞中的HAVCR2表达。(g-j) 箱线图显示表达HAVCR2、TIGIT、TNFRSF1A或TNFRSF1B的 NK 细胞百分比。(k) 热图显示所选基因在 NK 细胞中的平均表达。
+ + + + + + + + + + +
结 论
本项研究发现免疫检查点蛋白 T 细胞免疫球蛋白和Tim3的上调是鼠伤寒沙门氏菌感染期间 NK 细胞中 TNF 信号的生物标志物。在 NK 细胞中 TNF 受体 1 (TNFR1) 或 TNF 受体 2 (TNFR2) 有条件敲除的小鼠中,TNFR1 限制细菌清除,而 TNFR2 促进细菌清除。从机制上讲,TNFR1 和 TNFR2 都会诱导 Tim3 的上调,而 TNFR1 会加速 NK 细胞死亡,但 TNFR2 会促进 NK 细胞的积累和效应功能。因此,本项研究强调了炎症过程中两种 TNF 受体对 NK 细胞的复杂相互作用。
+ + + + +



 English
English


