文献解读|Immunity(43.474):Tfh细胞来源的白细胞介素21在慢性病毒感染期间维持效应性CD8+ T细胞反应
✦ +
+
论文ID
原名:Tfh-cell-derived interleukin 21 sustains effector CD8+ T cell responses during chronic viral infection
译名:Tfh细胞来源的白细胞介素21在慢性病毒感染期间维持效应性CD8+ T细胞反应
期刊:Immunity
影响因子:43.474
发表时间:2022.03.08
DOI号:10.1016/j.immuni.2022.01.018
背 景
在急性病毒感染、细菌感染期间,初始抗原特异性CD4+ T细胞主要分化为T辅助性1型(T helper type 1, Th1)或T滤泡辅助性(T follicular helper,Tfh)细胞,分别表达谱系决定转录因子T-bet和Bcl-6。
这其中,Th1细胞移动到感染部位并产生促炎细胞因子IL-2, IFN-g和TNF-α,促进CD8+T细胞及巨噬细胞的活化。Tfh细胞则主要存在于次级淋巴器官,为B细胞提供必要的帮助信号,促进高亲和力抗体的产生。这其中,DC通过呈递抗原和分泌IL-6等方式,诱导T细胞Bcl-6的表达和CXCR5上调,促进早期Tfh细胞分化。
然而,相比急性病毒感染中Th细胞分化和功能的研究,慢性病毒感染期间,Th细胞的分化亚群,表型及其功能的认识尚不完全清楚。深入理解慢性病毒感染中CD4+T细胞的表型及功能变化,有助于研究者开发新型的治疗方法。
实验设计
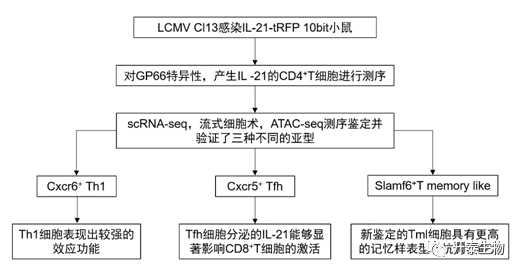
结 果
01

scRNA-seq揭示了慢性病毒感染期间IL-21+ CD4+ T细胞的异质性
为了充分描述慢性病毒感染过程中CD4+T细胞的异质性,作者用LCMV Cl13(淋巴细胞性脉络丛脑膜炎病毒——株13)感染IL-21-tRFP 10bit (IL-10)小鼠,并对表达IL-21的gp66病毒特异性CD4+ T细胞进行scRNA-seq分析(图1A)。
根据基因表达的差异,最终聚类到了三个主要簇:Cxcr6+ Th1, Cxcr5+ Th2和先前未曾报导过的一种Slamf6+记忆样亚群,它们分别高表达相关的特征基因(图1B)。
Cxcr6+ Th1: Il2rb, Gzmb,Ifng,Tbx21,Cxcr6
Cxcr5+ Th2: Il6ra, Id3, Cxcr5
Slamf6+ memory like: Tcf7, Slamf6
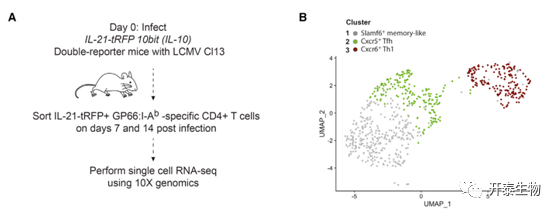
图1 scRNA-seq揭示了慢性病毒感染期间IL-21+ CD4+ T细胞的异质性
(A)实验设计。用LCMV Cl13感染IL-21-tRFP 10bit报告小鼠,GP66+ IL-21-tRFP+ CD4+ T细胞在第7天和第14天(每个时间点2只小鼠)从这些小鼠中分类纯化,随后10X Genomics测序。然后准备一个scRNA-seq库。(B) UMAP显示不同的分群
02

CXCR6和CXCR5的差异表达定义了三个CD4+ T细胞亚群
作者利用流式细胞术验证了CXCR6和CXCR5的表达可以区分这三种亚群(图2A),即CXCR6+ Th1细胞,CXCR5+ Th2细胞以及CXCR5- CXCR6- Tml(T-memory-like)细胞,并且鉴定了每个亚群特异性高表达的marker(图2B-2C)。

图2 CXCR6和CXCR5的差异表达定义了三个功能不同的CD4+ T细胞亚群
(A) LCMV Cl13感染后第14天GP66+ CD4+ T细胞亚群分布为CXCR6+、CXCR5+和DN T细胞亚群的代表性流式图。(B - C)具有代表性的流式直方图(B)和总结数据(C)显示了GP66+ T细胞亚群中各种细胞表面分子标记在14-21天的相对表达。
03

Th1, Tfh和Tml细胞亚群由不同的表观遗传和基因调控网络调控并参与命运决定
作者利用R包SCENIC对单细胞RNA-seq数据进行了基因调控网络分析,并用ATAC-seq测序鉴定了这三种细胞亚群的染色质可及性。结果进一步验证了这三种细胞亚群具有不同的基因调控网络及表观遗传状态,参与影响了细胞亚型的命运决定。
04

慢性病毒感染使得CD4+ T细胞倾向于Tml亚群分化
随后作者集中探究了慢性感染过程中不同CD4+T细胞亚群的分布变化。在第8天,三个亚群呈现出类似的分布,但从第二周开始,CXCR6+Th1细胞在感染急剧减少,并且Th1细胞的减少伴随着约60%的GP66 CD4+ T细胞获得DN(double negative, CXCR5-CXCR6-)表型,而CXCR5+ Tfh细胞的比例在感染的前几周保持相对稳定(图3)
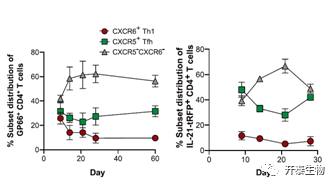
图3:总结数据显示在LCMV Cl13感染期间GP66+和IL-21-tRFP+ CXCR6+,CXCR5+和DN亚群的数量变化
除此以外,作者验证了这种CD4+ T细胞倾向于Tml亚群分化的趋势只在LCMV Cl13介导的慢性感染中存在,而在LCMV Armstrong诱导的急性病毒感染中不存在(图4)。

图4:GP66+脾CD4+ T细胞亚群变化总结图。* p < 0.05, **p < 0.01, ***p < 0.0001
05

Th1、Tfh和Tml细胞亚群表现出不同程度的增殖潜能,可塑性以及“帮助”潜能
为了探究这三种不同细胞亚群的增殖潜能和可塑性,作者进行了细胞过继转移实验。发现DN供体来源的细胞表现出更高的增殖优势,更高的可塑性,增强的积聚能力。CXCR5+Tfh细胞则表现出更强的辅助CD8+T细胞功能(图5)。
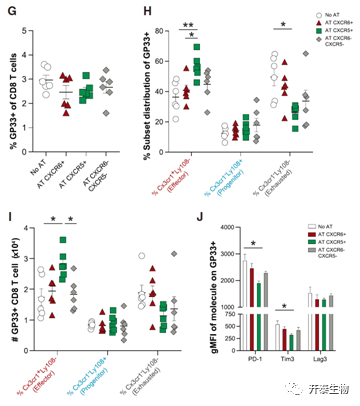
图5:流式细胞术汇总数据显示了GP33+ CD8+ T细胞在Tpro、Teff和Texh CD8+ T细胞亚群中的比例、总数和亚群分布,及其细胞表面抑制性受体(PD-1,Tim3,Lag3)的表达。
06

持续的抗原提呈和CD40-CD40L相互作用对于维持IL-21+Tfh反应和Teff CD8+ T细胞分化至关重要
尽管高抗原负荷已被充分证明可诱导CD8+ T细胞对慢性感染反应的耗尽表型,但持续抗原暴露对CD4+ T细胞分化的影响尚不清楚。于是,作者用a-MHC-II阻断抗体,阻断了抗原提呈细胞对CD4+T细胞的抗原提呈。这最终导致IL-21tRFP+ CD4+ T细胞比例下降~40%-50%,这表明持续的TCR信号通路对于IL-21的持续产生很重要(图6)。
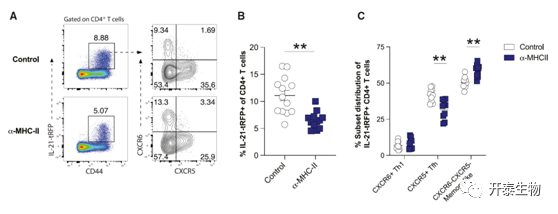
图6:Tri报告小鼠感染LCMV Cl13,并在第6、11和15天分别用同型对照或a-MHC-II阻断抗体处理
(A) 流式图显示在第18天使用流式细胞术评估病毒特异性CD4+和CD8+ T细胞反应。(B和C)汇总数据显示IL-21+ CD4+ T细胞的比例及其在CXCR6+、CXCR5+和DN亚群中的分布。
MHC-II阻断实验揭示了Tfh和B细胞之间的互作,可能对维持IL-21+Tfh发育和慢性感染期间Teff细胞分化很重要。除了通过B细胞提呈抗原外,Tfh细胞还通过多种途径与B细胞相互作用,包括ICOS-ICOSL和CD40-CD40L相互作用。当阻断CD40-CD40L时,在很大程度上干扰了IL-21+ CD4+ T细胞的发育,Tfh和GCB细胞的比例也大幅降低。
07

Tfh衍生的IL-21对Teff细胞分化至关重要
尽管CD4+-T细胞衍生的IL-21在慢性病毒感染期间对维持Teff CD8+ T细胞反应至关重要,但目前尚不清楚提供IL-21关键来源的辅助性亚群。作者之前的数据表明,与Th1或Tml细胞亚群相比,Tfh细胞在每个细胞基础上产生更多的IL-21,并且IL-21+ Tfh细胞反应与Teff细胞发育密切相关。这些观察结果,再加上作者发现的CXCR5+细胞的过继转移增加了Teff细胞的形成,暗示了Tfh衍生的IL-21可能是促进CD8+ Teff细胞分化的关键。
为了验证Tfh产生的IL-21在维持Teff细胞分化中的重要性,作者构建了一系列混合骨髓(mixed bone marrow,MBM)嵌合体小鼠,使得CXCR5+ CD4+ T细胞特异性缺乏IL-21表达,并利用了LCMV CI13感染这些MBM嵌合体小鼠,在一个月后评估CD8+T细胞反应。作者观察到IL-21血液中gp33特异性CD8+ T细胞减少了2倍,且耗竭性T细胞占比上升,说明干扰Tfh的IL-21产生能够明显抑制慢性病毒感染过程中,病毒特异性CD8+T细胞形成及其功能。
总结图:
+ + + + + + + + + + +
结 论
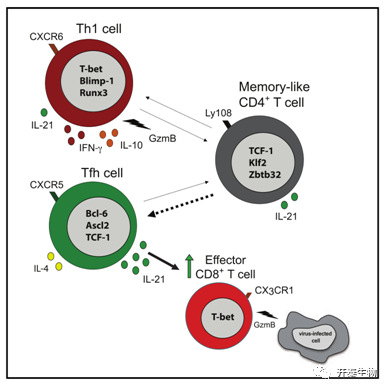
本研究中,研究人员应用scRNA-seq和ATAC-seq的方法,确定了LCMV Cl13感染期间IL-21+ CD4+ T细胞的异质性。结果显示慢性病毒感染期间,初始抗原特异性CD4+T细胞倾向于分化成转录组水平、表观遗传水平上均不同的三个群体:Cxcr6+ Th1细胞、Cxcr5+ Tfh细胞和一个先前未报导过的Slamf6+记忆样(Tml)亚群。在慢性而非急性LCMV感染期间,T细胞分化特异性地重定向至记忆样Slamf6+Tml亚群。
虽然Tml亚群显示出增强的抗凋亡能力和一定的发育可塑性,但它在很大程度上仍然是静息的,这可能阻碍了它的辅助潜力。相比之下,骨髓嵌合实验揭示了Tfh细胞分泌的IL-21,对维持和促进CD8+ T细胞的抗病毒反应和病毒控制至关重要,这为慢性病毒感染中激活CD8+T细胞介导的细胞杀伤提供了新的思路。
+ + + + +



 English
English

