文献解读|Cell Rep Med(11.7):不同病因慢性肝病晚期纤维化的综合蛋白质转录组学表征
✦ +
+
论文ID
原名:Integrative proteo-transcriptomic characterization of advanced fibrosis in chronic liver disease across etiologies
译名:不同病因慢性肝病晚期纤维化的综合蛋白质转录组学表征
期刊:Cell Reports Medicine
影响因子:11.7
发表时间:2025.01.30
DOI号:10.1016/j.xcrm.2025.101935
背 景
慢性肝病 (CLD) 是全球范围内严重的健康和经济负担,影响着约 15 亿人。CLD的主要病因包括慢性病毒性肝炎 (CVH)、酒精性肝病 (ARLD) 和代谢功能障碍相关脂肪变性肝病 (MASLD)。CLD的特征是慢性肝损伤和持续性炎症,导致肝纤维化,而肝纤维化可能发展为肝硬化并增加患肝细胞癌 (HCC) 的风险。肝纤维化的严重程度已成为长期发病率和死亡率的重要指标。最近的数据表明,由于饮酒率和代谢紊乱的上升,肝纤维化和相关疾病变得越来越普遍,导致全球每年约有 200 万人死亡。然而,由于该病进展缓慢且通常无症状,对潜在分子机制的理解有限,以及缺乏有效的生物标志物来识别严重纤维化高风险患者。
实验设计
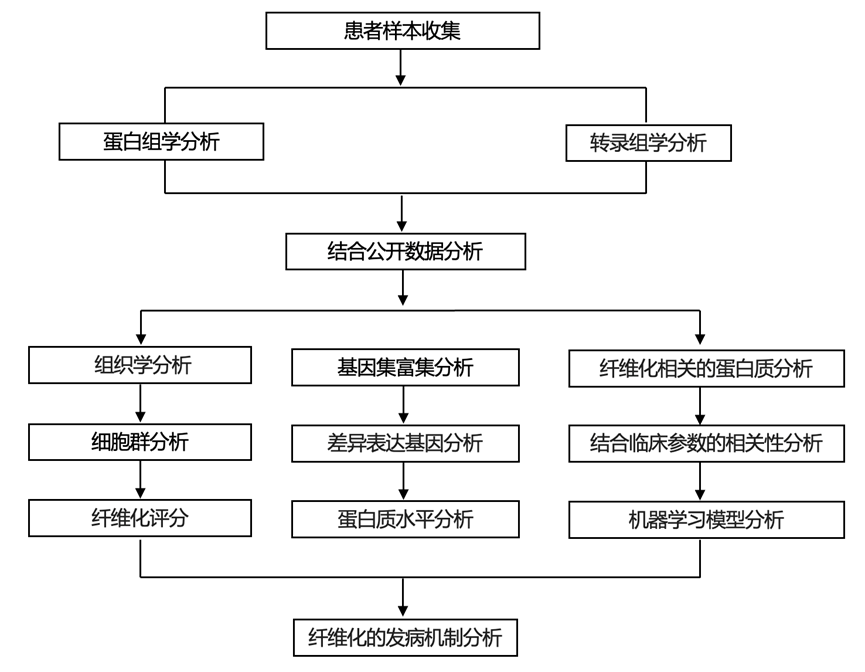
结 果
01
转录组特征区分晚期纤维化
本研究包括两个队列:发现队列和验证队列,共包括 330 名成年参与者(图 1A-D和图2 A)。发现队列包括 40 名健康个体、144 名 CLD 患者和 34 名 CLD 和 HCC 患者(中位年龄 53 岁, 36.2% 为女性)。在 CLD 患者中,诊断包括 CVH(40.3%)、ARLD(9.7%)和 MASLD(50%)。对于 HCC 患者,70.6% 患有 CVH 相关 HCC,29.4% 患有 MASLD 相关 HCC。验证队列由另外 68 名 CLD 患者和 44 名 CLD 相关 HCC 患者组成,年龄和性别匹配。
研究团队对MASLD 患者肿瘤周围肝组织和 CLD 患者肝组织中的纤维化阶段进行组织学评估,并使用病毒性肝炎组织学数据Meta分析 (METAVIR) 评分系统对 CVH 进行组织学评估。他们对发现队列中患者的 178 个肝组织进行了转录组学分析(RNA-seq)(图 1B)。此外,使用 Olink Explore 1536平台检测了所有研究参与者的 1463 种血浆蛋白。
为了阐明晚期肝纤维化相关的分子变化,他们首先分析了发现队列中患者的肝脏转录组数据。根据组织学评估的纤维化阶段,将样本分为早期纤维化(0/1/2 期,在后续分析中称为 F0-2)、严重纤维化(3 期,F3)和肝硬化(4 期,F4)(图 2 A)。
数据的均匀流形近似和投影 (UMAP) 揭示了与纤维化严重程度相关的明显变化(图 2 B)。样本似乎没有根据性别、生活方式(如吸烟)或合并症(如糖尿病)进行分类。比较晚期(F3 或 F4)和早期 (F0-2) 纤维化之间的基因表达谱时,基因集富集分析发现与 ECM 重塑和细胞基质相互作用相关的通路显著上调(例如 ECM-受体相互作用、粘着斑和肌动蛋白细胞骨架的调节)(图 2 C)。与先前证明炎症特征性纤维化进展的研究结果一致,这些数据进一步强调,与免疫反应和炎症相关的通路(例如造血细胞谱系和白细胞介素 [IL]-17、肿瘤坏死因子、磷脂酰肌醇 3-激酶-Akt 和 p53 信号通路)在晚期纤维化中上调(图 2C)。相反,与过氧化物酶体、碳和能量代谢相关的代谢通路在肝硬化中下调(图 2C)。其中一些通路从 F2 开始在 MASLD 患者中显著下调,这意味着代谢功能障碍是进行性 MASLD 的主要标志。值得注意的是,转录因子富集分析显示,在晚期纤维化中,NF-κB1、REL、RELA、JUN、JUND、ATF4、SMAD3、CREB1和PARP1靶向的转录组上调(图 2D)。这些转录因子是炎症、免疫反应和细胞应激反应的关键调节因子,与纤维化的发展和进展有关。
此外,差异表达基因(DEG)分析确定了与 F0-2 组相比,F3 阶段纤维化中存在 93 个DEG。这些基因中超过 97% 在肝硬化中也表现出显著性,共确定了 8328 个 DEG(图 2 F)。该 DEG 组包括肝脏中的肌成纤维细胞标志物,17例如肝脏驻留的活化肝星状细胞(例如ACTA2、COL1A1、SPP1和PDGFRB)、与上皮-间质转化相关的标志物(例如KRT19)、活化的门脉成纤维细胞(例如CALCA、COL15A1、THY1和IL-18R1)以及骨髓来源的成纤维细胞(例如CXCR4和ICAM1)和间充质干细胞(例如MCAM)(图 2 F)。
为了进一步研究肝硬化中发生的广泛转录改变是否与特定病因相关,他们分别分析了 ARLD、MASLD 和 CVH 患者的肝硬化样本。在本研究中,转录组谱未显示出这些基于病因的组之间的明显区别(图 2 G)。与 ARLD 患者相比,MASLD 患者的一个基因(TBC1 结构域家族成员 3)显著过表达。在 ARLD 与 CVH 以及 MASLD 与 CVH 中分别有 22 个和 501 个基因显示出显著变化,两组比较中有 17 个基因与病毒感染和免疫反应有关(图 2 H)。有趣的是,对 MASLD 与 CVH 中的 DEG 进行功能分析,与核小体组装、染色质组织和重塑、DNA 包装和病毒过程调节相关的生物过程显著富集。这些结果可能表明,与代谢功能障碍相关的肝硬化相比,宿主-病毒相互作用在病毒感染导致的肝硬化的发病机制中至关重要。
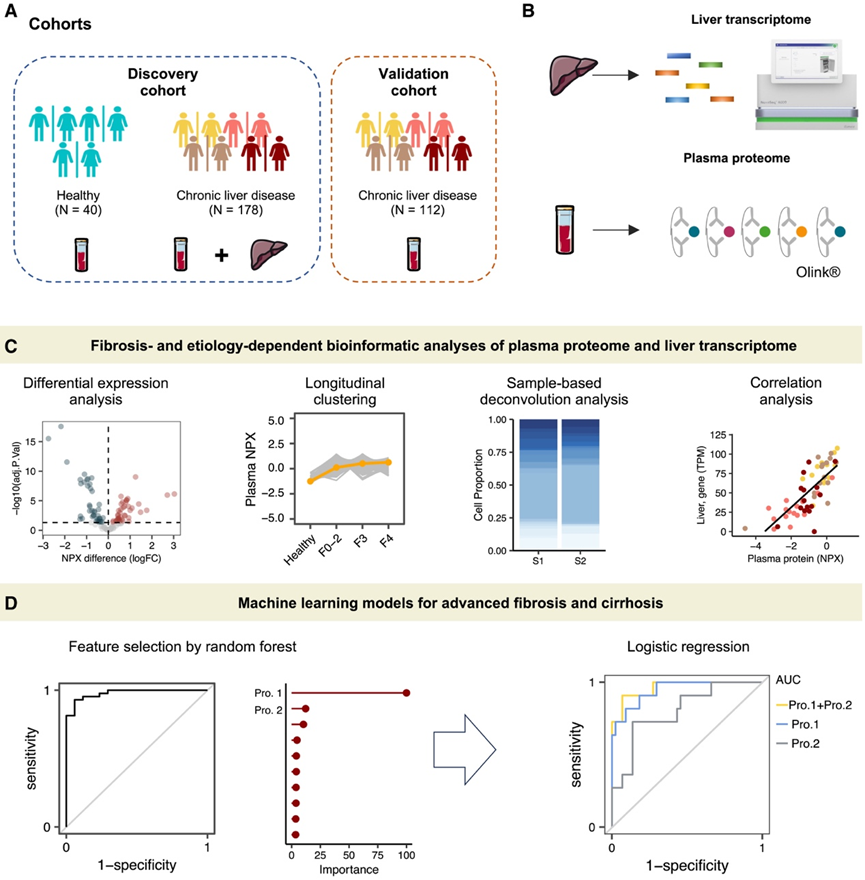
图1. 研究概述。
(A)临床队列。(B)多组学分析。(C) 本研究的生物信息学工作流程示意图。(D) 使用基于机器学习的分类模型来识别晚期纤维化和肝硬化的潜在生物标志物。
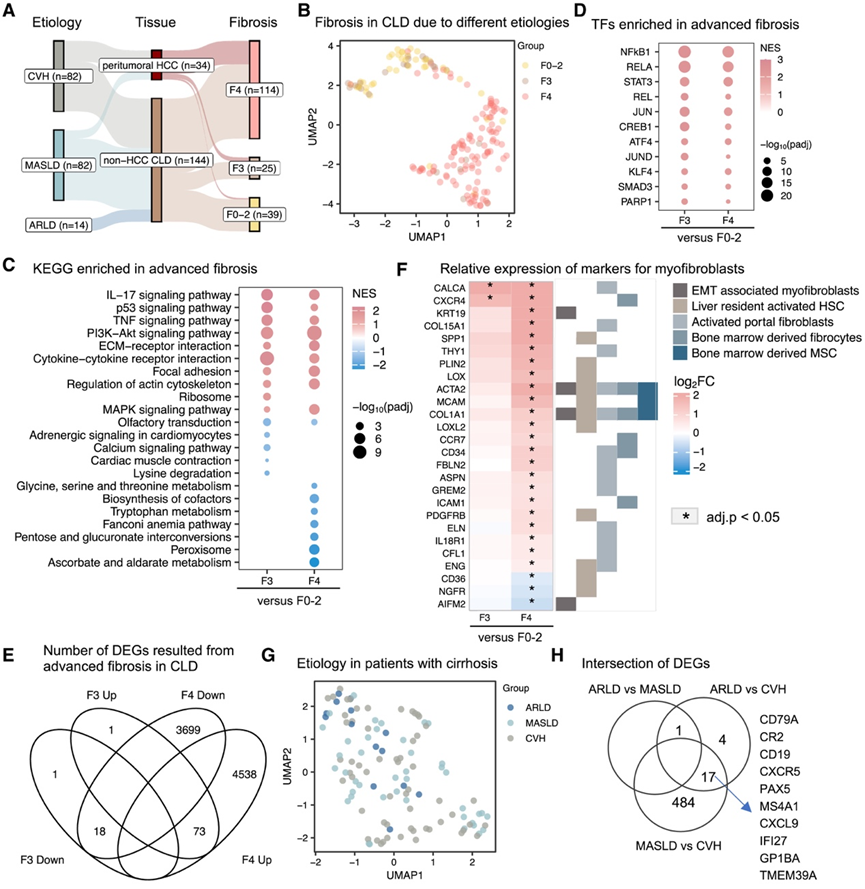
图2. 转录组特征区分晚期纤维化。
(A) 流程图显示来自CLD或肿瘤周围CLD的肝组织样本数量,按每种病因和各自的纤维化组织学评估阶段进行分类。(B) 对肝组织的转录组学数据进行UMAP分析。(C)通路分析。(D)转录因子分析。(E) 维恩图显示,与 F0/1/2 阶段相比,晚期纤维化组织的DEG数量。(F)热图显示晚期纤维化肝组织与 F0/1/2 阶段肝组织中纤维化标志物基因的相对表达。(G) 对不同病因导致的肝硬化组织的转录组学数据进行 UMAP 分析。(H) 三种病因的成对比较中共有的DEG数量。
02
单细胞反卷积揭示细胞类型组成异质性及其与纤维化评分的关系
先前的一项研究使用单细胞转录组数据(scRNA-seq)揭示了晚期肝硬化患者纤维化微环境中细胞群的异质性。为了探索不同纤维化阶段肝脏微环境内的细胞组成变化,他们接下来使用衰减加权最小二乘算法进行了单细胞反卷积。这种方法通过计算从大量基因表达数据中估计细胞类型比例。计算并分析了公开数据中注释的总共 44 个细胞群,以确定纤维化依赖性差异。他们还评估了这些细胞群的丰度与几个关键临床变量之间的相关性,包括体重指数 (BMI) 和纤维化评分(纤维化-4 [FIB-4])。FIB-4 是根据年龄和血浆天冬氨酸氨基转移酶 (AST)、丙氨酸氨基转移酶 (ALT) 和血小板计数水平计算得出的(图3A-C)。
他们确定了 12 个在纤维化依赖组中表现出显著丰度变化的细胞(亚)群(图3A-B)。成对分析显示,与纤维化早期阶段相比,肝硬化(F4 )中的肝细胞、CD34 − CLEC4M +肝窦内皮细胞和自然杀伤细胞的丰度明显降低(图 3 A-B)。此外,由TREM2、CD9、SPP1、TNFSF12和LGALS3等标志物分化的瘢痕相关巨噬细胞 (SAM)和PDGFRA +肌成纤维细胞在肝硬化患者中的比例增加(图 3 B)。这些观察结果与不同纤维化阶段患者中这些标志物基因的表达模式一致。据报道,上皮细胞损伤可促进促炎介质的释放,触发 T 细胞(包括 Th1、Th2 和 Th17)的激活和分化。与此一致,他们观察到由SELL、CCR7和CD8A等标志物分化的两个 CD4+和 CD8+T 细胞亚群在肝硬化中显著扩增(图3B)。值得注意的是,这些扩增的细胞类型的丰度与各组纤维化评分呈正相关(图3B-C)。总体而言,这些结果表明肝脏中的微环境是异质的,并为他们了解各种细胞类型丰度随纤维化阶段和不同纤维化阶段的炎症程度而变化提供了有价值的见解。
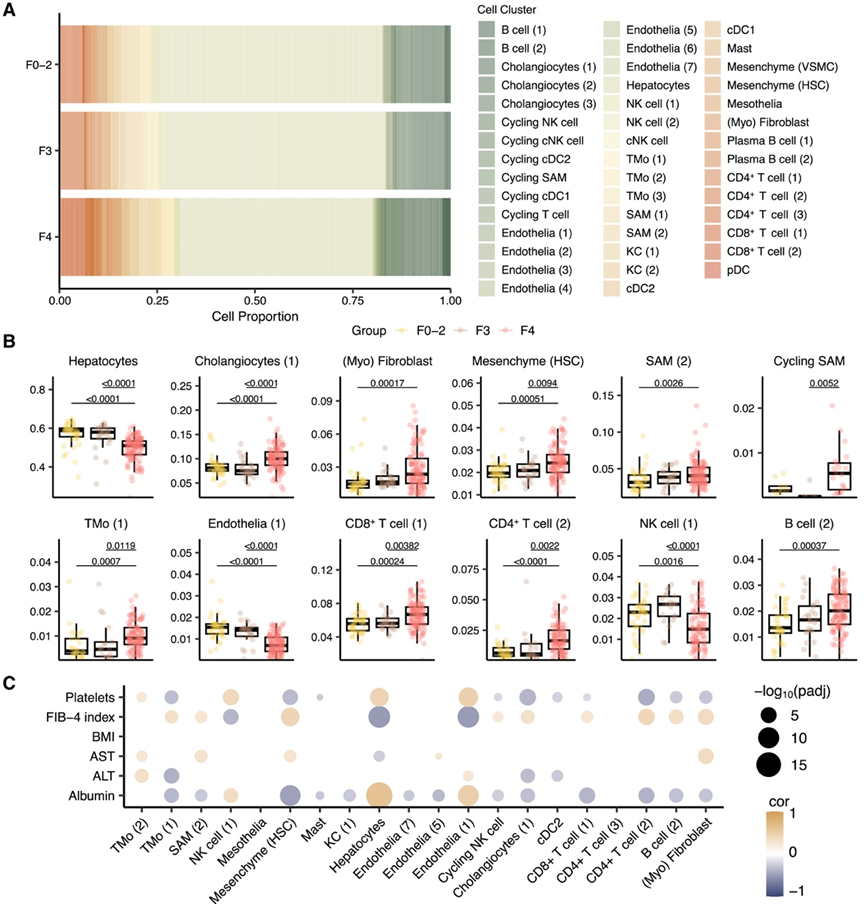
图3. 单细胞反卷积揭示细胞类型组成的异质性及其与纤维化评分的关联。
(A)细胞数量分析。(B) 箱线图显示分组比较中显著分化的细胞群。(C) 估计的细胞比例与临床测量值之间的 Spearman 系数相关性。
03
肝病患者血浆蛋白质组学变化反映疾病严重程度
为了研究肝脏病理对血浆蛋白质组的影响及其反映肝纤维化的可能性,他们进一步表征了健康个体和不同阶段肝纤维化患者的血浆蛋白质组谱。UMAP 分析显示健康个体和患者的蛋白质组谱之间存在明显分离。在患者组中,他们观察到蛋白质组谱的逐渐变化与肝脏纤维化的进展阶段相关(图 4 A-C)。为了说明蛋白质组的变化是否表明生物过程随着疾病的进展而发生改变,他们使用 Mfuzz 聚类对具有相似丰度变化的蛋白质进行分组,并在纤维化依赖组中确定了三组蛋白质轨迹(图 4 A-C)。具体而言,聚类1 中的 680 种蛋白质,包括促炎和抗炎细胞因子(例如IL - 6和IL - 10)以及肝纤维化标志物(例如ACTA2、KRT19和SPP1),随着纤维化阶段的增加而逐渐增加(图 4D-E)。聚类 2 中的 418 种蛋白质与伤口愈合和囊泡介导的运输有关,在纤维化早期阶段中位水平略有增加,随后在肝硬化时急剧下降。聚类3 中的另外 363 种蛋白质主要与免疫反应和信号调节有关,在肝纤维化患者中持续升高。
同时,他们分析了与健康对照相比,肝纤维化不同阶段的蛋白质水平。这些研究结果显示,F0-2、F3 和 F4 组中分别有 699、772 和 1,091 种蛋白质发生了显著变化(图 4 F)。其中,554 种蛋白质在所有患病组中有共同之处。约 33% 的此类蛋白质在免疫反应中显著富集(图 4 G),包括趋化因子(例如CCL3、CCL4、CCL11、CXCL6、CXCL13和CCL24)、细胞因子(例如OSM、IL - 6、IL - 10)、生长因子(例如TGFB1和MDK)和肿瘤坏死因子受体(例如FAS、TNFRSF1B、TNFRSF4、TNFRSF11A和TNFRSF14)的升高。例如,发现关键的抗炎细胞因子IL - 10是患者中升高最显著的蛋白质之一(图 4 D)。IL-10升高先前已证明与免疫细胞麻痹的病理生理过程有关,这种麻痹是急性慢加肝衰竭中免疫反应功能障碍的特征。此外,生物粘附已确定为第二大过度代表类别(图 4 F)。具体而言,观察到与粘附连接相关的蛋白质上调,包括 E-钙粘蛋白 ( CDH1 )、N-钙粘蛋白 ( CDH2 ) 和原钙粘蛋白 1,还发现与局部粘连有关的蛋白质,如 paxillin 和整合素α5,在患者血浆样本中上调。
他们还研究了与肝硬化患者不同病因相关的蛋白质组改变,在比较ARLD和MASLD患者的蛋白质谱时,没有蛋白质在其血浆水平上表现出显著差异。在ARLD和CVH患者之间,他们鉴定出24种蛋白质(例如,GSTA3、DCXR、FBP1和ALPP),它们的血浆水平表现出显著差异,但它们的肝脏mRNA表达水平在两组之间没有差异表达。同样,在MASLD和CVH患者肝脏之间鉴定出的501个DEG中,在肝脏中,其中49种相应的蛋白质存在于血浆中,MASLD患者和病毒性肝炎患者之间的血浆水平没有显著差异。
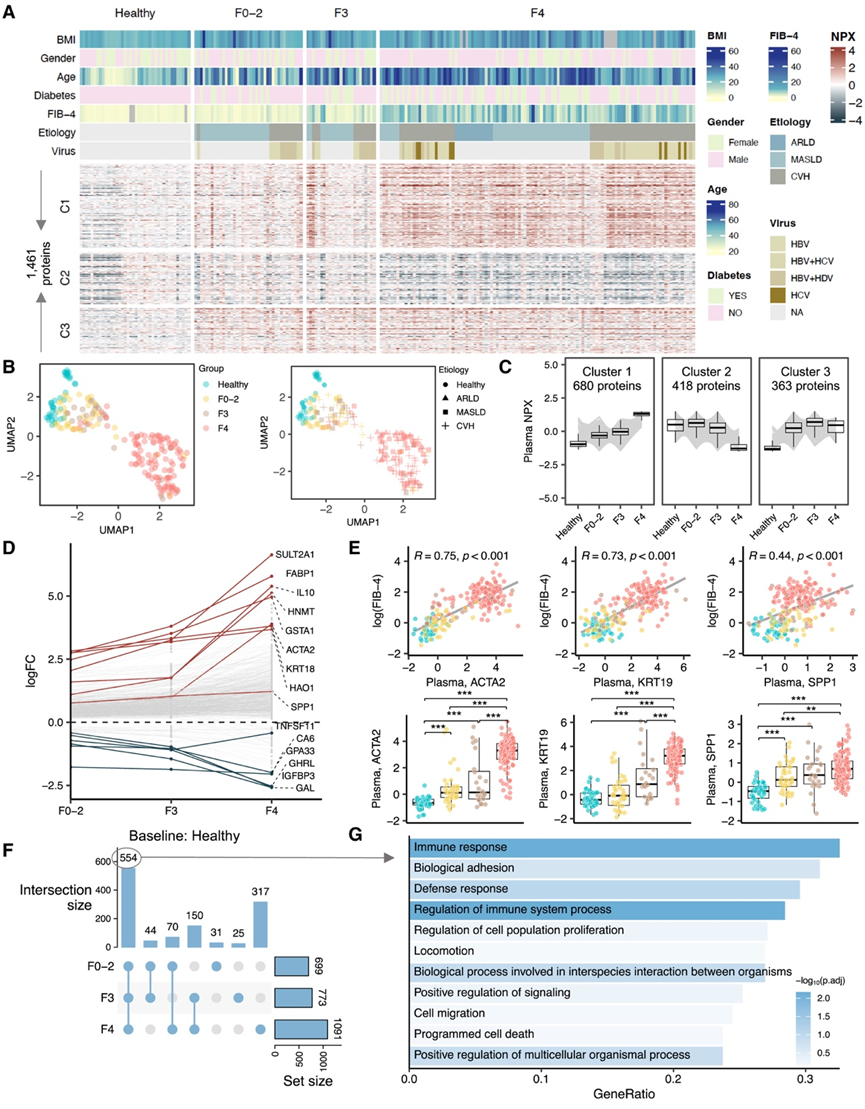
图4. 肝病患者血浆蛋白质组学变化反映疾病严重程度。
(A) 发现队列中受试者的血浆蛋白质分析。(B) 对从发现队列中的受试者获得的蛋白质组进行 UMAP 分析。(C) 模糊聚类确定了三个蛋白质聚类,这些蛋白质聚类具有与疾病严重程度相对应的不同丰度模式。(D) 每次组间比较中前 5 种蛋白质的logFC。(E) 纤维化标志物(ACTA2、KRT19和SPP1)与纤维化评分(fibrosis-4、FIB-4)(上)以及各组血浆水平(下)之间的 Spearman 相关性。(F) 翻转图总结了患者与健康受试者体内蛋白质水平存在显著差异的数量。(G)GO分析。
04
与晚期纤维化相关的蛋白质学特征
接下来,他们试图整合与晚期纤维化相关的蛋白质组和转录组特征,通过对显著改变的基因和它们相应的蛋白质水平进行成对相关性分析,遵循最近在蛋白质转录组学研究中应用的方法。与早期相比,晚期纤维化患者中 498 种蛋白质的肝脏基因表达水平和血浆中的丰度均存在显著差异(图5 A)。值得注意的是,其中 132 种蛋白质的丰度与患者队列中的肝脏平均 mRNA 表达(定义为下游分析的蛋白质转录组特征)高度相关,根据人类蛋白质图谱35 的注释,包括 20 种来自肝脏的蛋白质(图 5 A-B)。此外,将蛋白质转录组特征映射到人类蛋白质的亚细胞图谱上,发现其中 47 种蛋白质分泌到血液中(图5B-C)。例如,肝因子FGF21是一种应激诱导激素,主要由肝脏表达和分泌到血液中,以内分泌方式发挥作用,在整个患者队列中,其 mRNA 和蛋白质水平呈正相关。肝脏分泌的胱抑素超家族蛋白胎球蛋白 B (FETUB)的 mRNA-蛋白质水平 在患者队列中表现出很强的相关性(图 5D)。单纯脂肪变性的肥胖参与者的血浆FETUB水平升高,并且与胰岛素抵抗有关。有趣的是,他们发现肝纤维化早期阶段(F0-2)和 F3 患者的FETUB水平升高,而与健康对照组相比,肝硬化患者的 FETUB 水平显著降低(图 5 F)。这一观察结果与单细胞分辨率下肝硬化肝细胞中FETUB表达降低相一致,表明这些肝因子在反映肝损伤进展和严重程度方面具有潜在作用。他们还探讨了 132 种蛋白质的血浆丰度与临床参数之间的相关性。大多数蛋白质与FIB-4呈正相关性,但与血浆白蛋白水平和血小板计数呈负相关性(图5F)。
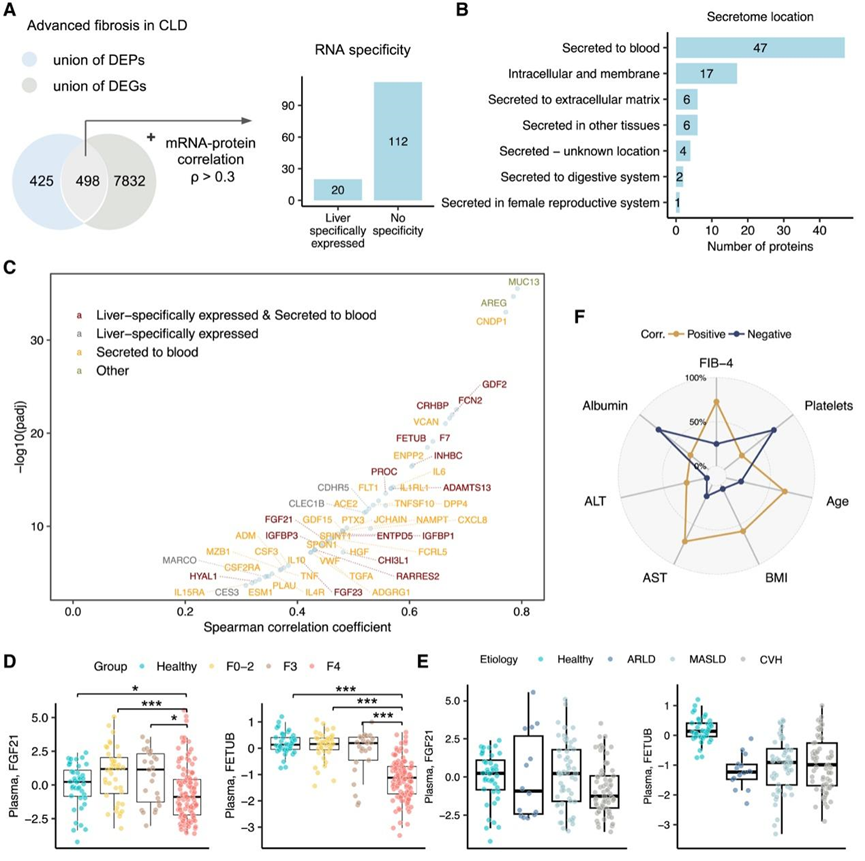
图5. 肝脏和血浆蛋白组学概况的综合分析。
(A) 维恩图显示与晚期纤维化相关的 DEP 和 DEG 的并集之间的交集。(B) 根据人类蛋白质图谱中的注释,预测过滤蛋白质的分泌蛋白组位置。 (C) 过滤蛋白质的 mRNA-蛋白质水平之间的 Spearman 相关性。(D-E) 箱线图显示纤维化组和病因组血浆中的 FGF21 和 FETUB 水平。
05
晚期纤维化和肝硬化的生物标志物组
为了进一步根据蛋白质转录组特征精确定位能够对晚期纤维化患者进行分层的蛋白质,他们开发了两个二元分类器,旨在区分 (1) 晚期纤维化患者(3 期或更高,称为 ≥F3 模型)和 (2) 肝硬化患者(肝硬化模型)。对于特征选择,他们采用了随机森林 (RF) 算法,使用分层 5 倍交叉验证和发现队列中的内置参数调整对 70% 的样本进行模型训练。构建模型以区分病例组和对照组,对照组包含每个特定模型中的所有其他非病例样本。然后在同一队列中剩余的 30% 样本和另一个由 112 名处于不同肝病阶段的患者组成的验证队列中测试这些模型的性能。
最终训练好的 RF 模型在预测发现队列中≥ F3 和肝硬化的受试者工作特征曲线下面积 (AUROC) 得分分别为 0.98和 0.99(图 6 A)。在验证队列中,这些模型在预测≥ F3 和肝硬化方面的 AUROC 得分分别为 0.88和 0.89(图 6 A)。这两个模型在发现和验证队列中分别实现了高达 91% 和 81% 的平衡准确率(图 6 B)。他们展示了每个模型中重要性得分最高的前 15 种蛋白质,以及与早期阶段相比,晚期纤维化患者肝脏和血浆中的相对变化(图6C-D)。在这两个模型中的 25 种独特蛋白质中,有 3 种是“肝脏特异性”的,并分泌到血液中,包括FCN2、IGFBP3和GDF2(图6C-D)。NFASC和生长分化因子 15 (GDF15)在预测晚期纤维化方面表现出最高的重要性(图 6C)。
使用逻辑回归进行进一步分析,发现队列中的 AUROC 评分为 0.97(95% CI 0.92–1)和 0.99(95% CI 0.98–1),验证队列中的 AUROC 评分为 0.85(95% CI 0.76–0.95)和 0.94(95% CI 0.89–0.98)(图 6 E)。此外,他们研究了这些顶级蛋白质的各个子集(例如前 1、2、3、5、10 和 15)的预测能力,并将它们与使用 FIB-4 训练的模型进行了比较(图 6 E)。分析表明,使用NFASC和GDF15训练的模型在预测晚期纤维化方面具有更优异的性能,在发现和验证队列中的平衡准确度分别约为 93% 和 87%,而使用 FIB-4 训练的模型(平衡准确度分别为 79% 和 62%)(图 6 E)。对于肝硬化模型,前 10 种蛋白质(FLT1、IGFBP3、KRT19、FCN2、CRIM1、NFASC、TGFA、CA9、ANXA5和IL - 4R)在发现和验证队列中的平衡准确度分别约为 95% 和 83%(图 6 F)。
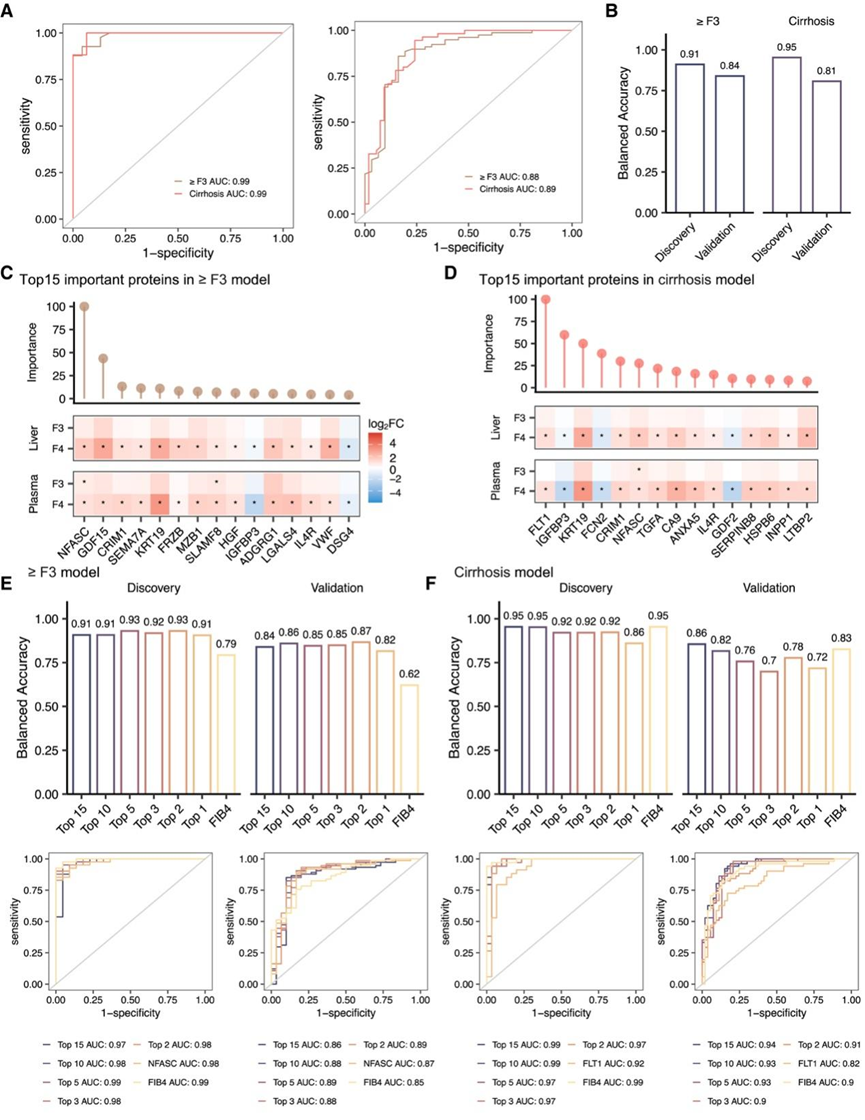
图6. 晚期纤维化和肝硬化的生物标志物组。
(A-B) 使用基于血浆蛋白的随机森林算法在发现和验证队列中预测晚期纤维化(≥F3 模型)和肝硬化(≥F4 模型)的 AUC-ROC 曲线和平衡准确度。(C-D) 随机森林算法分别从 ≥F3和肝硬化模型中确定的前 15 种重要蛋白质。(E-F) 使用逻辑回归算法,基于发现和验证队列中前 15、前 10、前 5、前 3 和前 2 个重要蛋白质,预测晚期纤维化和肝硬化的 AUC-ROC 曲线和平衡准确度。
+ + + + + + + + + + +
结 论
本研究使用蛋白质组学和转录组学方法分析了 330 人的肝脏和血浆样本,其中包括 40 名健康个体和 290 名因慢性病毒感染、饮酒或代谢功能障碍相关的脂肪肝疾病而出现组织学特征性纤维化的患者。本研究揭示了晚期纤维化中与细胞外基质、免疫反应、炎症和代谢相关的失调通路,还确定了 132 种与晚期纤维化相关的循环蛋白,其中神经束蛋白和生长分化因子 15 对晚期纤维化的预测性能优于fibrosis-4 模型(AUROC 0.85 [95% CI 0.78–0.93])。这些发现有助于深入了解纤维化的发病机制,并强调了更准确的非侵入性诊断的潜力。
+ + + + +



 English
English


