文献解读|Cell(45.5):泛癌症单细胞解剖揭示表型不同的 B 细胞亚型
✦ +
+
论文ID
原名:Pan-cancer single-cell dissection reveals phenotypically distinct B cell subtypes
译名:泛癌症单细胞解剖揭示表型不同的 B 细胞亚型
期刊:Cell
影响因子:45.5
发表时间:2024.07.23
DOI号:10.1016/j.cell.2024.06.038
背 景
癌症免疫疗法的成功启发了人们对整体肿瘤生态系统的深入探索,特别是肿瘤微环境 (TME) 的免疫方面。肿瘤浸润 T 细胞和髓样细胞的功能状态和异质性的综合图谱促进了多种新的治疗策略产生。然而,只有部分患者获得持久的反应,并且不同癌症类型之间的反应率差距很大。因此有必要在泛癌症水平上全面了解 TME,以充分挖掘人类癌症免疫监视的潜力。B 细胞作为免疫系统的核心组成部分,在免疫中发挥重要作用,但它们受到的关注较少,肿瘤浸润 B 细胞 (TIB) 的组成和功能异质性尚未系统地研究。
实验设计
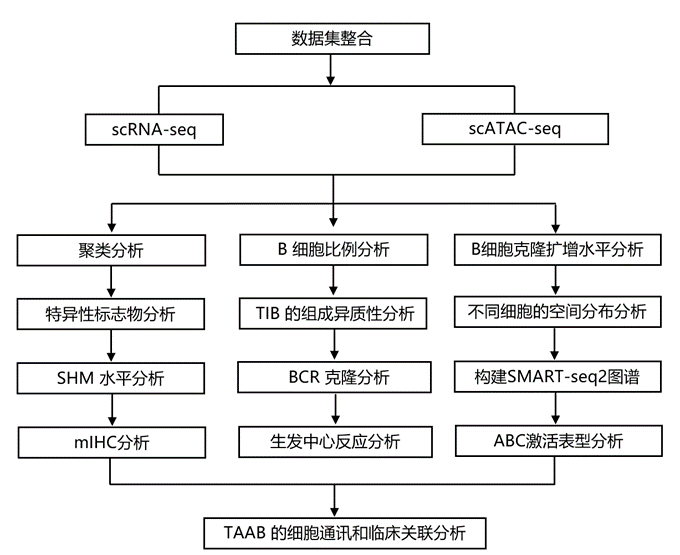
结 果
01
构建泛癌症 B 细胞单细胞图谱
本项研究新生成的泛癌症单细胞转录组分析(scRNA-seq)数据集与另外 54 项已发表的研究整合在一起,以阐明 TIB 的泛癌症特征。研究团队进行了严格的质量控制和过滤,然后通过每个数据集中的无监督聚类将 B 细胞与其他细胞类型区分开来,保留高度表达典型 B 细胞标记基因的聚类。然后编制了一个高质量的scRNA-seq图谱,其中包含来自 19 种主要癌症类型的 649 名患者的 948 个样本的 511847 个 B 细胞,主要覆盖肿瘤组织、邻近非肿瘤组织 (ANT) 和外周血(图 1 A)。此外,对于那些具有原始测序数据的 59592 个细胞(图 1 A),他们利用库序列调用工具 TRUST4 计算重建了它们的 B 细胞受体 (BCR) 序列。为了研究 TIB 的空间定位,他们对 80 份石蜡包埋的组织样本进行了多种 TIB 相关标志物的 IHC 检测,这些样本涵盖了 9 种癌症类型(图 1 A)。
所有收集的 scRNA-seq 数据集通过 Harmony整合并消除批次效应, 然后进行系统的无监督聚类以表征 B 细胞的转录亚群。正如预期的那样,鉴定出了五个主要聚类,包括四个 B 细胞主要谱系—幼稚 B(Bn)细胞、记忆 B(Bm)细胞、生发中心 B(Bgc)细胞和抗体分泌细胞 (ASC)—以及一个循环 B 细胞聚类(图 1 B),根据其典型标志物—IGHD/TCL1A、CD27/TNFRSF13B、BCL6/AICDA、MZB1和MKI67的高表达进行区分。对单一癌症类型的独立分析产生了一致的聚类结果。然后,他们分别对上述五个主要聚类进行聚类,发现总共 20 种不同的细粒度 B 细胞亚型,每种都有特定的特征基因(图 1 B)。具体来说,循环 B 细胞被分为三个亚群,它们在主要谱系特异性标志物的表达上有所不同,因此分别重新分配到 Bgc、Bm 和 ASC 谱系。
他们接下来采用基于基因集的分析来进一步阐明 B 细胞亚群的分子表型(图 1 C)。对于 Bm 细胞,他们确定了 8 个亚群,其中 c08_ABC_FCRL4 和 c09_ABC_FGR 类似于非典型 B 细胞 (ABC) 的转录表型。他们观察到 c11 的一个稀有群体,它高度表达了前生发中心 (pre-GC) B 细胞特征。这些细胞还显示出生发中心所需的Myc 通路活性升高(图 1C)。进一步考虑到与类别转换重组 (CSR) 机制相关的基因在 c11 细胞中高度表达,他们将 c11 定义为前生发中心细胞。他们将 c10_Bm_TCL1A 确定为 Bn 和 Bm 细胞之间的过渡状态,因为这两个主要谱系的标志物同时在这个亚群中高度表达。两个 Bm 亚群 c06_Bm_stress-response 和 c07_Bm_IFN-response 表现出受环境因素影响的分子表型,其中 c06 具有高表达应激相关热休克基因(包括HSPA1A、HSPA1B和DNAJB1),而 c07 则显示出 IFN 刺激基因表达升高(图 1 C)。
重建的 BCR 序列使能够用以检测 TIB 的各种克隆型特征,他们根据 TIB 的 Ig 恒定区鉴定了它们的 Ig 重链同种型,发现 B 细胞主要谱系中存在不同的同种型分布模式(图 1 D)。Bn 聚类以 IgM 和 IgD 同种型为主,ASC 聚类显示出 IgA 和 IgG 同种型的高度富集,而 Bm 和 Bgc 聚类则表现出各种同种型的混合。然后,他们将每个细胞的体细胞超突变 (SHM) 水平量化为 Ig 可变区的点突变率,分为三组:低 SHM(突变率 < 1%)、中等 SHM(1%–5%)和高 SHM(> 5%)。他们观察到 Bn 细胞的 BCR 中 SHM 水平较低,而 Bm 细胞、Bgc 细胞和 ASC 的 BCR 中 SHM 水平中等或高(图 1 D),这与它们的逐渐成熟阶段相对应,这种模式在不同癌症类型中均有观察到。他们进一步根据各自的中位 SHM 水平将 Bgc 细胞、Bm 细胞和 ASC 分为两组,发现 B 细胞成熟标志物CD27在 SHM 高组中表现出更高的表达水平,而IGHM和IGHD在 SHM 低组中表达更高。
为了绘制肿瘤中 B 细胞主要谱系的空间布局,他们对 12 种肿瘤组织进行了四组多重 免疫组织化学分析(IHC) (mIHC)。首先将三级淋巴结构 (TLS) 定义为具有清晰 B 细胞和 T 细胞区域的有组织结构。通过定量,说明 Bn 细胞(CD20+ IgD +)、Bm 细胞(CD20 + CD27 + Bcl-6 −)和 Bgc 细胞(CD20+ Bcl-6 +)主要位于 TLS 中,其中 Bgc 细胞主要占据 TLS 的中心区域(图1 E-F),这与先前的发现一致,即 Bm 细胞和 Bgc 细胞在肾细胞癌的 TLS 中富集。相比之下,他们在 TLS 周围检测到了ASC(CD79a + CD27 + CD138 +),并且发现它们是癌细胞附近最丰富的 B 细胞谱系。对涵盖 9 种癌症类型的肿瘤进行的 IHC 染色证实了 CD20+B 细胞的聚集分布和 CD138+ 浆细胞 (PC) 在 TLS 附近、肿瘤内以及纤维化基质中的存在。
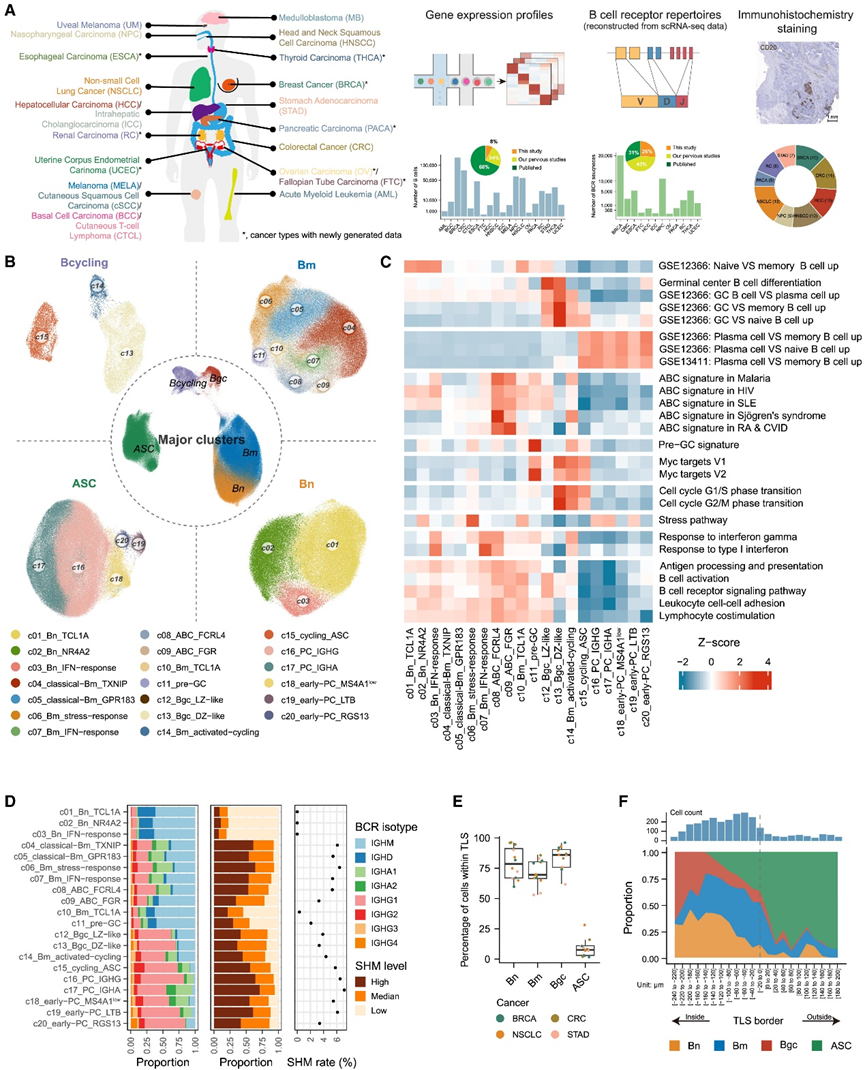
图1. 泛癌B细胞单细胞谱。
(a) 图集示意图。(b)均匀流形近似和投影 (UMAP) 图显示 B 细胞的主要聚类和子集。(c) 热图显示 B 细胞亚群中基因特征的表达。(d) 热图显示 B 细胞亚群中基因特征的表达。(e)基于 mIHC 数据量化的 B 细胞主要谱系中 TLS 内的细胞百分比。(f) 代表性 TLS 内部或外部的 B 细胞主要谱系的空间分布模式。
02
不同癌症类型的 B 细胞异质性
泛癌症图谱能够系统地检测不同癌症类型中 TIB 的异质性。在肿瘤中,免疫区室中的 B 细胞比例在不同癌症类型中差异很大(图 2 A),从葡萄膜黑色素瘤 (UM) 中的接近 0% 到鼻咽癌中的 29.5% 不等。有趣的是,对于某些肿瘤中含有大量 B 细胞的癌症类型,例如结直肠癌 (CRC)、胃腺癌 (STAD) 和食道癌 (ESCA),在其 ANT 中也检测到了较高的 B 细胞流行率。此外,在这些源自粘膜组织的癌症类型中,观察到 ANT 和肿瘤之间 B 细胞群大小呈正相关(图 2 B),这反映出这些组织中存在炎症状态或 TLS 可能导致观察到的较高水平的 B 细胞。相比之下,在同样以大量 B 细胞为特征的乳腺癌 (BRCA)、NSCLC 和胰腺癌 (PACA) 中,他们发现肿瘤中的 B 细胞丰度高于 ANT。鉴于即使是同一癌症类型的患者中 TIB 水平也存在差异(图 2 A),他们假设 TME 特异性细胞间通讯也可能影响 B 细胞浸润。事实上,与肿瘤浸润 T 细胞和髓样细胞相比,TIB 很少在泛癌症水平上单独存在(图 2 C)。
然后,他们根据主要谱系比例检测了 TIB 的组成异质性(图 2 D)。通常,Bgc 细胞仅占 TIB 的不到 5%,代表肿瘤部位相对较小的群体。Bn 细胞在各种癌症类型中的患病率稳定(约 10%–15%),而 Bm 和 ASC 比例的变化较大。特别是,肿瘤中的主要谱系组成可能受宿主器官固有特征的影响。例如,CRC 肿瘤及其 ANT 具有大量 Bgc 细胞和 ASC(图 2 D)。此外,通过基于亚群比例的癌症类型分层来描绘 B 细胞亚群水平的异质性(图 2 E)。值得注意的是,CRC 和 STAD 表现出相似的 TIB 组成并聚集在一起,表明在塑造它们的 B 细胞相关抗肿瘤免疫方面存在共同因素。
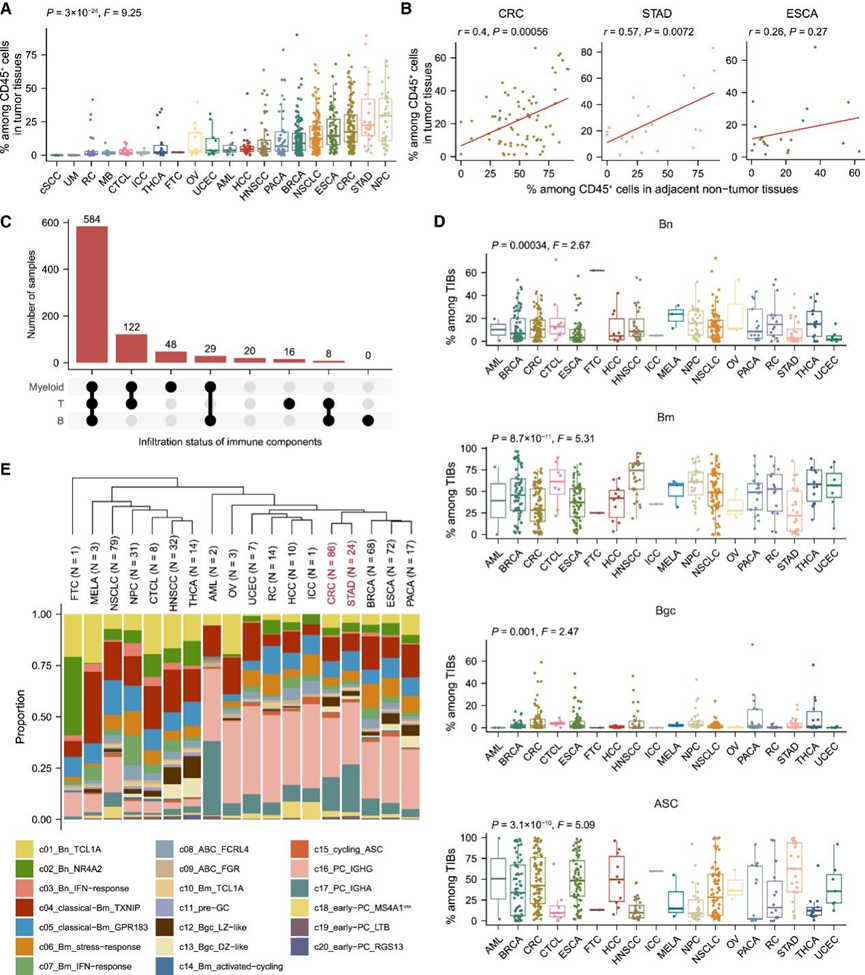
图2. 不同癌症类型的 B 细胞异质性。
(a) 不同癌症类型CD45+细胞中的 TIB 比例。 (b) CRC、STAD 和 ESCA 中肿瘤与 ANT 之间的 B 细胞比例的 Pearson 相关性。(c)肿瘤内三种主要免疫成分的浸润状态。 (d) 不同癌症类型的 TIB 主要谱系组成。 (e)不同癌症类型的 TIB 主要谱系组成。
03
人类肿瘤内生发中心反应的重现
本研究的图谱还提供了分析稀有细胞类型的机会。以 Bgc 细胞为例,观察了它们在 TME 中的转录特征和转变动态。传统上,次级淋巴器官 (SLO) 中的 B 细胞亲和力成熟主要发生在生发中心,Bgc 细胞在明区和暗区之间循环并反复积累 BCR 突变,最终产生抗原特异性 Bm 细胞和 PC。在肿瘤中,他们确定了两个 Bgc 亚群,c12_Bgc_LZ-like 和 c13_Bgc_DZ-like,并证实它们存在于几乎所有分析的癌症类型中。这些 c12 细胞表达参与调节 T 细胞活化、抗原加工和呈递通路的基因,而细胞增殖相关通路在 c13 细胞中上调(图 3 A)。值得注意的是,在肿瘤中,c12 和 c13 细胞的丰度是相关联的,表明它们经常同时出现(图 3 B)。因此,来自 c12 和 c13 的大部分细胞共有 BCR 克隆(图 3 C),表明它们之间存在状态转换。为了进一步阐明 Bgc 细胞的进化动态,对于每个包含 Bgc 细胞的 TIB 克隆,他们基于相应细胞的第三互补决定区 (CDR3) 序列计算重建了谱系树。对于几个代表性谱系树,c12 和 c13 细胞之间多轮交替转换逐渐积累,并伴随着这一过程出现了 Bm 细胞和 PC(图 3 D-E)。事实上,某些 Bm 和 ASC 亚群与 c12 和 c13 共有克隆,在 c20_early-PC_RGS13 中识别出显著的 BCR 共有特征(图 3C),它们可能是新分化的并准备离开生发中心。
接下来,他们探讨了 Bgc 细胞与其他 B 细胞亚群以及肿瘤内其他免疫亚型的关联。Bn 和 Bm 细胞在含有 Bgc 细胞的肿瘤中的丰度似乎明显高于不含 Bgc 细胞的肿瘤,而 PC 的流行率没有显著差异(图 3F)。在其他免疫亚型中,CD4 T 滤泡辅助 (Tfh) 细胞与 Bgc 细胞表现出最强的正相关性(图 3G)。由于 CD4 Tfh 细胞可以在 SLO 中的生发中心反应期间协助 B 细胞的克隆选择,他们假设肿瘤中的生发中心反应也可能与 CD4 Tfh 细胞结合以促进 TIB 亲和力成熟。总的来说,这些的数据支持了以下观点:与 SLO 类似,T 细胞依赖性生发中心反应也发生在肿瘤内,其中这两个 Bgc 亚群经历了转变周期和 BCR 序列进化,产生了 Bm 细胞和 ASC。
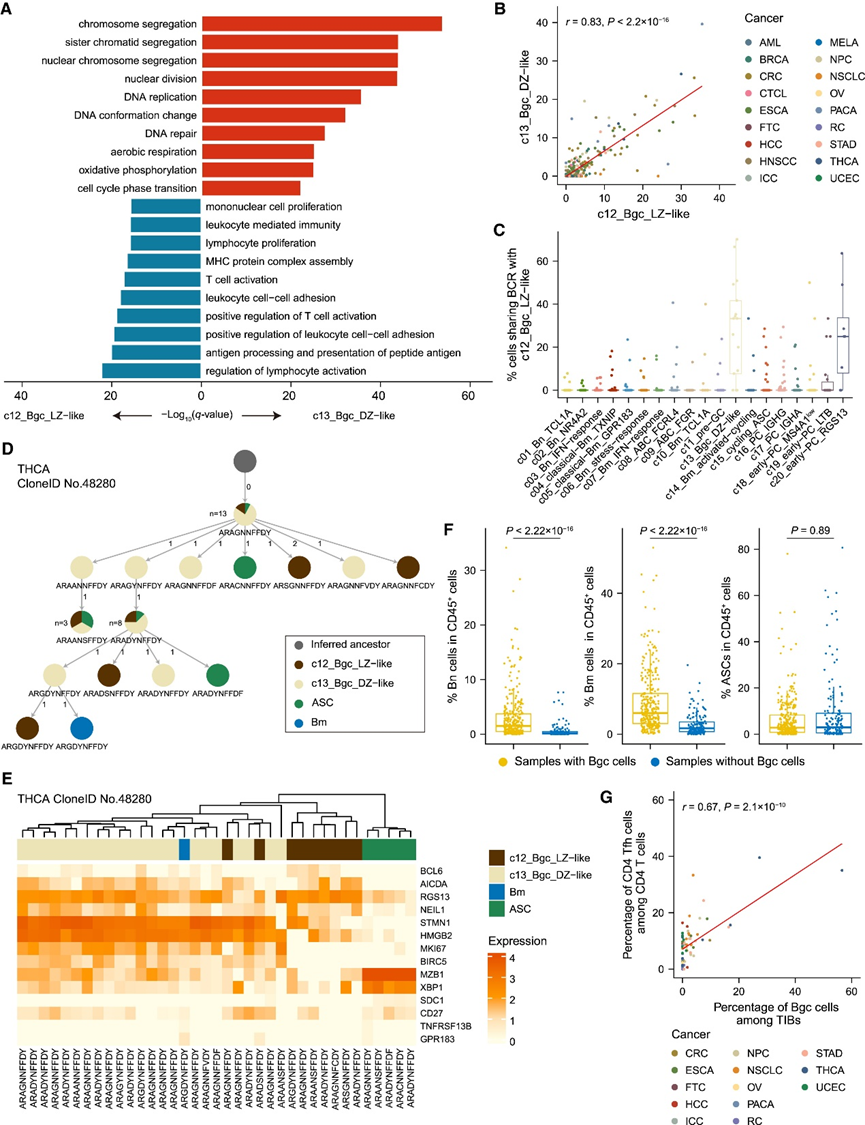
图3. 人类肿瘤内生发中心反应的重现。
(a) 肿瘤内 c12 和 c13 Bgc 细胞中富集的通路。(b) 未经治疗的肿瘤样本(B 细胞 > 50)中 c12 和 c13 Bgc 细胞丰度之间的 Pearson 相关性。(c)每个 B 细胞亚群中与肿瘤内 c12_Bgc_LZ 样细胞共有 BCR 的细胞比例。 (d) THCA 肿瘤的 TIB 代表性谱系树。(e) 热图显示 (D) 中谱系树中 B 细胞中 B 细胞主要谱系标志物的表达。(f)箱线图比较了含有和不含有 Bgc 细胞的肿瘤中 Bn 细胞、Bm 细胞和 ASC 的丰度。 (g) 肿瘤中 Bgc 细胞和 CD4 Tfh 细胞丰度之间的 Pearson 相关性。
04
识别与肿瘤免疫反应相关的潜在 B 细胞亚群
利用跨组织转录组学和 BCR 数据,他们接下来重点从三个角度精确定位可能参与肿瘤相关免疫反应的关键 B 细胞亚群,包括肿瘤富集程度、克隆扩增和增殖。对不同组织中 B 细胞亚群分布的分析揭示了循环 B 细胞和组织浸润 B 细胞之间存在巨大差异。在血液中,ASC 的丰度与组织相比低得多,而一些 B 亚群仍然主要富集,包括 c01_Bn_TCL1A、c04_classical-Bm_TXNIP、c09_ABC_FGR 和 c18_early-PC_MS4A1 low(图 4 A)。事实上,血液显示出的 B 细胞组成多样性低于肿瘤或 ANT,其中肿瘤中的 B 细胞具有最高的多样性。此外,c17_PC_IGHA 细胞在 ANT 中富集,而 c06_Bm_stress-response、c07_Bm_IFN-response、c08_ABC_FCRL4 和 c16_PC_IGHG 在肿瘤中表现出强烈的分布偏好(图 4 A)。
抗原驱动的克隆扩增和增殖是 B 细胞反应的典型特征。肿瘤组织中克隆大小 > 1 的 B 细胞克隆比例高得多,表明发生了肿瘤相关的 B 细胞免疫反应。正如预期的那样,Bgc 和 ASC 谱系在肿瘤中表现出比 Bn 和 Bm 细胞更高的克隆扩增水平(图 4 B),与它们作为克隆型扩增阶段的状态一致。在 ASC 谱系中,他们还比较了不同分型的克隆扩增能力。值得注意的是,虽然具有 IgA 和 IgG 同种型的 ASC 在 ANT 中显示出相似的克隆扩增水平,但来自肿瘤的 IgG ASC 的特征是克隆扩增比来自 ANT 的 ASC 更强(图 4 C)。相对有限的 Bm 细胞出现克隆扩增(图 4 B),但 c08_ABC_FCRL4 亚群在肿瘤内仍显示出明显更高的克隆扩增水平(图 4 D)。此外,此类肿瘤衍生的 c08_ABC_FCRL4 细胞比 ANT 中的细胞扩增得多(图 4 E),这意味着肿瘤内刺激可能与它们的克隆扩增有关。
重点关注循环 B 细胞的转录特征,他们观察到循环 Bm 细胞 (c14) 高表达 c08_ABC_FCRL4 细胞的多个标记基因(图 S1 F)。进一步利用 CellTypist方法,他们发现在所有循环 Bm 细胞中,大约 52.6% 预测为 c08_ABC_FCRL4(图 4 F)。此外,与 ANT 相比,肿瘤组织中 FCRL4 + Bm 细胞内循环细胞的比例显著升高(图 4 G)。mIHC 染色证实了多种癌症类型的人类肿瘤中存在 Ki67+ FCRL4 + Bm 细胞(图 4 H)。这些观察结果证明了 FCRL4 + Bm 细胞的增殖能力,表明它们在 TME 内持续存在。此外,循环 ASC 的同种型主要来自 IgG (图 4 I)。简而言之,这些分析强调了某些 B 细胞亚群,包括 FCRL4+ Bm 细胞和 IgG PC,可能积极参与肿瘤相关免疫反应。
随后,他们研究了 ASC 谱系的特征,重点关注前面提到的肿瘤中富集的 IgG PC。ASC 在不同癌症类型中往往具有最高的变异性,这主要归因于它们依赖于癌症类型的 Ig 基因优先表达。虽然 c16_PC_IGHG 在泛癌症水平上在肿瘤组织中表现出比 c17_PC_IGHA 更强的富集(图 4 A),但不同癌症类型的富集程度不同。CRC、STAD、ESCA 和 NSCLC 主要来源于胃肠道和呼吸道组织,这些组织中丰富的 IgA 抗体积极维持着正常的粘膜免疫,在肿瘤和 ANT 之间观察到 c16 至 c17 PC 丰度的最大异质性(图 4 J)。
他们进一步比较了肿瘤和 ANT 之间 ASC 的同种型组成。重要的是,IgG1 是肿瘤样本 ASC 中最常见的同种型,并且从 ANT 中显著增加,但其他 IgG 同种型的变化很小(图 4 K)。他们持续观察到肿瘤中与 IgG1 同种型共享克隆型的上游抗体同种型(IgM/D 和 IgG3)的百分比升高(图 4 L)。因此,Ig 类别转换为 IgG1 同种型的情况可能在肿瘤中更频繁地发生。此外,IgA1 和 IgA2 同种型的流行率在肿瘤中均显著下降(图 4 K)。此外,在 CRC 肿瘤内,IgA+细胞主要聚集在靠近肿瘤区域的粘膜区域,而 IgG+细胞主要位于肿瘤区域内(图 4 M)。与选择性结合 IgA 的 Fc 阿尔法受体 (FcαR) 相比,对 IgG 具有特异性的 Fc 伽马受体 (FcγR) 在细胞毒性自然杀伤 (NK) 细胞和多种巨噬细胞亚群中高表达。总的来说,在肿瘤中 ASC 的同种型从 IgA 偏向 IgG 同种型,他们推测 IgG PC 可能更有可能参与抗体相关反应。
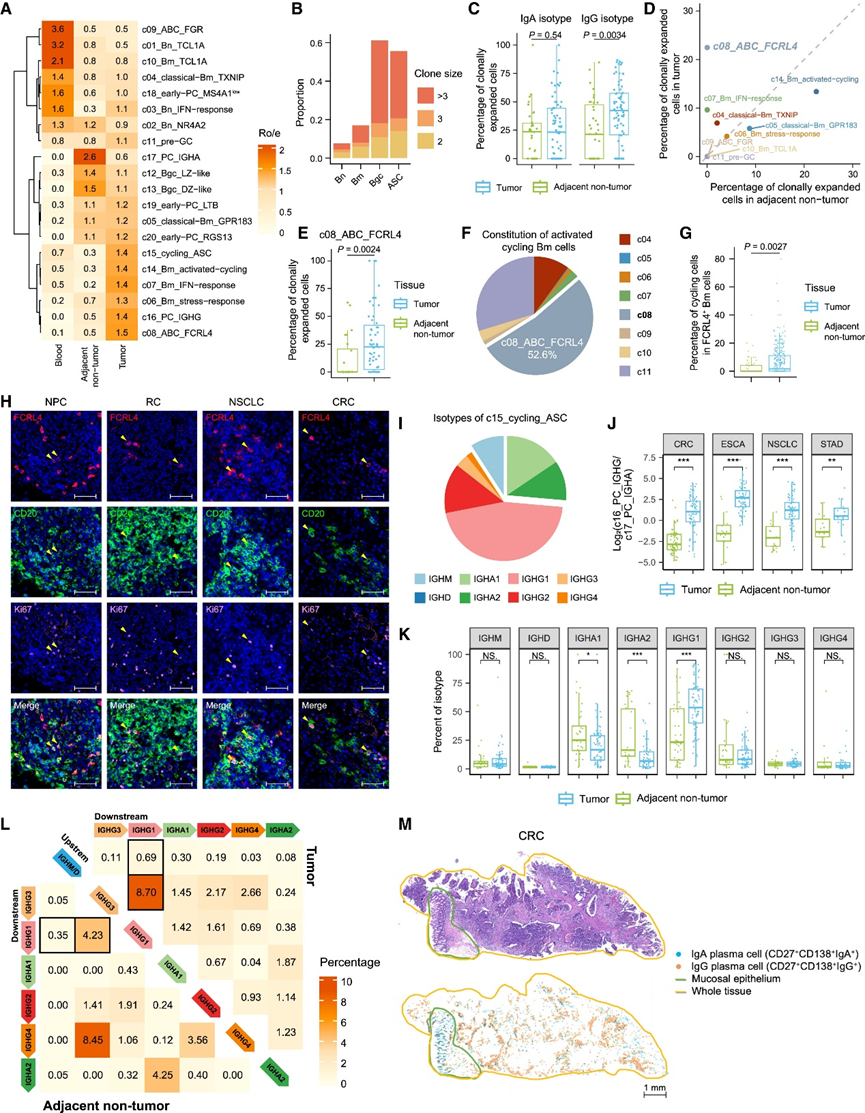
图4. 识别与肿瘤免疫反应相关的潜在B细胞亚群。
(a) 通过 Ro/e 指数评估每个 B 细胞亚群的组织偏好。 (b) 肿瘤中 B 细胞主要谱系的克隆扩增水平,细胞根据其相应克隆的克隆大小进行分类。 (c) 箱线图比较肿瘤和 ANT 之间 IgA 和 IgG 同型 ASC 中克隆扩增细胞(定义为克隆大小 > 1 的克隆型细胞)的百分比。(d) 散点图显示肿瘤和 ANT 中每个 Bm 亚群中克隆扩增细胞的中位百分比。(e)箱线图比较肿瘤和 ANT 之间 c08_ABC_FCRL4 细胞中克隆扩增细胞的百分比。(f) CellTypist 分配的子集特征在激活的循环 Bm 细胞中的分布。 (g) 箱线图比较肿瘤和 ANT 中所有 FCRL4+ Bm 细胞中循环细胞的比例。 (h) 经 mIHC 染色的肿瘤样本代表性示例,显示存在 Ki67+ FCRL4+ B 细胞。(i) c15_cycling_ASC 中 IgH 同种型的分布。(J)箱线图比较肿瘤和 ANT 之间 c16 与 c17 PC 的丰度比。 (K) 箱线图比较肿瘤和 ANT 之间 ASC IgH 同种型的组成。(L) 肿瘤(右上)和 ANT(左下)中不同 IgH 同型的 B 细胞间 BCR 库重叠。(M) CRC 肿瘤样本的苏木精-伊红染色,显示 IgA 和 IgG PC 的空间分布。
05
FCRL4+和应激反应 Bm 细胞与患者预后相关
为了进一步了解 B 细胞亚群在肿瘤中的作用,他们利用 TCGA 数据在校正总 B 细胞丰度的影响后,探究了 B 细胞亚群特征与癌症患者总体生存期的关联(图 5 A)。值得注意的是,B 细胞亚群表现出与癌症类型相关的患者预后相关性。在泛癌症水平上,FCRL4 + Bm 特征表达相对较高的患者往往显示出更长的生存期。然而,应该注意癌症类型的异质性,因为在某些癌症中,例如头颈部鳞状细胞癌 (HNSC) 和结肠腺癌 (COAD),FCRL4 + Bm 特征的预后趋势略差(图 5 B)。
相比之下,另一个 B 细胞亚群 c06_Bm_stress-response 与泛癌症水平上的不良生存相关(图 5 A)。具体而言,其特征可预测 ESCA、肺鳞状细胞癌 (LUSC) 和胰腺腺癌 (PAAD) 的不良结果(图5 C)。调节性B细胞 (Breg)起着促肿瘤作用并且与不良预后相关,但无监督的转录组谱聚类并不能唯一地区分它们。然后,他们检测了用于区分Breg的细胞因子的表达,例如白细胞介素-10 (IL-10)、IL-35和转化生长因子β (TGF-β)。
值得注意的是,IL10和IL12A/EBI3(编码 IL35)在转录水平上很少检测到,而TGFB1表达几乎存在于所有TIB亚群中,但没有明显的模式。为了减少由不同技术引起的差异,他们随后仅使用来自SMART-seq2平台的scRNA-seq数据集建立了另一个图谱(图5 D-F)。正如预期的那样,在这个基于 SMART-seq2 的图谱中,观察到了更高的IL10表达率(图 5 F-G)。符合先前报道的 Breg 表面标记的细胞,包括 CD19 + CD24 + CD38 +和 CD19 + CD24高CD27 + ,表现出增加的IL10表达(图 5 H)。然而, IL10的表达分散在不同的 B 细胞主要聚类中(图 5 G)。这些IL10+ B细胞可以表达不同的标记物,表明不同的B细胞主要谱系(图 5 I)。简而言之,这些结果证明了 Breg 或至少IL10+ B 细胞可能不代表 B 细胞的不同谱系,而是可能以依赖于环境的方式从 B 细胞分化的各个阶段产生。
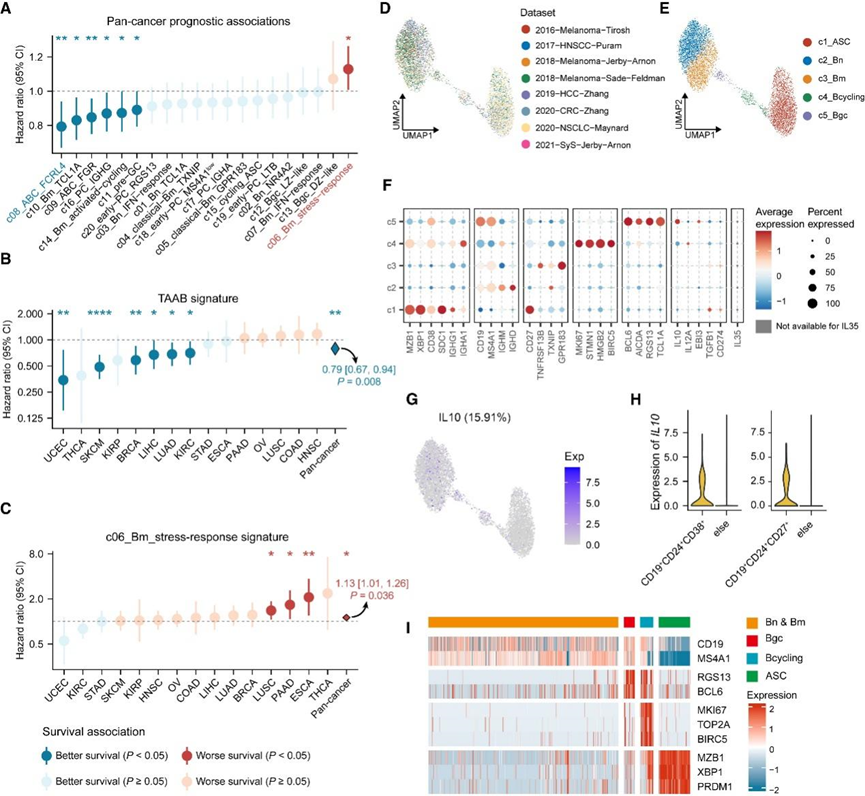
图5. FCRL4+和应激反应记忆 B 细胞与患者预后相关。
(a-c)TIB 子集特征的预后关联。 (d-e) SMART-seq2 B 细胞图谱的 UMAP 图,显示数据集和主要聚类的分布。 (f) SMART-seq2 图谱中 B 细胞聚类间特征基因的表达。(g) UMAP 图显示SMART-seq2 图集中IL10的表达模式。(h) 根据报告的 Breg 表面标志,通过计算机模拟FACS从 SMART-seq2 图谱中选择的 B 细胞中IL10 的表达。 (i) 热图显示SMART-seq2 图谱中IL10+ B 细胞上的主要谱系标记表达。
06
肿瘤相关 ABC 的激活表型
上述分析共同指出了 FCRL4+ Bm 细胞在肿瘤中的关键作用。虽然丰度各不相同,但在几乎所有癌症类型的肿瘤中都发现了FCRL4+ Bm 细胞(图 6 A)。然后,他们通过分析 BRCA 患者的转座酶可及染色质 (scATAC-seq) 数据集研究了 TIB 的表观基因组景观。在表观遗传水平上,可以通过无监督聚类轻松识别所有 B 细胞主要谱系。一部分 Bm 细胞可以分为 FCRL4 + Bm 细胞(图 6 B)。深入研究该子集的特定可及染色质区域,发现 c08 细胞转录标记基因的 DNA 片段的开放性增强(图 6 B),进一步证实了 FCRL4 + Bm 细胞的表观遗传独特性。因此,FCRL4+ Bm 细胞可能是跨癌症类型的常见、稳定的细胞类型。考虑到肿瘤浸润 FCRL4 + Bm 细胞与之前报道的 ABC的转录相似性(图1 C,图6 C),因此他们将它们命名为肿瘤相关 ABC (TAAB)。
接下来,他们试图探究肿瘤中 TAAB 的分子特性。值得注意的是,此类细胞在与 BCR 信号传导和 B 细胞活化有关的多个过程中表现出增强的活性,包括肌动蛋白细胞骨架重建、细胞间粘附和抗原呈递(图 6 D)。与其他组织富集的 Bm 细胞相比,TAAB 始终表现出 B 细胞活化标志物的表达升高,包括CD80、CD86和FAS(编码 CD95)(图 6 C)。此外,某些转录因子,包括BHLHE40和SPIB(图 6 C),已知它们分别调节 BCR 信号通路和影响 B 细胞活化,在 TAAB 中高度表达。基于 SCENIC 的调节子分析也证实了这些转录因子的活性(图 6 E)。这些观察结果以及上述克隆扩增状态表明,TAAB 可能在肿瘤中经历基于抗原刺激的激活。此外,TAAB 上调了 MHC-II 基因,表明它们具有抗原呈递潜力(图 6C)。此外,他们观察到多种细胞因子受体(包括IFNGR1、CXCR3和CCR1 )表达增加(图 6C),已知这些受体在TAAB中参与对炎症信号的反应。流式细胞分析证实,与 FCRL4− B 细胞相比,从肝细胞癌 (HCC) 和肝内胆管癌 (ICC) 新鲜肿瘤组织中分选出的 FCRL4 + B 细胞显示出更高的 ABC 标志物 CD11c 和 T-bet、活化标志物 CD86、MHC-II 分子 HLA-DR 和趋化因子受体 CXCR3 表达(图 6 F)。
然后,他们通过检测TAAB 与其他 Bm 细胞的谱系关系并通过计算推断肿瘤中的进化轨迹来检查 TAAB 的发育动态。首先,通过 STARTRAC 转换指数量化 TAAB 与其他聚类的 BCR共有程度,结果显示两个 Bm 亚群 c04_classical-Bm_TXNIP 和 c07_Bm_IFN-response 与 TAAB 的转换倾向明显高于其他亚群(图 6 G)。因此,他们重点关注这三个亚群 c04、c07 和 c08,并使用 RNA 速率分析来分析它们的转换方向,观察到从 c04 和 c07 到 c08 细胞的定向流(图 6 H)。将伪时间与基因表达谱相关联表明,伪时间的增加伴随着 ABC 标记基因、T 细胞共刺激相关基因、MHC-II 基因和炎症细胞因子受体的逐渐上调(图 6 I)。总之,这些结果表明 TAAB 处于分化和激活状态。
通过无监督聚类确定了非典型样聚类,高表达FCRL5、ITGAX和TBX21。值得注意的是,虽然FCRL4在本研究的图谱中的 TAAB 中能广泛检测到,但在非癌症图谱中的 ABC 中仅表现出微量检测率。与非癌症条件相比,FCRL4在肿瘤中显示出选择性更高水平(图 6 J)。这一观察结果表明FCRL4是一种依赖于环境的 ABC 标记,偏好于肿瘤内的 TAAB。为了探索TAAB 中FCRL4高表达的潜在机制,他们对FCRL4+ B 细胞进行了体外诱导,发现通过癌胚抗原、CpG 和抗 CD40 的组合可以在 B 细胞中有效诱导 FCRL4 表达(图 6 K-L)。
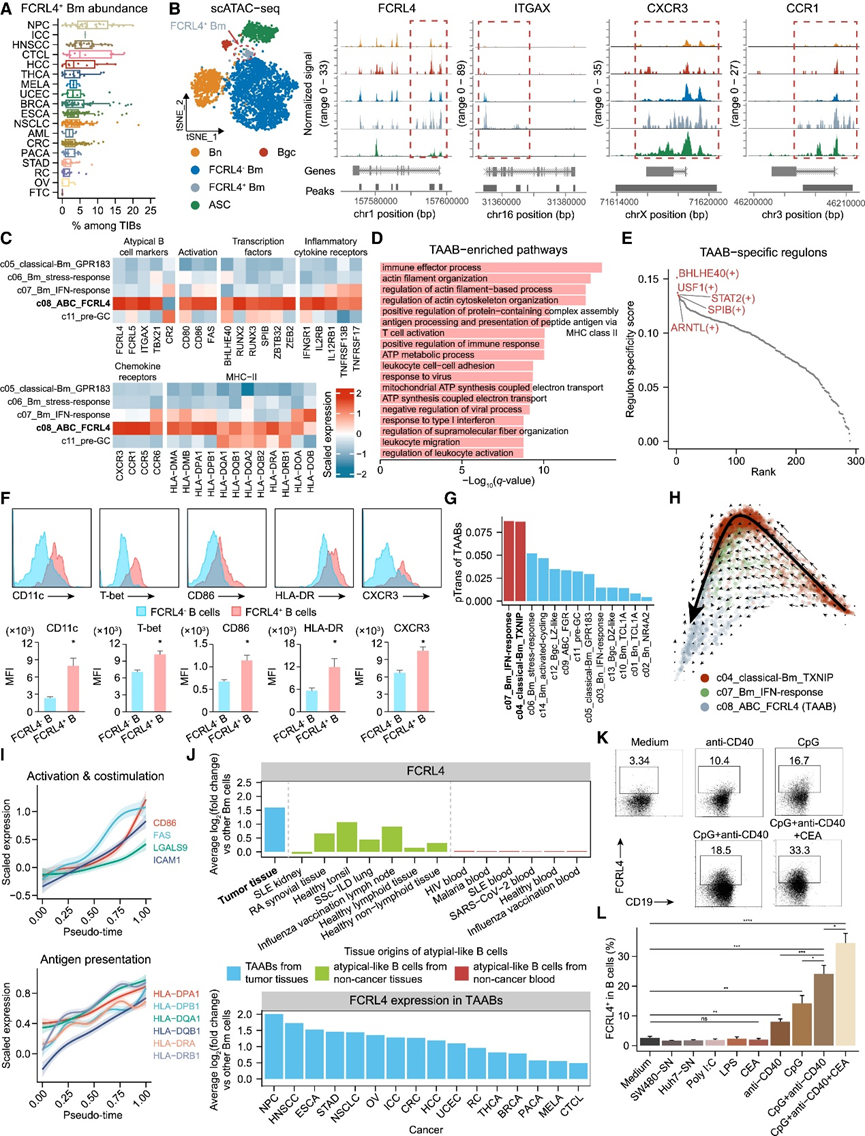
图6. 肿瘤相关非典型B细胞的表观遗传和转录特征。
(a) 不同癌症类型的 TIB 中 FCRL4+ Bm 细胞的比例。 (b) t 分布随机邻域嵌入 (t-SNE) 图显示 BRCA 患者 scATAC-seq 数据集中的 B 细胞注释(左)。ATAC-seq 轨迹显示四个 TAAB 标记基因位点的染色质可及性(右)。(c) 与肿瘤中其他组织富集的 Bm 亚群相比,TAAB 中差异表达的选定基因的表达。(d)通路分析。(e)TAAB 特异性调控子按调控子特异性得分降序排列。(f) 流式细胞分析。(g) TIB 子集与 TAAB 的成对转换指数 (pTrans),其中突出显示了前两个子集。 (h) RNA 速率分析。 (i) 选定基因表达与伪时间之间的关系。(J) ABC 与其他 Bm 细胞之间FCRL4表达变化。(K)FCRL4 + B 细胞诱导实验。 (L) 在不同条件下培养的总 B 细胞中FCRL4+ B 细胞的百分比。
07
TAAB 与 CD4 T 细胞相互作用,可作为免疫治疗反应的预测因子
考虑到据报道 TIB 会与其他免疫细胞(尤其是 T 细胞)结合,他们接下来探索了 TME 中 TAAB 的物理邻域和分子调节因子。首先,他们对来自三种癌症类型的七个肿瘤样本进行了 mIHC 以定位 TAAB 和其他免疫细胞类型(图 7 A)。在整个肿瘤切片中,分别确定了与每个 FCRL4 + TAAB 物理上最近的 CD4 + T、CD8 + T 和 CD68 +髓系细胞。定量评估显示,TAAB 与最近的 CD4 + T 细胞(中位距离约 10 μm)之间的空间关系比 CD8 + T 细胞和 CD68 +髓系细胞(中位距离约 25 μm)更密切(图 7 B)。这种空间关系,再加上 TAAB 上 MHC-II 基因表达升高(图 6 C),使他们假设 TAAB 可能与 CD4 T 细胞相互作用。
在转录水平上,他们观察到 TAAB 上调参与抗原加工和呈递各个步骤的多个基因(图7 C)。肿瘤样本上的额外 mIHC 一致地显示在 TAAB 和 CD4 + T 细胞之间的连接处有清晰的 HLA-DR 表达(图 7 D),这表明 TAAB 可能通过 MHC-II 抗原呈递为 CD4 T 细胞活化提供信号。值得注意的是,前面提到的TAAB 中CD80和CD86的高表达反映了它们提供共刺激信号的潜力(图 6 C)。基于 CellChat 的分析进一步表明,在 TIB 中,TAAB 与 CD4 T 细胞表现出最强的相互作用潜力。具体而言,与其他 Bm 亚群相比,TAAB 含有更多可介导与 CD4 T 细胞相互作用的共刺激配体-受体对,其中突出的例子包括 CD86-CD28、ADGRE5-CD55、和 ICAM1/2 相关粘附分子(图7 E)。值得注意的是,在不同癌症类型的肿瘤样本中,TAAB 均显示出比其他 Bm 细胞更高的 MHC-II 基因和共刺激相关分子的总体表达。此外,肿瘤样本上的 mIHC 显示,与距离 TAAB 50-200 μm 的 CD4 T 细胞相比,距离 TAAB 较近(< 20 μm)的 CD4 T 细胞表现出更高的活化标志物 CD69 表达(图 7 F-G)。总之,TAAB 可能专门用于抗原呈递,可能分别通过 MHC-II 和共刺激分子提供两种信号,从而与 CD4 T 细胞的激活有关。
IL-21 已知可促进 B 细胞活化和扩增,并作为 PC 分化的最有效诱导剂发挥作用,它在 TAAB 中的信号传导活性高于肿瘤中所有其他 Bm 亚群(图 7 H)。因此,他们观察到 TAAB 与肿瘤中的 ASC 具有比其他 Bm 细胞更高的 BCR 共有程度(图 7 I)。他们随后检查了 TME 免疫亚型中IL21的表达模式,发现IL21仅由CXCL13+ CD4 T细胞亚群表达(图 7 J)。TAAB 患病率较高的肿瘤中的 CD4 T 细胞具有CXCL13 +CD4 T 细胞,包括CXCL13、SOX4和LAG3,以及更高比例的CXCL13 + CD4 T 细胞(图 7 K),这意味着 TAAB 和肿瘤反应性 CD4 T 细胞在 TME 中同时出现。简而言之,CD4 T 细胞,尤其是肿瘤反应性 CD4 T 细胞,可能与 TAAB 协同活化并向 PC 分化。
综上所述,这些结果表明,TAAB 通过与 CD4 T 细胞相互作用,可能表现出 TIB 相关抗肿瘤活性的两个方面,作为抗原呈递细胞参与 T 细胞反应,并作为 PC 前体介导体液反应,这与它们与多种癌症的良好预后相关相一致,而与整体 B 细胞存在无关(图 5 B)。他们还收集了接受抗 PD-1、抗 CTLA-4 或过继细胞转移疗法的个体的未治疗肿瘤样本数据集,发现在 NSCLC 和黑色素瘤中,与无应答者相比,应答者往往具有更高的 TAAB 特征表达(图 7 L)。
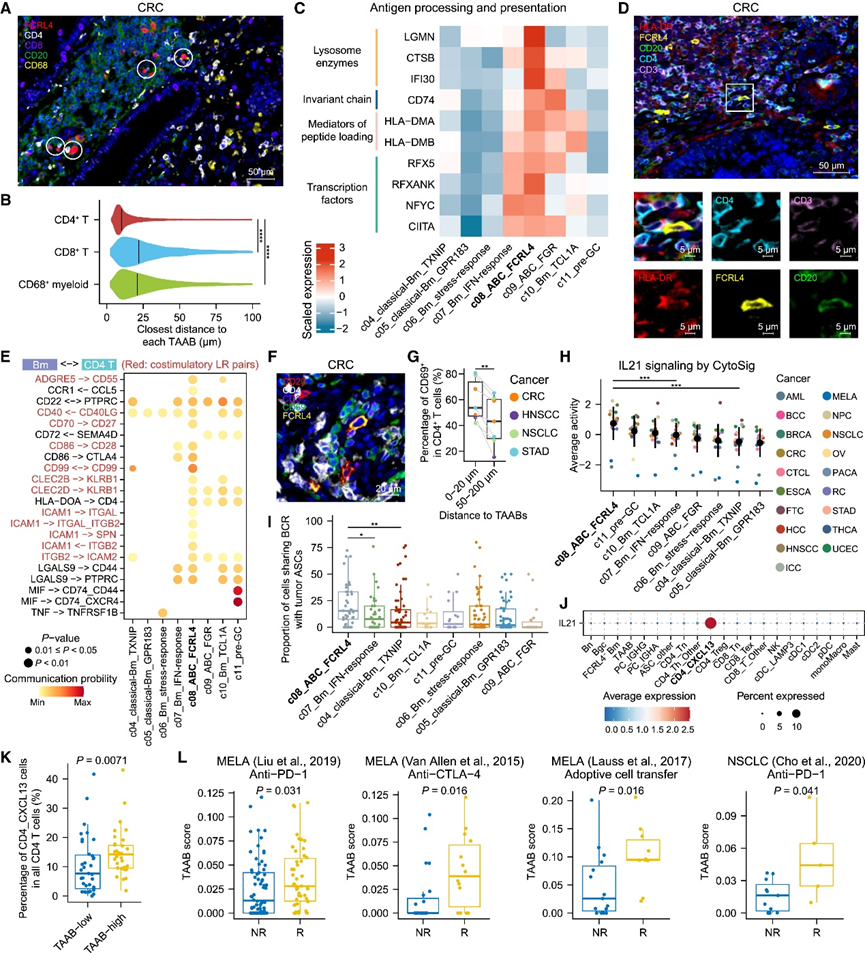
图7. TAAB 的细胞通讯和临床关联。
(a) 细胞空间分布分析。(b) 所有染色肿瘤中每个 TAAB 与其最近的 CD4+ T、CD8+ T 或 CD68+髓系细胞之间的距离。(c)肿瘤内 Bm 亚群中抗原加工和呈递相关基因的表达。(d) 细胞空间分布分析。(e) 肿瘤内 CD4 T 细胞与每个 Bm 亚群之间的显著配体-受体对。(f) mIHC 分析。(g) CD4+ T 细胞与 TAAB 的距离与活化 CD4+ T 细胞占总 CD4+ T 细胞的百分比之间的关系。(h) 肿瘤内每个 Bm 亚群的 IL-21 信号活性。(i) 每个 Bm 亚群中与肿瘤内 ASC 共有 BCR 的细胞比例。(J) TME 免疫亚型中的IL21表达。(K) 两组肿瘤样本中CXCL13 + CD4 T 细胞占所有 CD4 T 细胞的百分比分析。 (L) 癌症免疫疗法应答者和无应答者之间 TAAB 特征表达的比较。
+ + + + + + + + + + +
结 论
本项研究通过整合来自 19 种主要癌症类型的 649 名患者的 B 细胞scRNA-seq数据,建立了人类 B 细胞的综合图谱,它们的总丰度和亚型组成存在相当大的异质性。此外,笨研究还确定了应激反应记忆 B 细胞和TAAB,这是两个具有预后潜力的肿瘤富集亚群,以泛癌症方式共存。特别是,TAAB 具有高克隆扩增水平和增殖能力以及与肿瘤中活化的 CD4 T 细胞密切相互作用的特征,可预测免疫疗法反应。
+ + + + +



 English
English


