文献解读|Cell Metab(27.7):揭示与肥胖代谢健康相关的脂肪群体
✦ +
+
论文ID
原名:Unveiling adipose populations linked to metabolic health in obesity
译名:揭示与肥胖代谢健康相关的脂肪群体
期刊:Cell Metabolism
影响因子:27.7
发表时间:2024.12.17
DOI号:10.1016/j.cmet.2024.11.006
背 景
虽然肥胖患者的代谢表型存在很大差异,但精准医疗仍未视为肥胖治疗的标准治疗方法。影响代谢疾病风险变化的最重要因素之一是脂肪组织 (AT) 功能障碍;然而,人们对不同细胞群、细胞类型特异性转录程序和疾病严重程度之间的联系了解甚少。
实验设计
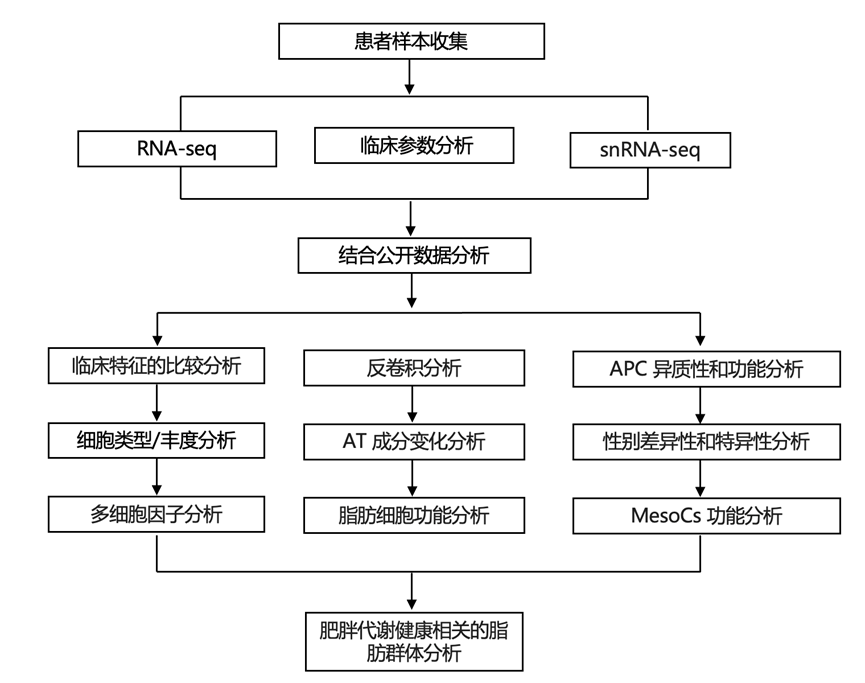
结 果
01
肥胖患者的 AT 在不同健康状态下以特定的方式进行了广泛的重塑
为了研究 AT 功能在代谢疾病中的作用,研究团队收集了 77 名患有代谢健康肥胖 (MHO)和代谢不健康肥胖 (MUO) 的男性和女性的临床参数以及白色皮下和内脏 AT 样本,并进行了转录组分析(RNA-seq)和单细胞核转录组分析snRNA-seq(图 1 A)。与 MUO 患者相比,MHO 患者的体重指数 (BMI)、体脂含量、体重和腰围相似(图1B-C),但其特点是胰岛素敏感性标志物(正常血糖-高胰岛素钳制稳定状态下的葡萄糖输注率(图 1 D)、空腹血糖和胰岛素、口服葡萄糖耐量)、脂质稳态(脂肪酸、高密度脂蛋白 [HDL] 胆固醇)和肝功能测试(ALAT 和 ASAT)明显更好。4 名MUO 患者的内脏 AT 面积显著增加(图 1 E),而皮下 AT 的数量保持不变(图 1 F)。
由于 AT 能够在生理和病理条件下灵活调整其细胞组成,他们假设转录差异可能由 AT 细胞谱的改变所掩盖。因此,他们对来自每个 MHO 和 MUO 个体的合并 AT 样本进行了 snRNA-seq,收集到内脏 AT 的 28931 个细胞核和皮下 AT 的 19186 个细胞核,并根据先前描述的标记11对 AT 中存在的所有广泛的典型细胞群进行了注释(图 1 G-K)。与 MHO 和 MUO 相比,内脏 AT 的细胞组成有显著不同,影响几乎所有细胞群的丰度(图 1 G-I),而皮下 AT 的细胞景观基本没有变化(图 1 J-L)。最显著的变化是,MHO 患者的内脏 AT 中间皮细胞 (MesoC) 的相对比例过高(图 1G-I)。此外,MHO 中的内脏脂肪细胞比例高于 MUO(图 1G-I),表明脂肪细胞增生持续存在。
为了进一步扩展观察范围并提高统计能力,他们使用通过 snRNA 测序确定的细胞类型特异性标记对整个队列的RNA-seq数据集进行了反卷积,再次证实了上述内脏 AT 群体的变化是保守的(图 1 M)。此外,通过对皮下 AT 的RNA-seq数据集进行反卷积,能够捕捉到比较 MHO 和 MUO 的几个细胞群相对丰度的显著变化(图 1 N)。最值得注意的是,与皮下 AT 中的 MUO 相比,MHO 中脂肪细胞和脂肪细胞祖细胞 (APC) 的估计相对丰度更高(图 1 N)。
与皮下 AT 的细微成分差异一致,将估计的脂肪群体相对数量与代谢标志物关联起来,表明内脏群体与代谢疾病密切相关,而皮下 AT 显示出较弱的关联。具体而言,在内脏 AT 中,MesoC 和脂肪细胞表现出与有利代谢特征的稳健正相关性。为了以无监督的方式探索单核数据集,他们进行了多细胞因子分析(MOFA-cell),仅将分析限制在 SNP 解复用个体中代表性较好的主要细胞类型,以捕捉主要的变异来源(图 1 O-P)。对于内脏 AT,结果显示所有因子评分都捕获到了 MHO 和 MUO 之间的明显条件分离,但最强烈的是潜在因子 1,这主要是由 MesoC 和 APC 中的转录差异驱动的(图 1 O)。与内脏 AT 相反,皮下 AT 的条件分离不太明显。他们仍然观察到 MHO 和 MUO 之间的条件分离,主要是由脂肪细胞中的转录差异驱动的(图 1 P)。
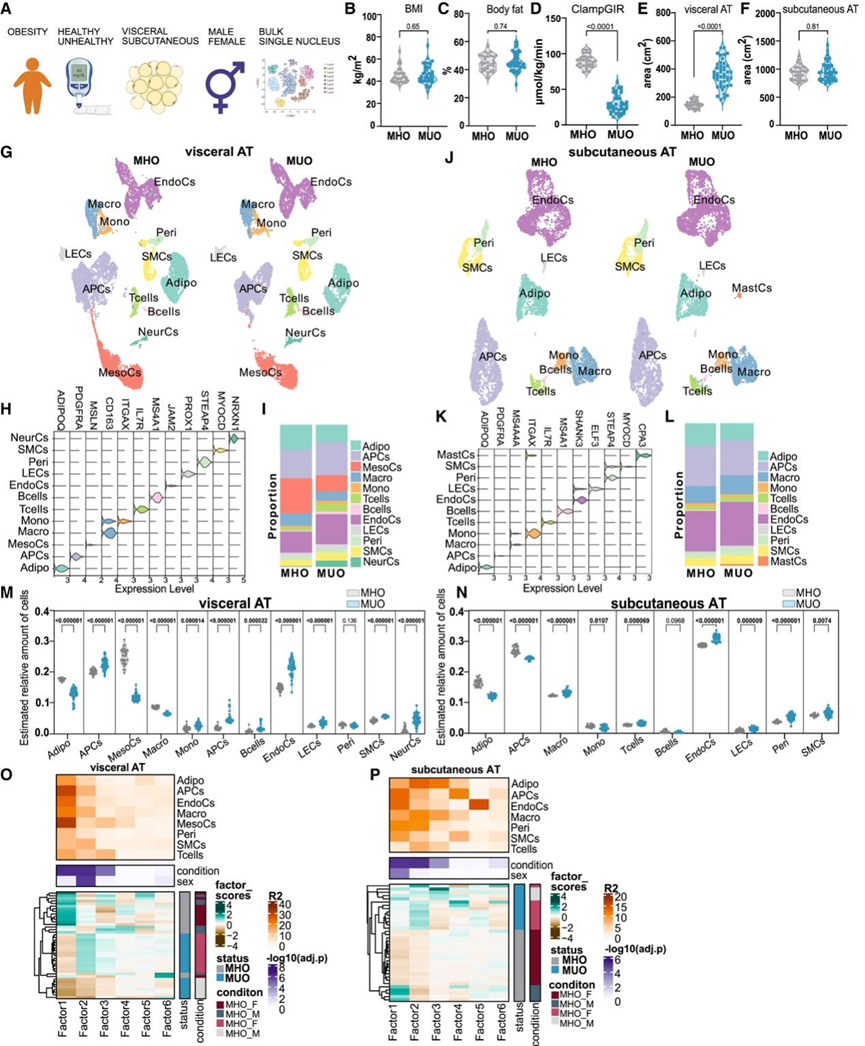
图1. 肥胖患者的脂肪组织在不同健康状态下以特定的方式进行广泛重塑。
(A) 队列设计和实验计划。(B-F) BMI、体脂、正常血糖、高胰岛素钳制葡萄糖输注率 (ClampGIR)、脏、以及MHO和 MUO个体之间的皮下 AT 面积分布。(G)UMAP可视化。(H) 小提琴图显示内脏 AT 细胞聚类的选定标记基因表达。(I) 条形图显示患有 MHO 和 MUO 的个体的内脏 AT 中的相对细胞类型比例。(J) 19186 个细胞核的 UMAP,代表 36 名具有 MHO 和 MUO 的个体的皮下 AT,按广泛细胞类型着色。(K) 小提琴图显示皮下 AT 细胞聚类的选定标记基因表达。(L) 条形图显示 MHO 和 MUO 患者皮下 AT 中的相对细胞类型比例。(M-N) 小提琴图显示了基于 snRNA-seq确定的标记基因。(O-P) 内脏 AT和皮下 AT的多细胞因子分析。
02
MUO 患者的 AT 成分变化主要与性别和肥胖无关
大量文献表明,肥胖进展后,患代谢疾病的易感性存在性别差异。同时,MOFA-cell 揭示了内脏 AT 中的潜在因子 2 (latent factor 2)清楚地区分了女性和男性的转录组(图 1 O)。该因子主要由 APC 和巨噬细胞驱动(图 1 O),并且性别的条件分离仅在 MUO 中明显,而在 MHO 中则并不明显(图 2 A-B)。在皮下 AT 中,性别在数据集中引入的变化甚至比代谢健康还要多(图 1 P)。因子 1 对 MHO 中性别相关的条件分离具有决定性作用,这是由 APC 和 EndoC 的转录差异驱动的(图 1 P),而脂肪细胞驱动的因子 3 有条件地将患有 MUO 的女性和男性分开。
在系统层面上,按性别对血浆参数进行分层后,发现疾病严重程度存在细微差异,女性总体上对胰岛素更敏感(图 2 C-E)。皮下 AT 体积保持不变(图 2 F),而 MUO 男性的内脏 AT 体积(图 2 G)和体重明显高于 MUO 女性。有趣的是,MUO 女性明显比 MHO 女性年龄大,这与绝经后女性不利的 AT 分布和代谢疾病发展相符。鉴于 MUO 个体的条件分离与性别有很强的相关性,他们对 MUO 的 snRNA-seq和反卷积RNA-seq数据集按性别进行了分层(图 2 H-M)。虽然在汇总的 snRNA 测序数据集中,疾病引起的内脏(图 2 H-I)和皮下 AT(图 2 J-K) 细胞组成改变发生了细微变化,但从反卷积的批量 RNA 测序数据集中得出的细胞类型估计比例并未显示出性别之间的统计学显著变化(图 2 L-M),这表明这些改变在较大的个体群体中并未保留。
接下来,他们旨在研究高肥胖本身(在没有增加代谢疾病参数的情况下)是否会诱导组织重塑。因此,他们对来自一组独立的非肥胖、代谢健康 (MHNO) 个体的每个 AT 库的汇总 AT 样本进行了 snRNA-seq,有趣的是,在比较 MHNO 与 MHO 的组成时,他们未能发现内脏(图 2 N-O)或皮下 AT(图 2 P-Q)中的主要细胞组成差异,这进一步证明健康的 AT 扩增与肥胖情况下全身营养稳态的维持密切相关。他们在两个库中发现的唯一差异是肥胖组的脂肪细胞数量比非肥胖组多。总之,MOFA 细胞分析揭示了患有 MUO 的女性和男性的不同细胞类型的转录差异,这可能解释了代谢疾病严重程度的性别二态性。然而,不健康的 AT 重塑引起的广泛成分变化主要与性别和肥胖无关。
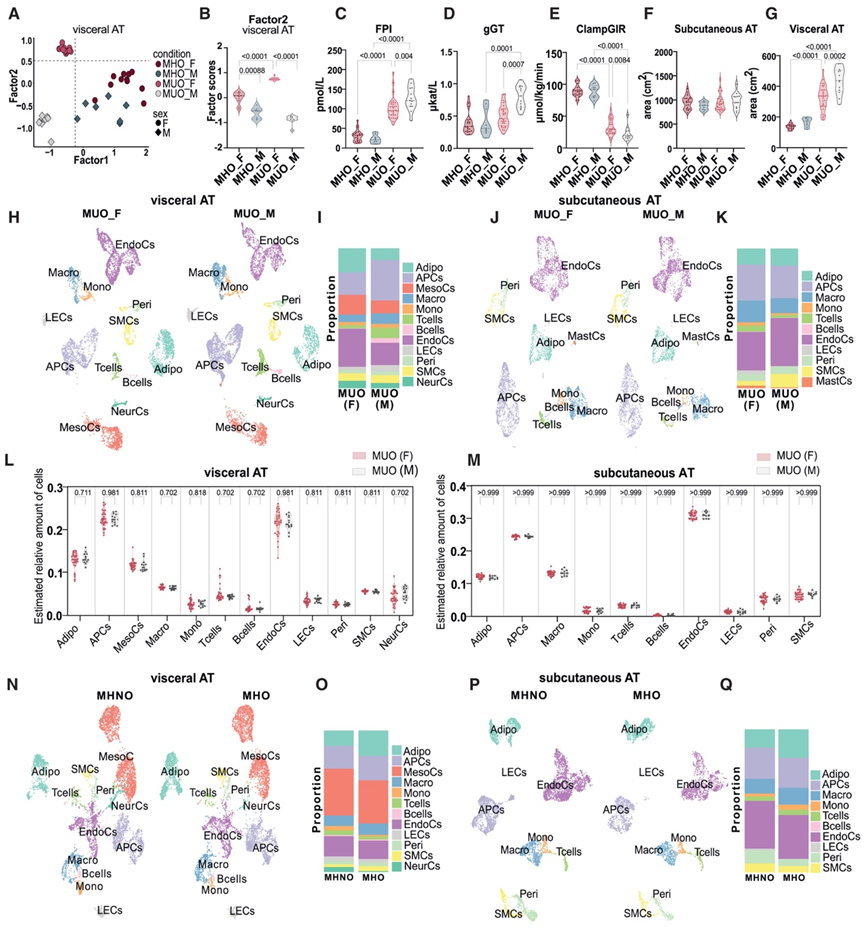
图2. MHUO 患者内脏 AT 的 AT 成分变化基本与性别和肥胖无关。
(A) 多细胞因子分析。(B) 小提琴图显示患有 MHO 和 MUO 的男性(_M)和女性(_F)个体的内脏 AT 潜在因子 2 评分分布。(C-G) 空腹血浆胰岛素 (FPI)、葡萄糖耐量 (gGT)、正常血糖、高胰岛素钳制葡萄糖输注率 (ClampGIR)、皮下和内脏 AT 面积分布。(H,J) UMAP 代表 MUO 患者的内脏 AT 和皮下 AT。(I,K) 条形图显示 MUO 患者的内脏 AT 和皮下 AT 中相对细胞类型比例。(L-M) 小提琴图显示了根据 MUO 患者的内脏 AT和皮下 AT的相对细胞类型比例。(N-P)UMAP可视化。(O-Q) 条形图显示 MHNO 和 MHO 在内脏 AT 和皮下 AT 中的相对细胞类型比例。
03
脂肪细胞功能与代谢健康密切相关
脂肪细胞是对营养信号做出最先反应的细胞之一,脂肪细胞的代谢灵活性对 AT 功能至关重要。此外,最近的研究已经开始剖析单个脂肪库内的脂肪细胞异质性,这表明它们可以分为几个不同的亚群。
与之前的数据一致,他们发现代谢不健康组的最大和平均脂肪细胞尺寸明显更大(图 3 A)。此外,他们还发现脂肪细胞具有明显的细胞异质性,这可以通过将内脏脂肪细胞聚集成五个群体(vAdipo1-5)来证明(图 3 B-C)。通过对五个亚群与之前定义的脂肪细胞亚群的基因特征进行详细比较,他们发现 Adipo1(瘦素 [LEP])、Adipo2(周脂素 [PLIN])和 Adipo3(血清淀粉样蛋白 A1 [SAA1])(图 3 B)对应于 Bäckdahl 等人13确定的三种白色脂肪细胞亚型。这些亚群表现出炎症(Adipo1 [LEP])、脂质代谢(Adipo2 [PLIN])和脂肪生成(Adipo3 [SAA1])途径的富集。两个脂肪细胞亚群是内脏脂肪库所特有的,即 vAdipo4(成纤维细胞生长因子 14 [FGF14])和 vAdipo5(fms 样酪氨酸蛋白酶 1 [FLT1])(图 3 B-C),其特征分别在于涉及粘着斑和血管生成相关途径上调。出乎意料的是,全身健康状况并不影响任何内脏脂肪细胞亚群的流行率(图 3 D)。
为了检查脂肪细胞对代谢健康状况的反应的一致性,他们使用 SNP 解复用的个体进行了伪批量分析,并在二维 PCA 空间中可视化了内脏脂肪细胞。与RNA-seq数据中缺乏条件分离相反,snRNA-seq 数据显示健康和患病条件下的内脏脂肪细胞之间存在明显分离(图 3E)。与许多报告脂肪细胞肥大会导致代谢不灵活的研究一致,在比较代谢不健康和健康的内脏脂肪细胞时,编码代谢途径的转录本丰度下降(图 3F),而参与缺氧相关途径的基因显著富集(图 3G)。
接下来,他们将分析重点放在皮下 AT 库中的脂肪细胞上。皮下脂肪细胞的重新聚类导致鉴定出两个库特异性群体,sAdipo4(早期生长反应 1 [EGR1])和 sAdipo5(神经元相关细胞粘附分子 [NRCAM]),而 Adipo1-3 在内脏和皮下 AT 中是保守的(图 3 H-I)。有趣的是,与 MHO 相比,MUO 皮下 AT 中 sAdipo5(NRCAM)的相对比例明显且持续较高(图 3 J-K)。皮下特异性脂肪细胞亚群的特点是参与炎症相关途径(sAdipo4 [EGR1])和生长相关途径(例如丝裂原活化蛋白激酶 (MAPK) 信号传导(sAdipo5 [NRCAM],的基因富集(图 3 L)。通过将 Emont 等人的脂肪细胞数据集与皮下脂肪细胞亚聚类进行比较,大多数脂肪细胞亚群(经预测)为 hAd1,代表皮下特异性基底脂肪细胞。更详细的分析显示,sAdipo4 (EGR1) 与 hAd1 的基因特征有相似之处,而 sAdipo5 (NRCAM) 和 sAdipo3 (SAA1) 表现出与 hAd4 一样的参与不饱和脂肪酸合成的途径的富集。与内脏脂肪细胞中疾病依赖性的转录改变一致,来自 snRNA-seq 数据集的皮下脂肪细胞转录组在 MHO 和 MUO 之间明显可分离(图 3M)。有趣的是,他们发现 MUO 皮下脂肪细胞中映射到胰岛素信号通路的基因转录本丰度增加(图 3N)。
这些数据证实了存在不同的脂肪细胞状态/亚群,只有一个皮下脂肪细胞亚群在疾病状态下富集。此外,内脏脂肪细胞亚群始终从代谢活跃表型转变为缺氧表型。
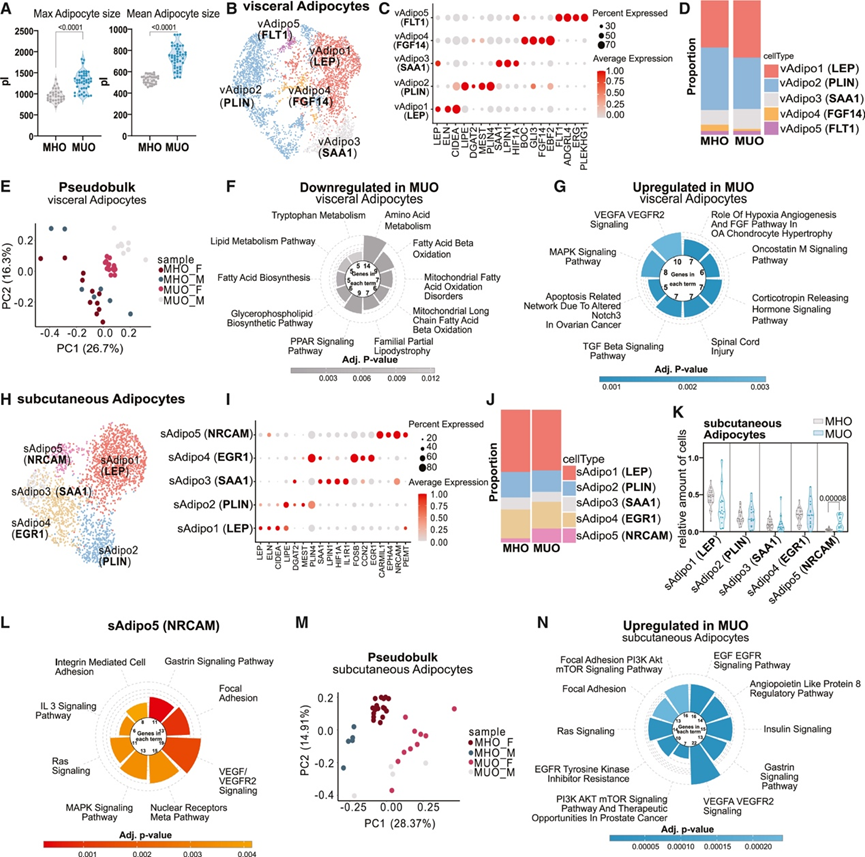
图3. 脂肪细胞功能与代谢健康密切相关。
(A) MHO 和 MUO 患者的最大和平均内脏脂肪细胞尺寸分布。(B) 4375 个细胞核的 UMAP,代表患有 MHO 和 MUO 的个体的内脏脂肪细胞。(C) 点图显示用于注释内脏脂肪细胞亚群的标记基因的表达。(D) 条形图显示 MHO 和 MUO 中内脏脂肪细胞亚群的相对比例。(E) 来自 SNP 解复用个体的PCA 显示 MHO 和 MUO 之间的内脏脂肪细胞聚类形成,按性别划分。(F-G) 在 MUO 与 MHO 患者的内脏脂肪细胞中,最显著下调和上调的通路。(H) 2614 个细胞核的 UMAP 代表患有 MHO 和 MUO 的个体的皮下脂肪细胞。(I) 点图显示用于注释皮下脂肪细胞亚群的标记基因的表达。(J) 条形图显示 MHO 和 MUO 中皮下脂肪细胞亚群的相对比例。(K) 小提琴图显示患有 MHO 和 MUO 的相对皮下脂肪细胞亚型比例。(L)通路分析。(M-N) PCA 显示 MHO 和 MUO 之间的皮下脂肪细胞聚类形成。
04
女性特异性、高分泌性抗脂肪生成祖细胞
MUO 个体的脂肪细胞肥大和 AT 重塑是由各自环境中不同细胞群的相互作用促进的。其中,APC是肥胖进展时新脂肪细胞的来源,它们可以在疾病条件下控制 AT 的促炎表型。
为了分析 MHO 和 MUO 下的 APC 异质性和功能,他们重新聚类了 APC,从而将它们分为五种不同的内脏(图 4 A-B)和四种皮下群体,它们均表达血小板衍生的生长因子受体 α (PDGFRA) 和层粘连蛋白亚基 α 2 (LAMA2)。根据已发表的标志物,将它们定义为纤维脂肪形成祖细胞 (FAP)、抗脂肪形成祖细胞 (AAP) 和两种不同的定向前脂肪细胞群体(CPAs1 和 CPAs2)。在内脏 AT 中,AAP 进一步聚类为两个亚群,AAPs1(EPHA3 + ZNF804B −)和 AAPs2(EPHA3 + ZNF804B +)图 4 A-B)。各组间皮下 APC 亚群的丰度没有变化,而许多内脏 APC 亚群表现出对代谢健康状况、性别或两者的依赖性(图 4 C-D)。具体来说,MUO 内脏 AT 中 CPAs1(含黄素单加氧酶 2 [FMO2])降低(图 4 C-D)。相反,男性 MUO 患者 CPAs2(细胞间粘附分子 1 [ICAM1])的相对丰度增加,但在女性中没有增加,这与 FAP 的丰度呈负相关(图 4 C-D)。两种 CPA 均高度表达脂肪形成基因,如过氧化物酶体增殖激活受体γ(PPARG)(图 4E),这与它们沿着脂肪形成轨迹的高级承诺一致,而 FAP 表达干细胞标志物二肽基肽酶 4(DPP4)(图 4E)。最显著的变化反映在 MUO 中定义为 AAPs2 的内脏特异性亚群的增加(图4C-D),其特征是锌指蛋白 804B(ZNF804B)的表达(图 4E)。他们在患有 MUO 的女性内脏 AT 的冠状结构内检测到了 ZNF804B 阳性细胞(图 4F)。有趣的是,AAPs2(ZNF804B)的相对丰度的增加强烈地依赖于性别,因为无法在任何肥胖男性中检测到这种祖细胞群(图 4C-D)。此外,ZNF804B 是 MUO 女性和男性内脏 APC 表达显著差异的基因之一,并且是 MOFA 细胞内脏 AT 因子 2 中区分 MUO 性别的最强标记之一。AAPs2 (ZNF804B) 的转录特征分析表明,它们选择性表达几种细胞因子(图 4 G)。配体-受体相互作用分析证实 AAPs2 具有很高的分泌能力并与其他 APC 亚群和免疫细胞相互作用(图 4 H)。这些相互作用在 MUO 的内脏 AT 中显著富集(图 4 H-I),这主要通过影响免疫细胞募集或细胞外基质组成的通路增加来介导(如 PTPRC、THBS1 和 LAMA3)信号传导。
他们接下来研究了 AAPs2 是否能以性别特异性的方式抑制脂肪生成。APC 的转录特征明显区分了患有 MUO 的男性和女性(图 4 J),与患有 MUO 的男性相比,患有 MUO 的女性的 APC 中的脂肪生成途径(如 PPARG 信号传导)整体下调(图 4 K)。此外,AAPs2 与免疫细胞的预测相互作用以及它们对编码细胞因子的基因的高表达促使他们研究该群体的丰度是否与内脏 AT 中的免疫细胞数量相关。重新聚类内脏免疫细胞群(图 4 L)显示,与 MHO 相比,MUO 内脏 AT 中的 T 调节细胞 (Tregs)、B 细胞和树突状细胞 (DCs) 的相对丰度更高(图 4 L-M)。有趣的是,这种适应性免疫细胞的富集仅存在于 MUO 女性中,而不存在于男性中(图 4 M),这与 AAPs2 (ZNF804B) 的存在相对应。此外,与 MUO 女性相比,MUO 男性的 PVM 和 LAM 过多,这与免疫组织化学验证的巨噬细胞数量总体增加相一致。与内脏 AT 相比,皮下 AT 中的免疫细胞亚型不会因代谢健康或性别而发生变化
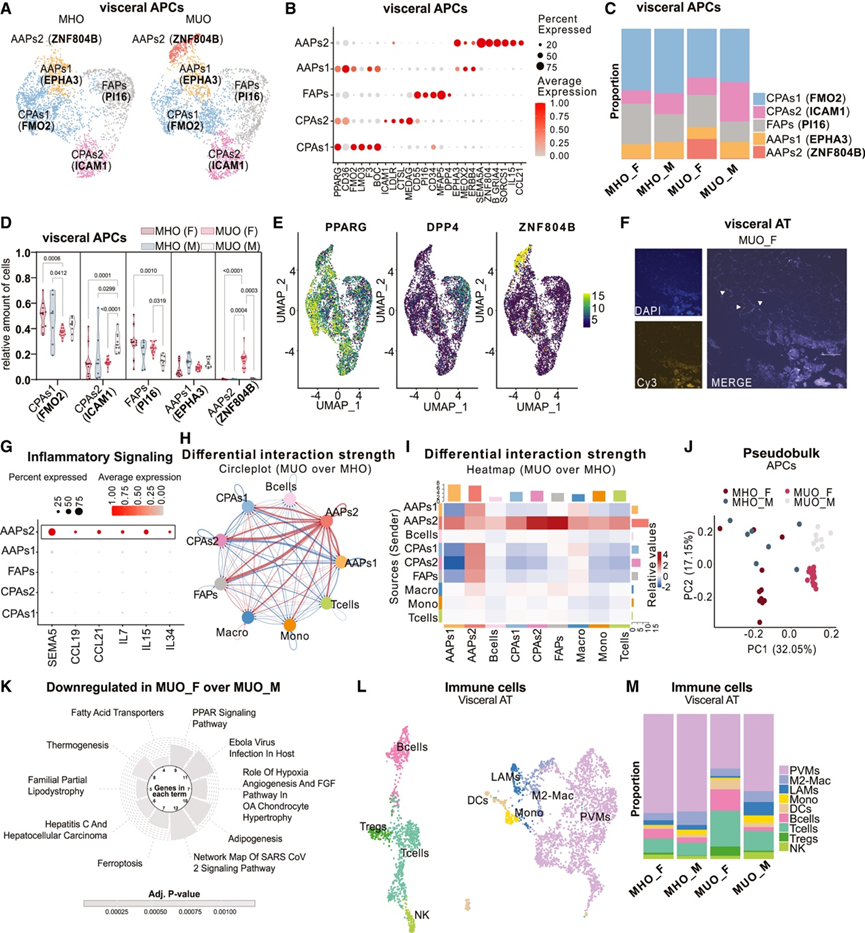
图4. snRNA-seq揭示了女性特异性、高分泌性抗脂肪生成祖细胞群,它们可能募集适应性免疫细胞至内脏 AT。
(A) 6233 个细胞核的 UMAP 代表按 MHO 和 MUO 分裂的个体内脏 APC。(B) 点图显示用于注释内脏 APC 亚群的标记基因的表达。(C) 条形图显示 MHO 和 MUO 中内脏 APC 的相对比例。(D) 小提琴图显示 SNP 分离个体中 MHO 和 MUO 的相对内脏 APC 亚型比例。(E) 特征图显示内脏 APC 中PPARG、DPP4和ZNF804B的表达。(F) 基于 RNA-scope 的染色显示MUO 女性内脏 AT 中 ZNF804B 探针的原位杂交。(G) 点图显示内脏 APC 中的细胞因子表达。(H-I) 圆形图和热图显示指示亚群的细胞间相互作用的预测差异强度。(J) PCA 显示 MHO 和 MUO 之间内脏 APC 的聚类形成。(K) 与男性相比,MUO 女性内脏 APC 中显著下调的通路。(L) 3710 个细胞核的 UMAP 代表按 MHO 和 MUO 着色的个体内脏免疫细胞。(M) 条形图显示 MHO 和 MUO 中内脏免疫细胞亚群的相对比例。
05
MesoC 从上皮状态向间质状态的转变与代谢健康密切相关
到目前为止, MesoC 一直可视为惰性细胞群,在内脏区形成一层保护层,包围着 AT。然而,最近的研究揭示了 MesoC的细胞异质性,并指出 MesoC 可能会转变为间充质状态。同时,他们注意到广泛聚类的 MesoC 分为两个不同的种群,其中一个种群以BCHE的表达为特征(图 5 A),而两个种群都表达 MesoC 标记KRT19(图 5 B)。BCHE 阳性间皮亚群显示出双重基因表达特征,这表现为参与间充质程序的基因表达增加(例如CDON和BCHE);因此,将它们定义为间充质 MesoC (meMesoCs)。有趣的是,通过对批量数据集进行反卷积,与经典 MesoC (cMesoCs) 相比,meMesoCs 在 MHO 中的富集程度明显高于 MUO(图5 C)。同时,对这两个广泛种群中的 MesoCs 进行分层后发现,meMesoC 与代谢健康的几个系统参数表现出更强的正相关性。接下来,他们利用 RNA-scope 进行原位杂交,分析了这些细胞的解剖位置。其中,BCHE 阳性细胞主要位于 AT 小叶的边界,但也可以部分散布在 AT 周围的脂肪细胞中(图 5D)。
cMesoCs 和 meMesoCs 的重新聚类揭示了六个不同的亚群,与 MHO 和 MUO 相比,它们的丰度变化灵活(图 5E-F)。除 MesoCs6 外,所有 MesoCs 亚群均表达间皮标志物KRT19、TM4SF1和EZR,但程度不同。此外,参考图谱显示 MesoCs 亚群与之前确定的 MesoCs 亚群一致,例如 Emont 等人数据集中的 hMes1 和 hMes2。有趣的是,MesoCs6(纤连蛋白 1 [FN1])几乎没有间皮标志物,但显示 APC 标记基因PDGFRA和FN1的富集(图 5 F),与上皮-间质转化(EMT)过程中干细胞标志物的逐渐增加一致。根据标记基因的表达,MesoCs1(角蛋白 19 [KRT19])、MesoCs3(分化簇 55 [CD55])和 MesoCs4(过氧化物酶体增殖激活受体γ [PPARG])代表 cMesoC(图 S7 I),而 MesoCs2(丁酰胆碱酯酶 [BCHE])和 MesoCs5(intelectin 1 [ITLN1])对应于 meMesoC。
此外,他们注意到只有特定的间皮亚型与代谢健康呈正相关(图 5G-H)。在 MUO 中,MesoCs4 (PPARG) 的比例明显较高,而 MesoCs6 (FN1) 的比例趋于较高(图5G-H)。相反,在 MHO 中,MesoCs2 (BCHE) 和 MesoCs5 (ITLN1) 的相对比例增加(图 5G),在对数据集进行解复用后,MesoCs5 (ITLN1) 的比例达到显著性(图 5H)。此外,MesoCs2(BCHE)和MesoCs5(ITLN1)的许多标记基因,例如BCHE、CDON、DPP4、WT1和ITLN1,在MHO的MesoCs中上调,并且也由内脏AT因子1中的MOFA细胞捕获,从而驱动条件分离。鉴于编码Omentin1的ITLN1代表一种脂肪因子,他们旨在研究MesoCs5(ITLN1)丰度的健康依赖性变化是否会产生全身影响。ITLN1仅由内脏AT内的MesoCs表达(图5I),而不存在于皮下AT中,重现了先前描述的ITLN1的库特异性表达模式。此外,MHO 患者的血浆 Omentin1 水平明显高于 MUO 患者(图 5J),表明其有望成为内脏 AT 功能的标志物。
接下来,他们研究了RNA-seq数据集中间皮亚群的标志物基因表达,发现 MesoCs1(KRT19)、MesoCs2(BCHE)和 MesoCs5(ITLN1)标志物的表达与代谢健康的临床参数呈正相关(图 5 K)。但对于 MesoCs3(CD55)、MesoCs4(PPARG)和 MesoCs6(FN1)标志物基因,这种关联并不明显。为了进一步研究 MesoCs 亚群和代谢后遗症的依赖性,他们利用了减肥手术时和术后 2 年体重指数至少下降 25% 的个体内脏 AT 的独立数据集。对该队列的大量 RNA 测序数据的分析表明,几个 MesoCs1(KRT19)、MesoCs2(BCHE)和 MesoCs5(ITLN1)标记物在减肥手术后体重减轻显著增加,而其他 MesoCs 亚型的标记物保持不变。
此外,在比较 MHO 和 MUO 的拟体分析中,MesoCs 显示出条件分离(图 5 L),证实它们会根据健康状态发生重大转录变化。MUO 内脏 AT 中 MesoCs 的上调基因富含炎症途径(图 5 M),而健康条件下 MesoCs 中的 Hedgehog 信号通路和 PDGFR 信号增加(图 5 N)。这些数据表明,在疾病条件下,MesoCs 可能会从间充质表型转变为炎症表型,为 MesoCs 在内脏 AT 重塑中的重要作用提供了额外的证据。
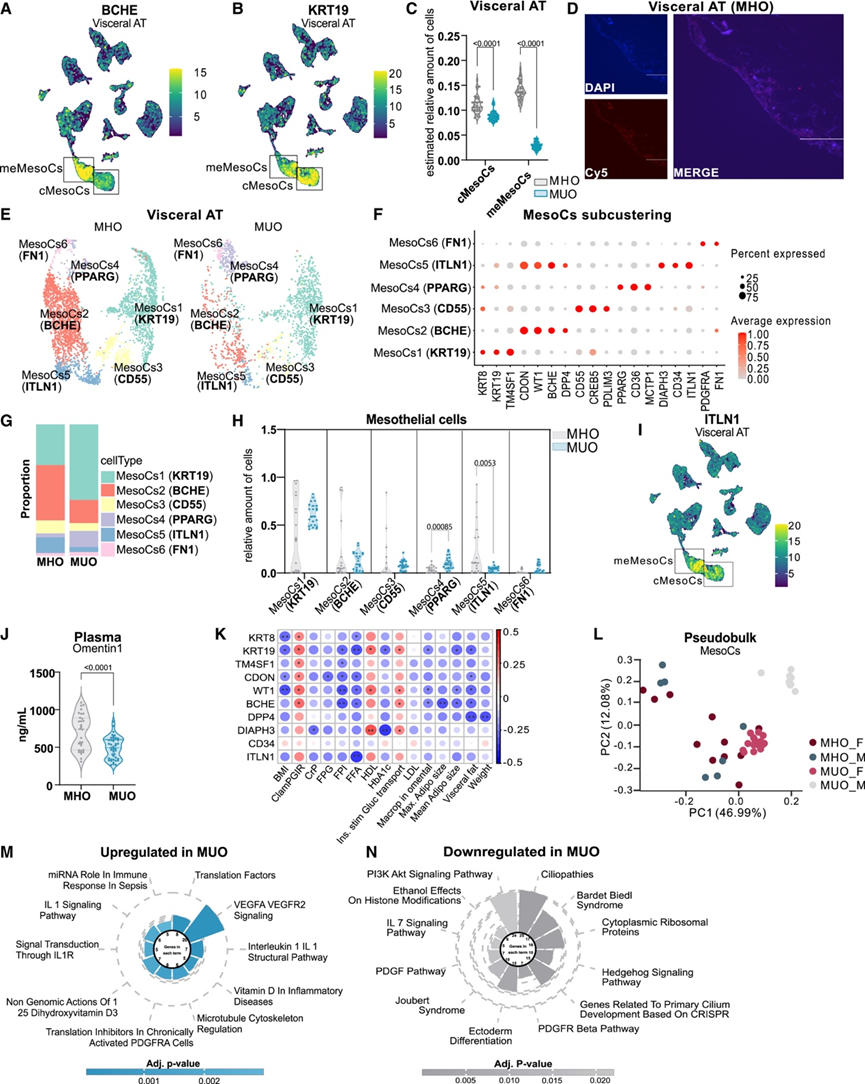
图5. 间皮细胞沿上皮向间质状态的转变与代谢健康密切相关。
(A-B) 特征图显示内脏 AT 中BC H E和KRT19的表达。(C) 经典间皮细胞 (cMesoCs) 和间充质间皮细胞 (meMesoCs) 的相对比例。(D) RNA-scope 染色显示患有 MHO 的女性内脏 AT 中存在 BCHE 阳性细胞。(E)UMAP可视化。(F) 点图显示用于注释内脏 AT 中间皮亚群的标记基因的表达。(G) 条形图显示 MHO 和 MUO 中内脏 MesoCs 亚群的相对比例。(H) 小提琴图显示内脏 AT 中具有 MHO 和 MUO 的相对 MesoCs 亚型比例。(I) 特征图显示内脏 AT 中ITLN1的表达。(J) MHO和 MUO患者血浆 Ometin1 水平分布。(K) Spearman 相关图显示RNA-seq 数据和所示临床参数中 MesoCs1、MesoCs2 和 MesoCs5 标记基因表达呈正相关和负相关。(L) PCA 显示 MHO 和 MUO 之间内脏 MesoC 的聚类形成。(M-N) 在 MUO 与 MHO 患者的内脏 MesoCs 中,最显著的上调和下调的通路。
+ + + + + + + + + + +
结 论
本研究生成了代谢健康和不健康肥胖患者的皮下和内脏 AT 的综合细胞图谱。通过将snRNA-seq数据与RNA-seq数据和临床参数相结合,本研究发现间皮细胞、脂肪细胞和脂肪细胞祖细胞与代谢疾病的相关性最强。此外,本研究发现了细胞特异性转录程序,例如间皮细胞向间充质表型的转变,这些程序参与了肥胖与代谢疾病的分离。
+ + + + +



 English
English


