文献解读|Nat Genet(31.7):非干细胞谱系作为炎症背景下肠道肿瘤发生的另一种起源
✦ +
+
论文ID
原名:Non-stem cell lineages as an alternative origin of intestinal tumorigenesis in the context of inflammation
译名:非干细胞谱系作为炎症背景下肠道肿瘤发生的另一种起源
期刊:Nature Genetics
影响因子:31.7
发表时间:2024.06.20
DOI号:10.1038/s41588-024-01801-y
背 景
绝大多数癌症起源于干细胞样或祖细胞样细胞,这些细胞满足主动增殖、自我更新和分化能力的需求。小鼠肠道的Apc肿瘤抑制基因功能丧失突变仅当发生在Lgr5+肠干细胞 (ISC)中时才能成功启动腺瘤形成。以人类结肠癌为例,西方饮食习惯和慢性炎症是增加消化道散发性恶性疾病风险的两个主要病因,它们会诱发肠上皮细胞的特定细胞和分子改变,最终导致肿瘤发生和发展的细胞靶标扩大。然而,哪些特定细胞谱系能够在组织损伤后去分化,哪些是潜在机制,在很大程度上仍不清楚。
实验设计
结 果
01
炎症背景下 PC 是肠道肿瘤的起源
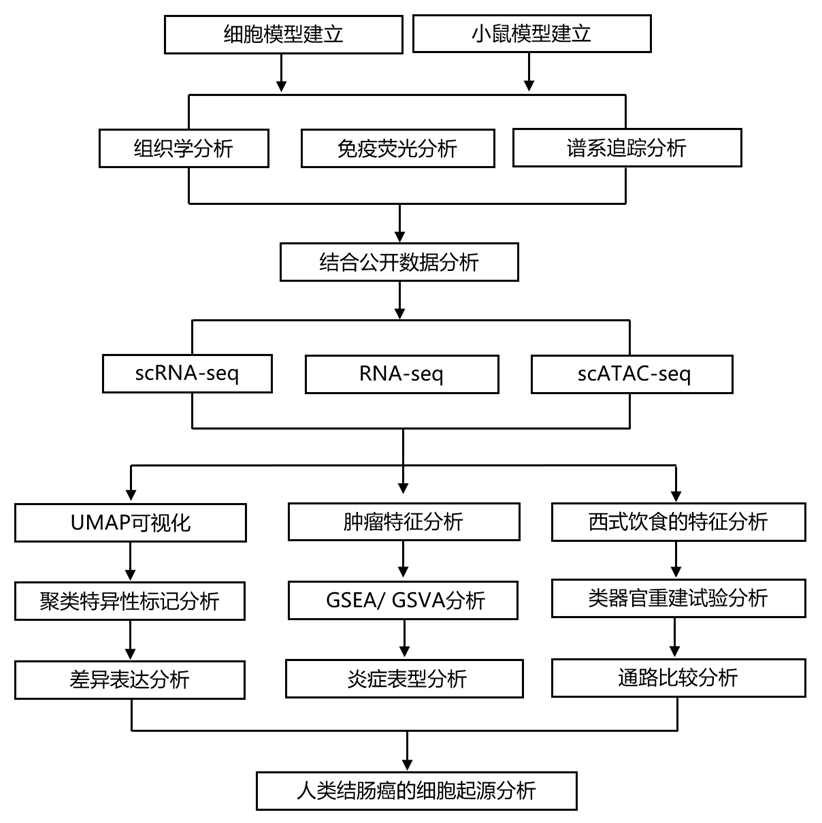
研究团队首次报道了潘氏细胞 (PC)(小肠利伯克氏隐窝最底部的特殊分泌细胞)在受到辐射和炎症时能够重新进入细胞周期并去分化,从而获得类似干细胞的特征并有助于组织再生反应。因此,他们提出假设:PC 可能是炎症背景下肠癌的起源。他们饲养了具有lox 等位基因的小鼠,这些等位基因是腺瘤到癌的序列中突变最频繁的肿瘤抑制基因和致癌基因,即Apc、Kras和Trp53(编码 p53),每种基因与对Lgr5+ ISC(Lgr5 CreERT2-EGFP)或 PC(Lyz1 CreERT2)特异的 Cre 结合。用他莫昔芬激活 Cre 后,通过饮用水给予葡聚糖硫酸钠 (DSS) 以模拟炎症(图1a)。在没有DSS诱导的炎症的情况下,PC特异性单基因突变不会导致肠道肿瘤。相反,Lgr5 + ISC中Apc的缺失将隐窝转化为β-cateninhigh灶,并在Cre诱导4-6周后长成多个腺瘤(图1b)。当单基因突变与DSS给药相结合时,PC中Apc的缺失导致核和细胞质β-catenin表达增加,最终导致PC衍生的腺瘤形成(图1c)。值得注意的是,即使在存在炎症刺激的情况下,PC特异性Kras或Trp53突变也不会导致肿瘤形成(图1d)。然而,即使在没有DSS的情况下,PC中Apc的复合缺失和Kras的致癌激活也导致肿瘤多发性显著增加(6.1倍)(图1e)。 PC 中的Apc和Trp53突变组合也导致 DSS 给药后肿瘤多发性增加(1.6 倍),虽然与复合Apc / Kras突变基因型相比程度较小,这可能表明这些小鼠的肿瘤发病机制不同。磷酸组蛋白 H2A.X (Ser139) 免疫组织化学 (IHC) 分析证实Trp53突变肿瘤中的 DNA 损伤和染色体不稳定性增加。在没有炎症刺激的情况下,靶向 PC 中的所有三个基因会导致非常侵袭性的表型和高肿瘤多发性(10.1 倍)(图1e)。与源自 PC 的Apc驱动的肿瘤相比,靶向两个或三个基因的小鼠的腺瘤组织学显示发育不良和侵袭性形态逐渐增加。
为了验证观察到的肠道肿瘤的 PC 起源,他们建立了带有 R26 LSL-tdTomato或 R26 LSL-YFP报告基因的Lyz1 CreERT2小鼠模型,并追踪了它们在他莫昔芬驱动的Apc、Kras和Trp53突变靶向作用下的谱系(图1f)。总体而言,在炎症背景下,Apc基因消融后,PC 可以引发肠腺瘤。与Apc缺失相结合,致癌Kras的激活或Trp53功能的丧失可缓解对炎症刺激的需求,并导致 PC 衍生肿瘤的多样性增加并进展为恶性表型。
接下来,他们使用 IHC 鉴定了 PC 和 ISC 来源肿瘤中的谱系特异性标志物。值得注意的是,虽然表达 PC 标志物溶菌酶 (LYZ1) 的细胞在Lgr5来源的肿瘤中很明显,但它们在源自 PC 的腺瘤中几乎不存在(图1g-h)。DCLK1(双皮质素样激酶1)是一种Tuft19和肿瘤干细胞标志物,与Lgr5源性肿瘤(Lgr5/Apc)相比,其在PC来源的腺瘤(Lyz1/Apc)中检测到DCLK1(双皮质素样激酶1)的频率更高(图1i-j)。为了在转录水平上证实这些结果,他们通过定量 PCR 和逆转录分析了Lyz1和Dclk1基因的表达水平(图1k)。与Lgr5衍生的肿瘤相比,PC来源的肿瘤中Lyz1 的表达较低。
为了评估不同肿瘤组之间 WNT 信号通路的相对激活程度,他们检测了Axin2的表达水平,Axin2 是公认的 WNT 下游靶点。与 PC 衍生肿瘤相比,Lgr5衍生肿瘤中的Axin2表达更高(图1k)。此外,Kras致癌激活和炎症均逐渐增加PC 衍生肿瘤中的Axin2水平,这与之前报道的Apc和Kras突变在激活 WNT 通路方面的协同作用一致。在肿瘤发生时,PC 会去分化到阻碍分泌分化的状态,从而导致与Lgr5衍生肿瘤不同的特定肿瘤组织学和基因表达模式。
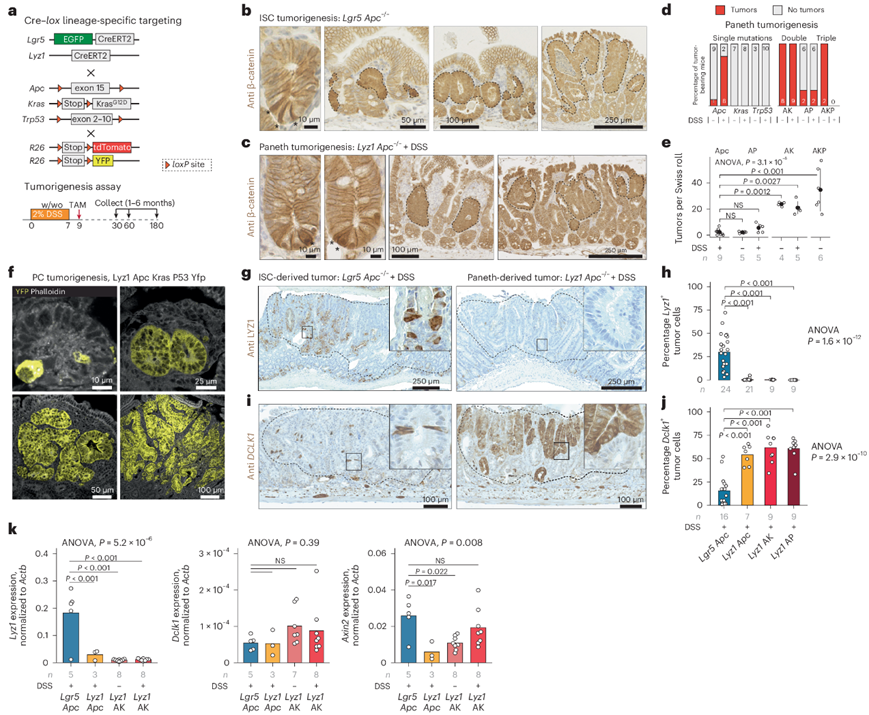
图1. 在炎症和 Apc 缺失的背景下 PC 作为肠道肿瘤的细胞来源。
(a) Cre-lox策略旨在靶向ISC(Lgr5+ ISC)和PC(Lyz1+ PC)中的Apc、Kras和Trp53突变。(b-c) IHC 分析。(d- e) 根据荷瘤小鼠和每种基因型的肿瘤数量计算肿瘤多发性。 (f) 在肿瘤起始和进展的不同阶段,使用黄色荧光蛋白 (YFP) 标记的 PC 的谱系追踪分析。(g-j) IHC 分析和肿瘤细胞数量的定量。 (k) 不同腺瘤基因型的Lyz1、Dclk1和Axin2定量 PCR 表达分析。
02
在增强的 WNT 信号激活下,PC 去分化为复苏干细胞
为了阐明在炎症和/或特定基因命中的背景下 PC 转化为小肠肿瘤细胞来源的机制,他们将单细胞转录组分析(scRNA-seq)技术与谱系追踪技术相结合,在存在或不存在 DSS 的情况下在 R26 LSL-tdTomato / Lyz1 CreERT2(或 R26 LSL-YFP )报告菌株中诱导Apc、Kras和Trp53基因突变(图2a)。随后,从肠上皮收获细胞,通过 FACS 纯化并通过 scRNA-seq 进行分析。预处理后,从 32 只小鼠身上获得了23231 个上皮细胞的转录组数据,分布在肠上皮的不同谱系中(图2b)。仔细检查报告基因阳性的细胞,发现在 DSS 施用和特定基因突变后出现了新的 PC聚类(PC聚类1-4),但在稳态条件下的 PC 中未观察到(图2c)。
为了表征新的 PC 衍生状态,他们进行了差异表达分析并确定了聚类特异性标记(图2d)。PC聚类1 在不同基因型中出现的频率较低,而 PC聚类2 则在暴露于炎症刺激后直接出现。PC聚类1 和聚类2 均以两种放射抗性和分泌性祖细胞标志物的表达增加为特征,这两种标志物在再生过程中具有自我更新能力,即Krt19和Atoh1。与聚类 1 相比,在聚类 2 中Reg3b和Cdkn1a(编码 p21)的表达增加。
PC聚类3 在单独携带Apc突变(追踪细胞的 7.23% ± 5.77%)和与 DSS 治疗相结合(追踪细胞的 16.40% ± 2.10%)的小鼠中以及在双重和三重突变(AP、AK 和 AKP)小鼠中变得明显,但在携带单个Kras或Trp53突变的小鼠中没有出现。PC聚类3 显示Gif(胃内因子)、Cd81 (四跨膜蛋白家族成员,已知可标记对伽马射线的反应并与 ISC 和增殖基因28的表达相关)和Prom1(也称为CD133,一种已证实的结肠癌干细胞标记物)的表达。
PC聚类4 由来自小鼠的细胞组成,其中双重 (AK) 和三重 (AKP) 突变针对 PC。Anxa2(编码膜联蛋白 2)是炎症反应的功能性标记物,而Clu(簇蛋白)的表达增加,此前已证明在伽马射线照射后可标记复苏干细胞 (RSC) ,在 PC聚类4 中存在。因此,对 RSC 特征的评估显示 PC 聚类中的表达增加(图2e),并且在携带复合突变(AK 和 AKP)的小鼠的 PC 衍生肿瘤中进行原位杂交分析证实了Clu表达增加(图2f)。最后,通路分析揭示了 PC聚类 4 与 RSC 之间的相似性,两者都以 Yap1 信号和特定炎症通路的激活为标志(图2g)。与 RSC 相比,聚类4 中的 PC 衍生细胞和Apc/Kras突变细胞显示出 TGFβ 和 WNT 信号水平的增加。
总的来说,这些结果表明,PC 在基因靶向或炎症刺激下有效地去分化,从而产生不同的细胞身份。在由Apc/Kras驱动的肿瘤发生过程中,PC 与 YAP1 依赖的 RSC 身份具有共同的特征,并进一步激活 TGFβ 和 WNT 信号,从而转化为真正的肿瘤细胞。
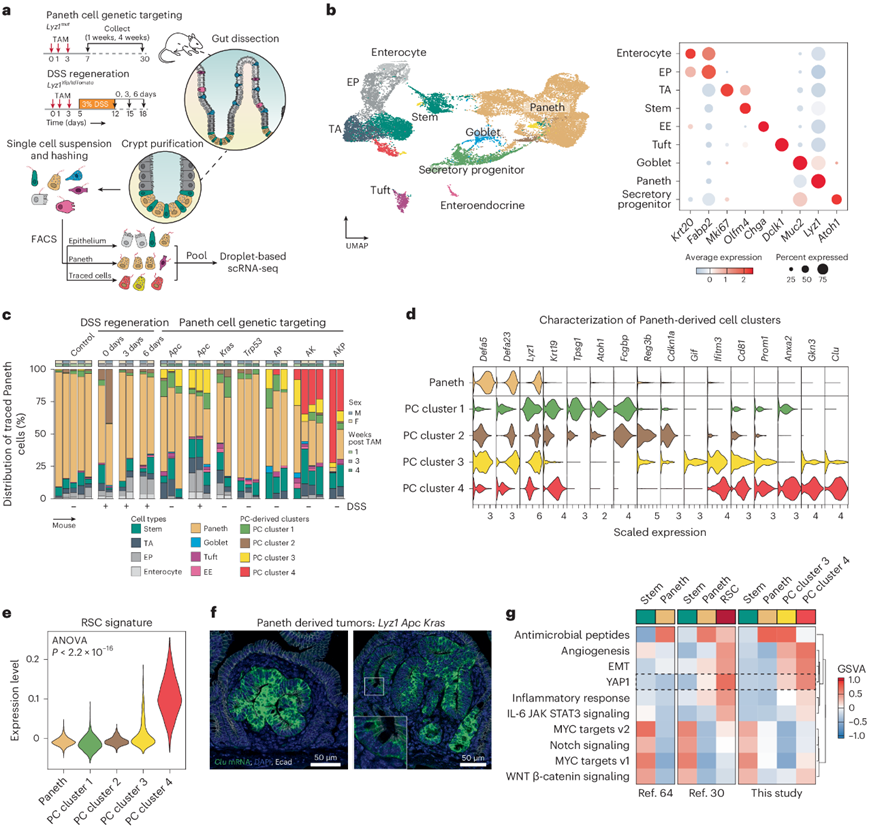
图2. PC 可能去分化为复兴干细胞身份。
(a) 实验方法示意图。(b) 不同细胞聚类或谱系的 UMAP 可视化,根据典型标记基因的表达进行注释。(c) 不同小鼠基因型和实验条件下追踪细胞分布的条形图。(d) 小提琴图代表新发现的Paneth衍生细胞聚类(PC聚类 1-4)的标记基因。(e) RSC 特征与 PC聚类1-4 的关联分析。(f) RNA 原位杂交。(g) 基因集变异分析。
03
PC和Lgr5衍生肿瘤的转录组学比较揭示了干细胞表型特征
为了研究细胞来源身份对由此产生的肠道肿瘤转录谱的影响,他们对源自ISC和PC的宏观解剖病变进行了bulk 转录组分析(RNA-seq)(图3a)。主成分分析(PCA)显示,主要变异成分(61%)归因于细胞来源的差异,而基因型或炎症刺激的影响在第二个变异成分(10%)中变得明显(图3b)。在相同遗传和炎症背景下源自PC和ISC的肿瘤(Apc和DSS)之间的差异表达分析揭示了每个细胞来源特有的肿瘤特征。
基因集富集分析 (GSEA) 表明,源自 ISC 的肿瘤具有高水平的 MYC 和 WNT 信号传导特征,而 PC 衍生的腺瘤显示出更高水平的炎症通路,表明来自肿瘤微环境 (TME) 的浸润(图3c)。值得注意的是,在没有 DSS 驱动的炎症的情况下,将Apc和Kras突变靶向 PC 的小鼠中也观察到了 PC 衍生肿瘤的炎症特征(图3d),这表明特定的突变基因型和来源细胞类型可以通过模仿 DSS 带来的炎症环境来触发肿瘤发生。
接下来,他们使用 ISC 指数来预测肠道肿瘤中 RSC 和隐窝基部柱状 (CBC) 干细胞的相对比例。与 scRNA-seq 分析一致,PC 衍生的肿瘤富含 RSC,而 ISC 衍生的肿瘤主要由 CBC 组成(图3e)。
接下来,鉴于不同细胞来源的小鼠肠道肿瘤的转录谱存在显著差异,他们研究了人类微卫星稳定(MSS) 散发性结直肠癌 (sCRC) 和炎症性肠病患者 (IBD-CRC) 的 RNA-seq谱。GSEA中小鼠肿瘤中差异表达最多的基因显示,Lyz肿瘤特征与IBD-CRC之间存在显著关联,而Lgr5T特征与sCRC显著相关(图3f)。对来自分子特征数据库的特征进行评估,揭示了 PC 衍生的肿瘤和 IBD 相关 CRC(干扰素 α/干扰素 γ、炎症反应、IL-6/IL-2 信号传导、KRAS、补体、同种异体移植排斥)以及Lgr5衍生的肿瘤和 sCRC(MYC 靶标、G2M 检查点、E2F 靶标和 WNT β-catenin 信号传导)共有的基因集(图3g)。
然后,他们比较了 PC 衍生的小鼠肿瘤与Lgr5衍生的小鼠肿瘤以及人类 IBD-CRC 与 sCRC 的差异表达基因(Paneth/IBD-CRC),并基于大型 scRNA-seq CRC 研究可视化了它们在不同细胞类型中的表达(图3h)。值得注意的是,PC衍生的肿瘤和 IBD-CRC 之间共有的标志物主要在肌成纤维细胞(例如ITGAM、SLC1A3)、T 细胞(例如SELPLG、LAX1)和基质细胞(例如CHRDL1、RELN)中表达。相比之下,Lgr5衍生的肿瘤/sCRC 标志物主要在上皮细胞中观察到(例如HOXB6、HOXB8、HOXB9、AXIN2、ASCL2),表明这些肿瘤之间的基质成分存在差异(图3h)。对大型 CRC 队列中的基因特征的比较证实了两种不同特征的存在(图3i-j):一种是富含 RSC 的结肠炎样特征,在共识分子亚型 4 (CMS4)(67%)和 CMS1 (36%) 肿瘤中普遍存在;另一种是散发性特征,富含 CBC,在 CMS2 (55%) 和 CMS3 肿瘤 (52%) 中很常见(图3k-l)。生存分析显示,散发性 CRC 组和结肠炎样 CRC 组之间的无复发生存率存在显著差异(图3m)。因此,源自 PC 的小鼠小肠肿瘤的转录特征与在 IBD 背景下出现的人类结肠癌的转录特征明显重叠,可能揭示了分泌谱系中的共同细胞来源。
图3.PC来源的腺瘤具有模仿结肠炎相关结肠癌的炎症表型。(a) 比较 PC 和Lgr5衍生腺瘤的实验方法示意图。(b) PCA 图显示来源细胞是方差的主要判别因素。(c) 条形图总结了 Paneth 衍生(Lyz1 Apc DSS)和 ISC 衍生(Lgr5 Apc DSS)肿瘤之间的 GSEA。(d) 炎症通路子集,根据来自 GSVA 的值可视化为热图。(e) 箱线图显示干细胞指数的结果。(f) GSEA 显示Lyz1肿瘤特征与 IBD-CRC 之间以及Lgr5肿瘤特征与 sCRC之间存在显著但相反的关联。(g) 热图显示小鼠和人类肿瘤组之间具有相似模式的通路的 GSVA 评分。(h) 热图突出显示差异表达基因。(i) 热图显示 GSVA 评分的 Pearson 相关性。(j-k) 散点图显示所有结肠癌中存在两个不同的聚类,即散发性聚类和结肠炎样聚类,并根据其 CMS 分层。(l) 堆积条形图分析显示 CMS1 至 CMS4 在结肠炎样和散发样结肠癌中的分布。(m) 无复发生存期的 Kaplan-Meier 生存分析。
04
西式饮食引发炎症反应,导致分泌细胞分化不良
患者来源的结肠癌的表达谱与 PC 来源的小鼠肿瘤(图3j)相似,其相对代表性大大超过了有临床表现的 IBD 病史的患者中结肠癌的预期比例。这种明显差异的一个可能解释是,西方饮食习惯(常与长期营养过剩和久坐的生活方式相结合)与慢性代谢性炎症状态(称为“代谢性炎症”)有关。最近有研究表明,模仿西方饮食习惯并导致结肠癌风险增加 (NWD1) 的小鼠饮食可诱导低程度的慢性肠道炎症和定义人类 IBD 发病机制的其他机制。因此,他们提出假设:除 IBD 之外的其他结肠癌病因驱动因素(包括广泛的西式饮食习惯)可能是与急性 DSS 驱动的炎症中观察到的类似的去分化和肿瘤发生机制的基础。
为了支持这一假设,他们首先用西式 (NWD1)和对照 (AIN-76A)饮食喂养 C57BL6/J 小鼠 3 个月,并将 PC 的转录反应与 DSS 给药后的转录反应进行比较(图4a)。与对照饮食的小鼠相比,NWD1 喂养的小鼠的这些基因水平有所不同但总体上有所增加(图4b)。
鉴于之前报道称 PC 在炎症后会获得类似干细胞的特征,他们接下来使用了类器官重建试验 (ORA)来评估西式饮食是否会产生类似的效果。首先将 AIN-76A 和 NWD1 喂养的小鼠的PC细胞和Lgr5 +细胞以四种组合共孵育。来自 NWD1 喂养的小鼠的 PC 显著改善了类器官的形成,而与用 NWD1 或 AIN-76A 喂养的小鼠的 Lgr5 + 细胞重建无关,这可能表明旁分泌效应增强了 PC 已建立的生态位作用(图4C)。然而,与来自 AIN-76A 喂养的小鼠的 PC 或来自两组小鼠的Lgr5 + ISC 相比,来自 NWD1 喂养的小鼠的单个(即未用Lgr5 + ISC 重建)PC 形成类器官的效率更高。通过对 R26 LSL-YFP Lyz1 CreERT2 NWD1 喂养的小鼠中的 PC 进行谱系追踪分析,进一步验证了这些离体结果,结果显示延伸的黄色荧光蛋白 (YFP) 标记带,从而证实了它们的去分化和获得由西方饮食引起的干细胞样特征(图4d)。
为了分析PC 对 NWD1 的主要转录反应,他们利用了之前暴露于 NWD1 后生成的 scRNA-seq 数据(图4a)。在将小鼠转换为 NWD1 饮食后的 4 天内,一组 PC 变得明显,其转录谱与 DSS 特征密切相关(在图4e中标记为“饮食反应细胞”)。与之前在 DSS 炎症刺激后立即获得的观察结果相似,这些西方饮食反应细胞增加了其转录组多样性(图4f)。短暂暴露于 NWD1 后,饮食反应细胞获得了干细胞标记,同时保留了一些分泌特征(图4g)。PC 对 DSS 和 NWD1 的转录反应之间的比较通路分析显示 WNT、MYC、Hedgehog 和 G2M 检查点信号通路的类似上调(图4h)。短暂暴露于 NWD1 后,饮食反应细胞获得了干细胞标记,同时保留了一些分泌特征(图4g)。PC 对 DSS 和 NWD1 的转录反应之间的比较通路分析显示 WNT、MYC、Hedgehog 和 G2M 检查点信号通路的类似上调(图4h)。
由于观察到的西方饮食驱动的基因表达变化很可能是通过表观遗传修饰实现的,他们接下来分析了scATAC-seq(用高通量测序对转座酶可及染色质进行单细胞分析)数据。与 scRNA-seq 分析观察到的情况类似,他们确定了一组具有显著表观遗传修饰的 NWD1 饮食反应性 PC,包括小鼠 11 号染色体(与人类 17 号和 5 号染色体合成)上的主要聚类(52%),它包含了编码 WNT、PI3K-AKT 和细胞周期通路成员的相当一部分基因(图4i-k)。
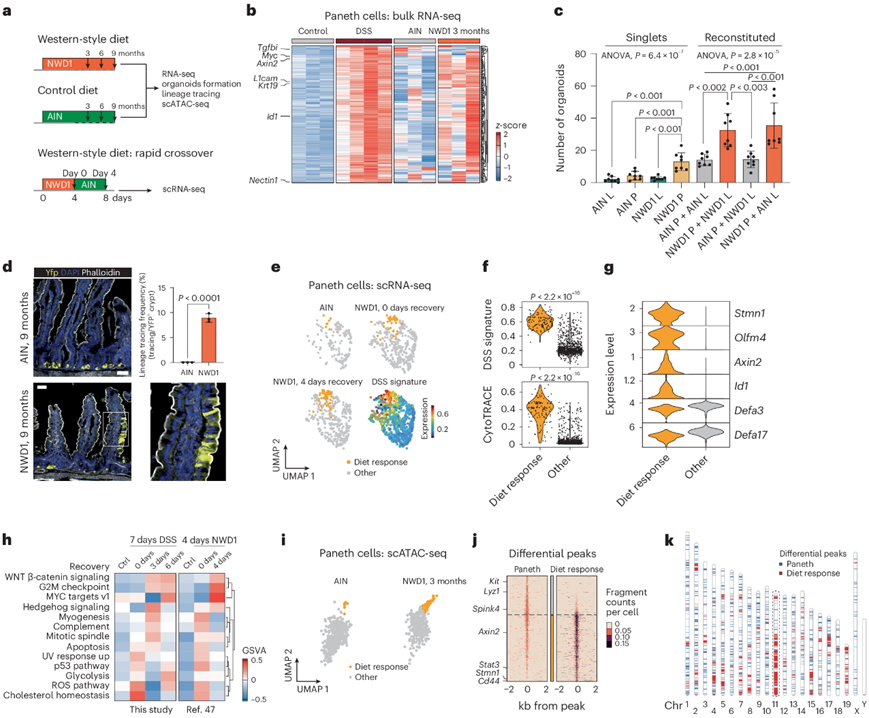
图4. 西式饮食会引发炎症反应,导致 PC 去分化。
(a) 研究短期和长期暴露于西式饮食(NWD1)与对照(AIN-76A)饮食的后果的实验方法示意图。 (b) 热图显示暴露于 DSS 或 NWD1 的 PC 中z分数的 DSS 特征。(c) 来自单个 ISC 或 PC 以及重组双联体的类器官多样性。 (d) 谱系追踪代表性图像。(e) UMAP 显示喂食 AIN-76A (AIN) 和 NWD1 的小鼠的 PC 。(f) 小提琴图显示对 NWD1 饮食有反应的 PC 和其他 PC 之间不同水平的 DSS 特征(上)和 CytoTRACE 分数(下)。(g) 小提琴图代表对 NWD1 饮食有反应的 PC 的标记基因,显示干细胞和分泌标记共表达。(h) GSVA 的热图可视化,表明暴露于 DSS 或 NWD1 后 PC 中激活的通路。(i) 用 AIN和 NWD1治疗的小鼠的 scATAC 数据集中 PC 子集的 UMAP 图。 (j) 热图列出了饮食反应 PC 与其他 PC 之间的差异峰。(k) 显示了与 PC 特征峰相比,饮食反应观察到的差异峰沿小鼠染色体 (Chr) 的分布。
05
分泌谱系是人类结肠癌的细胞起源
为了评估 NWD1 饮食对小鼠结肠的影响,他们采用增殖的潘氏样细胞(也称为 DCS 细胞)进行研究。通过将结肠组织与分泌谱系标志物麦胚凝集素 (WGA) 和 Ki67共染色,在喂食 NWD1 饮食的小鼠和作为阳性对照(饮用水中添加 DSS 的小鼠)中均观察到位于隐窝底部的增殖分泌细胞数量显著增加(图5a-c)。虽然大多数散发性结肠癌似乎起源于干细胞 (52%),但在 IBD 相关病例中,杯状细胞 (40%) 和 BEST4 (28%) 代表了普遍的起源细胞。相当大比例 (>40%) 的散发性病例也起源于非干细胞谱系,即杯状细胞 (22%)、肠细胞 (2%) 和 BEST4 细胞 (17%)。后者以 bestrophin 4 基因 (BEST4) 的特异性表达命名,这由此形成了一种新发现的、迄今为止仅部分表征的肠上皮谱系,具有双重吸收和分泌特征。对一组溃疡性结肠炎患者进行的 IHC 和 scRNA-seq 分析证实了活跃增殖的杯状细胞和 BEST4 细胞(MUC2 +和 BEST4 +)(图5e-f),表明炎症在这些原本有丝分裂后的细胞中产生了主要影响,可能先于它们获得类似干细胞的特征。
从患者衍生肿瘤子集中获得的 RNA -seq数据能够确认 RSC 样表达谱的普遍性以及 CMS1 和 CMS4 在散发性和 IBD 病例中的高比例,这些病例预测源自非干细胞,特别是杯状细胞(图5g-h)。
炎症增加结肠癌风险的总体影响可能反映了一种“权衡”效应,在这种效应中,损伤的慢性特性不断刺激已经分化的细胞群转化为干细胞样细胞,以支持组织的再生反应,从而导致潜在肿瘤起点的细胞池扩大。同样,导致炎症的风险因素必然会影响肿瘤向恶性发展的进程,从而导致一类具有特定预后和治疗反应的结肠癌(图5i)。
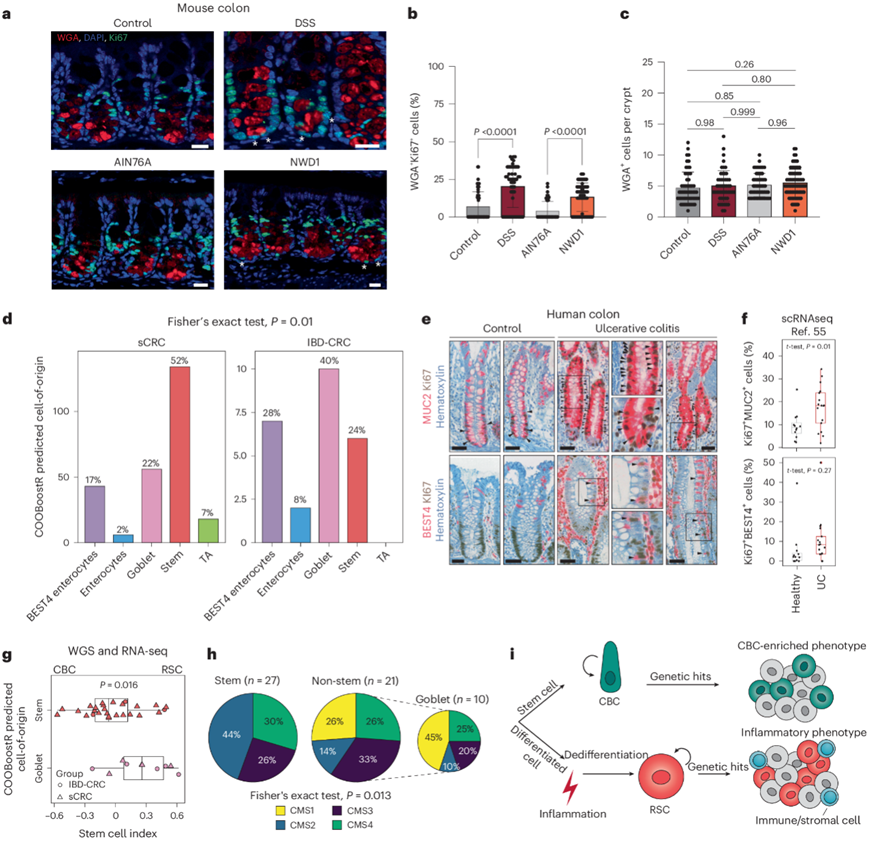
图5. 炎症激活结肠中不同的来源细胞。
(a) 增殖性 DCS 细胞分析。(b-c) 对小鼠下结肠隐窝中的WGA + Ki67 +细胞和总 WGA +细胞进行定量。 (d) 条形图显示了基于COOBoostR计算方法的IBD-CRC和sCRC队列中预测的起源细胞。(e) 对来自对照组和 IBD 患者的结肠组织进行IHC 分析。 (f) 箱线图显示溃疡性结肠炎 (UC) 患者和对照组中循环 (Ki67+) MUC2 +和 REG4 +细胞的百分比。(g) 箱线图表示在IBD-CRC 和 sCRC 病例子集中基于预测细胞来源分层的干细胞指数差异。(h) 根据预测的细胞来源分层的肿瘤样本上的 CMS 映射。(i) 本研究模型的示意图。
+ + + + + + + + + + +
结 论
本项研究使用潘氏细胞作为模型来评估分化谱系在小鼠炎症背景下触发肿瘤发生的能力。在炎症发生时,PC特异性Apc突变导致的肠道肿瘤不仅让人联想到炎症性肠病患者的肿瘤,还让人联想到更大比例的人类散发性结肠癌。后者可能是因为西方饮食习惯的炎症后果,这是结肠癌的主要风险因素。在相当一部分散发性病例中,结肠癌的起源存在于分泌谱系中,而不是干细胞中。
+ + + + +



 English
English


