文献解读|Nat Commun(16.6):太空飞行对小鼠神经元影响的空间分辨多组学研究
✦ +
+
论文ID
原名:Spatially resolved multiomics on the neuronal effects induced by spaceflight in mice
译名:太空飞行对小鼠神经元影响的空间分辨多组学研究
期刊:Nature Communications
影响因子:16.6
发表时间:2024.06.11
DOI号:10.1038/s41467-024-48916-8
背 景
中枢神经系统 (CNS) 受损会对长期太空任务中的宇航员的健康造成重大风险。直接对宇航员进行的研究必须尽可能微创,因此分子和细胞水平结果的信息有限,而太空飞行的啮齿动物模型允许对太空飞行的影响进行从亚细胞到行为水平的研究。
实验设计
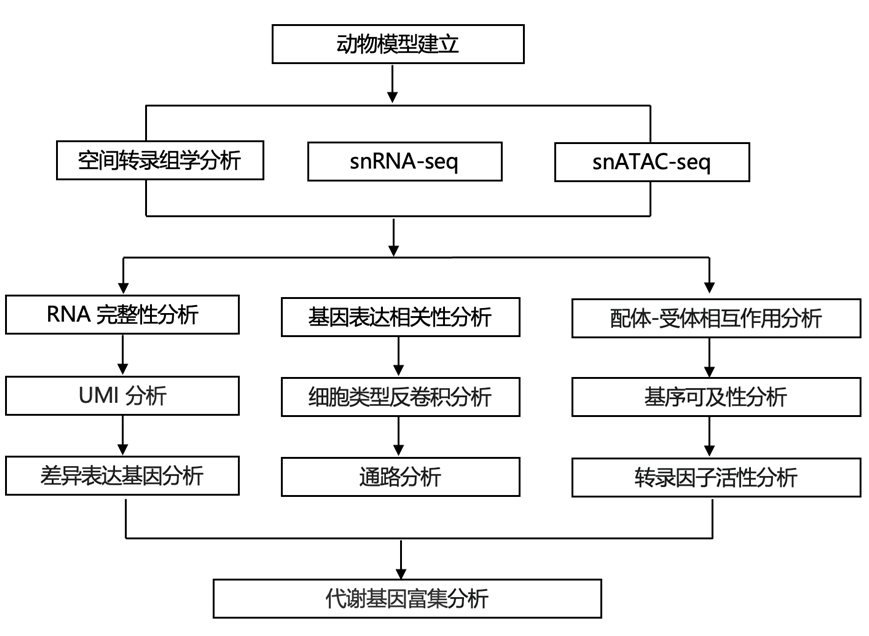
结 果
01
ST和snMultiomics分析
为了识别受太空飞行影响的特定细胞微环境,研究团队将空间转录组学 (ST) 技术和单细胞核多组学 (snMultiomics)技术(包括单细胞核染色质可及性分析:snATAC-seq、单细胞核转录组分析:snRNA-seq)结合用于小鼠大脑。总共,他们分析了在国际空间站 (ISS) 上安乐死的三只小鼠的大脑和在匹配条件下饲养的地面对照小鼠的三只大脑。对于每个样本,从一侧半球分离细胞核进行 snMultiomics 分析,并对另一侧半球进行冷冻切片以进行 ST 分析,重点关注海马区域(图 1)。
他们检测了每个样本的 RNA 完整性数 (RIN),发现平均为 9.15(图S1A)。此外,他们还进行了组织优化实验,确认 RNA 完整性和组织形态均具有足够的质量进行 ST 分析(图S1B)。
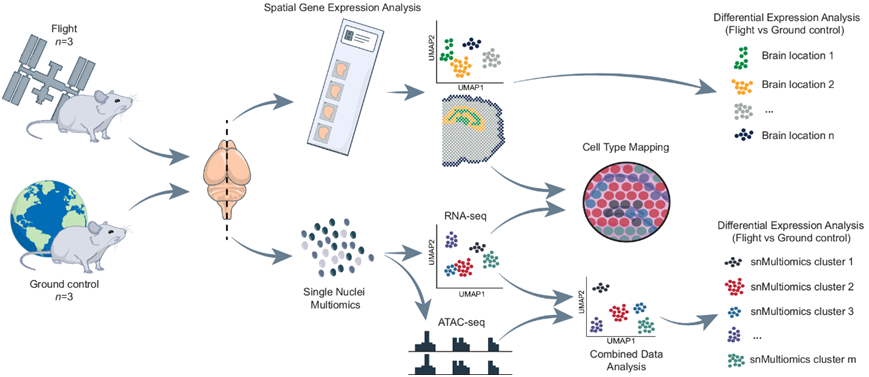
图1. 实验流程图。
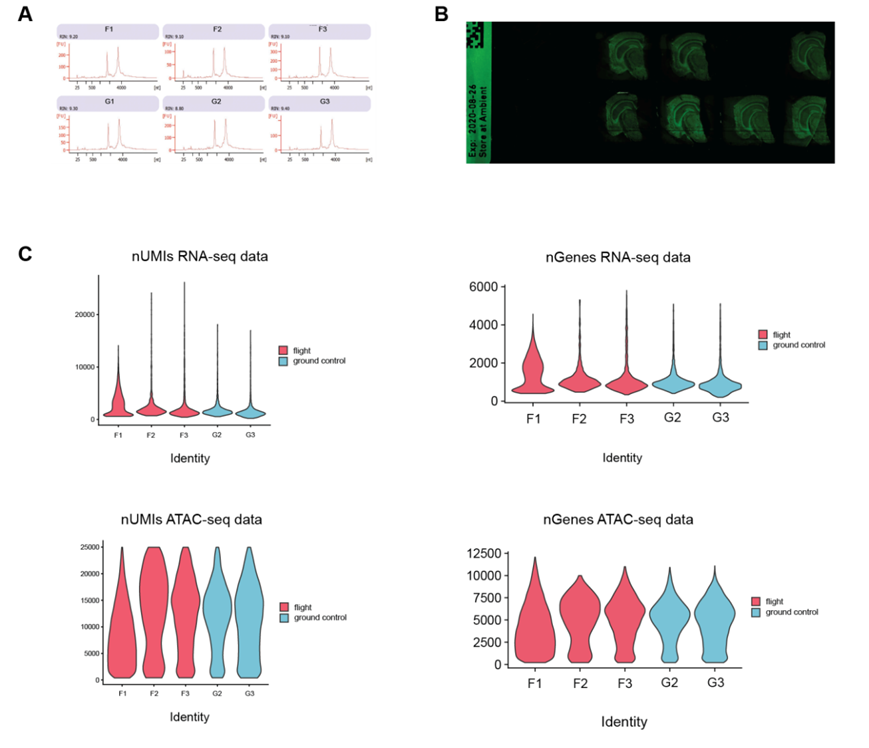
图S1. (a) 生物分析仪显示所有脑样本的RIN值。
(b) 脑组织切片的荧光足迹。(c) 在单核RNA-seq多组学数据集(RNA-seq在上,ATAC-seq在下)中,每个样品中每个细胞核检测到的独特分子和基因的分布以小提琴图的形式显示,以样品条件着色。
02
太空飞行对小鼠大脑中不同细胞类型的影响
为了在单核水平上剖析太空飞行引起的改变,他们对三只太空飞行小鼠(F1、F2、F3)和三只地面对照小鼠(G1、G2、G3)的半球进行了 snMultiomics 分析,获得了来自同一细胞核的 RNA 表达谱(RNA-seq)和染色质可及性(ATAC-seq)信息。从太空飞行和对照样本中分离出了 21178 个细胞核,平均每个细胞核有 3140 个独特转录本(唯一分子标识符: UMI)(即来自 snRNA-seq),每个细胞核有 9217 个峰(即来自 snATAC-seq)(图 2A-B,图S1C),并且太空飞行和地面对照样本之间的基因表达总体上具有较高的相关性(图 2C)。通过整合 snRNA-seq 和 snATAC-seq 数据并进行联合聚类分析,他们确定了 18 个 聚类(图 2D)。然后,他们根据标记基因,为 18 个聚类确定 11 个宏观类别(图 2E)。大多数聚类与神经发生、神经元活动和突触传递有关,通过神经递质(GABA能、谷氨酸能、多巴胺能)的差异和基因表达模式来区分,与下丘脑、纹状体、皮层和海马的神经元位置有关。
他们在所有多组学聚类中鉴定了太空飞行样本和地面对照样本之间共 825 个差异表达基因 (DEG)。这 825 个 DEG 中的大多数与神经元发育(聚类 9、11)、轴突或树突生长(聚类 9)和突触传递(聚类 4)有关,特别是 GABA 能突触传递(聚类 11)。将 825 个太空飞行多组学 DEG 与来自同一 NASA 任务(RR-3)的同一小鼠大脑的转录组分析(RNA-seq) 数据的629 个显著 DEG进行比较,表明有 11 个共有基因。在这 11 个重叠基因中,只有 2 个基因(Gabra6 和 Kctd16)在两个数据集中都显示出相同的方向变化,表明大多数太空飞行效应是细胞类型特异性的,并强调需要对中枢神经系统对太空飞行的反应进行细胞特异性分析。
为了在空间层面研究太空飞行引起的中枢神经系统变化,他们对 3 只飞行小鼠(F1、F2、F3)和 3 只地面控制小鼠(G1、G2、G3)的其他大脑半球进行了 ST 分析,从每个大脑半球收集了两个冠状切片,其中包含海马体、躯体感觉皮层、纹状体、杏仁核和胼胝体。总的来说,他们捕获了 14630 个基因,平均检测到 10884 个 UMI/点和 3755 个基因/点(图 2F-G),并发现太空飞行和地面对照组织切片之间存在较高的整体基因表达相关性(图 2H)。
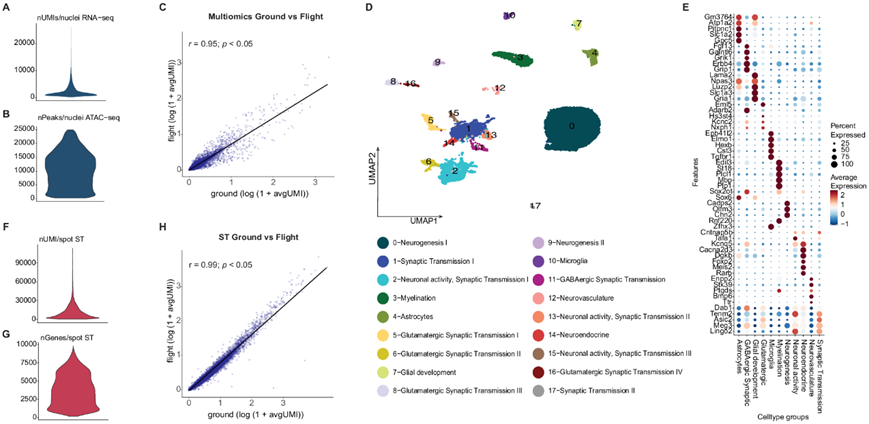
图2. 太空飞行小鼠大脑的单核多组学分析。
(a) 整个 snRNA-seq 数据集中每个细胞核的 UMI 分布。 (b) 整个snATAC-seq 数据集中每个细胞核的峰分布。(c) 行(y 轴)和地面控制(x 轴)单核多组学样本之间的相关性。(d) 单细胞核多组学数据和聚类注释的 UMAP。(e) 11个功能性多组学聚类类别。(f) 整个空间转录组学 (ST) 数据集的每个点的 UMI 分布。(g) 整个空间转录组学 (ST) 数据集中每个点的独特基因分布。(h) 飞行(y轴) 和地面控制(x 轴)ST 样本之间的相关性。
03
ST 提供小鼠大脑区域基因表达变化的高分辨率映射
他们对斑点信息进行无监督聚类分析,确定了 18 个不同的空间聚类(进一步称为 ST 聚类)(图 3A-B),这些聚类显示出皮质顶层(ST 聚类 1)和底层(ST 聚类 9)之间的明显分离,以及其他主要结构,包括海马体(CA1、CA3 和齿状回分别在 ST 聚类 10、8 和 11 中分离)、丘脑(ST 聚类 5)、纹状体(ST 聚类 0、14)、下丘脑(ST 聚类 2)、垂体(前部和后部;ST 聚类 2)、胼胝体(ST 聚类 12)和大脑脚(ST 聚类 4)(图 3C)。许多 ST 聚类所共有的标记物的主要功能包括神经发生、神经元发育、轴突生长和突触形成,这表明 ST 聚类受神经元基因表达的主导。
接下来,他们研究了太空飞行如何影响空间层面的基因表达,并在 18 个 ST 聚类中的 7 个中确定了总共 4057 个 DEG。大多数 DEG 涉及神经元发育、突触形成和突触可塑性以及神经退行性,包括海马 CA3 神经元中的 21 个 DEG。太空飞行导致的基因表达最明显的变化是在皮质神经元(底层;ST 聚类 9)中观察到的,其中有 3208 个 DEG(1808 个上调,1400 个下调)具有与体感、运动和视觉皮质中的神经元发育和突触传递相关的类似功能。共识通路分析强调了皮质神经元(底层;ST 聚类9)中的神经退行性疾病相关通路,包括蛋白质错误折叠和异常蛋白质清除,表明与以蛋白质错误折叠和积累为特征的神经退行性疾病(如帕金森病)存在潜在相似性(图 3D)。
为了推断多组学识别出的集群的空间分布,他们使用Stereoscope对匹配的ST数据集进行点反卷积分析(该分析在计算细胞类型比例概率之前校正了不同实验技术产生的偏差)(图3E)。反卷积分析揭示了多个多组学和空间数据聚类之间的相似性,例如突触传递(多组学聚类1与ST聚类0和2匹配),髓鞘化(多组学聚类3与ST聚类4和12匹配),以及神经元活动(多组学聚类15与ST聚类5匹配)(图3F)。这项比较分析表明了太空飞行对突触传递的影响,特别是在皮质中(包括神经元和星形胶质细胞),以及对多巴胺能神经元发育的影响,特别是在纹状体中。
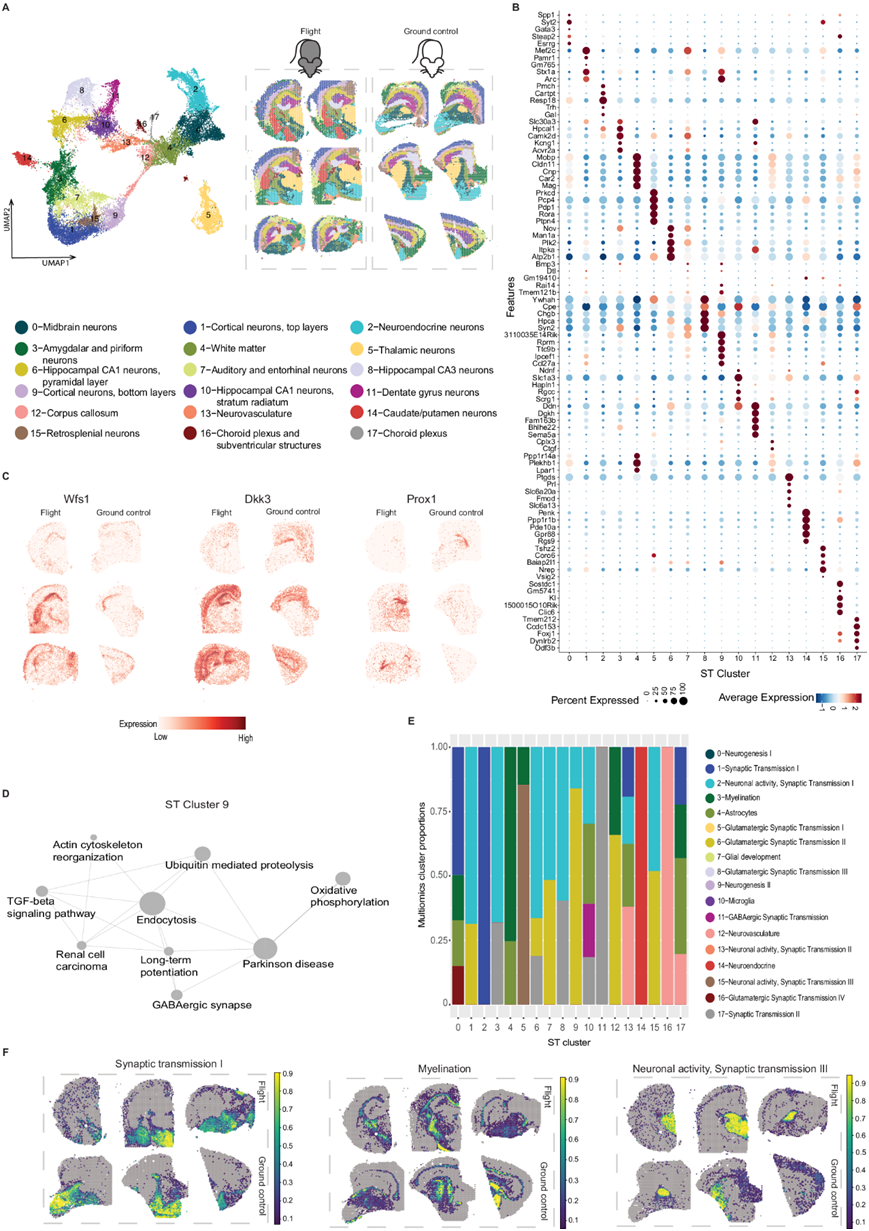
图3. 空间转录组学数据集、细胞类型反卷积和 ST 数据的通路分析。
(a) 在飞行和地面对照小鼠脑切片上可视化的空间转录组学数据聚类、聚类注释和聚类的空间位置。 (b) 每个ST 聚类的标记基因可视化为点图。(c) 三个飞行(左栏)和三个地面对照(右栏) ST 切片中 3 个基因(海马 CA1 区的 Wfs1、海马 CA1 和 CA3 区的 Dkk3 和齿状回的 Prox1)的空间分布。(d) ST 聚类 9(皮质神经元,底层)中飞行和地面对照之间的通路存在显著差异。(e) 可视化单核多组学识别的聚类数量及其在每个 ST 聚类中的比例。(f) 细胞类型比例映射到三个地面控制(上)和三个飞行(下)小鼠脑切片的空间坐标。
04
配体-受体相互作用分析表明太空飞行介导对星形胶质细胞功能的影响
为了评估太空飞行对细胞间相互作用水平的影响,他们对两个多组学聚类进行了配体-受体分析,这两个多组学聚类显示出对太空飞行反应的差异表达基因数量最多,即多组学聚类4(星形胶质细胞)和聚类11(GABA 能突触传递)。他们发现 4 个显著上调的相互作用,包括粘附分子对、EGFR(表皮生长因子受体)对和 VEGFA(血管内皮生长因子)(图 4A)。这些配体-受体相互作用已证明参与中枢神经系统细胞发育,EGFR参与神经元发育,包括轴突生长。同时,VEGFA主要调节血管生成,尽管它也可以参与海马神经生成,而星形胶质细胞产生的 VEGFA 之前已证明可以调节神经元 NMDA 受体活性。有趣的是,他们发现太空飞行大大增加了与星形胶质细胞和突触传递相关的多组学聚类对之间的 VEGFA_GRIN28 相互作用,即聚类4-11(星形胶质细胞-GABA 能突触传递)。这些聚类中的配体-受体相互作用没有显著下调。
为了研究太空飞行对转录因子 (TF) 的影响,他们对单核多组学数据中的 snATAC-seq 峰进行了基序分析,结果揭示了太空飞行介导的几个多组学聚类中的 TF 活性差异,尤其是 聚类4(星形胶质细胞)和 聚类11(GABA 能突触传递)。航天飞行与多组学聚类4(星形胶质细胞)中基序Zic1、Zic2和Atoh1的可及性降低相关(图4B)。同时,在多组学聚类11(GABA能突触传递)中,基序Pou5f1和Sox2的可及性增加可能表明在太空飞行中神经元分化减少(图4C)。除了神经元效应之外,共同抑制免疫应答的基序Pparg、Rxra和Nr2f6在端脑中间神经元中的可及性降低(多组学聚类11),提示空间炎症反应增加,并且可能存在昼夜节律失调。
根据细胞类型丰度,他们没有发现飞行和地面控制之间细胞类型共定位的任何显著变化(在组织重组或病变形成期间会发生),这与之前发现的反卷积结果中细胞类型丰度没有显著变化相对应。相反,信号通路的变化与单个细胞类型有关。神经血管中的细胞丰度(多组学聚类12)与航天飞行中 MAPK 信号降低共定位(图 4D)。同样,在航天样本中也发现了其他几种细胞类型的局部邻域(MISTy 视图)的信号变化(图 4E):(1)EGFR 信号与谷氨酸能神经元细胞的负相关性降低;(2)MAPK 与胆碱能、单胺能和肽能神经元的负相关性增强;(3)GABA 能中间神经元附近的 TGFbeta 信号增强;(4) II 类谷氨酸能神经元的 WNT 信号减弱。为了评估这些变化的下游效应,他们使用 CellOracle 从多组学数据中构建了一个组织特异性基因调控网络 (GRN),并用它来预测空间数据中的 TF 活性,并计算了包含上述细胞类型的斑点中失调通路的 TF 和信号活性之间的 Pearson 相关性。该网络表明,太空飞行中 MAPK 信号的减少分别增加了转录因子 Glis3 的活性并降低了神经血管中的 Lef1(图 4F-G)。
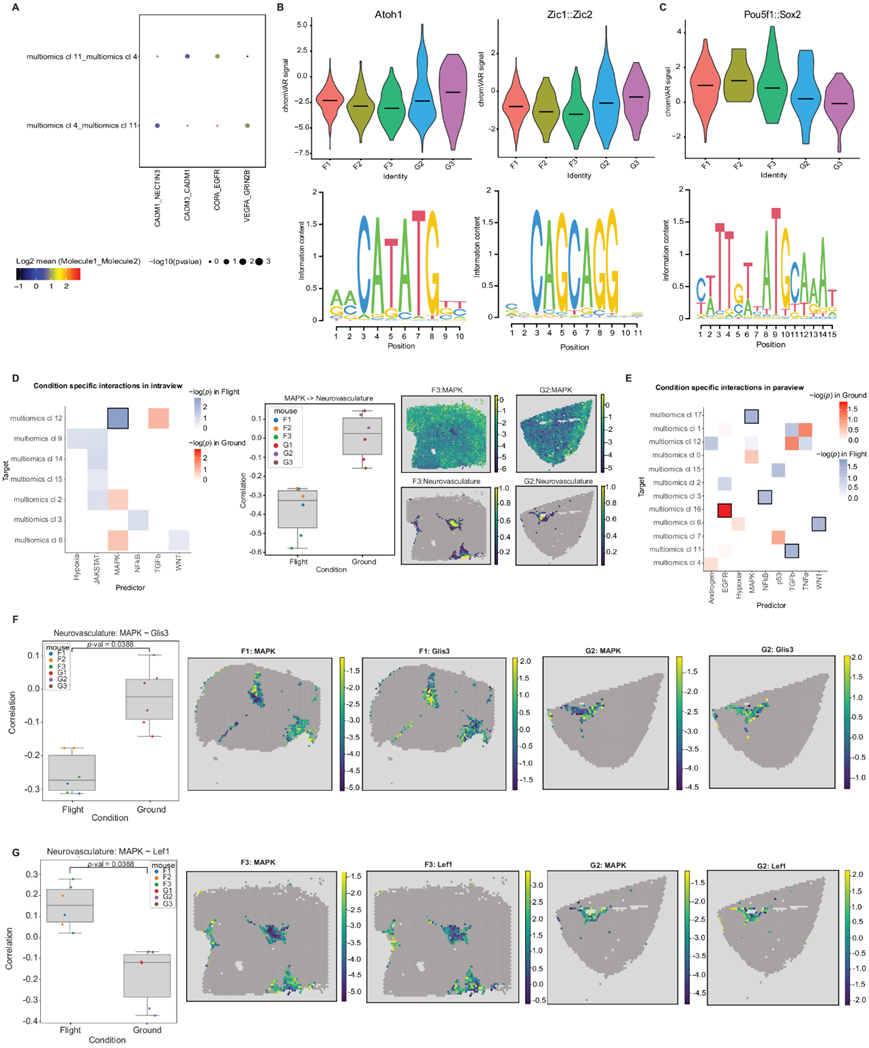
图4. 受太空飞行影响的配体-受体相互作用、基序可及性和信号通路。
(a) 点图显示了 CellPhoneDB 在两个相互作用的多组学聚类(4 和 11)之间发现的差异表达配体受体对。(b) 飞行小鼠和地面对照小鼠的多组学聚类4 中基序 Atoh1、Zic1 和 Zic2 的可及性差异。 (c) 飞行和地面对照小鼠多组学聚类 11 中 Pou5f1 和 Sox2 基序的可及性差异。(d) (左)调整后的 MISTy 在内部视图中发现的差异相互作用的p值。(中)MAPK 通路活性与神经血管丰度的相关性,并映射到两个样本的 Visium 载玻片上(右)。(e) 显示 MISTy 在 paraview 中发现的差异相互作用。(f) 包含血管内皮细胞的 Glis3 活性(左)和 MAPK 活性的 Pearson 相关性(n = 6 个单独的 ST 小鼠样本,3 个飞行样本,3 个地面对照样本)及其在 Visium 载玻片中的各自活性(右侧 4 个图)。 (g) 包含血管内皮细胞的斑点内的 Lef1 活性(左)和 MAPK 活性的 Pearson 相关性,以及它们在 Visium 载玻片中的各自活性(右侧 4 个图)。
05
代谢基因富集分析显示太空飞行小鼠的基因表达下降
对 ST 数据进行基因集富集分析 (GSEA) 表明太空飞行介导的氧化磷酸化通路受到抑制,特别是复合物 I 信号传导(图 5A),以及与糖酵解/糖异生、果糖和甘露糖代谢和花生四烯酸代谢(图 5B)相关的通路。多组学数据分析与太空飞行介导的这些通路和脂肪酸合成的减少相一致(图 5C)。糖酵解和氧化磷酸化的缺陷与先前报道的太空飞行引起的线粒体损伤一致,而花生四烯酸主要由星形胶质细胞产生,并表明星形胶质细胞功能障碍是未来太空飞行中枢神经系统研究的潜在靶标。
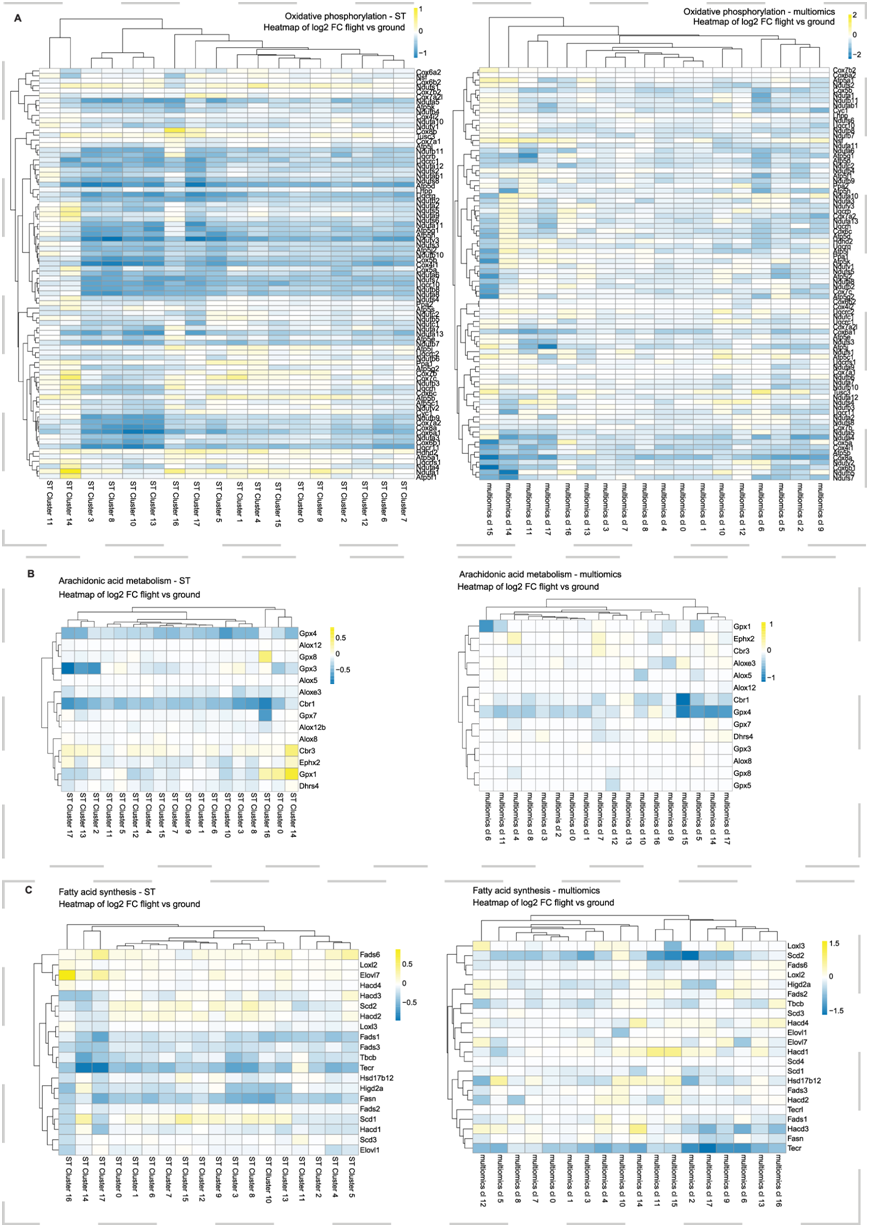
图5. 代谢基因集富集分析。
(a) 热图显示 ST 和多组学数据集中氧化磷酸化通路中飞行和地面对照样本之间的差异倍数。(b) 热图显示 ST 和多组学数据集中花生四烯酸代谢途径中飞行和地面对照样本之间的差异倍数的log2值(log2FC)。(c) 热图显示 ST 和多组学数据集中脂肪酸合成途径中飞行和地面对照样本之间的log2FC。
+ + + + + + + + + + +
结 论
本项研究将单细胞核多组学(转录组学和染色质可及性)与空间转录组学相结合,以阐明太空飞行对雌性小鼠大脑的影响,对地面动物和太空飞行动物的比较分析揭示了大脑基本过程的重大改变,包括神经发生、突触形成和突触传递,特别是影响皮层、海马、纹状体和神经内分泌结构。此外,观察到星形胶质细胞活化和免疫功能障碍的迹象。在通路水平上,一些太空飞行引起的大脑变化与神经退行性疾病表现出相似性,其特点是氧化应激和蛋白质错误折叠。综合空间多组学方法是了解太空飞行引起的中枢神经系统损伤(在单个大脑区域和细胞类型水平)的重要手段,并为未来太空飞行研究的比较提供基础。
+ + + + +



 English
English


