文献解读|Dev Cell(11.8):恢复CPEB 4的表达能阻滞增龄过程中肌肉干细胞的衰老
✦ +
+
论文ID
原名:Restoration of CPEB 4 prevents muscle stem cell senescence during aging
译名:恢复CPEB 4的表达能阻滞增龄过程中肌肉干细胞的衰老
期刊:Development Cell
影响因子:11.8
发表时间:2023.08.07
DOI号:10.1016/j.devcel.2023.05.012
背 景
全球人口老龄化背景下,肌肉衰老已成为当下亟待解决的老年人健康问题。衰老一方面会导致终末分化的肌肉细胞中的蛋白质分解代谢显著增强,造成肌肉萎缩,另一方面会导致肌肉干细胞活性和功能显著减弱,使得肌肉损伤后再生能力受损,最终导致的肌肉功能退化。然而目前,衰老过程中何种因素削弱了肌肉干细胞功能,以及通过何种方式削弱尚不完全清楚,这严重阻碍了人们寻找有效的药物靶点进而延缓肌肉衰老的脚步。
实验设计

结 果
01
衰老小鼠的肌卫星细胞呈现衰老特征
为了探究增龄过程中肌卫星细胞(stem cell, SC)为何无法正常修复受损肌肉这一问题,研究者团队对成年小鼠(3~6月龄)、老年小鼠(18~24月龄)和衰老小鼠(>28月龄)的SC进行了原位蛋白质组学分析,并发现不同年龄阶段小鼠SC的蛋白质组有很大差异(图1 A-B),且随着老龄化程度的增加,SC中自噬信号通路、Notch信号通路和Wnt信号通路中的相关蛋白表达水平不断降低(图1 C)。不仅如此,研究者团队还发现衰老小鼠SC中Cd34和Pax7等部分SC标志蛋白的表达水平显著降低,而衰老相关基因的蛋白表达水平却显著增加(图1 C-E,1G)。与上述结果一致,针对成年小鼠和衰老小鼠SC的转录组测序结果也证实,衰老小鼠SC中Notch信号通路相关基因表达水平显著下降(图 1 F),衰老相关分泌表型(senescence-associated secretory phenotype, SASP)的mRNA表达水平则显著增加(图 1 G-H)。通过检测β-半乳糖苷酶(SA-β-gal)这一衰老标志物,研究者团队进一步发现,与年轻小鼠相比,衰老小鼠受损肌肉和SC中SA-β-gal阳性细胞的比例显著增加(图 1 I,1J)。
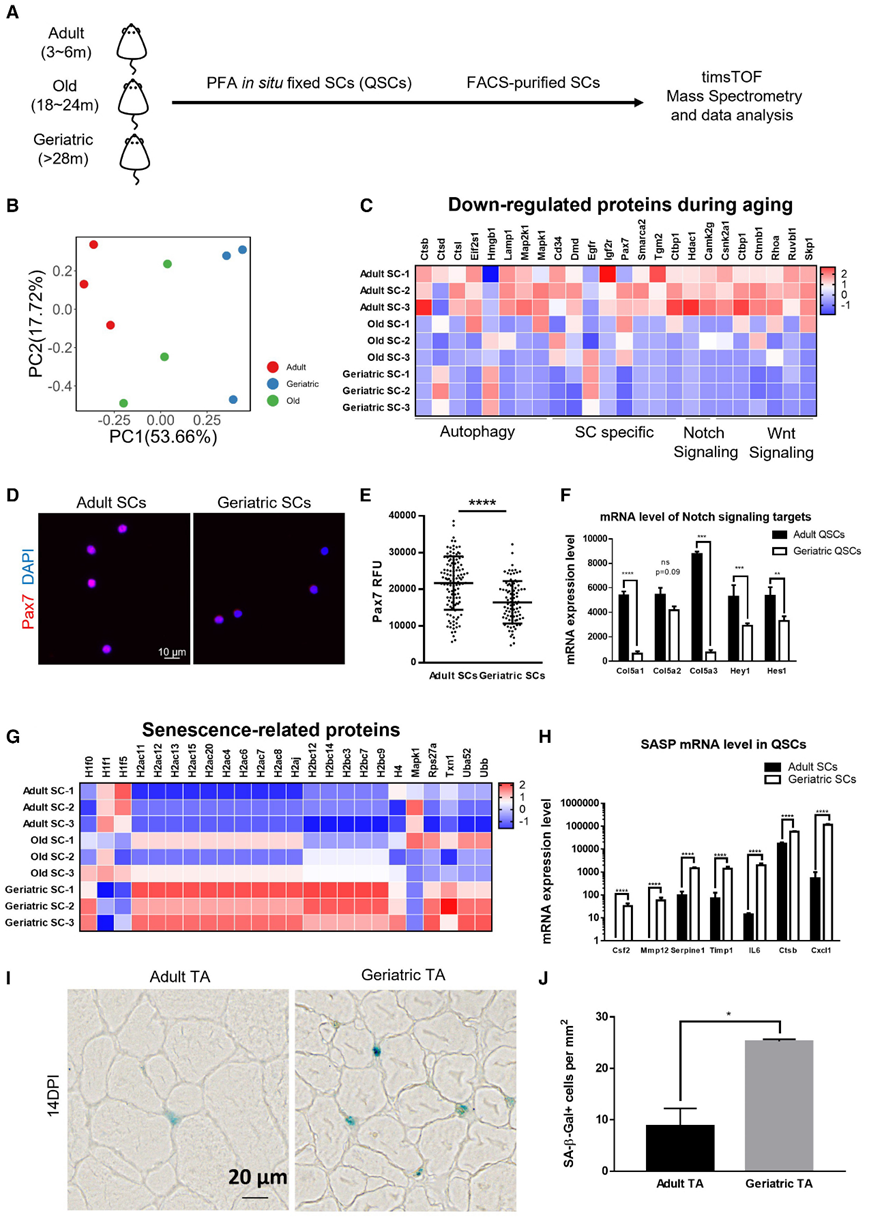
图1 衰老小鼠SC呈现衰老表型
02
衰老小鼠肌卫星细胞能量代谢受损
有趣的是,研究者团队深入分析蛋白质组学数据发现,与成年小鼠相比,衰老小鼠SC中绝大部分线粒体氧化磷酸化相关蛋白(三羧酸循环和线粒体呼吸链蛋白)表达水平均显著降低(图 2A)。由于线粒体是SC能量代谢的中心,于是,为了探究SC能量代谢水平是否会受到衰老的影响,研究者团队针对性地筛选了在衰老小鼠SC中表达水平降低的线粒体蛋白,并发现与成年小鼠相比,衰老小鼠SC中有205个线粒体蛋白表达显著下调,且这些蛋白与脂肪酸氧化和能量代谢密切相关(图2 B-D)。为了验证衰老是否还会对线粒体蛋白活性产生影响,研究者团队对成年小鼠和衰老小鼠的SC进行了活细胞能量代谢分析,并发现衰老会导致SC基底耗氧量、最大耗氧量以及线粒体ATP生产量显著减少(图2 E-G)。以上数据表明,衰老可通过抑制SC线粒体蛋白表达并抑制线粒体蛋白活性,最终削弱SC能量代谢水平。
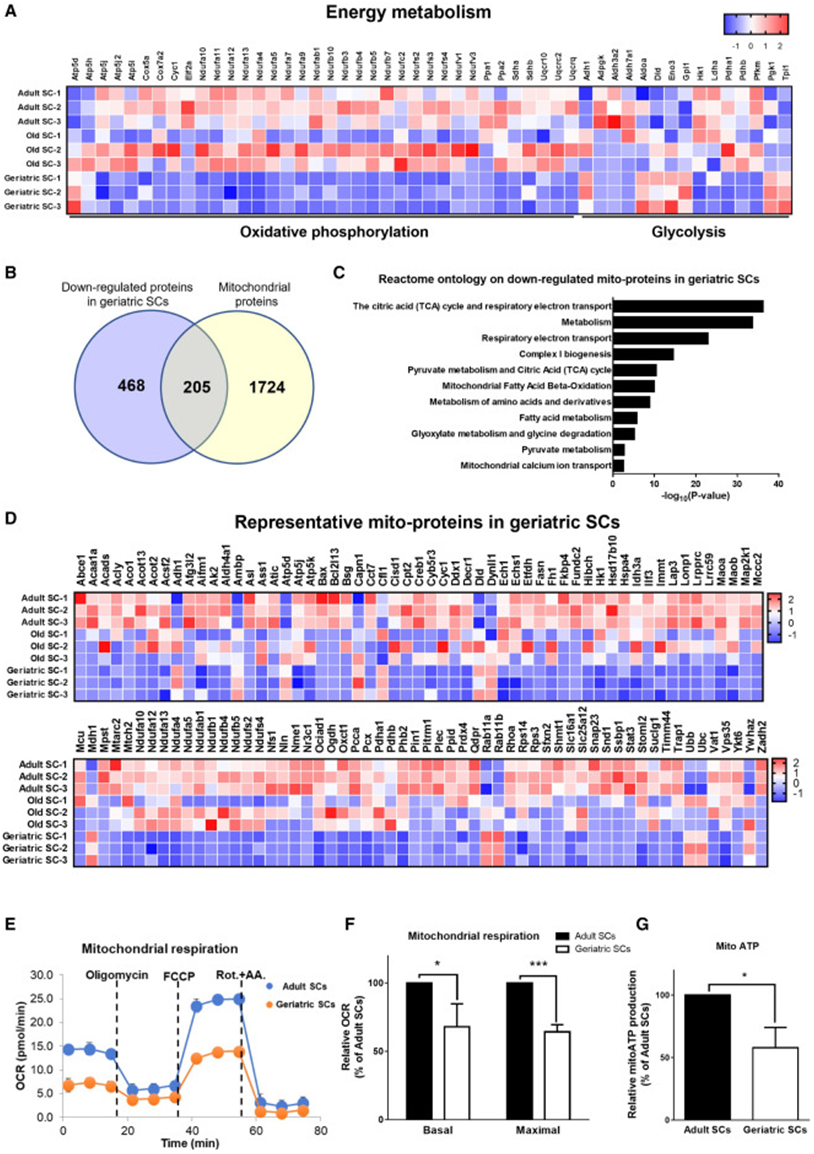
图2 衰老SC的线粒体蛋白质组和活性存在缺陷
03
线粒体代谢缺陷导致细胞衰老
研究表明,线粒体代谢缺陷可通过引起DNA突变、诱发炎症和促进活性氧的产生(ROS)以诱导细胞衰老(图3 A),基于此,研究者团队随后在体外检测了抑制线粒体代谢是否会导致原代成肌细胞衰老。实验结果表明,利用鱼藤酮和抗霉素A处理细胞以选择性抑制线粒体电子传递链复合物活性后,与对照组相比,处理组细胞中SA-β-gal阳性的细胞比例显著增加(图3 B-D),且这一结果在新鲜分离的SC中也得到了验证(图3 E-G)。综上所述,研究者团队的数据表明,线粒体缺陷可导致SC衰老。
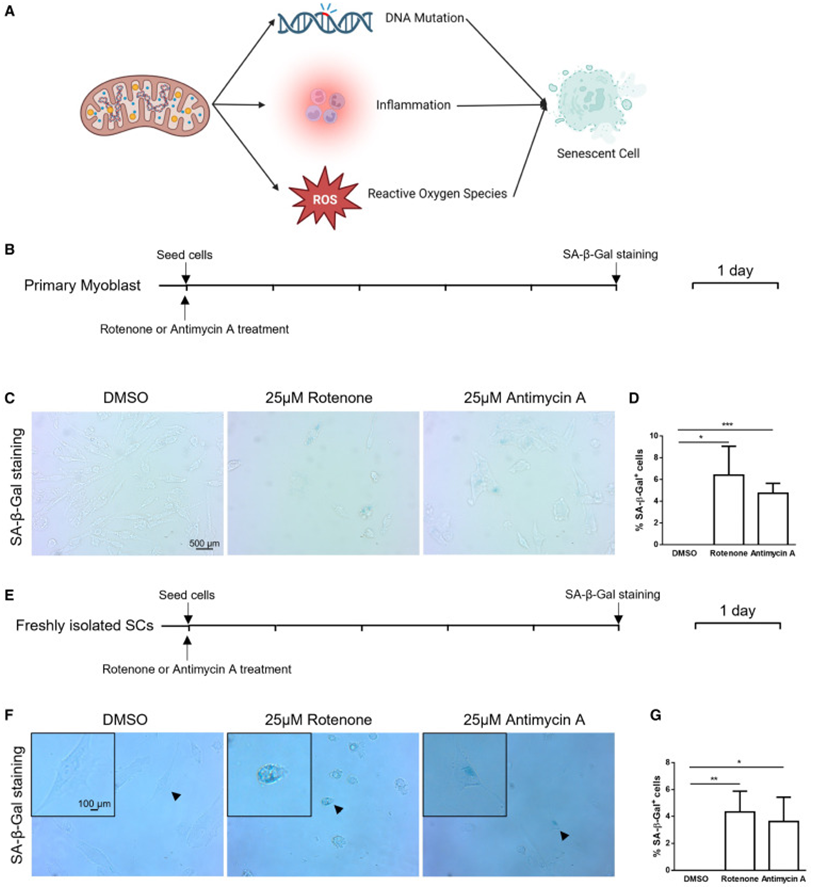
图3 线粒体缺陷会导致细胞衰老
04
衰老过程中多种组织CPEB 4表达下调,且CPEB 4缺失会损害成年小鼠的SC功能
CPEB蛋白家族属于RNA结合蛋白家族,具有4个成员,分别为CPEB 1-4。研究表明,CPEB蛋白家族可通过控制转录调节包括干细胞分化和细胞周期在内的多种生物学过程。值得注意的是,研究者团队此前曾报道CPEB 1可作为转录后调控因子控制SC激活过程中细胞内的蛋白质组景观。于是研究者团队假设衰老会引起该蛋白家族表达失调。。为了验证以上假设,研究者团队首先检测了增龄过程中CPEB 1-4在不同组织中的表达水平,结果发现,CPEB 1-3的表达水平在多种组织中基本没有变化,而CPEB 4在骨骼肌、心肌、肝脏和小肠等组织中的表达水平却随着年龄增长明显下降(图 4A)。通过进一步研究CPEB 4蛋白在成年和老年小鼠肌肉切片中的表达情况,研究者团队发现,衰老确实会导致肌肉中CPEB 4表达水平降低(图 4B-4C)。
基于上述实验结果,研究者团队为了进一步研究SC中CPEB 4的功能便构建了他莫昔芬诱导的肌卫星细胞特异性CPEB 4敲除小鼠,并发现正常情况下敲除CPEB 4会致使SC自身激活延迟,增殖能力受损(图 4 D-F)。通过分析比较CPEB 4敲除小鼠和WT小鼠肌肉损伤七天后的组织切片,研究者团队发现与WT小鼠相比,CPEB 4敲除小鼠再生肌纤维的尺寸明显较小(图 4 G-I),且Pax7阳性的SC数量也有所降低(图 4J-K)。综上,以上结果表明CPEB 4 对受损肌肉的再生修复及维持干细胞池至关重要。
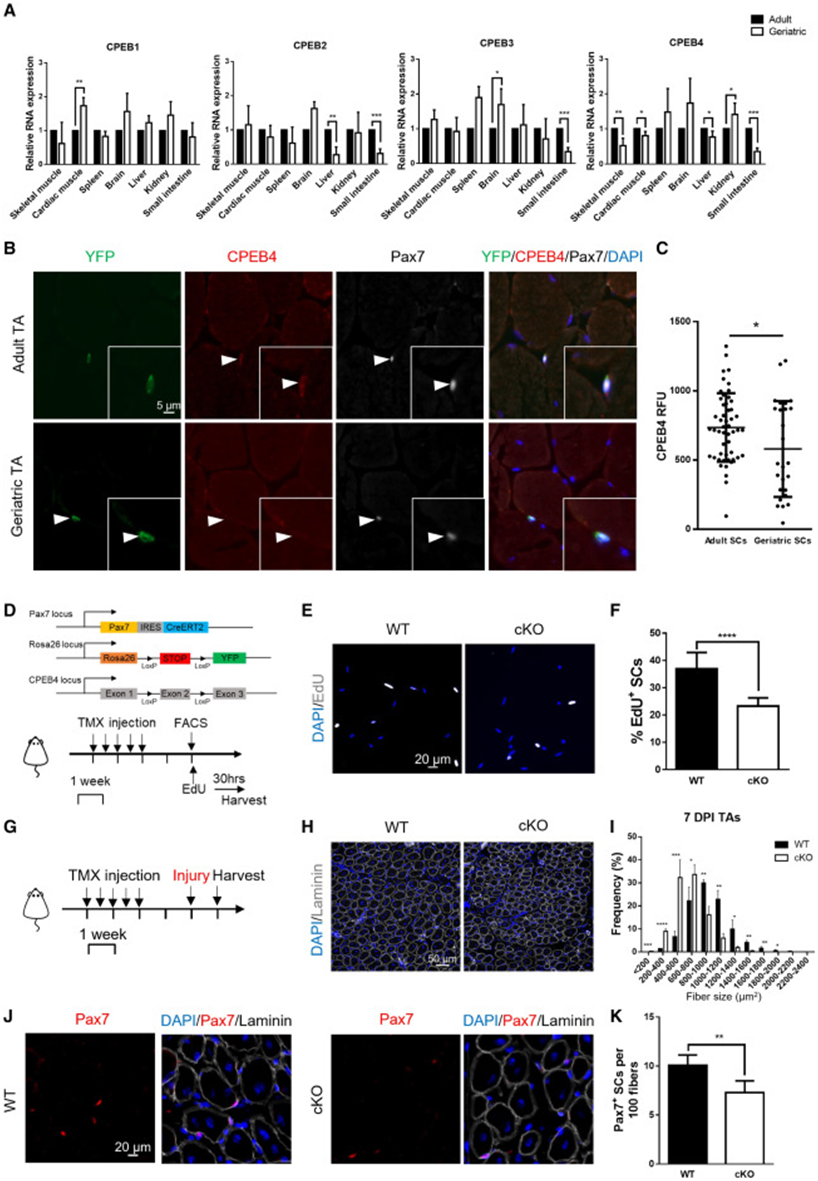
图4 CPEB 4表达水平在衰老小鼠多种组织中下调,且CPEB 4缺失会损害成年小鼠SC功能
05
CPEB 4控制线粒体的翻译景观
作为一种RNA结合蛋白,CPEB 4能与靶mRNA上富含U的胞质多聚腺苷酸化元件(cytoplasmic polyadenylation element,CPE)特异性结合进而调节蛋白质翻译过程。因此,为了进一步探究哪些基因是CPEB 4的功能靶基因,研究者团队进行了CPEB 4-RIP-seq(RNA immunoprecipitation sequencing)并发现CPEB 4能结合许多编码线粒体蛋白的基因。Reactome富集分析显示,与CPEB 4结合的这些基因功能主要富集在“无义介导的mRNA降解”、“翻译”、“线粒体复合物I的生物发生”和“TCA循环”等通路上(图 5 A-C)。有趣的是,KEGG分析还表明,与CPEB 4结合的基因还与“冠状病毒疾病”以及“帕金森病”、“阿尔茨海默病”等与衰老相关的疾病有关(图 5D)。利用结构光照明超分辨显微成像技术(super-resolution structured illumination microscopy,SIM),研究者团队在激活的肌肉干细胞中进一步观察发现,部分CPEB 4蛋白定位在线粒体中(图 5E)。于是,研究者团队进一步猜测CPEB 4是否与线粒体翻译有关?为了验证这一猜想,研究者团队进行了免疫沉淀串联质谱分析,并发现与CPEB 4结合的368个蛋白中,许多都是线粒体核糖体或线粒体蛋白复合物的构成成分(图 5G、5H)。功能网络分析显示,与CPEB 4结合的蛋白可以分为4类,第1类蛋白与线粒体翻译延伸或终止相关蛋白联系密切(图 5I)。综上所述,CPEB 4不仅能靶向编码线粒体蛋白的基因,还与线粒体翻译密切相关。
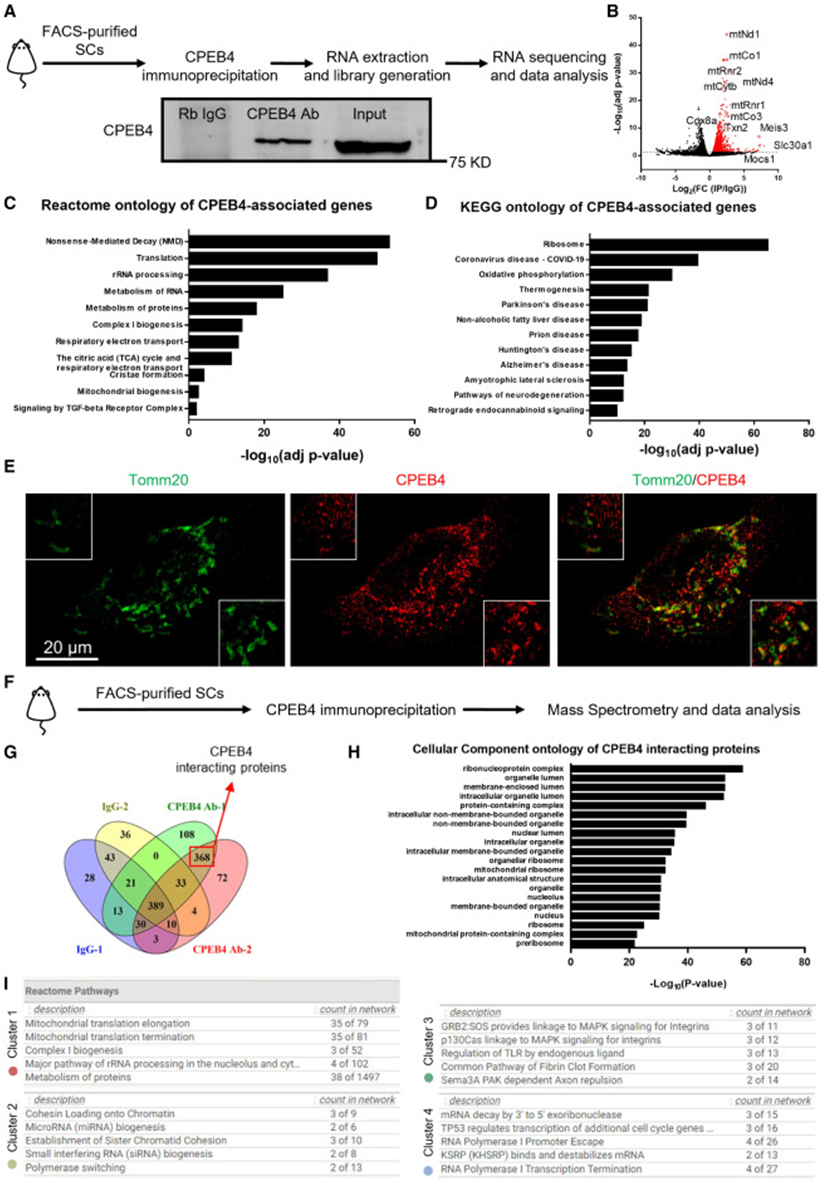
图5 CPEB 4能结合线粒体转录本,并与线粒体翻译机制相互作用
06
CPEB 4是维持线粒体蛋白质组和线粒体活性所必需的
为了直接探究CPEB 4能否调控SC线粒体代谢,研究者团队利用海马能量代谢分析仪检测了野生型小鼠和CPEP 4敲除小鼠SC的线粒体功能,并发现与野生型小鼠相比,CPEP 4敲除小鼠SC线粒体活性、最大氧气消耗速率以及最低氧气消耗速率均显著降低(图 6A-C),更重要的是,研究者团队还发现敲除CPEP 4会使SC线粒体ATP的生成量减少(图 6D)。随后,通过分析CPEP 4敲除小鼠SC蛋白质组学数据(图6 E),研究者团队发现157个蛋白的表达水平在敲除CPEP 4后显著上调,另有807个蛋白则显著下降(图6 F),这些表达降低的蛋白中,有200个归属于线粒体蛋白,其功能与TCA循环和线粒体脂肪酸氧化等有关(图 6G-I)。随后,研究者团队对CPEP 4敲除后表达水平显著上调的157个蛋白作进一步分析发现,这些蛋白主要集中在“衰老相关分泌表型”、“DNA损伤/端粒应激诱导的衰老”等通路(图 6 J-L)。此外,针对蛋白质组数据的PCA分析结果也表明,CPEB 4敲除组与老年SC组相关性更强(图 6 M)。不仅如此,研究者团队还通过关键的β-半乳糖苷酶染色发现,敲除CPEP 4会导致β-半乳糖苷酶阳性的SC数量显著增加(图 6N-O)综上,研究者团队的数据表明CPEB 4是维持SC线粒体活性和蛋白质组稳态所必需的,且CPEB 4可通过调节线粒体蛋白质组的结构和活性来控制细胞衰老。
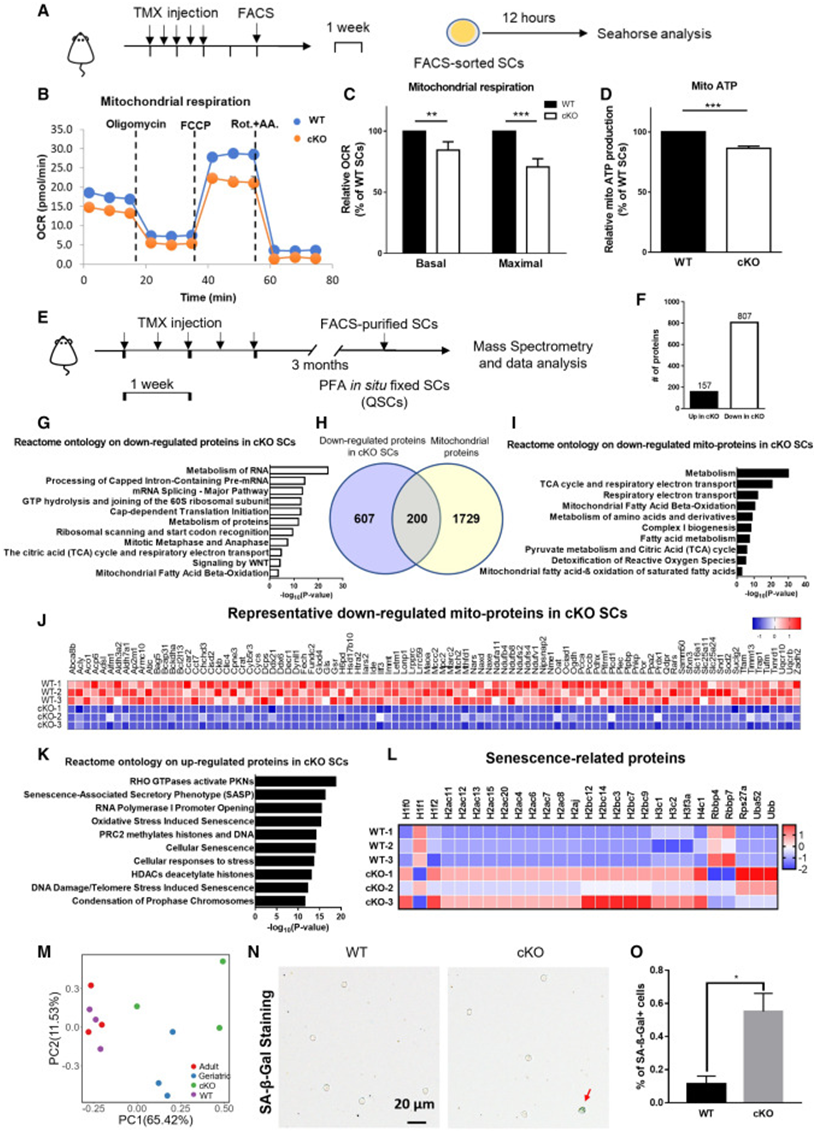
图6 CPEB 4缺失会导致线粒体能量代谢缺陷并诱导细胞衰老
07
过表达CPEB 4不仅可以改善线粒体功能、恢复老年SC功能,还可逆转过氧化氢诱导的细胞衰老
接下来,研究者团队想了解恢复CPEB 4的表达对衰老SC功能的影响。为此,研究者团队分析比较了过表达CPEB 4对衰老SC蛋白质组的影响,并发现过表达CPEB 4促进124个蛋白表达上调,这其中有33个属于线粒体蛋白,功能主要与跨膜转运和ATP合成有关(图 7 A-D)。此外,研究者团队还发现过表达CPEB 4显著增加了衰老SC的最大氧气消耗速率以及最低氧气消耗速率(图 7E-F),并促进了ATP的生成(图 7G)。为了研究恢复CPEB 4的表达能否挽救衰老肌肉的再生障碍,研究者团队将过表达CPEB 4后的老年SC移植到老年受体小鼠的损伤肌肉中。移植实验的结果表明,与对照组相比,仅恢复老年SC中CPEB 4的表达就足以挽救肌肉再生能力并促进新肌纤维得以形成。(图 7H-I)。接着,研究者团队试图了解CPEB 4是否能通过恢复线粒体功能进而抑制细胞衰老。为此,研究者团队在乙酰半胱氨酸(ROS抑制剂)存在的条件下用CPEB 4病毒或对照GFP(green fluorescence protein)病毒感染过氧化氢预处理过的HeLa细胞,然后进行TMRE和SA-β-gal染色,结果发现与对照组相比,在有乙酰半胱氨酸的情况下,过表达CPEB 4的细胞TMRE信号强度最高,且SA-β-gal水平最低(图 7 J-L),以上数据表明,恢复CPEB 4的表达可通过增强线粒体功能来逆转应激诱导的细胞衰老。
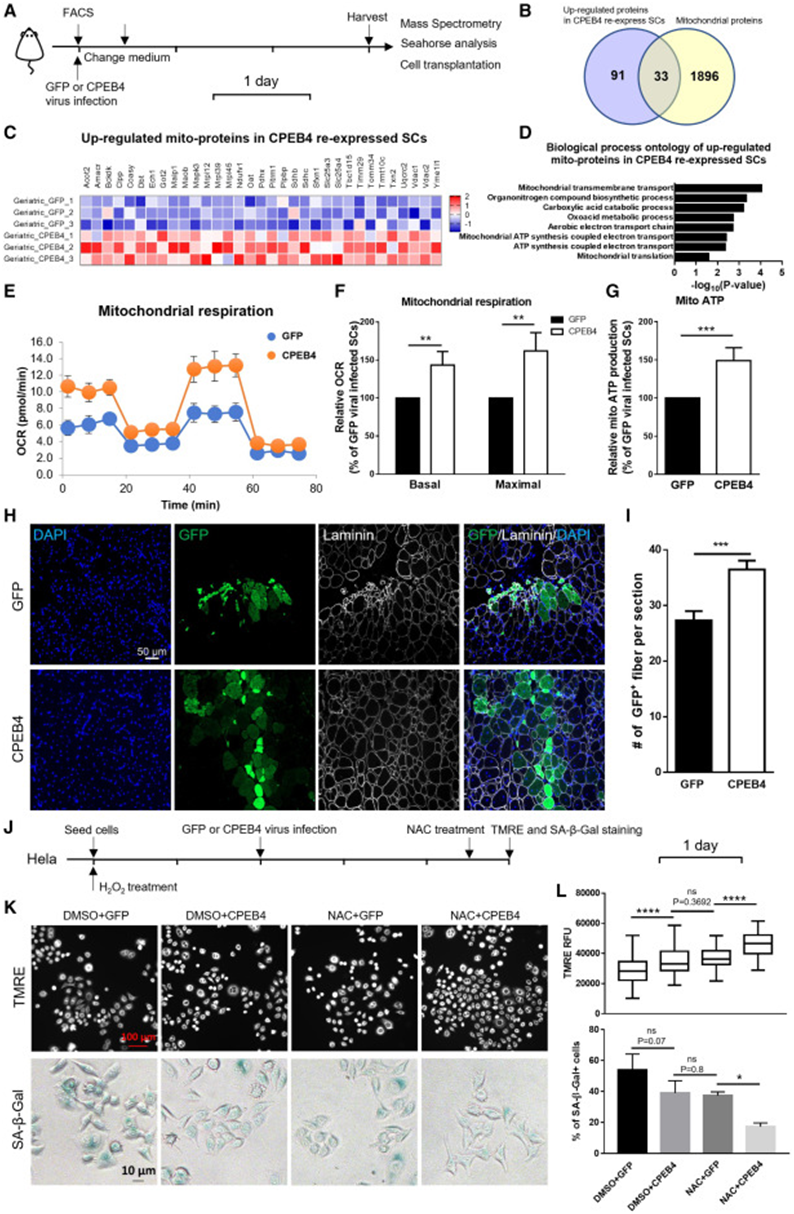
图7 恢复CPEB 4的表达可以恢复线粒体功能,并防止细胞衰老
+ + + + + + + + + + +
结 论
研究者团队发现,在衰老小鼠肌卫星细胞中,RNA结合蛋白CPEB 4表达下调,且CPEB 4可通过控制肌卫星细胞线粒体翻译过程调控肌卫星细胞能量代谢,并最终影响细胞衰老进程。
+ + + + +



 English
English


