文献解读|Cell Discov(13.0):针对 SNRNP200 诱导的剪接失调为糖酵解三阴性乳腺癌提供了免疫治疗机会
✦ +
+
论文ID
原名:Targeting SNRNP200-induced splicing dysregulation offers an immunotherapy opportunity for glycolytic triple-negative breast cancer
译名:针对 SNRNP200 诱导的剪接失调为糖酵解三阴性乳腺癌提供了免疫治疗机会
期刊:Cell Discovery
影响因子:13.0
发表时间:2024.09.17
DOI号:10.1038/s41421-024-00715-7
背 景
三阴性乳腺癌 (TNBC) 是乳腺癌中最具侵袭性的亚型,其特点是复发率和死亡率极高。部分肿瘤(包括 TNBC)表现出广泛的剪接失调和对剪接体完整性的高度依赖性,使它们易受药物剪接抑制。调节特定的剪接基因可选择性地诱导TNBC 中的细胞死亡,而不会影响正常的乳腺上皮细胞,这表明 RNA 剪接是一种很有前途的治疗策略。虽然之前的研究主要集中于探索与细胞代谢紊乱相关的新型可变剪接 (AS)亚型,但对 TNBC 中大多数剪接异常的潜在机制以及 RNA 剪接在细胞代谢中的调控的全面了解仍然不完整。
实验设计
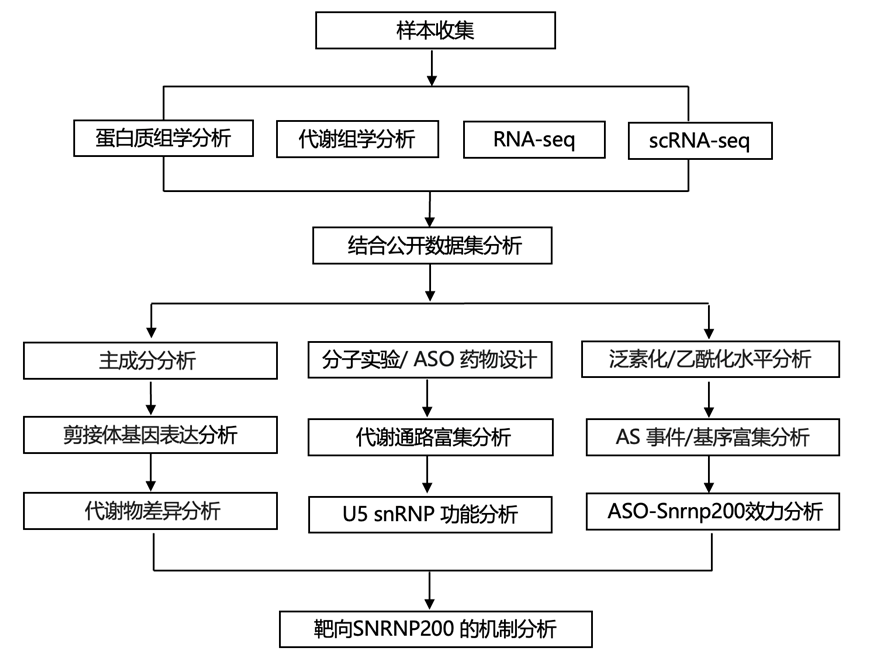
结 果
01
与 TNBC 代谢失调相关的特定 RNA 剪接情况
在本研究中,研究团队利用来自 TNBC 队列的多组学数据来阐明 TNBC 的剪接情况,前期研究已证实了 TNBC 中剪接异常与代谢失调之间的因果关系,发现了三种不同的基于代谢途径的亚型(MPS) :脂肪形成亚型(MPS1,以脂质代谢增强为特征)、糖酵解亚型(MPS2,以碳水化合物和核苷酸代谢升高为特征)和混合亚型(MPS3,以部分通路失调为特征)。研究团队确定 SNRNP200 是糖酵解 TNBC 的关键驱动因素,它促进细胞代谢异常,特别是在乳酸和谷胱甘肽通路中,并赋予对免疫检查点阻断的抵抗力。值得注意的是,他们提出并通过实验验证了 SNRNP200 反义寡核苷酸 (ASO) 和免疫疗法联合治疗糖酵解 TNBC的效果(图1a)。
本研究收集了多组学 TNBC 数据集,其中包括 360 个具有转录组数据的样本、90 个具有蛋白质组学数据的配对样本和 72 个具有代谢组学数据的样本,来研究 RNA 剪接模式及其在 TNBC 代谢失调中的作用。整合基因表达和蛋白质组学分析来检查复旦大学上海肿瘤医院 (FUSCC) 队列中 TNBC 和相应正常组织中的剪接体移位。蛋白质组学分析发现 TNBC 组织中 372 种异常上调的 RNA 相关蛋白,包括 141 种参与 RNA 剪接的蛋白和 42 种核心剪接体成分(图1b)。与 FUSCC 和 TCGA 队列中的非 TNBC 和正常样本相比,TNBC 样本中的核心剪接体基因表达谱不同。t分布随机邻域嵌入 (t -SNE) 进一步强调了 TNBC 亚型之间 RNA 剪接特征的多样性(图1c)。欧几里得距离分析表明,TNBC,特别是 MPS2 亚型,在剪接体基因表达方面表现出显著的转录组多样性(图1d)。糖酵解 MPS2 亚型与更高的肿瘤等级和更差的预后相关,表现出独特的剪接模式和 42 个核心剪接体成分的表达升高,特别是 U1、U2 和 U5 snRNP 基因(图1e)。
代谢组学数据显示,MPS2 肿瘤中糖酵解和核苷酸代谢中间体大量积累,包括乳酸、氧化谷胱甘肽、果糖 1,6-二磷酸 (F-1,6-BP)、腺苷二磷酸 (ADP)、尿苷二磷酸葡萄糖 (UDPG) 和 S-腺苷甲硫氨酸 (SAM)(图1f)。这种积累与负责合成和分解这些代谢物的关键代谢酶 RNA 水平的显著增加相对应,表明 RNA 在调节 TNBC 代谢中起着至关重要的作用(图1g)。总体而言,TNBC 亚型显示出不同的 RNA 剪接模式,糖酵解肿瘤显示上调的核心剪接体基因和独特的 RNA 剪接谱,表明易受剪接抑制。然而,糖酵解肿瘤激活 RNA 剪接以重新编程代谢的机制仍然未知,需要进一步研究 RNA 剪接调控的治疗潜力。
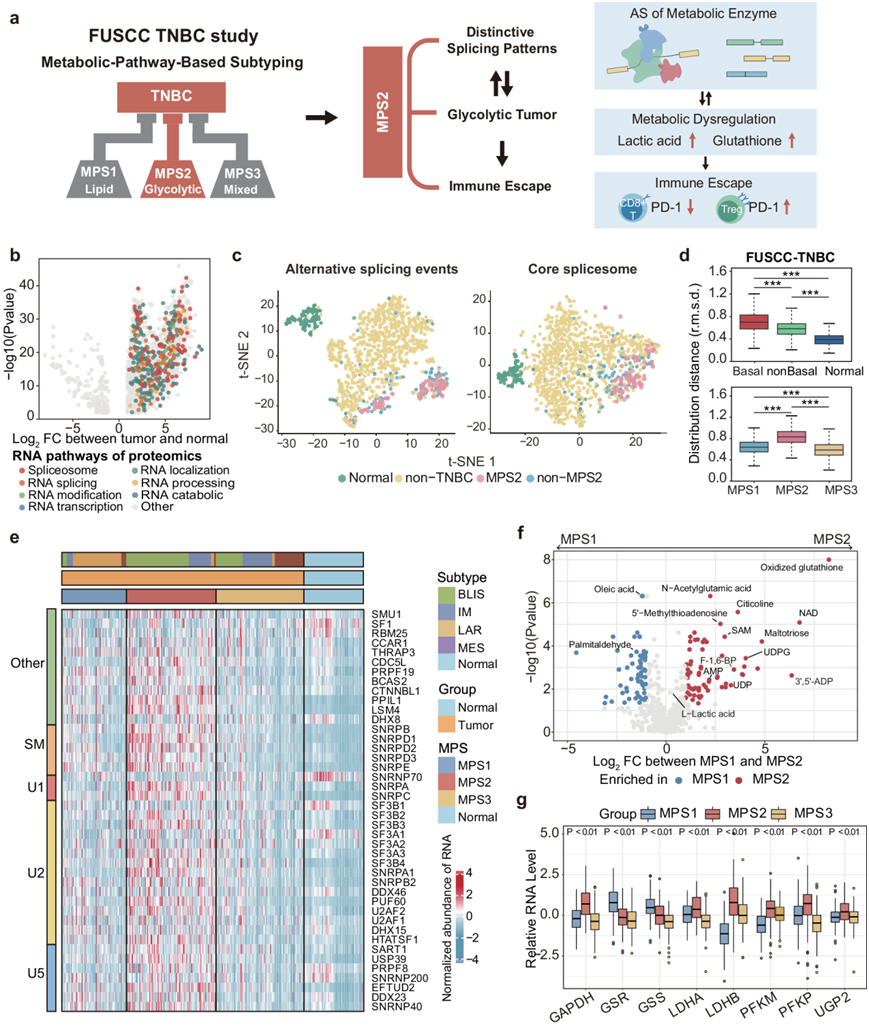
图1. 与 TNBC 代谢失调相关的可变 RNA 剪接的特定情况。
(a) 实验流程。(b) 火山图说明了 TNBC 中显示异常蛋白质水平的 2147 种蛋白质的蛋白质谱。(c) TCGA 样本的 AS 景观。(d) FUSCC-TNBC 队列中基底、非基底和正常组织之间剪接体基因表达的整体差异(上)。FUSCC-TNBC 队列中 MPS 亚型之间剪接体基因表达的整体差异(下)。(e) 热图显示 FUSCC-TNBC 队列中每个单个样本肿瘤中上调的 42 个核心剪接体基因的标准化表达水平。(f) MPS1 和 MPS2 之间 594 种注释代谢物的火山图。(g) GAPDH、GSR、GSS、LDHA、LDHB、PFKM、PFKP和UGP2的 mRNA 表达。
02
确定 SNRNP200 是体外和体内促进 TNBC 糖酵解的关键调节因子
使用加权基因共表达网络分析 (WGCNA),他们鉴定出 1230 个在 MPS2 亚型中表现出显著且协调改变的基因。在这些基因中,有 8 个基因与 42 个上调的核心剪接体蛋白重叠,包括 2 个 U5 snRNP 成分(SNRNP200 和 EFTUD2)和 1 个 U4/U6.U5 tri-snRNP 成分(USP39),表明 U5 snRNP 在糖酵解亚型中具有调控作用(图2a)。为了探索剪接体成分在 MPS2 中的代谢调控,他们研究了它们对葡萄糖变化的反应。对 14 种核心剪接体蛋白的筛选显示,U5 snRNP 成分水平对 MPS2 细胞(MDA-MB-231 和 BT-549)中的葡萄糖波动显著敏感,而 mRNA 水平保持稳定(图2b)。值得注意的是,在不同的葡萄糖条件下,USP39 水平在 RNA 和蛋白质水平上都有所不同,表明存在不同的调控机制。葡萄糖剥夺实验证实了葡萄糖可用性对 U5 snRNP 的影响,重新引入葡萄糖显著提高了蛋白质水平(图2c)。此外,在高葡萄糖条件下(25 mM),U5 snRNP 蛋白的半衰期延长。在 MPS2 乳腺癌细胞中,这些关键蛋白质的表达持续显著增加,其中 SNRNP200 对葡萄糖浓度的波动最为明显(图2b-c)。相比之下,与 MPS2 相比,TNBC 亚型 MPS1(MDA-MB-468)和 MPS3(HCC1143)的 U5 snRNP 蛋白水平对葡萄糖波动的反应变化较小,表明亚型特异性代谢依赖性。核心 U5 snRNP 成分在 MPS2 TNBC 细胞和 TNBC 患者队列中持续上调。基因集变异分析(GSVA)进一步揭示碳水化合物和核酸代谢通路(MPS2 的主要特征)与 U5 snRNP 成分的 RNA 丰度之间存在正相关,而脂质代谢则呈负相关(图2d)。这些发现表明,葡萄糖稳定的 U5 snRNP 蛋白加上 RNA 水平的升高导致了 TNBC 的 MPS2 亚型中观察到的代谢失调。
U5 snRNP 对剪接体活化和活性位点形成至关重要,因为它的催化功能与 PRPF8、SNRNP200 和 EFTUD2 蛋白有关。在 SNRNP200 敲低的细胞中,PRPF8 和 EFTUD2 蛋白水平降低而不影响相应的 mRNA 水平,表明 SNRNP200 不依赖于转录稳定 U5 复合物(图2f)。免疫沉淀 (IP) 试验证实,SNRNP200、PRPF8 和 EFTUD2 之间稳定的蛋白质-蛋白质相互作用不受 U5 snRNA 消化的影响(图 2g)。环己酰亚胺 (CHX) 处理进一步证实 SNRNP200 敲低导致 PRPF8 和 EFTUD2 的半衰期缩短。引入对SNRNP200 sgRNA-1靶向性有抵抗作用的SNRNP200 突变体(SNRNP200 Mut)可恢复蛋白质水平并延长高糖条件下的半衰期,证实了 SNRNP200 在 U5 复合物稳定性中的作用。此外,与正常乳腺上皮细胞(MCF10A)相比,TNBC 细胞,特别是糖酵解亚型的细胞(Hs-578T、BT-549 和 MDA-MB-231),SNRNP200 mRNA 和蛋白质水平显著升高。在临床样本中,SNRNP200 在糖酵解 TNBC 亚型中显著上调,并且与较差的总体生存率相关。
为了研究 SNRNP200 的生物学功能,他们通过 CRISPR-Cas9 技术在 MPS2 细胞中进行了 SNRNP200 敲低实验。克隆形成、EdU 标记和 CCK-8 检测表明,SNRNP200 敲低后,体外 MPS2 细胞增殖显著抑制(图2h)。为了探索 SNRNP200 作为糖酵解 TNBC 的潜在治疗靶点,他们检测了一组针对小鼠Snrnp200的 ASO 药物。在三种设计的 ASO 中,ASO-2 最大程度地降低了 Snrnp200 的表达,而对照 ASO 对小鼠 MPS2 细胞系(4T1)中的 Snrnp200 水平没有影响。用 ASO-Snrnp200处理 4T1 细胞可显著抑制细胞生长并增加体外细胞凋亡。为了评估 ASO- Snrnp200的体内功效,他们通过将 5 × 105 4T 小鼠乳腺癌细胞系注射到用 ASO- Snrnp200处理的小鼠体内来生成 4T1 异种移植肿瘤模型,与 PBS 处理的对照组相比,肿瘤生长显著减少(图2i-j)。通过肿瘤中 Snrnp200 蛋白表达的降低证实了靶向药效动力学活性(图2k)。
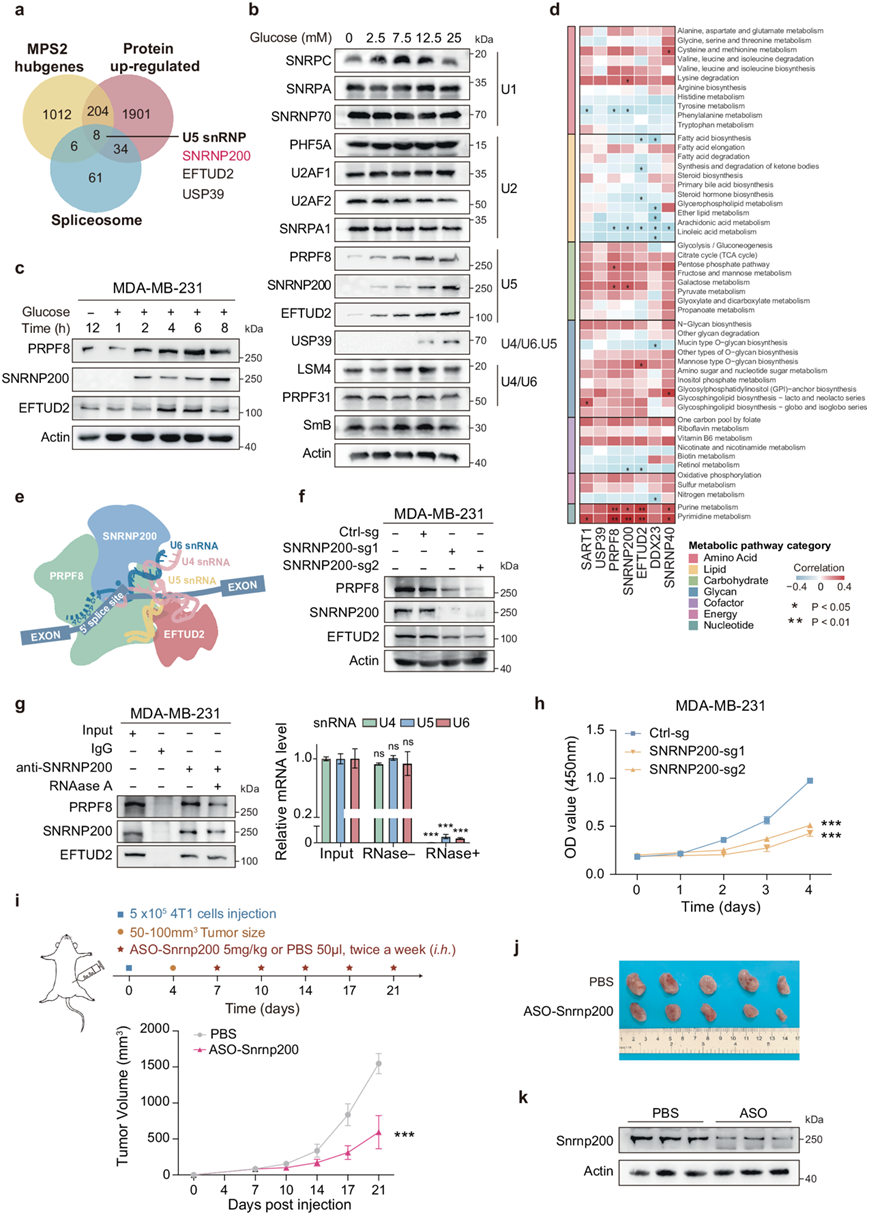
图2. SNRNP200 是糖酵解 TNBC 的关键调节剂,促进体内和体外肿瘤增殖。
(a) 维恩图描绘了 MPS2 中心基因与 TNBC 中蛋白质水平上调的 42 个剪接体基因之间的重叠。(b-c) 免疫印迹分析。(d) 肿瘤中上调的 U5 snRNP 基因的标准化 mRNA 表达水平与 FUSCC-TNBC 队列中代谢通路富集分数之间的关联。(e) 图表描绘了 U5 snRNP 核心成分。(f-g) 免疫印迹分析。(h) CCK-8 增殖分析。(i) 示意图显示了Snrnp200靶向 ASO 治疗时间线:将 4T1 小鼠乳腺癌细胞皮下注射到 BALB/c 小鼠体内。(j) 不同组的肿瘤生长情况。(k) 免疫印迹分析。
03
葡萄糖水平升高会触发 SNRNP200 K1610 乙酰化,保护其免受蛋白酶体降解
在高糖条件下,他们观察到SNRNP200蛋白水平和稳定RNA水平的增加(图2b-c)。鉴于泛素-蛋白酶体系统和自噬在细胞降解中的作用,他们研究了SNRNP200的降解途径。在体内,MPS2细胞中的泛素化分析显示,在高糖条件下,SNRNP200泛素化显著降低(图3a)。蛋白酶体抑制剂MG132或组蛋白去乙酰化酶抑制剂曲古抑菌素A (TSA)可增加SNRNP200蛋白水平(图3b)。然而,自噬抑制剂巴佛洛霉素A1 (Baf-A1)和氯化铵(NH4Cl)以及自噬诱导剂雷帕霉素(Rapa)均不影响MPS2细胞中SNRNP200的水平。这些结果表明,SNRNP200的降解主要通过泛素-蛋白酶体途径,而不是自噬-溶酶体途径。此外,TSA显著增强SNRNP200的乙酰化,同时阻碍其泛素化(图3c-d)。IP-液相色谱-质谱(IP-LC- MS)数据确定PCAF是负责SNRNP200乙酰化的潜在乙酰转移酶(图3e)。通过IP实验进一步验证了SNRNP200和PCAF之间的相互作用(图3f)。此外,PCAF过表达增强SNRNP200乙酰化并抑制其泛素化,而内源性PCAF缺失导致SNRNP200乙酰化显著降低,SNRNP200半衰期显著缩短,随后SNRNP200蛋白水平降低(图3f-k)。值得注意的是,体外实验表明,葡萄糖并不直接影响PCAF和SNRNP200之间的相互作用,但可能影响其他因素的可及性(图3l)。最近的研究表明,乙酰化与乙酰CoA直接相关,并受乙酰CoA可用性的影响。同样,他们观察到细胞内乙酰CoA水平的显著波动与葡萄糖浓度的变化相对应,这与观察到的SNRNP200乙酰化的模式一致(图3l-m)。
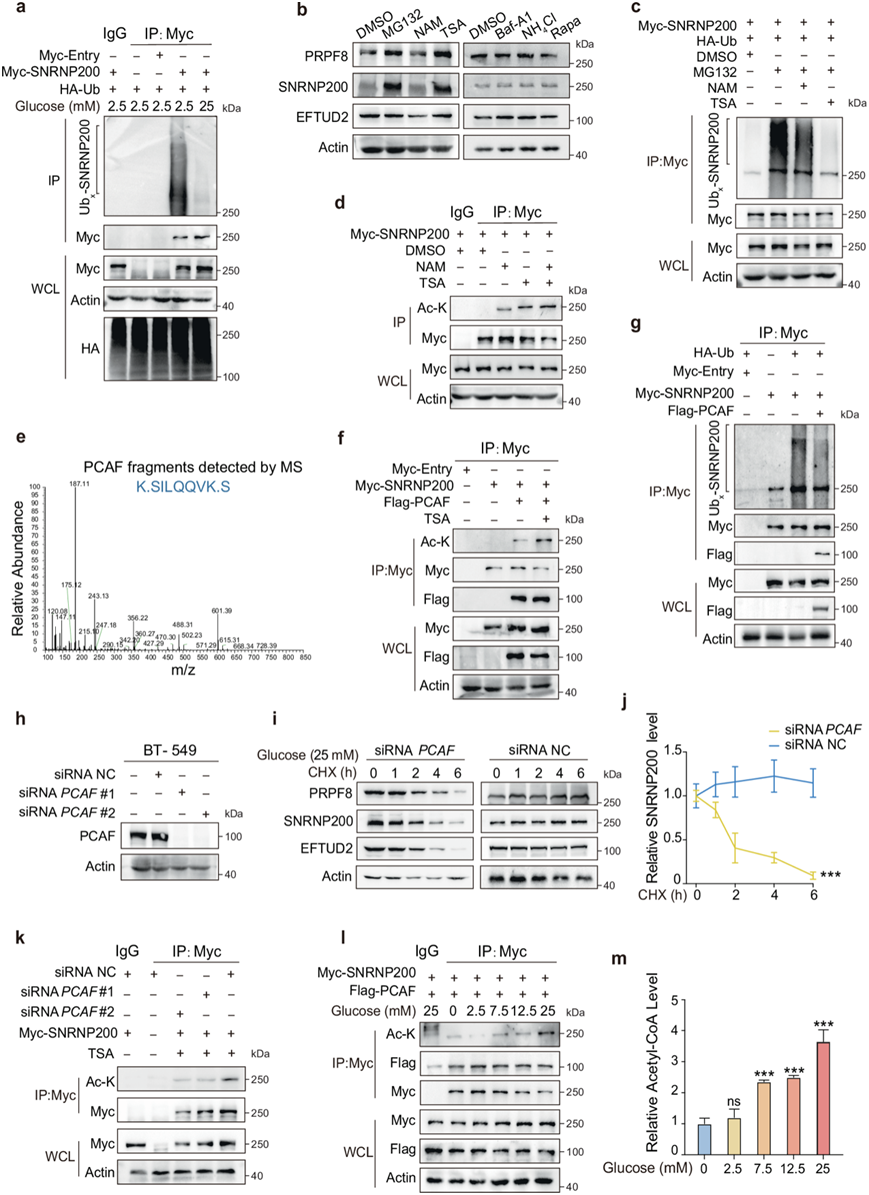
图3. 升高的葡萄糖水平会触发 PCAF 介导的 SNRNP200 乙酰化。
(a) 泛素化分析。(b) 免疫印迹分析。(c-d) 泛素化水平和乙酰化水平分析。(e) PCAF 特征肽的 MS2 光谱。(f) 进行 Co-IP 分析以确定 SNRNP200 和 PCAF 之间的相互作用。(g) 通过使用抗 HA 抗体的 IP-蛋白质印迹法确定 SNRNP200 的泛素化。(h) 免疫印迹分析。(i-j) 通过免疫印迹法分析内源性 SNRNP200、EFTUD2 和 PRPF8 蛋白,并针对肌动蛋白进行定量。(k) 通过免疫印迹法分析 SNRNP200 的乙酰化水平。(l) 通过免疫印迹法分析 SNRNP200 的乙酰化水平,进行 Co-IP 测定以确定 PCAF 和 SNRNP200 之间的动态相互作用。(m) 用指定浓度的葡萄糖处理的 BT-549 细胞中测量乙酰CoA 水平。
04
SNRNP200 在赖氨酸 1610 处的乙酰化保护其免受蛋白酶体降解
IP-LC-MS 数据鉴定出赖氨酸 1610 (K1610) 是 SNRNP200 上的主要乙酰化位点(图4a)。K1610 位于 DEXH 盒结构域(残基 1310-1897)内,在物种间高度保守(图4b-c)。TSA 处理增加了野生型 (WT) SNRNP200 的乙酰化并降低了泛素化,但没有降低 K1610R (未乙酰化)或 K1610Q(模拟乙酰化)突变体的泛素化(图4d)。高葡萄糖稳定了 WT SNRNP200,但没有稳定 K1610R 或 K1610Q 突变体(图4e)。为了确定负责 SNRNP200 的脱乙酰酶,他们研究了三种主要的脱乙酰酶,发现组蛋白脱乙酰酶 5 (HDAC5) 特异性促进 SNRNP200 脱乙酰化(图4f)。HDAC5 过表达降低了 SNRNP200 乙酰化并增加了泛素化(图4f-g)。内源性 IP 测定证实了 MPS2 肿瘤细胞中 SNRNP200 和 HDAC5 之间的相互作用。此外,当暴露于较低葡萄糖浓度(2.5 mM)时,HDAC5 对 SNRNP200 表现出更大的亲和力,随着葡萄糖浓度的增加,结合力降低(图4g)。通过 IP-MS 鉴定出 RNF123 是一种潜在的 SNRNP200 相互作用蛋白。降低葡萄糖会增加SNRNP200泛素化及其与RNF123的结合,RNF123 消耗会在低糖条件下降低SNRNP200泛素化,延长SNRNP200的半衰期(图4h-j)。值得注意的是,低糖有效促进了K48型多泛素化,而没有观察到SNRNP200的单泛素化或非降解性K63型多泛素化。这些结果表明葡萄糖保护SNRNP200免受蛋白酶体降解。
总之,这些数据表明,糖酵解亚型中葡萄糖摄取增加会提高乙酰CoA 水平,从而通过 PCAF 维持 SNRNP200 K1610 乙酰化。这可防止 HDAC5 介导的去乙酰化和 RNF123 介导的 K48 型多泛素化,从而保护 SNRNP200 免受蛋白酶体降解(图4k)。
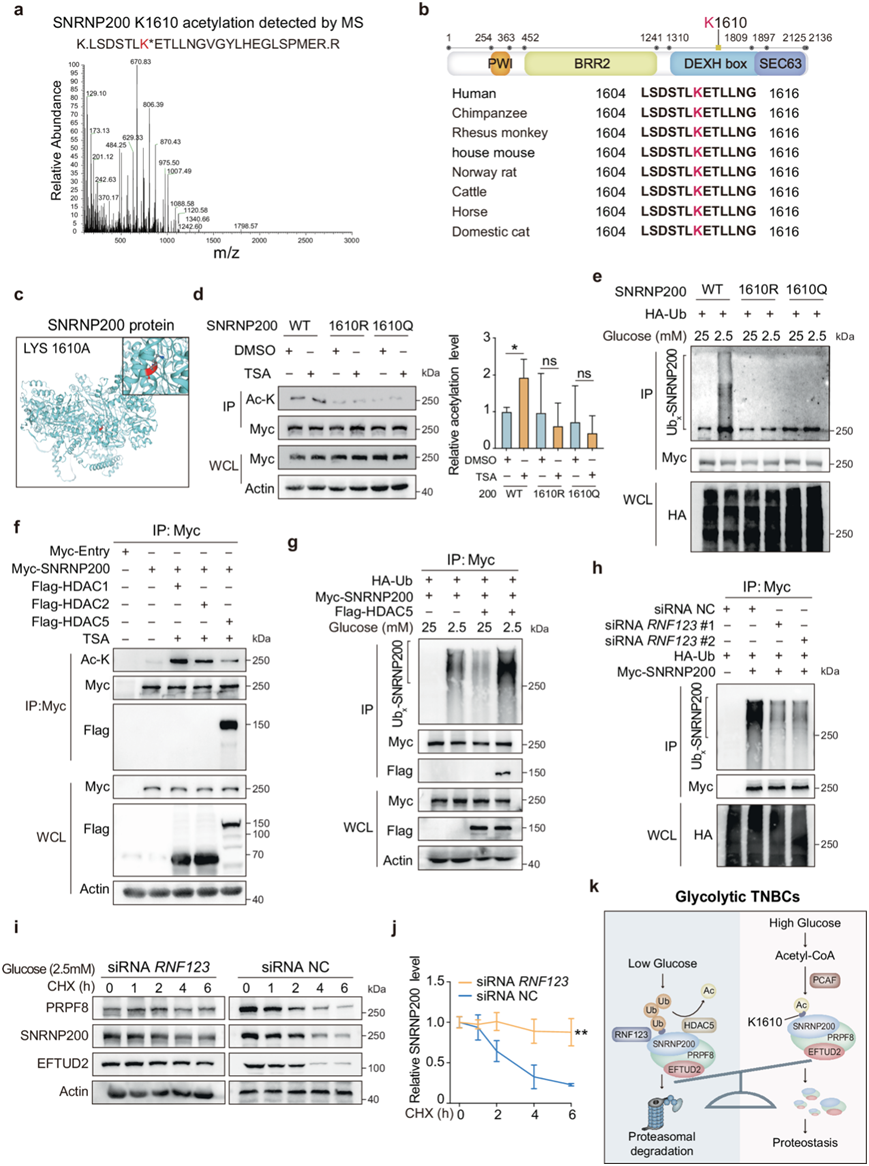
图4. SNRNP200 在赖氨酸 1610 处的乙酰化保护其免受蛋白酶体降解。
(a) 从 HEK293T 细胞中免疫沉淀内源性SNRNP200并通过 LC-MS 进行分析。(b) 不同物种之间 SNRNP200 蛋白质序列的比对。(c) SNRNP200 的二级结构模型。(d) 根据免疫沉淀的 Myc 标签量化 SNRNP200 的乙酰化水平。(e) 通过免疫印迹法揭示泛素化分析。(f) 通过免疫印迹法测定 SNRNP200 的乙酰化水平,进行 Co-IP 测定以确定 SNRNP200 和 HDAC5 之间的相互作用。(g) 通过 IP-蛋白质印迹法测定 SNRNP200 泛素化水平,进行 Co-IP 测定以确定 SNRNP200 和 HDAC5 之间的动态相互作用。(h) 通过免疫印迹法分析泛素化的 SNRNP200 水平。(i-j) 通过免疫印迹分析内源性 SNRNP200、EFTUD2 和 PRPF8 蛋白,并针对肌动蛋白进行量化。(k) 工作模型说明了糖酵解 TNBC 中 SNRNP200 的互斥乙酰化和泛素化。
05
SNRNP200 增强具有弱 5’ 剪接位点的代谢酶编码基因中的 RNA 剪接
本项研究采用转录组分析(RNA-seq)技术来研究 SNRNP200 介导的 TNBC 糖酵解亚型内的剪接调控。SNRNP200 敲低导致 2134 个基因中的 2742 个 AS 事件发生显著改变,包括跳过的外显子 (SE)、替代 5' 剪接位点 (A5SS)、替代 3' 剪接位点 (A3SS)、保留的内含子 (RI) 和互斥的外显子 (MXE)。值得注意的是,292 个基因出现了两个或更多的 AS 事件,突出了 SNRNP200 对转录组多样性的影响。与其他 AS 类型相比,RI 事件上调的比例更大,影响了与细胞周期调控、DNA/RNA 加工和细胞代谢相关的基因中富集的内含子(图5a)。具体而言,参与糖酵解和核苷酸代谢的代谢酶在 SNRNP200 消耗后表现出改变的剪接模式。例如,GAPDH 是一种关键的糖酵解酶,负责将 3-磷酸甘油醛转化为 1,3-二磷酸甘油酸,在 SNRNP200 敲低后表现出 RNA 剪接改变,导致内含子 4 和 5 保留。同样,编码谷胱甘肽 (GSH) 合酶的 GSS转录本在 SNRNP200 耗竭后在内含子 4 中富集(图5b)。半定量 RT-PCR 验证了 SNRNP200 在调节代表性基因剪接中的作用(图5c)。
他们进一步研究了 RI 事件增加的转录本的共同特征,重点研究了 SNRNP200 消耗后保留和正确剪接的内含子之间剪接位点强度的差异。剪接效率低下的内含子往往具有较弱的 5' 剪接位点(图5d),而 3' 剪接位点的区别不太明显。基序富集分析验证了这些结果(图5e)。此外,与非 RI 相比,RI 的 GC 含量略高,类似于相邻外显子中观察到的 GC 水平(图5f)。综上所述,这些结果强调了 U5 snRNP 成分(尤其是 SNRNP200)在调节以弱 5' 剪接位点为特征的代谢酶编码基因剪接模式中发挥的关键作用。
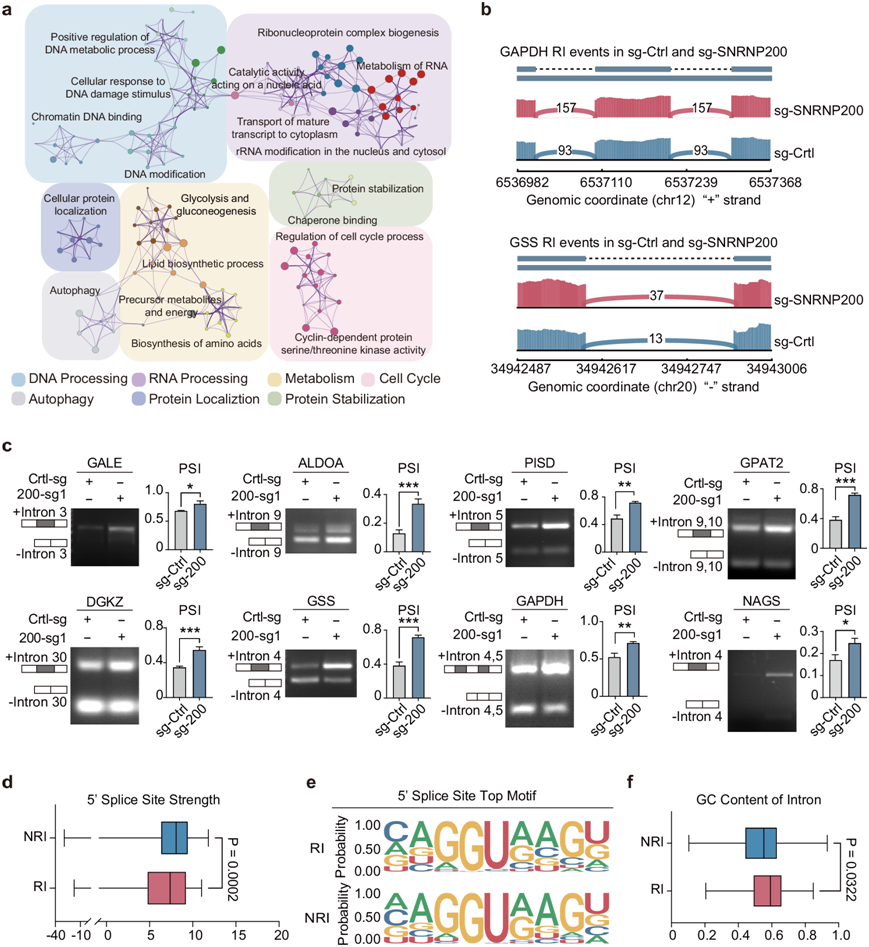
图5. SNRNP200 增强编码具有弱 5' 剪接位点的代谢酶的基因中的 RNA 剪接。
(a) 通过 Metascape 分析并可视化了对照和 SNRNP200 敲低的 MDA-MB-231 细胞中内含子保留转录本的富集网络。(b) GAPDH和GSS 的 RI 。(c) RT-PCR 验证。(d) 对RI 事件进行了 5' 剪接位点强度分析。(e) 同一组基因的基序富集分析表明,最常识别的基序与 RI 和 NRI 的共识 5' 剪接位点序列一致。(f) 通过将每个内含子的 GC 含量除以其相邻外显子的平均值来计算 RI 和 NRI 的 GC 组成。
06
SNRNP200 通过 RNA 剪接增强糖酵解和谷胱甘肽代谢
为了阐明 SNRNP200 通过 RNA 剪接进行代谢调节的作用,他们对 WT 和 SNRNP200 敲低细胞进行了非靶向代谢组学分析。SNRNP200 的消耗导致糖酵解和谷胱甘肽代谢所必需的代谢物显著减少,包括乳酸、氧化谷胱甘肽、UDPG、NAD(烟酰胺腺嘌呤二核苷酸)和 SAM(图6a)。这些代谢物在糖酵解亚型中显著富集(图1f),突出了 SNRNP200 在这些通路中的关键作用。此外,特定脂质的水平,如二酰甘油 (DAG)、磷脂酰乙醇胺 (PE)、磷脂酰丝氨酸 (PS) 和磷脂酰胆碱 (PC),在 SNRNP200 敲低后增加(图6b)。基于通路的差异丰度 (DA) 分析证实了由于 SNRNP200 消耗导致代谢通路发生改变。
他们进一步探讨了编码关键酶的基因中内含子的保留是否对细胞代谢物有明显的影响。SNRNP200 敲低导致ALDOA(内含子 9)、GAPDH(内含子 4 和 5)和GSS(内含子 4)中的内含子保留,从而引起移码突变和过早终止密码子(图6c)。这导致 ALDOA、GAPDH 和 GSS 的蛋白质水平降低(图6d)。临床上,U5 snRNP SNRNP200表达与 TNBC 患者队列中的ALDOA、GAPDH和GSS呈正相关。SNRNP200 耗竭后,糖酵解和谷胱甘肽通路中的代谢物,如乳酸、谷氨酸和谷胱甘肽显著下调(图6f)。SNRNP200 缺陷细胞的细胞外酸化率 (ECAR) 也降低(图6e)。此外,SNRNP200 敲低后,编码脂质通路代谢酶的基因内的内含子,特别是二酰甘油激酶 (DGKZ) 和磷脂酰丝氨酸脱羧酶 (PISD),得以保留。这种保留可能抑制代谢物的转化,导致 PS 和 DAG 的积累。这些结果表明 SNRNP200 调节特定代谢酶编码基因的 RNA 剪接,从而影响细胞代谢。
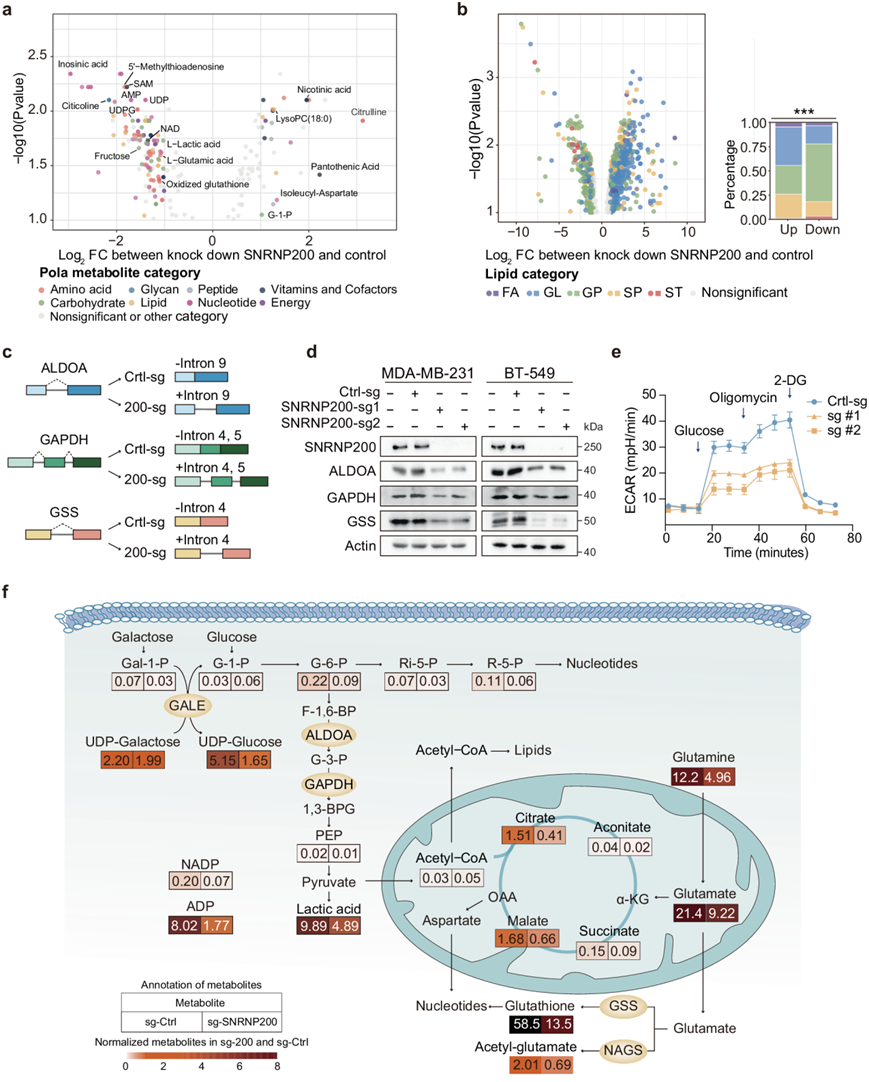
图6. SNRNP200 通过 RNA 剪接增强糖酵解和谷胱甘肽代谢。
(a) 对照和 SNRNP200 敲低的 MDA-MB-231 细胞中极性代谢物的火山图。(b) 对照和 SNRNP200 敲低的 MDA-MB-231 细胞的脂质谱火山图。(c) ALDOA、GAPDH和GSS的RI图像。(d)免疫印迹分析。(e) 对照和 SNRNP200 敲低的 MDA-MB-231 细胞之间的 ECAR 比较。(f) 参与糖酵解、TCA 循环和谷氨酸代谢的代谢基因。
07
ASO-Snrnp200增强糖酵解 MPS2 肿瘤的免疫治疗效果
大量研究已经探索了免疫反应和代谢状态之间错综复杂的联系。最近的研究阐明了调节性 T (Treg) 细胞在通过营养线索塑造免疫反应中的关键作用,它们作为代谢导体发挥作用。谷胱甘肽已成为维持 Treg 功能的关键因素,而高度糖酵解的肿瘤微环境中的乳酸会促进 Treg 细胞中 PD-1 的表达,导致对 PD-1 阻断疗法的耐药性并抑制肿瘤浸润的 CD8+ T 细胞。他们研究了 SNRNP200 是否通过调节乳酸和谷胱甘肽水平来影响免疫功能,以及 ASO-Snrnp200处理是否增强了糖酵解 TNBC 的免疫治疗敏感性。在 MPS2 肿瘤细胞 (4T1) 中,ASO-Snrnp200体外降低了细胞内和细胞外的乳酸和谷胱甘肽水平。ASO-Snrnp200显著降低了体内 4T1 异种移植肿瘤中的 Snrnp200 表达以及乳酸和谷胱甘肽水平(图7a-c)。与 LDH 抑制剂 FX-11 加抗 PD-1 相比,ASO-Snrnp200和抗 PD-1共同处理显著抑制了肿瘤生长(图7d)。联合处理产生了明显的免疫反应,其特征是肿瘤浸润 CD8+ T 细胞比例增加(图7e),同时伴随着这些细胞内 PD-1 表达升高(图7g)。此外,联合治疗组的 CD8+ T 细胞 IFN-γ 和颗粒酶 B 的产生增加(图7h)。联合处理下调了 Treg 中的 FOXP3 和 PD-1 表达(图7f-g),并降低了活化标志物(CTLA-4、ICOS 和 GITR)(图7i)。对肿瘤的 CD8+ T 细胞和 Treg 进行多重免疫组织化学(mIHC)染色一致验证了这些观察结果(图7j)。这些结果强调了 ASO-Snrnp200提高免疫治疗效果的潜力,凸显了其在调节肿瘤微环境动态中的作用,这对治疗结果有益。
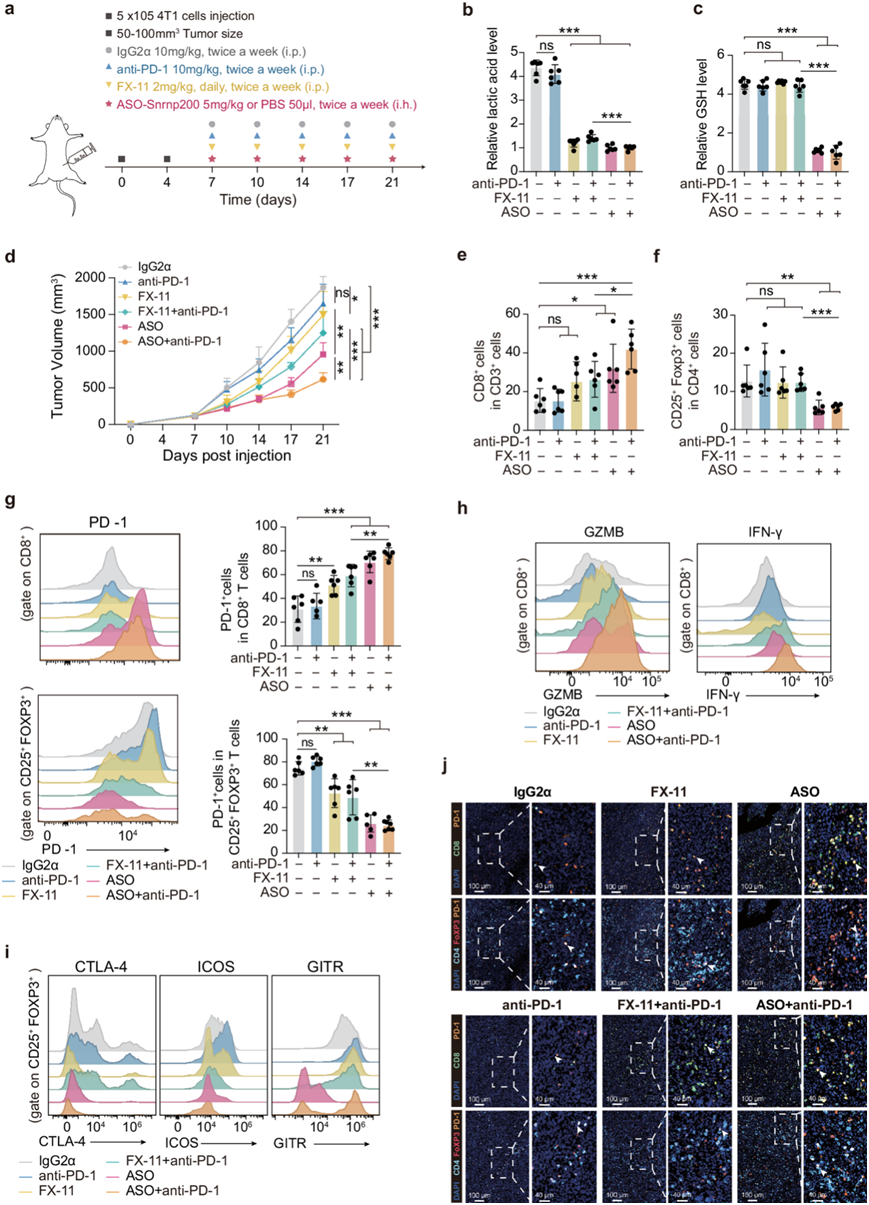
图7. ASO- Snrnp200协同免疫疗法增强糖酵解肿瘤中的抗肿瘤反应。
(a) Snrnp200靶向 ASO 治疗或 LDH 抑制联合抗 PD-1 抗体治疗肿瘤的示意图。(b-c) 六个治疗组的相对乳酸和GSH水平。(d) 不同组内的肿瘤生长情况。(e-f)流式细胞分析。(g) CD8 + T 细胞和 Treg 细胞的 PD-1 表达。 (h) 代表性直方图显示CD8+T 细胞中的 GZMB +和 IFN-γ +细胞。 (i) 代表性直方图显示Treg 细胞中的CTLA4 +、ICOS +和 GITR +细胞。(j) 代表性多重免疫组织化学图像。
08
SNRNP200 水平升高的 TNBC 患者的免疫治疗效果有限
为了评估 SNRNP200 作为接受免疫治疗的 TNBC 患者治疗反应预测因子的潜力,他们在 I-SPY2 新辅助平台试验(ClinicalTrials.gov:NCT01042379)中进行了研究。I-SPY2 试验重点研究高风险早期乳腺癌,主要终点是病理完全缓解 (pCR)。对照组遵循标准治疗方案,包括每周连续使用紫杉醇,然后使用阿霉素/环磷酰胺。在入组的 114 名 TNBC 患者中,29 名接受了帕博利珠单抗加化疗,85 名接受了化疗(图8a)。有趣的是,接受免疫治疗且肿瘤中 SNRNP200 表达高的患者的 pCR 率显著降低,但这种现象在接受化疗的患者中并未观察到(图8b)。此外,SNRNP200 表达较高的 TNBC 表现出糖酵解活性增强、谷胱甘肽代谢增强、CD8+ T 细胞浸润增加(图8c)。
为了进一步研究 SNRNP200 在癌细胞状态中的预测作用,他们整合了两个单细胞转录组分析(scRNA-seq)数据集(图8d)。第一个数据集包括 13 名接受 pembrolizumab 治疗的 TNBC 患者(BioKey 研究,ClinicalTrials.gov:NCT03197389),而第二个数据集包括 7 名未接受过治疗的 TNBC 患者(GSE176078),确定了 22017 个癌细胞(图8e)。他们在单细胞水平上对糖酵解 TNBC 中上调的 42 个剪接体基因(包括 SNRNP200)的表达水平进行了评分。这些基因在单个细胞中的相对得分使得能够识别出表现出显著升高的 RNA 剪接活性的细胞。观察到曲线下面积 (AUC) 值的两个明显峰值,当阈值设为 0.16 时,12873 个细胞显示出较高的 AUC 值。高于阈值 0.16 的癌细胞指定为剪接体基因阳性 (SG+) 细胞,而低于阈值的癌细胞归类为剪接体基因阴性 (SG-) 细胞(图8f)。值得注意的是,在对免疫疗法有反应的患者中,他们观察到更多的 SG+癌细胞数量和 AUC 值(图8g)。一致地,通路富集分析显示 SG+癌细胞中的葡萄糖和核酸代谢升高(图8h)。
总之,这些强调了 SNRNP200 在葡萄糖驱动的代谢失调中的关键作用。升高的葡萄糖水平导致 K1610 乙酰化,稳定 SNRNP200 并增强代谢酶的基因剪接,从而导致乳酸和谷胱甘肽产生增加。使用 ASO 疗法靶向 SNRNP200 可通过激活肿瘤内 CD8+ T 细胞并抑制 Treg 细胞来提高抗 PD-1 疗法的疗效。ASO-SNRNP200与免疫疗法的结合是治疗糖酵解 TNBC 的一个有希望的方式(图8i)。
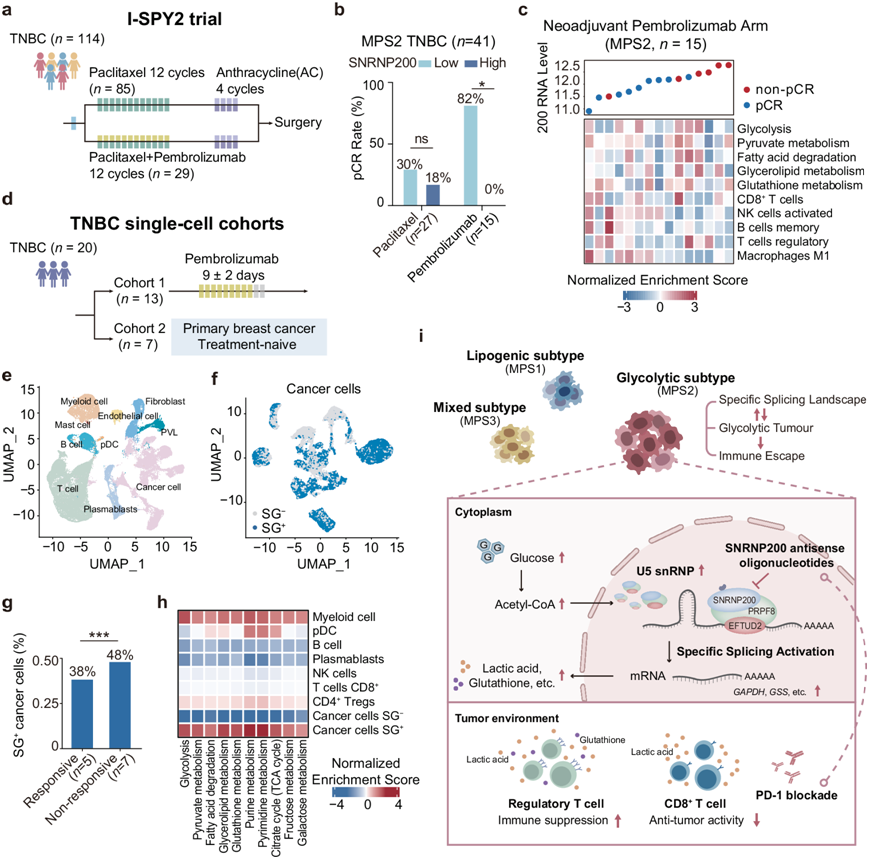
图8. SNRNP200水平升高的TNBC患者的免疫治疗效果有限。
(a) I-SPY2 临床试验概述。(b) 条形图显示 41 名已确认有反应的糖酵解型 TNBC 患者中的 SNRNP200 表达。(c) SNRNP200 的表达、MPS2 上调代谢通路的标准化富集分数和代表性浸润免疫细胞的比例 。 (d) 两个 scRNA-seq 数据集的概览。(e) 70190 个细胞的均匀流形近似和投影 (UMAP)图。(f) 22017个癌细胞的UMAP图根据 AUCell 值分组。(g) 对免疫疗法有反应或无反应的患者中SG+癌细胞的比例。(h) 热图描绘了指示细胞类型中 MPS2 上调代谢通路的标准化富集分数。(i) 示意图描绘了靶向SNRNP200促进糖酵解肿瘤中抗肿瘤免疫反应的机制。
+ + + + + + + + + + +
结 论
本项研究整合TNBC 队列的多组学数据,证明了糖酵解 TNBC 亚型中广泛的剪接失调和剪接体丰度增加。确定 SNRNP200 是葡萄糖驱动代谢重编程的关键介质。从机制上讲,葡萄糖诱导 SNRNP200 K1610 乙酰化,防止其蛋白酶体降解。增强的 SNRNP200 随后促进关键代谢酶编码基因(GAPDH、ALDOA和GSS)的剪接,从而导致乳酸和谷胱甘肽生成增加。使用ASO疗法靶向 SNRNP200 可阻碍肿瘤代谢并通过激活肿瘤内 CD8+ T 细胞同时抑制调节性 T 细胞来增强抗 PD-1 疗法的功效。临床上,较高的 SNRNP200 水平表明糖酵解型 TNBC 对免疫疗法的反应较差。总体而言,本项研究揭示了 RNA 剪接和代谢失调之间错综复杂的相互作用,为糖酵解型 TNBC 的免疫疗法提出了一种创新的组合策略。
+ + + + +



 English
English


