文献解读|EMBO J(9.4):小鼠卵母细胞减数分裂成熟过程中的整体磷酸化景观
✦ +
+
论文ID
原名:The global phosphorylation landscape of mouse oocytes during meiotic maturation
译名:小鼠卵母细胞减数分裂成熟过程中的整体磷酸化景观
期刊:EMBO Journal
影响因子:9.4
发表时间:2024.09.10
DOI号:10.1038/s44318-024-00222-1
背 景
在卵子发生过程中,蛋白质磷酸化会发生变化,参与多种生物学事件。激酶突变引起的底物磷酸化失调可能导致卵母细胞质量下降和女性不孕。因此,平衡的磷酸化和去磷酸化对于产生具有发育能力的卵子是必要的。目前已明确磷酸化是调节蛋白质功能和生物学结果的关键翻译后修饰。然而,对哺乳动物卵母细胞发育的磷酸化动力学仍知之甚少。
实验设计
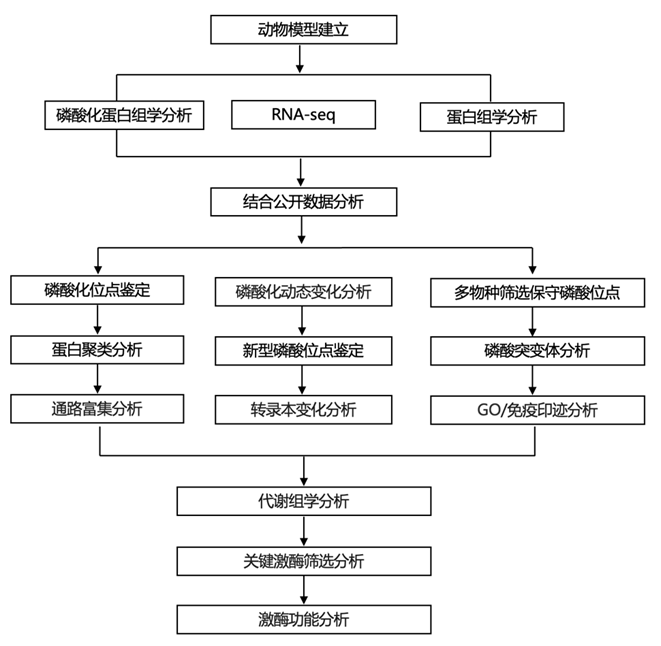
结 果
01
小鼠卵母细胞成熟的深入磷酸化蛋白质组学分析
研究团队在减数分裂成熟过程中的三个关键时间点[停滞的生殖囊泡 (GV) 期、减数分裂恢复的生殖囊泡破裂 (GVBD)阶段和排卵的减数分裂中期II(MII)卵母细胞]分离了大量小鼠卵母细胞,并进行了细胞内磷酸化蛋白质组分析(图 1A,图S1A)。结果显示各阶段样品分离良好,生物学重复之间高度可重复性,以及磷酸化水平的定量范围很广(图S1B-I)。他们对位于 2600 多个蛋白质上的 8090 个不同磷酸位点进行了定量(图 1B)。估计超过 30% 的卵母细胞蛋白质(总共 6700 种蛋白质中的 2268 种磷酸蛋白质)发生磷酸化(图S1J-K)。接下来他们检测了已鉴定磷酸位点的分布模式,观察到最多的是 Ser 磷酸化(86.5%,pS),其次是 Thr(13.0%,pT)和 Tyr(0.5%,pY)(图 1B)。与小鼠器官相比,卵母细胞中的磷酸酪氨酸丰度相对减少,表明生殖细胞中酪氨酸磷酸化的比例可能低于体细胞中的比例。
众所周知,MAPK1(T183/Y185)、MAPK3(T203/Y205)和CDK1(T161)上的活性位点在卵母细胞减数分裂期间会发生磷酸化,而CDK1上两个抑制残基(T14/Y15)的磷酸化在GVBD后会降低,磷酸化蛋白质组学结果完全证实了这些发现(图 1 C-D),表明数据集的可靠性。磷酸化位点的定量分析表明,本研究中鉴定的磷酸化蛋白质中有58%含有两个或两个以上的磷酸化位点,约10% (250/2604) 的蛋白质含有超过6个磷酸化位点,提示多磷酸化在减数分裂的卵母细胞中普遍存在(图 1E)。这些磷酸化位点主要与自噬信号、mTOR 通路和 RNA 加工等相关的蛋白质有关(图 1F)。
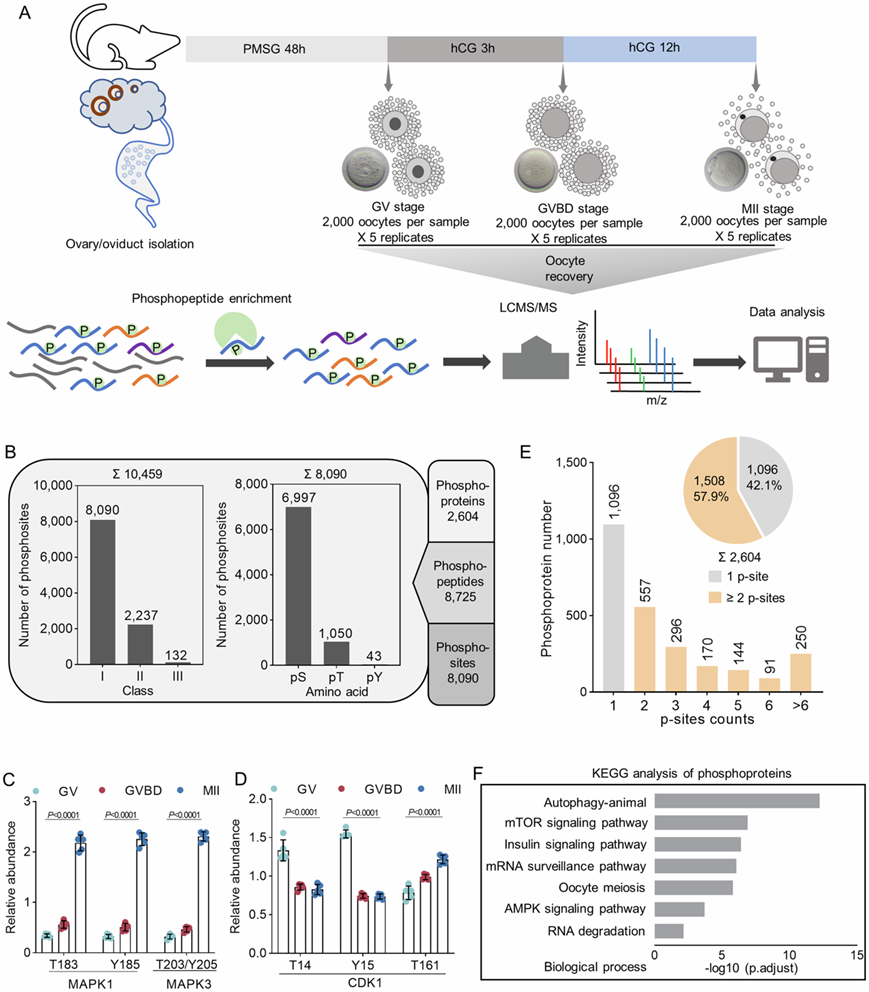
图1. 小鼠卵母细胞成熟的磷酸化蛋白质组学分析。
(A) 在 GV、GVBD 和 MII 阶段体内分离小鼠卵母细胞的图示。(B) 在所有测量样本中鉴定出的磷蛋白、磷酸肽和磷酸位点的数量。(C-D) 卵母细胞成熟过程中 CDK1、MAPK1 和 MAPK3 上关键残基的磷酸化动力学分析。 (E) 条形图和饼图显示每个蛋白质的磷酸化位点数量。(F)条形图显示磷酸化蛋白质组中统计上富集的 KEGG 通路。
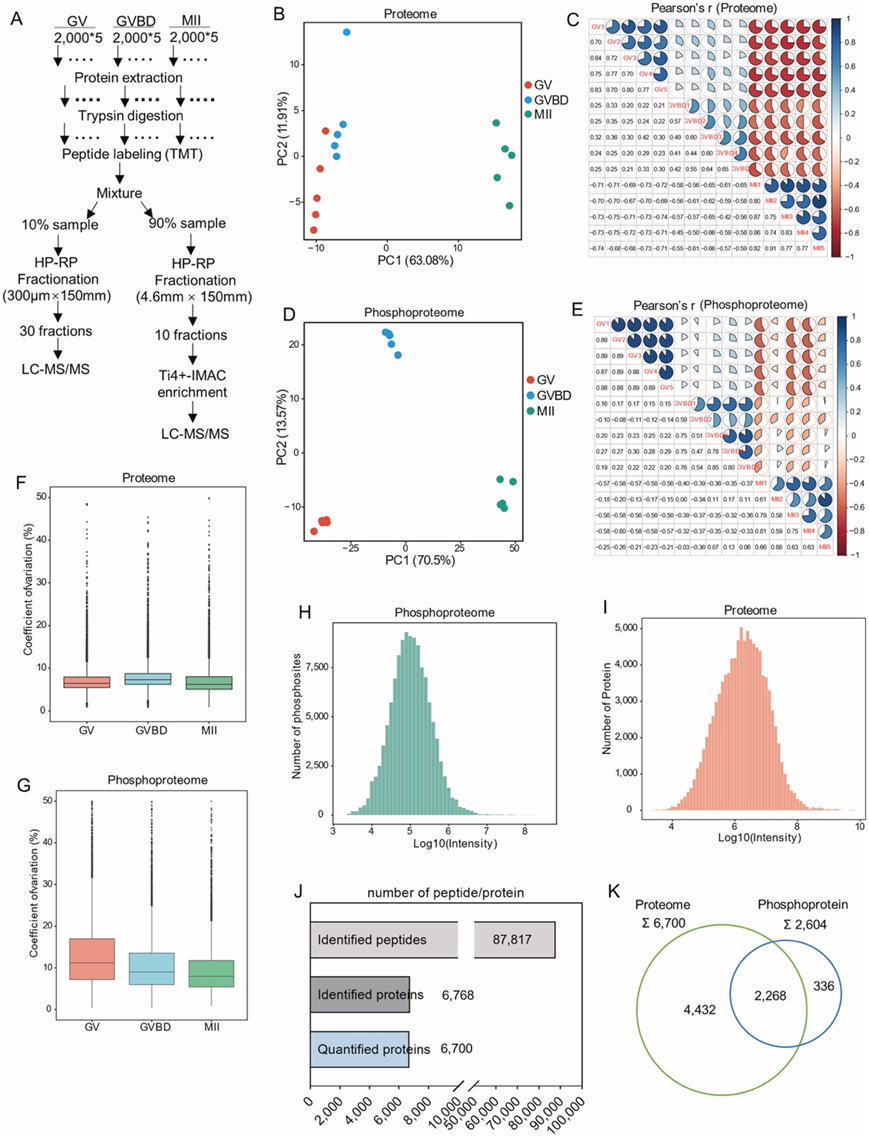
图S1. 小鼠卵母细胞成熟的磷酸化蛋白质组学分析。
(A) 蛋白质组学和磷酸化蛋白质组学的工作流程。(B) 主成分分析描绘了来自 GV、GVBD 和 MII 卵母细胞的五个蛋白质组重复的聚类情况。(C) 热图说明从 GV、GVBD 和 MII 卵母细胞获得的 15 个蛋白质组重复之间的 Pearson 相关性。(D) 主成分分析描绘了来自 GV、GVBD 和 MII 卵母细胞的五个磷酸化蛋白质组重复的聚类情况。(E) 热图说明从 GV、GVBD 和 MII 卵母细胞获得的 15 个磷酸化蛋白质组重复之间的 Pearson 相关性。(F) 来自 GV、GVBD 和 MII 卵母细胞的每个阶段样本的蛋白质组的变异系数箱线图。(G) 来自 GV、GVBD 和 MII 卵母细胞的每个阶段样本的磷酸化蛋白质组的变异系数箱线图。(H-I) 总磷酸肽和肽强度按升序排列。(J)条形图显示已鉴定的肽(上)、蛋白质(中)和定量蛋白质(下)的数量。(K)蛋白质和磷蛋白的重叠。
02
卵母细胞成熟过程中的磷酸化动力学
虽然已有报道称在卵母细胞成熟过程中某些蛋白质的磷酸化发生了变化,但整个磷酸化蛋白质组变化的确切动力学仍然未知。在成熟过程中,近 85% 的磷酸化蛋白质上超过 75% 的磷酸位点受到显著调控(图2A-B)。在整个减数分裂过程中,上调的磷酸位点和磷酸化蛋白质的数量有所增加,其中大多数调控发生在磷酸化水平,而蛋白质丰度的变化不太明显。此外,受调控的磷酸化蛋白质组和改变的蛋白质组之间只有 295 种蛋白质重叠。与蛋白质组数据相比(图2 C-D),磷酸化位点变化幅度的分布更广泛 。
为了进一步表征减数分裂卵母细胞中的磷酸化蛋白质组波动,他们使用模糊 c 均值算法将受调控的磷酸化位点根据其动态分为五个聚类(图 2E)。聚类1 位点的磷酸化在成熟过程中呈稳步下降趋势,主要富集在组蛋白泛素化(即 CUL4B-T106、HUWE-T1905)和蛋白质去磷酸化(即 CDC25B-S319、DUSP7-S220)中(图 2F)。聚类2 内的位点在减数分裂恢复时磷酸化升高,随后急剧下调(图 2G),具体涉及核分裂(即 CEP192-T674、CENPE-S2414)和核孔组织(即 NUP98-T553、NUP133-S44),这两者对于生殖囊泡分解都至关重要。相反,聚类3、4 和 5中的磷酸位点在细胞周期(即 CHEK1-S301。BRCA1-T1199)、细胞骨架组织(即 MYO5A-S600、KIF23-S125)和 mRNA 加工(即 PABPC1L-S109、SRSF2-S189)中富集(图 2H-J),在排卵的卵母细胞中表现出显著上调。此外,在卵母细胞中鉴定出的 2604 种磷蛋白存在于大多数蛋白质复合物的不同亚基上,突出显示与磷酸化信号相关的分子级联。例如,在 MAPK 信号通路(B-Ksr1-MEK-MAPK-14-3-3 复合物)、组蛋白修饰(Ikaros 复合物)以及后期促进复合物的成分中检测到了磷酸化的显著变化。总的来说,卵母细胞中的蛋白质磷酸化在成熟过程中是高度动态的,与蛋白质丰度无关,是发育控制的关键层。
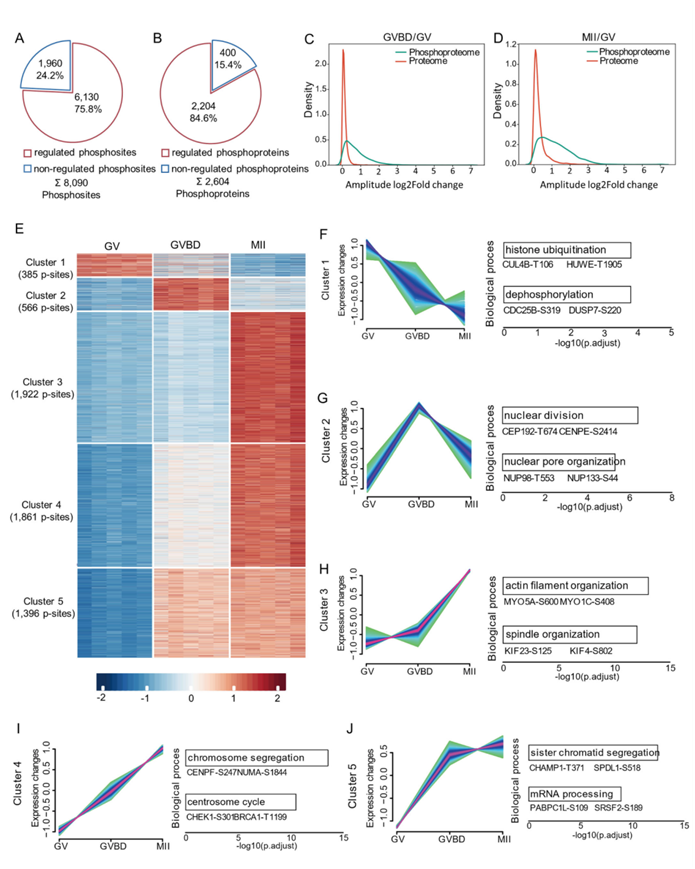
图2. 减数分裂成熟过程中的磷酸化动态。
(A) 饼图显示卵母细胞成熟过程中受调控的磷酸位点的百分比。(B) 饼图显示卵母细胞成熟过程中受调控的磷蛋白的百分比。(C-D) 密度图比较受调控的磷酸蛋白质组和相应蛋白质组的振幅。(E) 热图说明卵母细胞成熟过程中受调控的磷酸位点的动态变化。(F-J) 五个不同的受调控的磷酸蛋白质组聚类。
03
小鼠卵母细胞中新磷酸位点的鉴定
卵母细胞在女性生殖中发挥着独特的作用。鉴定卵母细胞特异性磷酸化位点将有助于了解其特殊的发育程序。值得注意的是,与小鼠多组织磷酸化蛋白质组数据和 PhosphoSitePlus 数据库相比,他们发现卵母细胞中 931 个蛋白质上超过 22%的磷酸位点在其他组织或细胞中未曾检测到(图 3 A-B)。其中,他们观察到大量含有新磷酸位点的表观遗传调控因子(即 DNA 甲基化修饰剂和组蛋白修饰酶)(图 3C-F)。具体来说, 在低复杂度域内鉴定出TET3上的一个新磷酸位点(S1522)(图3C),这对于保护卵母细胞基因组免于氧化去甲基化至关重要。DNMT1、UHRF1和DPPA3与卵子发生过程中DNA甲基化的建立和维持有关。这些数据揭示了其功能域中的几个新磷酸位点,例如DNMT1上的S311/356/S882(图 3D)、UHRF1上的S18/501/502(图 3E),以及DPPA3上的T29和S124。此外,他们还发现了许多以前从未在组蛋白甲基化擦除器(erasers)(KDM6B-S973)和写入器(writers)(KMT2B-S352、KMT2C-S679/S4059 和 KMT2D-S652/S655)上报告过的磷酸位点。上述观察结果表明,这些新的磷酸位点很可能满足卵母细胞发育中表观遗传控制的独特调控要求。
许多磷酸位点也是首次在卵母细胞特异性表达蛋白中发现的(图 3G-J),例如 NOBOX 上的 S86/92 和 T176、ZAR1L 上的 S257/183/144 和 T149、OBOX2 上的 T44 和 S40/47 以及 OBOX5 上的 S276/279。特别地,他们注意到皮层下母体复合体(SCMC)内的成分通常经历多位点磷酸化,以 NLRP5 为例,其具有 24 个不同的磷酸位点(图 3K)。母体效应物上这些特定位点的动态磷酸化变化可能充当关键的信号机制,协调卵子发生和胚胎发育所必需的下游分子事件。除了之前发现的磷酸化位点(例如 YBX2-T67/78),还检测到了大量新的磷酸化位点(例如 YBX2-S203/206/351、CUL4B-S155/147、CSNK1A1-T321 和 SRPK1-S37)(图 3L-O),这些卵母细胞特异性磷酸化位点的功能值得深入探索。
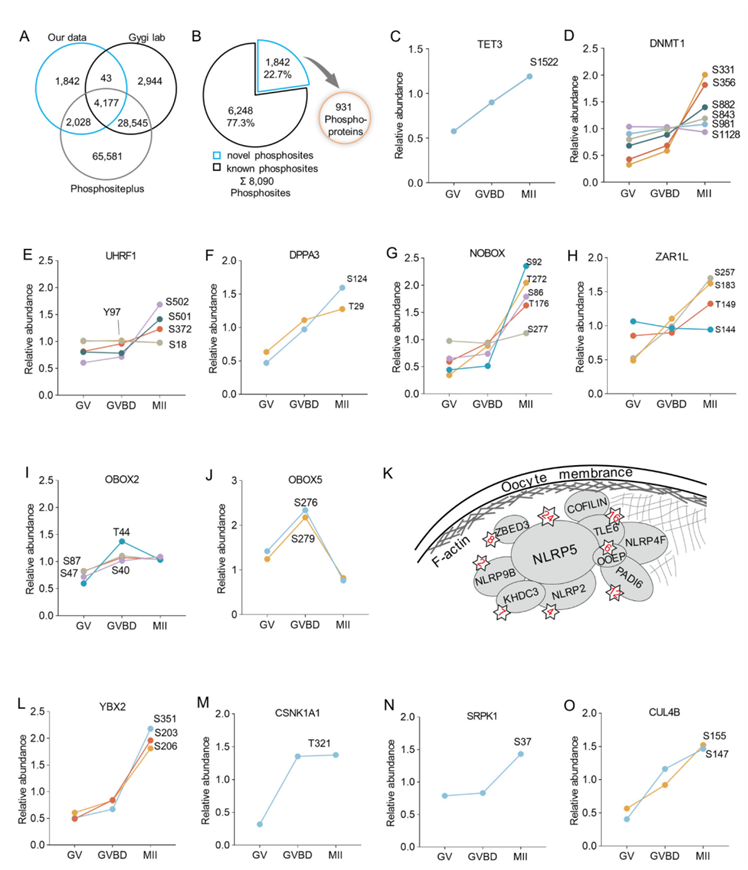
图3. 在小鼠卵母细胞中发现的新型磷酸位点。
(A) PhosphoSitePlus 数据库中磷酸化位点的重叠。(B) 饼状图显示在卵母细胞及其相应蛋白质中鉴定出的新磷酸位点的百分比。(C-J) 不同阶段代表性蛋白质中新磷酸位点的相对丰度。(K) 核心皮层下母体复合体的示意图,其中标明了每个成分的磷酸位点数量。(L-O) 不同阶段代表性蛋白质中新磷酸位点的相对丰度。
04
BTG4 磷酸化是母体 mRNA 降解的必要条件
BTG4 是一种母体效应物,已证明负责卵母细胞 mRNA 的降解。在这里,他们在 BTG4 上鉴定了三个连续的新磷酸位点(T145、S146 和 S147),表明在卵母细胞成熟过程中磷酸化逐渐增加(图 4A)。预计这三个位点在多个物种中是保守的,并且位于以易受磷酸化影响而闻名的内在无序区域 (IDR) 内(图 4 B-C)。为了确定磷酸化的功能参与,构建了 BTG4 突变体,其中 T145、S146 和 S147 残基(Btg4 wt)通过定点诱变变为丙氨酸(Btg4三重突变:Btg4 tm)(图4D)。接下来,进行转录组测序(RNA-seq)和 poly(A) 尾分析(PAT),以评估磷酸突变体表达时卵母细胞中的转录本变化(图 4E)。poly(A)尾在对照成熟卵母细胞中缩短,但值得注意的是,这一过程在Btg4tm卵母细胞中发生阻断(图4G-I),因此相应的转录本抵抗降解(图4J-K)。与此观察结果一致,RNA-seq分析显示,与Btg4wt卵母细胞相比,Btg4tm卵母细胞中的转录本显著上调。重要的是,在Btg4tm卵母细胞中增加的2802个转录本中,有2461个(87.8%)在正常的MII卵母细胞中发生降解(图4L)。此外,超过50%的这些上调转录本在Btg4tm和Btg4ko卵母细胞之间重叠(图4M)。
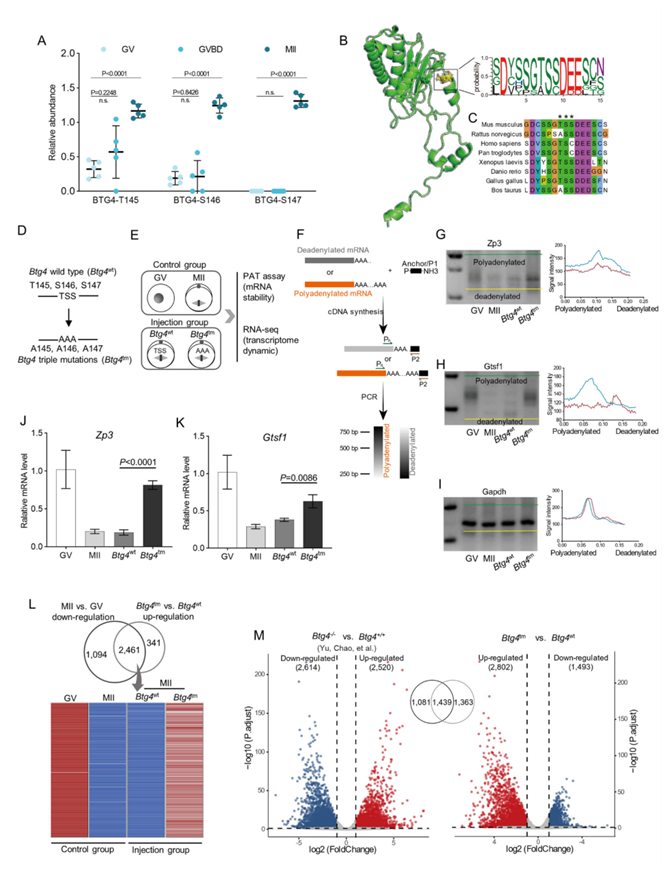
图4. BTG4磷酸化是母体mRNA降解所必需的。
(A) 卵母细胞成熟过程中 BTG4 蛋白上三个磷酸位点(Thr145、Ser146 和 Ser147,缩写为“TSS”)的相对丰度。(B) Robetta 预测了 BTG4 蛋白结构,TSS 磷酸位点用黄色残基表示。(C) 不同物种之间 BTG4 磷酸化聚类的对齐。(D) BTG4-TSS 磷酸化突变设计示意图。(E) 样品采集和 RNA -seq示意图。(F) 显示 mRNA poly(A) 尾 (PAT) 检测策略的图表。(G-I) PAT 检测显示对照组(GV 和 MII 卵母细胞)和注射组( Btg4 wt和Btg4 tm卵母细胞)中所示转录本的 poly(A) 尾长度变化。 (J-K) 通过 RT-qPCR 确定对照组(GV 和 MII 卵母细胞)和注射组(Btg4 wt和Btg4 tm卵母细胞)中所示转录本的相对丰度。(L) 热图分别显示 MII与GV 卵母细胞中下调的转录本以及Btg4 wt和Btg4 tm卵母细胞中异常积累的转录本。(M) 火山图显示差异表达的基因。
05
在多个物种的卵母细胞中发现保守的磷酸位点
为了发现不同物种卵母细胞中保守的磷酸位点,他们对已发表的数据集和本研究结果进行了比较分析(图 5A)。首先,选择了磷酸化肽(磷酸位点两侧的 13 个氨基酸残基),与至少另外两个物种的小鼠卵母细胞数据相比,其序列相似性大于 69%。在卵母细胞中共鉴定出 56 个蛋白质上的 76 个高度保守的磷酸位点(图 5B)。他们发现了在不同物种中对卵母细胞成熟至关重要的磷酸位点(MAPK1-T183、ARPP19-S62 和 CDK1-T14/Y15)。另一方面,他们还发现一些在四个物种中完全保守的磷酸位点,这些位点在卵母细胞中从未报道过(即HDAC2-S422/S424,NUP98-S888,PDCD4-S457)(图 5C-E)。这些结果表明这种进化上保守的磷酸化机制可能参与了卵母细胞中的关键事件。GO分析进一步表明,具有保守磷酸位点的卵母细胞蛋白主要富集在细胞周期、代谢、翻译和激酶活性等方面(图 5F)。例如,许多保守的磷酸位点位于激酶的活性残基内,表明其在酶调控中的重要性。在接下来研究中,他们确定了这些保守的磷酸位点在小鼠卵母细胞中是否具有功能。其中,MDH1-S241(图 5G)和RPL12-S38因其高度保守性和潜在参与代谢和翻译控制而备受关注。
均衡的代谢对于产生高质量的卵母细胞至关重要。由于卵母细胞成熟过程中代谢框架发生了重大重塑,许多发生在代谢酶上的保守磷酸化事件变得尤为重要。MDH1 是一种高度保守的蛋白质,在苹果酸天冬氨酸穿梭中发挥作用(图 5 G-H)。此外,Ser241 位于 MDH1 的关键功能域内,包括 NAD 结合域、苹果酸结合域和二聚体界面。为了研究 MDH1 磷酸化的作用,将 Ser241设计为 Ala(Mdh1mut)的突变引入(图 5 I-J),然后对对照组(Mdh1wt)和磷酸突变组(Mdh1 mut)进行代谢组分析(图 5K)。MDH1 突变后共鉴定出 15 种差异代谢物(图 5L)。如预期的那样,苹果酸-天冬氨酸穿梭的破坏导致Mdh1mut卵母细胞中的草酰乙酸显著减少和苹果酸积累。更重要的是,Ser241 磷酸化突变显著改变了天冬氨酸的代谢通量,促进了相关氨基酸(即苏氨酸、谷氨酰胺、胍基乙酸和天冬酰胺)的合成(图 5 M-N)。总之,保守的 S241 残基处的磷酸化似乎充当了 MDH1 活性的调节“开关”,参与了卵母细胞内的特殊代谢编程。
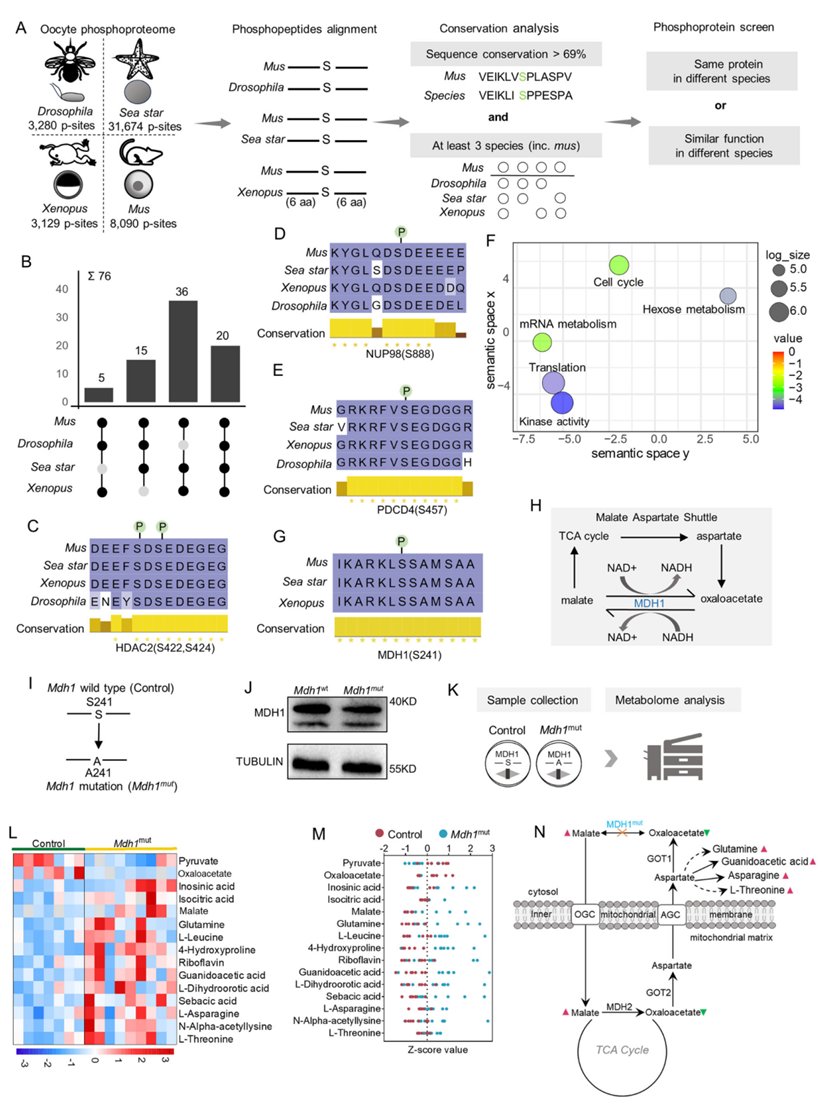
图5. 多个物种中保守的磷酸位点。
(A) 在四个物种中筛选保守磷酸位点的过程的流程图。(B) 显示在四个物种中已鉴定出的 76 个保守磷酸位点的翻转图。(C-E) HDAC2、NUP98和 PDCD4中保守磷酸位点周围序列的比对。 (F) 具有保守磷酸基的蛋白质的REVIGO聚类。(G) MDH1 中保守磷酸位点(S241)周围序列的比对。(H) 苹果酸-天冬氨酸穿梭示意图。 (I) MDH1 磷酸突变体设计的示意图。(J) 免疫印迹分析。(K) 示意图显示代谢组学分析的样本收集。(L) 热图显示Mdh1 mut组与对照组之间 15 种差异代谢物的动态。(M) 15 种差异代谢物的 Z 分值图。(N) 苹果酸-天冬氨酸穿梭、TCA 循环和相关代谢通路的示意图。
06
卵母细胞是富含激酶的储存库
目前基于kinmap数据库共鉴定出536种激酶,存在于不同组织和细胞中。值得注意的是,从蛋白质组和磷酸化蛋白质组分析中,小鼠卵母细胞中可检测到224种激酶。其中128种激酶发生磷酸化,而其中105种激酶的磷酸化在卵母细胞成熟过程中受到动态调控(本文称为调节性激酶)(图 6A)。CAMK(钙/钙调蛋白依赖性蛋白激酶)和 AGC(cAMP 依赖性、cGMP 依赖性和蛋白激酶 C)家族的代表性较高(图 6 B-C)。特别是,95 种受调节的激酶中只有 8 种同时在蛋白质水平上显示出差异积累,这反映了磷酸化(而不是蛋白质丰度)调节减数分裂卵母细胞中的激酶功能。有趣的是,在这些受调节的激酶中,他们发现了许多以前未曾研究过到的卵母细胞激酶(图 6D-F)。例如,随着减数分裂的恢复,MAST4 (S2478/S1906/S1781)、WNK1 (T12/T17/T71) 和 PDPK1 (S38/S25/S244) 的磷酸化水平急剧升高,表明激酶活性发生了改变。此外,本研究的数据不仅验证了卵母细胞激酶上已知的磷酸位点(即 MAP4K4-S795/629/646 和 MAP3K4-S1241/424/449),而且暗示这些酶上的新位点(即 MAP4K4-S5 和 MAP3K4-S114/461/T459)发生磷酸化并可能控制其活性。以上结果共同反映了卵母细胞中激酶活性的动态和微调调控。
先前的研究表明磷酸化可以显著影响激酶功能。在激酶分析中,他们观察到激酶磷酸化的变化,这可能表明激酶活性发生了改变。接下来,他们评估了 13 种代表性的未表征激酶(WNK1、CSNK1A1、DYRK1A、GRK6、CSNK1E、PDPK1、RIPK2、RSK2、SRPK1、STK3、VRK1、SMG1 和 PBK)对抑制剂处理后卵母细胞成熟的潜在影响(图 6G)。显然,抑制每一种激酶都能减少第一极体 (Pb1) 的排出(图 6G),强烈表明它们在卵母细胞成熟过程中发挥功能。他们进一步研究了 WNK1 抑制对卵母细胞发育的影响。首先,将完全生长的 GV 卵母细胞培养在添加了不同浓度 WNK1 抑制剂 (WNK-IN-11) 的培养基中,然后在指定时间点评估相关的成熟表型(图 6H)。WNK-IN-11 以剂量依赖性方式导致 GVBD 延迟和 Pb1 排出减少(图 6I-K)。共聚焦扫描显微镜进一步显示,WNK1 抑制会在中期 I 卵母细胞中诱导高频率的减数分裂缺陷,包括纺锤体混乱和染色体错位(图 6 L-M),表明减数分裂“装置”组装缺陷,这些发现结果激酶 WNK1 是卵母细胞有序减数分裂所必需的。
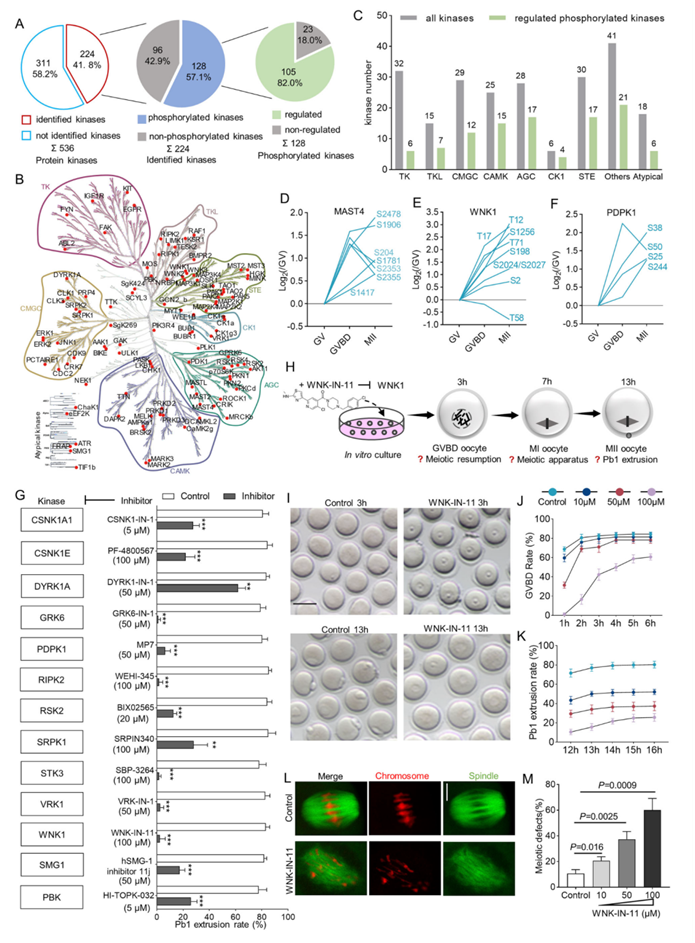
图6. 揭示调控卵母细胞成熟的关键激酶。
(A) 饼状图显示总激酶(左)、已鉴定激酶(中)和磷酸化激酶(右)的数量。(B) 主要激酶家族的受调节磷酸化激酶。(C) 条形图表示每个主要哺乳动物激酶家族的卵母细胞中所有激酶(灰色)和受调节的磷酸化激酶(绿色)的百分比。(D-F) MAST4、WNK1和PDPK1上的受调节磷酸化位点。 (G) 不同激酶抑制剂对第一极体排出的影响。(H) WNK-IN-11 处理实验的示意图。(I) 对照和 WNK-IN-11 处理的卵母细胞的明场图像。(J) 用不同浓度WNK-IN-11处理的卵母细胞中GVBD率的定量分析。(K) 用不同浓度WNK-IN-11处理的卵母细胞中Pb1挤出的定量分析。(L) 对照和WNK-IN-11处理的卵母细胞的代表性共聚焦图像。(M) 对照和WNK-IN-11处理的卵母细胞中减数分裂缺陷的定量分析。
07
揭示卵母细胞成熟过程中的磷酸酶动力学
在卵母细胞成熟过程中,蛋白质上约有 1000 个位点发生去磷酸化(图 2E),提示有蛋白磷酸酶参与。在卵母细胞中检测到了 67 种磷酸酶,其中 29 种发生了磷酸化。约 90%的磷酸酶在减数分裂的卵母细胞中表现出动态磷酸化(本文称为受调控磷酸化),反映了活性的潜在变化(图 7 A-B)。总体而言,在这 26 种磷酸酶上鉴定了 77 个受调控的磷酸位点,其中大多数位点的磷酸化水平发生了不同程度上调(图 7C-F)。CDC25B是哺乳动物卵母细胞减数分裂恢复所需的重要磷酸酶。除了众所周知的位点(即 S15、S158 和 S351)之外(图 7C),他们还发现了几个新的磷酸位点(图 7G) (S12、S209、S78、 S87)(图 7G)。有必要进一步探索以确定这些位点是否具有功能。此外,他们发现许多酪氨酸磷酸酶 (PTP)(即 DUSP7、MTMR 家族、PTPN 家族和 PTPR 家族)经历了磷酸化的剧烈变化(图 7D-F)。例如,MTMR14 上新发现的位点(即 S479、T620、S501、S516)在卵母细胞成熟过程中表现出磷酸化逐渐增加(图 7D-H),而 MTMR-S629、DUSP7-S220 和 PTPN13-S1286 的磷酸化水平则显著降低(图 7I)。值得指出的是,这些磷酸酶从未在卵母细胞中进行过检测。因此,它们如何控制成熟过程中的磷酸化动力学值得进一步研究。
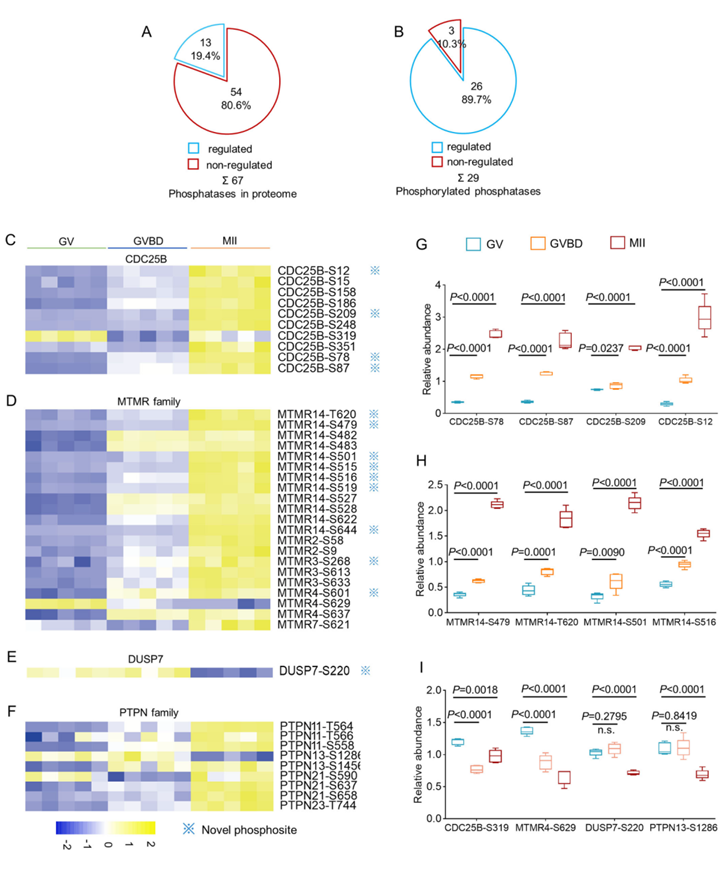
图7. 卵母细胞成熟过程中磷酸酶的磷酸化动力学分析。
(A) 饼图显示卵母细胞蛋白质组中受调节和不受调节的磷酸酶的数量。(B) 饼图显示受调节和不受调节的磷酸化磷酸酶的数量。 (C-F) 热图描绘了分为不同家族的磷酸化磷酸酶的磷酸化动力学。(G) CDC25B 中鉴定出的新型磷酸位点的相对磷酸化水平。(H) 代表性 MTMR14 酪氨酸磷酸酶的相对磷酸化水平。 (I)在特定磷酸位点处磷酸化水平下调的代表性磷酸酶。
+ + + + + + + + + + +
结 论
本研究中应用高分辨率质谱磷酸化蛋白质组学首次对小鼠卵母细胞磷酸化进行了体内定量分析。在 8000 多个磷酸位点中,75% 在减数分裂成熟过程中显著波动,64% 表现出明显的上调,表明磷酸化具有主导调节作用。此外,在卵母细胞蛋白质上发现了许多新的磷酸位点,并在不同物种的卵母细胞中发现了一些高度保守的磷酸位点。通过功能扰动,本研究证明特定位点的磷酸化状态参与调节减数分裂过程中的关键事件,包括代谢、翻译和 RNA 加工。结合抑制剂筛选和酶-底物网络预测,发现以前未开发的对卵母细胞成熟至关重要的激酶和磷酸酶。总之,本研究的数据定义了卵母细胞磷酸蛋白质组的概况,从而能够深入了解生殖细胞发育控制的机制。
+ + + + +



 English
English


