文献解读Clin Transl Med(10.6):综合多组学分析确定肝细胞癌的分子亚型和潜在靶点
✦ +
+
论文ID
原名:Integrative multiomics analysis identifies molecular subtypes and potential targets of hepatocellular carcinoma
译名:综合多组学分析确定肝细胞癌的分子亚型和潜在靶点
期刊:Clinical and Translational Medicine
影响因子:10.6
发表时间:2024.05.28
DOI号:10.1002/ctm2.1727
背 景
肝细胞癌 (HCC) 是最常见的肝癌类型,其特点是进展迅速,5 年生存率仅为 18%。根据Glisson's triad的分布,肝脏在解剖学上分为八个部分。然而,每个部分背后的分子机制及其与HCC异质性的关系尚不清楚。本研究的目标是对分割图谱进行全面的多组学分析,以研究 HCC 的潜在亚型和治疗方法。
实验设计
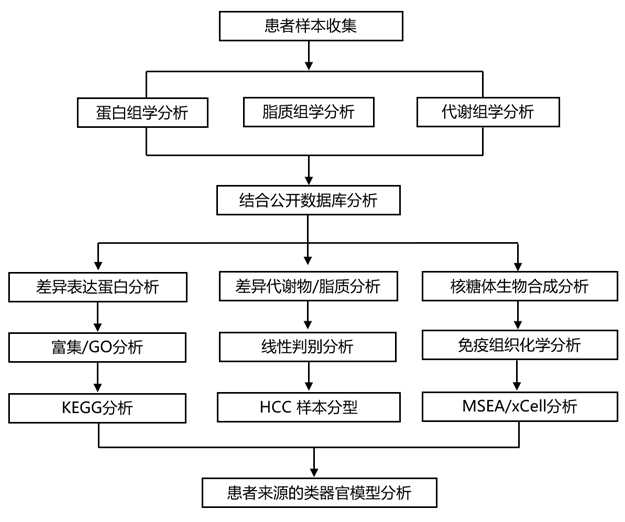
结 果
01
分段解析型肝细胞癌的多组学分析
肝脏在解剖学上分为以 Glisson 系统为中心的 8 个功能段。这些段由门静脉、肝动脉和胆汁引流决定。虽然肝段在组织学上相同,但由于 Glisson 系统源自消化道的不同分支,其微环境可能有所不同。肝脏由左叶(段 2-4,S2-S4)和右叶(段 5-8,S5-S8)组成。此外,还有一个称为尾状叶(S1)的独特部分,它位于静脉韧带和下腔静脉附近(图 1A)。本项研究的队列收集了 39 对早期 HCC 组织样本,并进行了片段解析的非靶向蛋白质组学、代谢组学和脂质组学分析,然后进行了生物信息学整合分析(图 1A,图S1A)。与 CPTAC HCC 队列相比,两个队列共检测到 8556 种蛋白质。具体而言,在本项研究的 HCC 队列中鉴定了 2659 种蛋白质,而 CPTAC 队列鉴定了 1693 种蛋白质(图 1B)。在肿瘤组织 (TT) 和正常邻近组织 (NAT)样本之间共鉴定了 7852 种共同蛋白质。此外,研究团队发现在 TT 样本中特异性检测到 2795 种蛋白质,在 NAT 样本中特异性检测到 567 种蛋白质(图S1B)。TT 样本中检测到的蛋白质数量明显高于配对 NAT 样本,尤其是在肝脏右叶(图1C,图S1C),这表明 HCC 样本具有高度的异质性。人类蛋白质图谱 (HPA) 分析显示,与 NAT 样本相比,TT 样本表现出更高的亚细胞蛋白质上调(图 1D)。相反,如 HPA 中注释的那样,在肿瘤中观察到肝脏特异性蛋白质的显著下调,这表明肝脏身份的丧失是 HCC 的一个特征(图S1D)。
为了全面表征 HCC 的多组学特征,他们同时对 HCC 样本进行了代谢组和脂质组分析。对代谢组和脂质组分析分别进行一致性评估(图S1E-F)。与负离子模式相比,液相色谱-串联质谱(LC-MS/MS)的正离子模式鉴定出更多的代谢物,包括脂质(图 1E)。通过将冗余代谢物与相同的化合物名称合并,注释了总共 3381 种脂质和 1029 种其他代谢物(图 1F)。如主成分分析 (PCA) 所示(图S1G),TT 组和 NAT 组的蛋白质组存在明显差异。TT 组的置信区间明显大于 NAT 组的置信区间,表明 HCC 样本的异质性很高。有趣的是,在代谢组和脂质组的正交偏最小二乘判别分析 (OPLS-DA) 中也得到类似的结果(图S1H-I)。
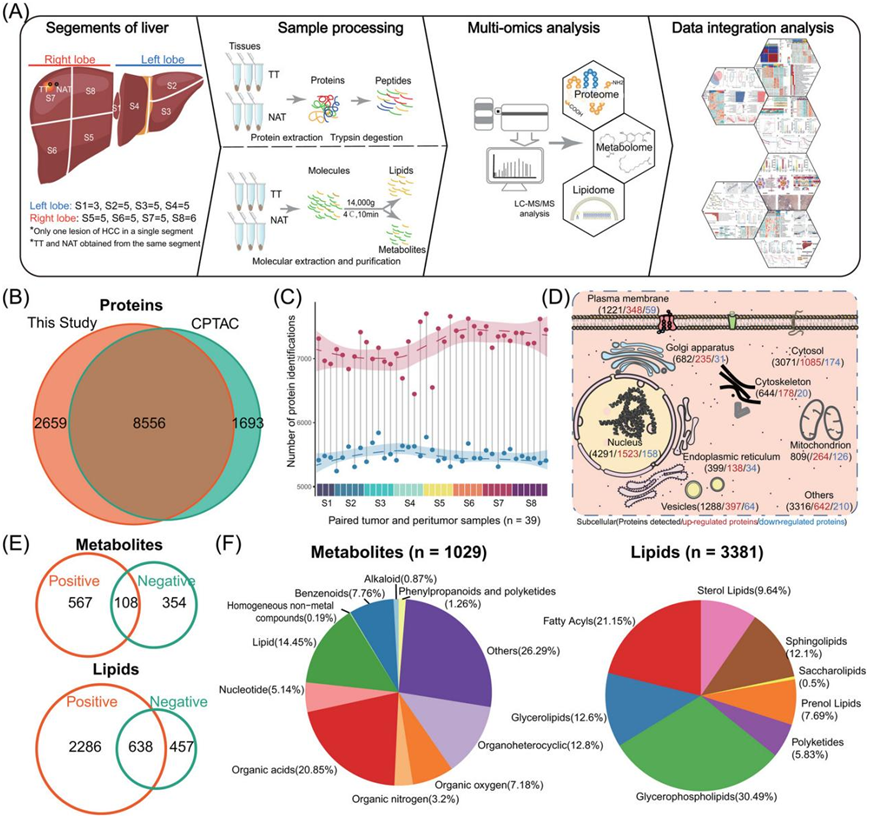
图1. 早期 HCC 样本的多组学表征。
(A) 实验和综合多组学分析的示意图摘要,包括肝脏分割、非靶向 LC-MS/MS 数据生成和整合分析。(B) 维恩图描绘了本研究和 CPTAC HCC 队列的重叠蛋白质。(C) 分段解析的 HCC 样本中蛋白质鉴定的概览。由套索回归拟合的虚线表示蛋白质鉴定的分布。套索曲线下面的阴影表示 95% 置信区间。(D) 通过人类蛋白质图谱研究的已鉴定蛋白质的亚细胞分布。(E) 维恩图显示在 LC-MS/MS 的正离子和负离子模式下鉴定的重叠代谢物和脂质。(F) 饼图显示了由人类代谢物数据库 (HMDB) 注释的已鉴定代谢物和脂质的类别。
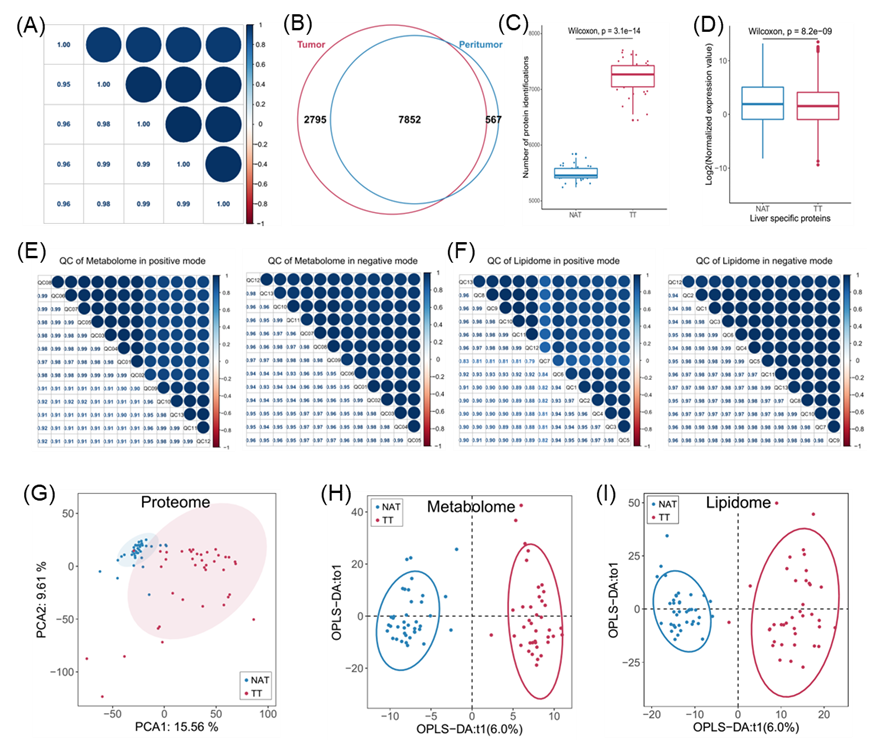
图S1. 配对HCC及质控样本的一般分析。
(A)质谱分析。(B)维恩图描绘了TT和NAT样品中鉴定的重叠蛋白。(C)箱线图分别显示了TT和NAT样品中鉴定出的蛋白质数量。(D)NAT组和TT组之间肝脏特异性蛋白相对表达的方框图。(E-F)代谢组和脂质组的QC样品分别在正/负离子模式中使用与蛋白质组分析质量控制相同的方法进行分析。(G)蛋白质组学数据的主成分分析(PCA)在很大程度上分离了肿瘤样本和NAT样本。(H-I)TT和NAT样品中代谢组和脂质组的正交偏最小二乘判别分析(OPLS-DA)。TT:肿瘤组织;NAT:正常邻近组织。
02
配对HCC样本的整合分析
与 NAT 相比,在 TT 中共鉴定出 908 种差异表达蛋白 (DEP)。其中,571 种上调,337 种下调(图 2A)。值得注意的是,TT 样本显示增殖相关蛋白上调,如微型染色体维持蛋白 (MCM)、线粒体核糖体蛋白 (MRP)、小核糖核蛋白多肽 (SNRP) 以及富含丝氨酸和精氨酸的剪接因子 (SARSF)。相反,NAT 样本表现出与物质代谢过程相关的细胞色素 P450 家族蛋白 (CYP) 和酒精脱氢酶 (ADH) 的上调。富集分析一致表明,TT 中上调的 DEP 主要与增殖相关过程有关,例如 mRNA 剪接和 DNA 代谢过程。另一方面,NAT中上调的蛋白质在多种代谢过程中富集,包括单羧酸代谢过程、小分子分解过程和生物氧化(图 2B)。此外,通过KEGG数据库确定的代谢通路相关蛋白质在TT样品中,与NAT样品相比,其显著上调(图 2C)。
在代谢组学和脂质组学分析中,总分数 (FOT) 用于表示所有样品中特定小分子的标准化丰度。结果表明,与 NAT 样品相比,TT 样品中 31 种代谢物上调,100 种代谢物下调, 218 种脂质上调,418 种脂质下调(图2A)。基于富集分析,与 TT 样品相比,NAT 样品显示出更多上调的代谢小分子,表明糖酵解、三酰甘油生物合成和线粒体电子传递链等代谢过程增加(图 2D)。将脂质合并到超类中后,NAT 样品中脂质组显著富集,包括磷脂酰甘油 (PG)、磷脂酰丝氨酸 (PS)、甘油三酯 (TG)、心磷脂 (CL)、辅酶 Q (CoQ) 和双半乳糖二酰甘油 (DGDG)。另一方面,单半乳糖二酰甘油 (MGDG)、磺基奎诺糖二酰甘油 (SQDG) 和神经酰胺 1-磷酸 (CerP) 在 TT 样品中表现出显著的富集(图 2E)。
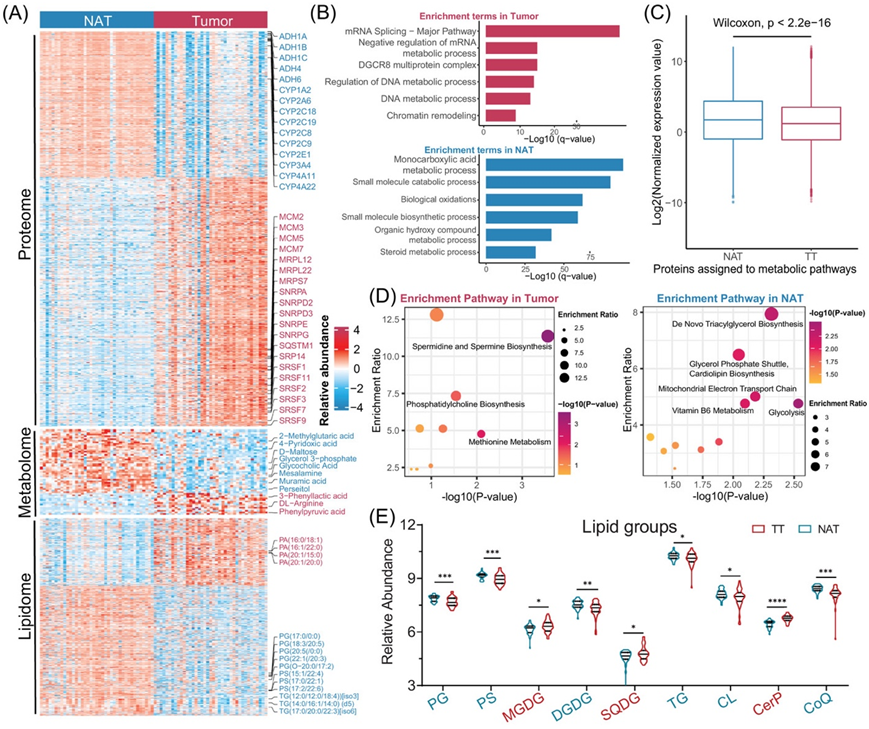
图2. 配对 HCC 样本的多组学分析。
(A)热图显示 TT 和 NAT 样本中的蛋白质、代谢物和脂质概况。(B)条形图表示基于 TT 和 NAT 之间失调蛋白质的富集通路。(C)NAT 和 TT 组之间分配给代谢途径的蛋白质相对表达的箱线图。(D)基于 TT 和 NAT 之间失调代谢物的富集途径的散点图表示。(E)TT 和 NAT 中失调脂质组的小提琴图。
03
NAT 分段解析多组学概况
为了分析每个肝段的非酒精性脂肪性肝炎 (NAT) 的多组学概况,他们采用 Kruskal-Wallis 检验计算并筛选出来自 8 个肝段的 1209 个 DEP。利用这些 DEP,他们进行了相关性分析,并将来自 8 个肝段的 NAT 样本分成两组,主要对应于肝脏的左叶和右叶(图S2A)。随后,他们对这些 DEP 进行了无监督的层次聚类,结果将 NAT 样本分为两类:聚类 1,主要代表左叶(包括 S1-S4),聚类 2,对应于右叶(包括 S5-S8)(图S2B)。
为了比较肝脏左叶和右叶的多组学分析,他们采用线性判别分析(LDA)来识别 NAT 蛋白质组数据的线性组合。左叶包含 18 个样本(包括 S1),而右叶包含 21 个样本。然后将得到的数据投影到前两个线性判别式上,这解释了两叶内 61.4% 的变异。通过蛋白质组学分析(图 3A),NAT 样本通常分布在左叶和右叶,这一结果在代谢组和脂质组的 OPLS-DA 中得到进一步证实(图 3B-C)。差异分析显示,左叶中上调的蛋白质和小分子数量高于右叶(图 3D)。具体而言,在蛋白质组中鉴定了 614 种失调蛋白质,其中左叶中 461 种蛋白质上调,右叶中 153 种蛋白质上调。此外,左叶中上调的代谢分子有 204 种,右叶中上调的有 111 种。左叶中上调的脂质有 377 种,右叶中上调的脂质有 358 种。富集分析的结果表明,左叶中失调的蛋白质主要与能量代谢过程有关。这些过程具体包括氧化磷酸化、TCA 循环、细胞呼吸和 ATP 合成。另一方面,在右叶中发现小分子代谢过程例如小分子生物合成过程、次级代谢过程、对毒性物质的反应和核苷酸糖的生物合成显著富集(图 3E)。
使用代谢组学数据中的代谢物组富集分析 (MSEA) 验证了结果。肝脏左叶在极长链脂肪酸的β氧化和糖酵解过程中富集,而肝脏右叶在甲基组氨酸代谢、牛磺酸和亚牛磺酸代谢以及组氨酸代谢中富集(图 3F)。研究还观察到肝脏 8 个节段之间脂质组丰度的显著差异。具体而言,左叶表现出神经酰胺 (Cer)、磷脂酸 (PA) 和 PG 上调,而右叶表现出 TG 上调,尤其是在 S7 和 S8 节段(图 3G)。总体而言,节段解析的多组学 NAT 数据可以区分肝脏左叶和右叶并识别它们不同的富集谱。
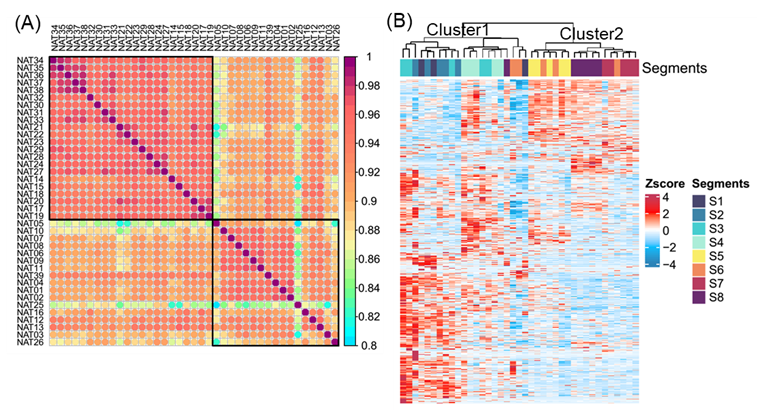
图S2. NAT样本的两个聚类。
(A)两组NAT样本的相关性分析。(B)热图显示NAT样本的无监督层次聚类分为两个聚类。
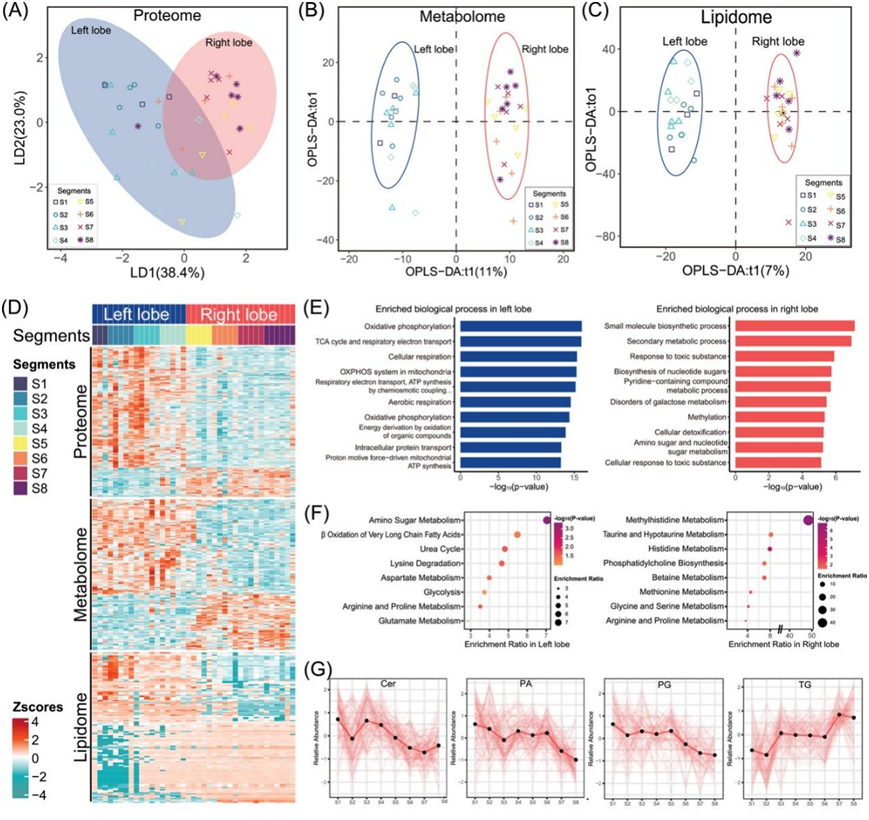
图3. NAT 样本的多组学景观。
(A)NAT 样本蛋白质组中的线性判别分析 (LDA) 主要分为肝脏的左叶(包括 S1,下同)和右叶。椭圆阴影表示 95% 置信区间 (95% CI)。(B-C)NAT 样本代谢组 (B) 和脂质组 (C) 中的正交偏最小二乘判别分析 (OPLS-DA) 揭示了左叶和右叶之间的明显划分。左叶和右叶样本分别用蓝色和橙色表示。(D)热图显示左叶和右叶之间 NAT 样本的失调蛋白质组、代谢组和脂质组。(E)左叶和右叶中 DEP 的富集分析分别为蓝色和橙色。(F)左叶和右叶失调代谢组的 MSEA。 (G) 折线图显示肝脏 8 个节段中四种脂质组的相对丰度。
04
早期HCC的蛋白质组学分层
根据蛋白质组学分层,将HCC 样本分为三个亚型:C1、C2 和 C3(图 4A)。GO分析注释显示,C1 亚型以 RNA 代谢相关通路为特征,特别是核糖体生物合成 (RB) 过程。该过程涉及蛋白质,例如 MRPS7、MRPS25、MRTO4、RPS27、WDR3、WDR36 和 WDR43(图 4B)。因此,他们将 C1 亚型定义为 S-RB 亚型。另一方面,C3 亚型显示出更高水平的与免疫反应相关的蛋白质,特别是中性粒细胞脱颗粒 (ND)。这些蛋白质包括 S100A8/9、CD84、TIMP1、HLA-E 和 LCN2,这种亚型称为 S-ND 亚型。同时,C2亚型表现出介于C1和C3亚型之间的中间表型,称为S-Im亚型。
最近的许多研究都强调了核糖体生物合成失调在上皮-间质转化、癌症转移和治疗耐药性中的重要作用。核糖体生物合成的过度活化可以增强翻译能力,从而增加蛋白质合成以促进细胞增殖。此外,它还可以通过上调程序性死亡配体 1 (PD-L1) 的表达来抑制免疫反应,从而促进细胞迁移(图 4C)。通过利用 KEGG 通路数据库,他们在 82 种与核糖体生物合成 (RB) 相关的蛋白质中鉴定了 57 种。在这些蛋白质中,有 16 种在 HCC 蛋白质组亚型中表现出显著相关性(图 4D)。此外,RNA 翻译能力的提高会导致核糖体蛋白 (RP) 的合成加速,而核糖体蛋白 (RP) 已知与肿瘤进展和治疗耐药性有关。在本研究中,他们检测了 74 种 RP,并将其分为两大类:核糖体大亚基 (RPL) 和核糖体小亚基 (RPS)。RPL 和 RPS 包括 RPL15、RPL19、RPS6 和 RPS15A,它们与消化系统恶性肿瘤的不良预后有关。值得注意的是,肝细胞癌 (HCC) 的 C1 亚型显示出最高的 RP 表达水平,其次是 C2 和 C3 亚型,而 NAT 中的水平最低(图 4E)。总之,核糖体生物合成过程在 HCC 的 C1 亚型 (S-RB) 中起着至关重要的作用。
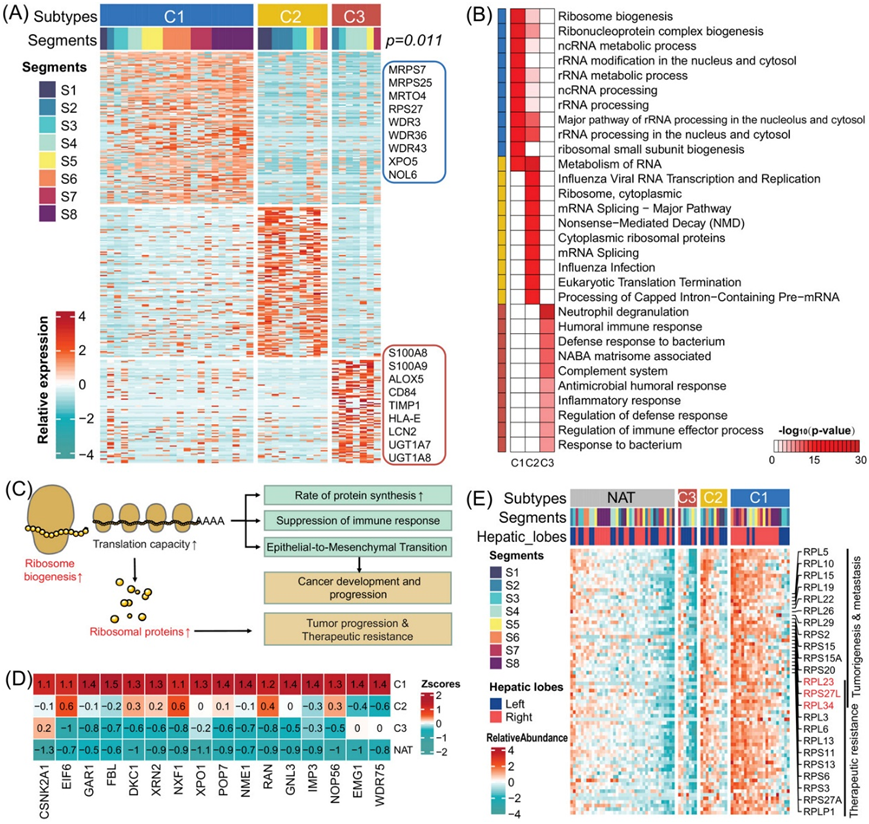
图4. 基于蛋白质丰度的 HCC 聚类。
(A) 三种蛋白质组亚型中上调蛋白质的相对表达和肝节段关联。(B) 不同通路中显著差异表达蛋白质。(C)系统图总结了癌症发展和进展中失调的核糖体生物合成。(D)蛋白质组亚型和 NAT 样本中与核糖体生物合成相关的失调蛋白质。每个细胞的颜色显示该样本中蛋白质的Z分数。(E)蛋白质组亚型和 NAT 样本中核糖体蛋白 (RP) 的相对表达。
05
核糖体生物合成驱动的肝细胞癌
为了确定核糖体生物合成相关过程中的潜在治疗靶点,他们检测了 TT 和 NAT 中 RB 和 RP 候选蛋白的表达(图 5A)。在 HCC 蛋白质组亚型和 NAT 中,C1 亚型表现出三种候选蛋白的最高表达:输出蛋白 1 (XPO1)、核前 mRNA 结构域调节蛋白 1b (RPRD1B) 和 ras 相关核蛋白 (RAN)(图 5B)。在 TCGA HCC 队列中,Kaplan-Meier 曲线以及对数秩检验显示患者根据 XPO1、RPRD1B 和 RAN 的生存差异存在显著分层(图 5C)。此外,在来自 CPTAC 门户的独立 HCC 队列中,在蛋白质水平上证实了 XPO1、RPRD1B 和 RAN 的生存差异(图 5D)。根据与肝叶匹配的蛋白质组亚型,观察到 C1 亚型样本主要位于肝脏右叶。此外,确定了三种候选样本,其中右叶的 RP 表达高于左叶(图 5E)。因此,他们选择了右叶的 HCC 样本进行进一步的免疫组织化学 (IHC) 分析。研究结果表明,与 NAT 相比,TT 中 XPO1、RPRD1B 和 RAN 的表达显著增加(图5F)。
XPO1、RAN 或 RPRD1B 的蛋白质表达在右叶高于在左叶(图 5E)。因此,他们选择了右叶的 HCC 样本进行进一步的免疫组织化学 (IHC) 分析。研究结果表明,与 NAT 相比,TT 中 XPO1、RPRD1B 和 RAN 的表达显著增加(图 5F)。他们选择了两个标记为 KOLV-057 和 KO-67220 的 HCC 样本进行患者来源的类器官 (PDO)分析,它们的原发性病变分别在左叶和右叶。正如预期的那样,以 XPO1 为靶点的抑制剂 Kpt185 显著降低了 HCC 细胞的增殖和存活率,IC50分别为 2.12 µM 和 3.7 µM(图 5G),这表明 XPO1 是 HCC C1 亚型的靶点。
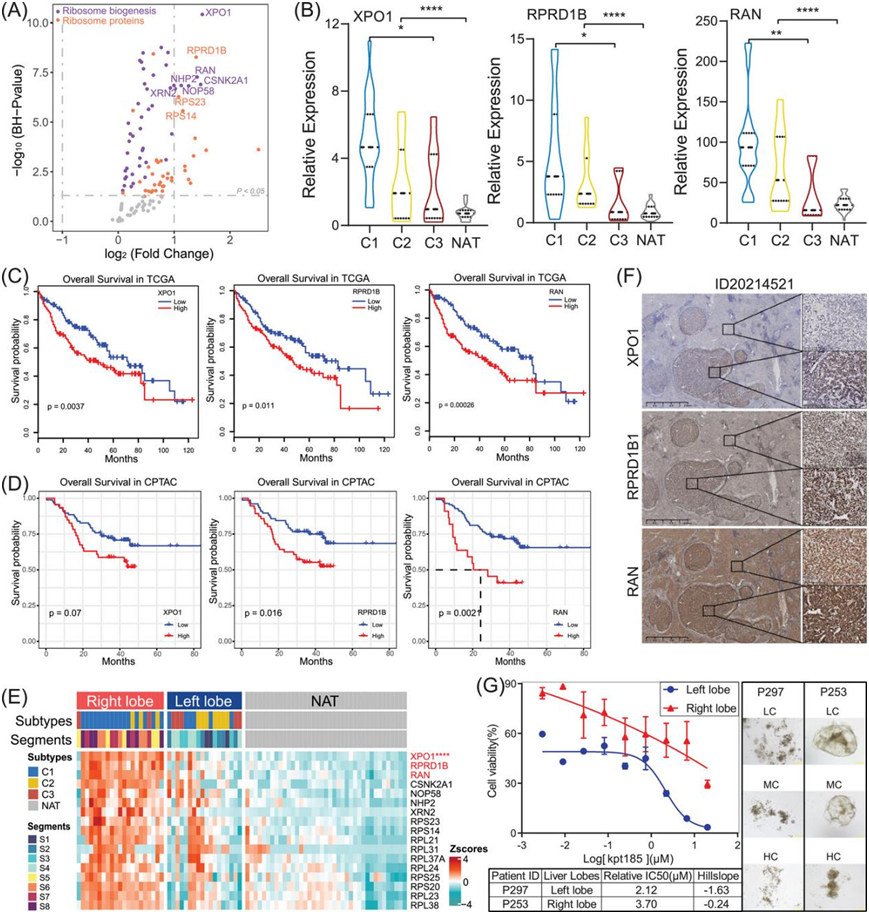
图5. 核糖体生物合成增加促进 C1 亚型 HCC 进展。
(A)散点图描绘了与 NAT 组相比,在 TT 中几乎上调的核糖体生物合成相关蛋白(RB,紫色点)和核糖体蛋白(RP,橙色点)。候选蛋白(调整p值 < 10 −5,log 2 FC| > 1)在图中标记。(B)小提琴图显示 XPO1、RPRD1B1 和 RAN 的候选蛋白在蛋白质组亚型和 NAT 组中的表达有显著差异。(C)基于 TCGA HCC 队列中 XPO1、RPRD1B1 和 RAN 的转录表达的总生存率的 Kaplan-Meier 曲线。(D)基于 CPTAC HCC 队列中 XPO1、RPRD1B1 和 RAN 的蛋白质表达的总生存率的 Kaplan-Meier 曲线。 (E) 热图显示左叶、右叶和 NAT 组中候选 RB 和 RP 的相对表达,包括 XPO1、RPRD1B1 和 RAN 蛋白。 (F) IHC 验证了 TT 和 NAT 样本中 XPO1、RPRD1B1 和 RAN 的相对表达。 (G) 证实从 HCC 肿瘤组织中获得的 PDO 对 XPO1 抑制剂 (Kpt185) 敏感,左叶和右叶的 IC50分别为 2.12 和 3.7。
06
中性粒细胞脱颗粒驱动的肝细胞癌
最近的研究表明,中性粒细胞脱颗粒可能促进癌症转移,并可能具有免疫抑制作用。肝细胞癌 (HCC) 的 S-ND (C3) 亚型与免疫反应密切相关,特别是中性粒细胞脱颗粒(图 4A-B)。与预期一致,xCell 算法显示 C3 亚型的肿瘤微环境、免疫反应、基质和中性粒细胞得分高于其他亚型和 NAT(图 6A)。
在癌症转移过程中,中性粒细胞颗粒的胞吐导致中性粒细胞表面标志物的变化和颗粒基质蛋白的释放。这些蛋白质包括髓过氧化物酶 (MPO)、CD63、CD18 (ITGB2)、CD11 (ITGAM)、TIMP1、肝素酶 (HPSE)、MMP9、S100A8/9 和 LCN2(图 6B)。其中,C3 亚型表现出与颗粒胞吐相关的蛋白质水平最高,特别是 CD63、S100A9 和 MPO(图 6C)。此外,中性粒细胞衍生的颗粒蛋白表达水平升高和释放的细胞因子与 HCC 患者预后较差相关。为了验证这些发现,他们对独立 HCC 患者的石蜡切片进行了 IHC 分析。他们始终观察到 TT 样本中 CD63、S100A9 和 MPO 的表达水平高于 NAT 样本(图 6D-E)。
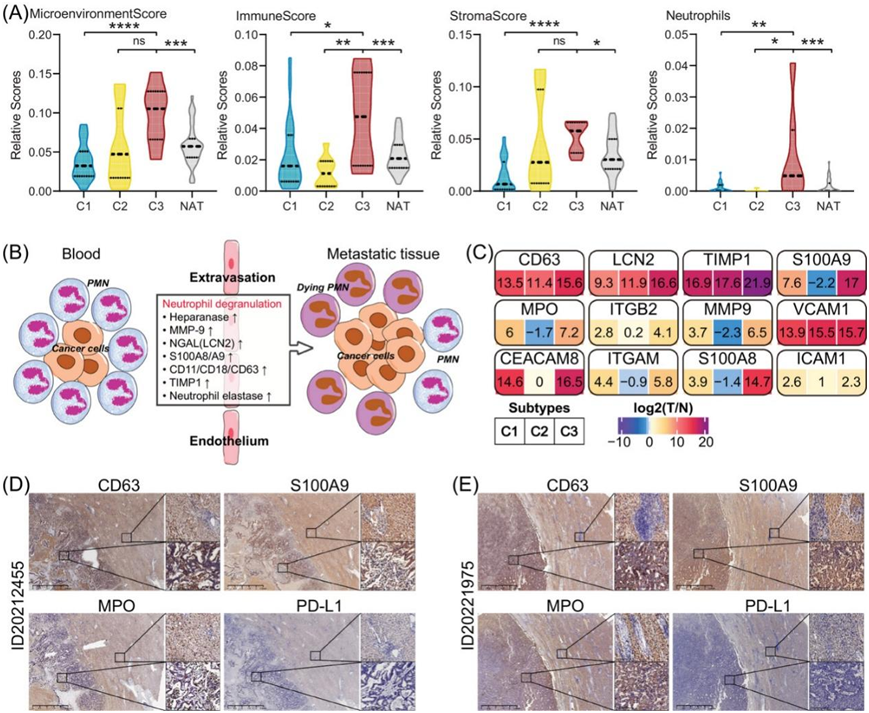
图6.中性粒细胞脱颗粒促进肝细胞癌转移。
(A)小提琴图显示不同 HCC 亚型和 NAT 样本的免疫(包括中性粒细胞)和基质的估计评分存在显著差异。(B)示意图显示了中性粒细胞脱颗粒在癌症转移中的可能机制。(C)中性粒细胞的蛋白质在不同的 HCC 蛋白质组亚型中存在不同的表达,例如 CD63、LCN2、S100A9、MPO、ITGB2、MMP9、VCAM1、CEACAM8、ITGAM、S100A8 和 ICAM1。(D-E) IHC 分析验证了 ID20212455和 ID20221975患者的 TT 和 NAT 样本中 CD63、S100A9、MPO 和 PDL1 的相对表达。
随后进行了多组学整合分析以表征 C3 亚型。结果表明,与 C1 和 C2 类型相比,C3 亚型具有更高的代谢物和脂质丰度,特别是油酸、棕榈酸 (PA)、花生四烯酸 (ARA) 和亚油酸 (LA)(图 7A)。为了进一步研究 C3 亚型的功能,进行了 MSEA。该分析表明,C3 亚型中不饱和脂肪酸的生物合成以及 LA 和 ARA 代谢显著富集(图 7B)。
肝癌的发展和进展与脂肪酸代谢有关。在从头合成过程中,棕榈酸 (PA) 和硬脂酸 (SA) 是通过一次向乙酰辅酶 A 添加两个碳而产生的。多不饱和脂肪酸 (PUFA) 可分为两类:ω-6 FA(包括 LA、GLA 和 ARA)和 ω-3 FA(如 ALA、DHA 和 EPA)(图S6A)。C3 (S-ND) 亚型显示几种 FA、专门的促分解脂质介质 (SPM) 和参与 FA 代谢的酶上调,包括 LA、ARA、前列腺素 E1/2 和 ALOX5(图 7C)。
FA 代谢对中性粒细胞的免疫反应至关重要。网络分析发现酶 ALOX5 对 ARA 代谢有密切的调控作用。这种代谢与参与中性粒细胞脱颗粒的蛋白质相互作用,例如 MMP9、MPO 和 ITGAM(图 7D)。相关性分析显示,ALOX5 的表达水平与 MMP9、CD63和 ITGAM的表达呈正相关。此外,在 CPTAC 队列中,ALOX5 表达越高,HCC 患者的预后越差(图 7E),使用 IHC 方法验证了独立 C3 亚型肿瘤患者中 ALOX5 的表达(图 7F)。
他们使用 KOLV-057 和 KO-67220 的永生化细胞进行 PDO 药物敏感性分析(图 7G)。尽管使用的药物浓度高于 Kpt185,但抑制 ALOX5 活性的药物Zileuton无法减少从右叶 HCC 组织中获得的恶性细胞的增殖。有趣的是,Zileuton显示出从左叶 HCC 永生化的恶性细胞的增殖和存活率显著降低,IC50值为 45.93 µM。这些数据表明 ALOX5 是 C3 亚型 HCC 的潜在靶点。
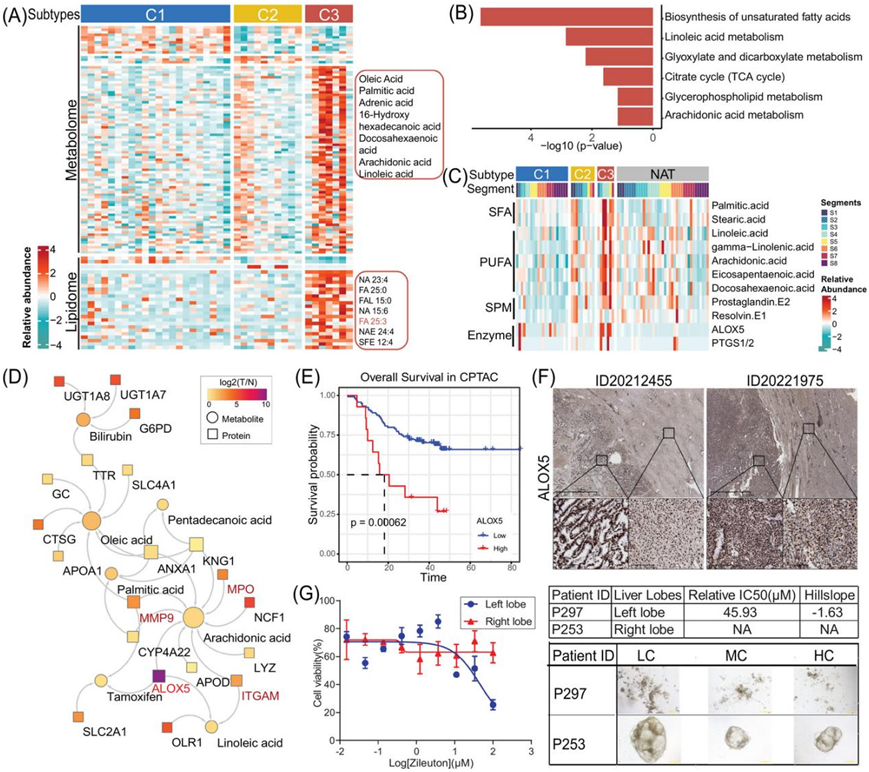
图7. 失调的 PUFA 代谢相关中性粒细胞脱颗粒促进 HCC 发展。
(A)热图显示 HCC 亚型中代谢组和脂质组的失调。(B)与其他亚型相比,C3 亚型中这些上调代谢物的 MSEA。(C)热图显示 HCC 亚型和 NAT 中 SFA、PUFA、SPM 和酶的相对表达。(D)脂肪酸与受调节蛋白质的相互作用。(E) CPTAC HCC 队列中 ALOX5 总体生存率的 Kaplan-Meier 曲线。(F) 来自两名独立患者(ID20212455 和 20221975)的 IHC 分析验证了 TT 和 NAT 样本中 ALOX5 的表达。 (G) 从 HCC 肿瘤组织中获得的 PDO 对 ALOX5i敏感,左叶的 IC50为 45.93 µM,但右叶不敏感。
+ + + + + + + + + + +
结 论
本项研究对8536个蛋白质、1029种极性代谢物和3381种非冗余脂质进行多组学分析,以分析HCC的分割图谱。数据分析表明,在正常的邻近组织中,左叶主要参与能量代谢,而右叶与小分子代谢有关。基于正常参考图谱,按节段解析分类的HCC患者分为三种亚型。C1亚型显示核糖体生物合成富集,C2亚型表现出中间表型,而C3亚型与中性粒细胞脱颗粒密切相关。此外,使用PDO分析,XPO1和ALOX5分别是C1和C3亚型的潜在靶点。本项研究揭示了有可能改善 HCC 预后的潜在治疗策略。
+ + + + +



 English
English


