文献解读|Cancer Cell(48.8):跨组织人类成纤维细胞图谱揭示了在免疫调节中具有不同作用的肌成纤维细胞亚型
✦ +
+
论文ID
原名:Cross-tissue human fibroblast atlas reveals myofibroblast subtypes with distinct roles in immune modulation
译名:跨组织人类成纤维细胞图谱揭示了在免疫调节中具有不同作用的肌成纤维细胞亚型
期刊:Cancer Cell
影响因子:48.8
发表时间:2024.09.17
DOI号:10.1016/j.ccell.2024.08.020
背 景
成纤维细胞在维持组织稳态、应对炎症和纤维化状况、帮助伤口愈合以及促进癌症进展的复杂过程方面发挥着关键作用。在癌症领域,成纤维细胞已成为肿瘤微环境 (TME) 中的中心人物,发挥着多方面的作用。这些作用包括沉积和重塑细胞外基质 (ECM)、与癌细胞进行复杂的相互信号相互作用以及与浸润白细胞进行复杂的相互作用。因此,它们成为优化抗癌治疗策略的潜在靶标。
实验设计
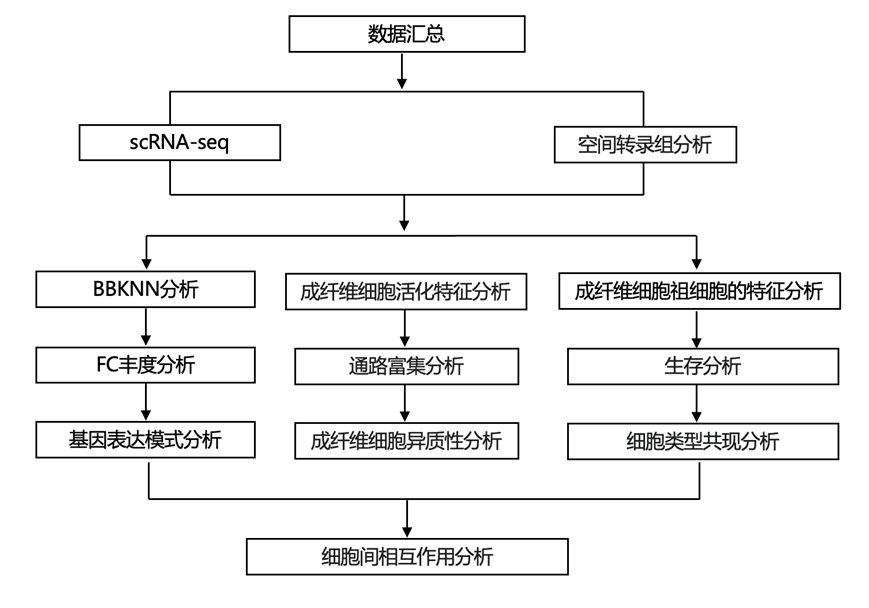
结 果
01
构建跨不同组织和病理状态的成纤维细胞 scRNA-seq 图谱
为了系统地表征健康和病理环境下成纤维细胞的异质性,研究团队收集了先前研究中的人类成纤维细胞的转录组分析(scRNA-seq)数据集(图1A)。为了增加特定癌症类型的覆盖率,他们纳入了来自四种不同癌症类型的 38 名患者的新生成的 scRNA-seq 数据(图 1 A-B)。该成纤维细胞图谱包含 11 种不同组织的 517 个样本,每个样本涵盖一系列病理状况,包括癌前病变、不同阶段的慢性炎症和纤维化、邻近的非肿瘤组织、癌症和转移(图 1 A-B)。
使用K-最近邻算法(BBKNN)对所有这些数据集进行整合聚类,鉴定出20个不同的转录成纤维细胞聚类,将这些聚类分为不同的功能群(图1C)。与之前的单细胞成纤维细胞研究一致,本研究分析证实了已知成纤维细胞亚型的存在,如PI16+成纤维细胞祖细胞(c05)、LRRC15+肌成纤维细胞(c04)、IL6+炎性成纤维细胞(c07)和CD74+抗原提呈成纤维细胞(c20)(图1C-E)。重要的是,跨组织整合确定了新的成纤维细胞聚类(FC),包括各种肌成纤维细胞聚类,例如 c11-HOPX 和 c16-SFRP2 成纤维细胞、c14-HSPA6 应激相关成纤维细胞和 c19-MMP1 成纤维细胞,它们同时表现出肌成纤维细胞和炎性成纤维细胞的特征(图 1D-E)。
他们首先分析了FC在组织类型中的分布,并发现了几种不同的丰度模式(图1F)。6 种 FC 仅存在于一种或两种组织类型中,因此定义为“组织特异性”FC。这些包括 c10-PRG4 成纤维细胞(特异性存在于滑膜中)、c15-SOX6 和 c02-ADAMDEC1 成纤维细胞(结肠和胃)、c18-HHIP SMC(结肠)、c07-IL6 成纤维细胞(乳腺和肺)和 c13-HGF 成纤维细胞(肾脏和肝脏)。值得注意的是,这些组织特异性成纤维细胞表现出与其各自器官功能维持相关的分子的更高表达。例如,c15-SOX6 成纤维细胞显示出SOX6和POSTN表达升高,表明其在隐窝-绒毛轴的上皮分化和增殖中发挥作用,而 c02-ADAMDEC1 成纤维细胞表达ADAMDEC1和各种细胞因子,可能有助于固有层中的白细胞募集。此外,他们还鉴定了在一两种组织类型中含量较高但在其他组织类型中含量较低的“共有”FC(图 1 F)。这些包括 c06-ADH1B 成纤维细胞、c11-HOPX 成纤维细胞、c20-CD74 成纤维细胞、c17-STMN1 成纤维细胞和 c12-间皮细胞。c06-ADH1B 成纤维细胞高度表达肺特异性成纤维细胞特征,代表一组在健康和正常肺组织中高度富集的肺泡成纤维细胞(图 1 F)。
在成纤维细胞图谱中,近一半的成纤维细胞聚类(9 个 FC)广泛分布于 8 种以上的组织类型中,因此将其定义为“通用”FC(图 1 F)。这些聚类包括成纤维细胞样细胞(c01-SMC 和 c08-周细胞)、应激相关成纤维细胞(c14-HSPA6)、成纤维细胞祖细胞(c05-PI16 和 c03-COL15A1)、肌成纤维细胞(c04-LRRC15、c16-SFRP2、c19-MMP1)和肌成纤维细胞样成纤维细胞(c09-CTNNB1)。有趣的是,通用 FC 倾向于下调组织特异性转录因子(TF)调节子,同时上调与其功能属性密切相关的 TF。例如,成纤维细胞祖细胞(c05 和 c03)表现出FOXP2的特异性上调,从而调节与祖细胞状态相关的基因,例如CD34和CD55。此外,肌成纤维细胞聚类(c04 和 c11)上调WNT 信号通路下游 TF LEF1,从而调节多个肌成纤维细胞特征基因。相反,c14-HSPA6 成纤维细胞与 c07-IL6 成纤维细胞和 c12-间皮细胞聚集在一起,显示出调节炎症相关基因(如NFKB1 )的 TF 的高活性,表明其具有促进成纤维细胞炎症表型的潜力。
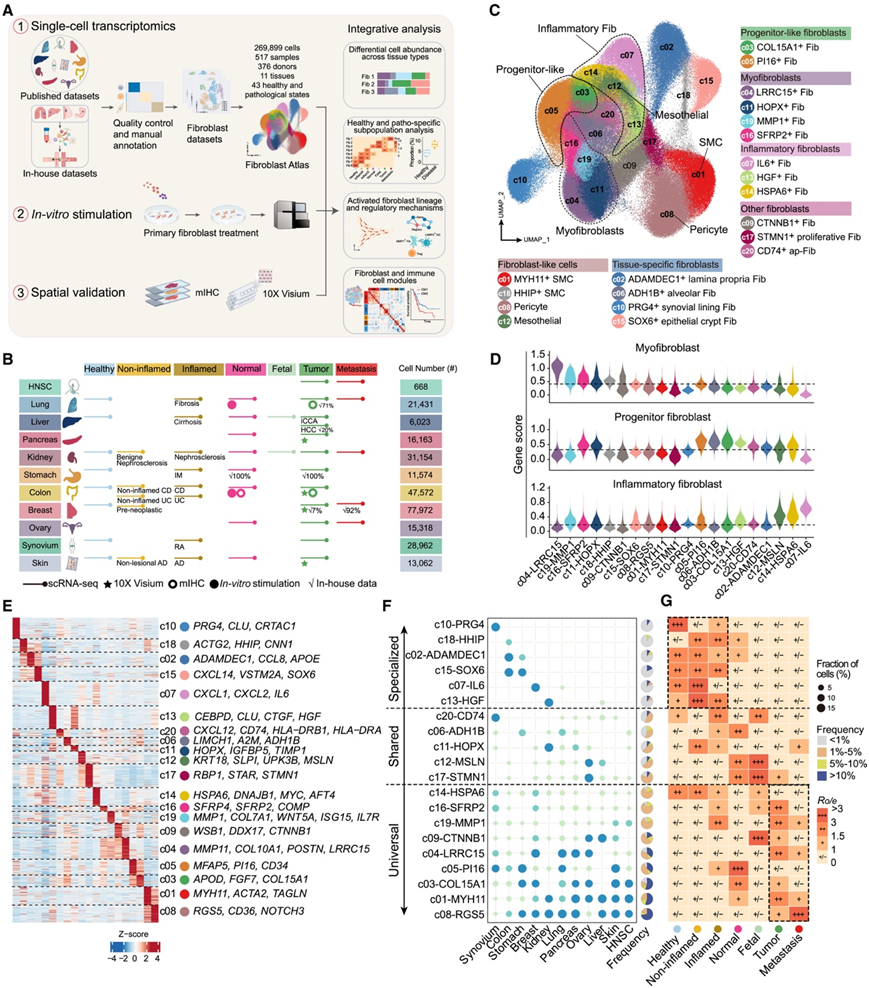
图1. 健康和疾病状态下的跨组织成纤维细胞图谱。
(A) 研究设计和分析流程的示意图。(B) 按病理状况(x 轴)和器官(y 轴)总结分析的数据集。(C) 成纤维细胞聚类(FC)的均匀流形近似和投影(UMAP)可视化。(D) 成纤维细胞功能特征的表达模式。(E) 热图显示每个成纤维细胞聚类中前 100 个显著高表达基因的表达模式。(F) 点图显示特定组织中所有成纤维细胞中 FC 的频率,右侧的饼图显示了不同组织中聚类丰度的分布。(G) 热图显示了Ro/e对聚类表型的偏好。
02
慢性炎症和癌症期间成纤维细胞区室的重塑
仔细检测这些成纤维细胞聚类的表型富集模式后,他们发现大多数组织特异性 FC 优先富集在健康组织中(图 1 G),进一步强调了它们在组织稳态中的作用。然而,一些组织特异性成纤维细胞在慢性炎症期间表现出扩增,如炎症性肠病中的 c18-HHIP SMC 和肾硬化和肝硬化中的 c13-HGF 成纤维细胞(图 2 A),表明它们参与了疾病进展。对于组织共有 FC,它们在病理状态下的特异性富集因组织而异。例如,c11-HOPX 肌成纤维细胞在肾硬化中富集,但也存在于几种癌性组织中(图 2 A)。c20-CD74 抗原呈递成纤维细胞在类风湿关节炎和克罗恩病患者的发炎滑膜和结肠组织中扩增,但在肺和胰腺等组织中,它们主要存在于恶性状态(图 2 A)。有趣的是,他们发现通用 FC,特别是肌成纤维细胞和肌成纤维细胞样细胞,与组织特异性和组织共有 FC 相比,其在恶性状态下高度富集(图 1 G)。这凸显了癌症和慢性伤口愈合之间的相似性,两者都涉及持续的炎症和组织重塑,这可能导致肌成纤维细胞的积累和激活。
比较不同疾病条件下的整体成纤维细胞组成,他们观察到炎症组织的中间活化状态,该状态保留了大部分组织特异性 FC,同时具有转变为癌变状态的趋势,肌成纤维细胞略有增加(图 2B)。通过定义成纤维细胞活化特征(图2C)。他们发现不同组织类型的炎症成纤维细胞与健康和肿瘤状态相比具有一致的中间评分水平(图 2D)。
为了进一步探索成纤维细胞的疾病相关转录重编程,他们使用具有两种表型(炎症和癌症)的组织比较了基因表达数据,重点关注在炎症和癌症组织中优先富集的两种 FC(c19 和 c20)(图 1 G、2 A)。结果表明,与炎症组织相比,癌症组织中的成纤维细胞促炎细胞因子(CXCL1和CCL2)表达较低,而 WNT(GREM1和SFRP2)和 TGF-β 受体信号基因(INHBA和LTBP1)表达较高(图 2 E-F),表明它们对成纤维细胞表型有不同的影响。通过将器官中获得的成纤维细胞总转录组与匹配的炎症和肿瘤组织进行比较,进一步证实了这一模式(图 2G),表明炎症中成纤维细胞的免疫相互作用特征可以在 TME 内重新编程为组织重塑表型。值得注意的是,与炎症相比,一些代谢通路在癌症中下调,例如视黄醇代谢和DNA去甲基化,这些通路对于维持成纤维细胞的静止状态至关重要,因此强调了在炎症和癌症条件下,代谢重编程和通路激活对成纤维细胞表型的不同调控(图2H)。
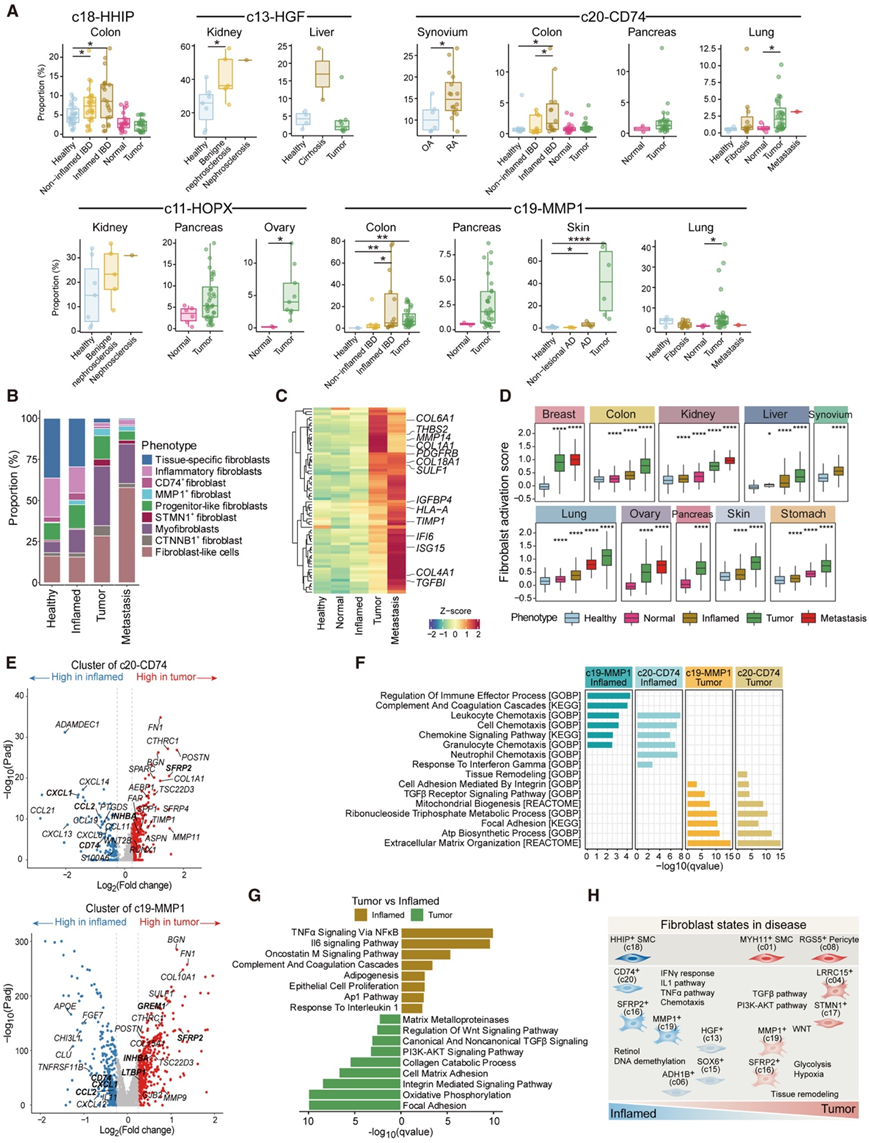
图2. 炎症和癌变组织中成纤维细胞区室的重塑。
(A) 箱线图比较不同病理状态下特定成纤维细胞聚类的比例。(B) 各种病理状态下细胞类型组成的概览。(C) 不同病理状态下与成纤维细胞活化相关的特征基因的表达。(D) 箱线图比较了各种组织表型中的成纤维细胞活化分数。(E) 火山图显示肿瘤和炎症组织中成纤维细胞之间的差异表达基因。(F-G) 炎症和肿瘤成纤维细胞之间的差异表达基因的富集通路。(H) 模型展示了炎症和癌症中成纤维细胞的组成和表型变化。
03
肌成纤维细胞异质性及其细胞起源类型
由于肌成纤维细胞是肿瘤基质的主要部分,他们进一步研究了数据集中的肌成纤维细胞亚群。他们鉴定了四个不同的肌成纤维细胞聚类(c04、c11、c16 和 c19),它们都高表达肌成纤维细胞特征基因(图 1 D),但基因表达和富集通路有所不同(图 3 A)。主要亚群是 c04-LRRC15 成纤维细胞,它高表达LRRC15(图 3 A),这是一种最近与具有免疫抑制特性的促肿瘤成纤维细胞有关的标志基因。它还表达COL10A1和MMP11(图3 A),它们与上皮-间质转化(EMT) 有关。值得注意的是,WNT 信号通路的关键调节因子CTNNB1和PTK7在c04中也高度表达(图3 A),强调了该通路在肌成纤维细胞分化和功能中的关键作用。
他们发现 c04-LRRC15 肌成纤维细胞似乎是肌成纤维细胞分化的终末分化状态,它们可能来自两个主要细胞来源,即成纤维细胞祖细胞(c05 和 c03)和周细胞 (c08)(图 3 B)。多重免疫组织化学(mIHC)证实存在表达周细胞标志物(MCAM+和PDGFRb+)的LRRC15+成纤维细胞(图3C),提示这些肌成纤维细胞的潜在周细胞来源。其他3个肌成纤维细胞亚群(c16、c19和c11)是源自不同前体细胞类型的不同中间过渡状态(图3B),提示它们属于原肌成纤维细胞状态。他们发现成纤维细胞随着谱系发育表现出 TGFβ 和 WNT 信号通路激活逐渐增加(图 3D),在 c04-LRRC15 肌成纤维细胞中达到峰值。对 TCGA 数据集的生存分析显示每个肌成纤维细胞聚类的预后不良,其中 c04 在不同癌症类型中始终表现出最差的预后,表明终末分化的肌成纤维细胞与患者不良生存率之间存在密切联系(图 3E)。有趣的是,他们发现肌成纤维细胞聚类的丰度在不同癌症类型中存在显著差异,这可能与特定组织中富集的前体细胞类型有关。事实上,两个可能源自周细胞的聚类 c11 和 c09 分别在胰腺癌和肝癌中含量丰富,而这两种癌都富含周细胞(图 1F,图3F)。c04 和 c16 在乳腺癌和肺癌中最为常见,后者含有大量 c05 祖成纤维细胞(图 1F,图3F)。c19 的分布也显示出对易发炎症的组织(如结肠和皮肤)的偏好(图 1F,图3F),这表明肌成纤维细胞的表型特征受到器官特异性信号环境的深刻影响。
在肌成纤维细胞聚类中,c19-MMP1 成纤维细胞因其独特的高炎症信号通路表达而脱颖而出(图 3D)。它们还表现出与白细胞介素(MMP1、SOD2、CXCL1和CCL11)和干扰素信号传导(CD74、ICAM1、ISG15和B2M)有关的基因上调(图 3A),表明它们具有潜在的免疫调节作用。与其他肌成纤维细胞聚类相比,HIF1A在 c19 中高表达,表明缺氧依赖性转录网络参与了 c19 表型的形成,这与 c19 的高缺氧活性一致(图3D,图3G)。相比之下,c16-SFRP2 成纤维细胞表现出与分泌型卷曲相关蛋白 (SFRP) 基因(SFRP1、SFRP2和SFRP4)和胰岛素生长因子 (IGF) 信号基因(IGF1和IGF2)相关的基因的高表达水平(图 3 A)。SFRP1抑制成纤维细胞凋亡,提示c16具有抗凋亡表型。与其他肌成纤维细胞聚类相比,NFIA(与胶质母细胞瘤细胞的凋亡逃避相关的转录因子)在c16中也上调(图3G)。与这些肌成纤维细胞聚类相比,c11-HOPX成纤维细胞独特地上调了纤维化相关基因,包括COL4A1、TCF21、HOPX和BGN(图3A)。c04 和 c11 之间共有多个 TF 调节子(图3 G),表明它们之间关系密切。他们还观察到最近报道可驱动系统性硬化症 (SSc) 成纤维细胞分化的CREB3L1在两个聚类中均上调(图 3 G)。此外,还鉴定出几种在终末分化的成纤维细胞 (c04) 中表现出最高水平 TF 调节子活化和基因表达的 TF,包括SOX4、GLIS2、STAT2、CREB3L1和TEAD1(图 3 H)。它们还可以调节肌成纤维细胞的多个关键靶基因,例如FAP和LRRC15(图 3 I)。
鉴于成纤维细胞的可塑性,他们随后研究了影响成纤维细胞分化的细胞外信号。将 TGFB1 确定为所有成纤维细胞聚类的刺激物(图3 J),这与 TGF-β 家族配体在驱动成纤维细胞活化方面的既定作用一致。值得注意的是,他们将干扰素家族成员(包括IFNA1和IFNG)以及肿瘤坏死因子(TNF)预测为c19特异性的刺激因子,这凸显了干扰素在塑造c19表型中的潜在作用(图3J)。对于c16, IL1B是一个高度优先考虑的调节因子。据报道,IL1B可减弱肌成纤维细胞中TGF-β信号传导,这表明c16表型是由具有不同功能的细胞因子组合形成的。此外,研究发现,c04和c11的最高调节因子之一是SPP1(图3J),SPP1与内皮-间质转化和纤维化相关成纤维细胞活化密切相关,突显了其在肌成纤维细胞活化中的关键作用。

图3. 肌成纤维细胞亚群谱系关系及其调控因子。
(A) 点图显示肌成纤维细胞亚群标记基因的表达水平。(B) UMAP 表示全组织成纤维细胞聚类。(C) 不同癌症类型的代表性组织切片中的 mIHC 染色。(D) 不同成纤维细胞聚类(行)间的平均通路活性(列)。(E) 森林图显示 c04 特征表达与总体生存率之间的关联。(F) 箱线图显示来自不同组织的肿瘤和炎症样本中肌成纤维细胞聚类的比例。(G) 热图显示肌成纤维细胞亚群中平均调节子活性得分。(H) 热图显示在 LRRC15 +肌成纤维细胞 (c04) 中高度表达的转录因子的调节子活性分数。(I) 预测 c04 特征基因(右)作为转录因子调节子的靶基因(左)。(J) 热图显示了排名靠前的配体对肌成纤维细胞特征基因的调控潜力。
04
成纤维细胞祖细胞的特性和可塑性
两种通用成纤维细胞祖细胞 c05-PI16 和 c03-COL15A1 成纤维细胞可在多种组织类型中分化为肌成纤维细胞(图 3B),这与之前的研究一致。尽管两个聚类都表现出以高DPT表达为特征的祖细胞状态(表 S2),但它们之间的基因表达谱存在显著差异,这意味着它们具有不同的功能。具体而言,c05 表现出与 TNF-α 信号传导(ATF3和MYC)和缺氧通路(S100A4、ACKR3和CAV1)相关的基因的上调(图 4A-B),并且已在血管周围区域发现,具有血管重塑的潜在作用。相反,c03 表现出与脂肪生成、基底膜成分(COL15A1、LAMA2和COL18A1)以及组织再生和增殖(APOD、APOE、IGF1和MDK)相关的基因的上调(图 4 A-B),表明可能参与维持上皮细胞再生和组织稳态,这与它们之前报道的上皮周围位置一致。
有趣的是,与多种组织类型的健康和癌症样本相比,这些祖成纤维细胞在相邻的非癌组织中最为丰富(图 4 C)。使用 mIHC 染色在结肠癌和胃癌中也证实了 c05-PI16 成纤维细胞在相邻正常区域中优先富集,而 c04 肌成纤维细胞则相反(图 4 D-E)。
为了评估成纤维细胞组成如何对肿瘤患者进行分层,他们根据不同癌症类型中的成纤维细胞聚类比例对肿瘤样本进行分类,揭示了 TME 内存在四个主要亚组(图 4 F)。“CT 特异性”亚组的特点是癌症类型特异性成纤维细胞在成纤维细胞群中占主导地位,“混合肌成纤维细胞”亚组则具有多样的肌成纤维细胞亚聚类,并且在样本中的流行率各不相同。除此之外,大多数肿瘤样本可分为两种主要亚型,其特征是终末分化的肌成纤维细胞或成纤维细胞祖细胞数量较多(图 4 F),癌症样本中成纤维细胞祖细胞(c05 和 c03)和终末分化的肌成纤维细胞(c04)之间的细胞频率呈显著负相关性。值得注意的是,通过根据成纤维细胞祖细胞和 c04-LRRC15 肌成纤维细胞的差异富集对癌症患者进行分类,他们发现 myoF lo progF hi肿瘤的预后优于 myoF hi progF lo肿瘤,无论是在癌症类型中还是在单个癌症类型中,例如乳腺癌和肺癌(图4G-H)。
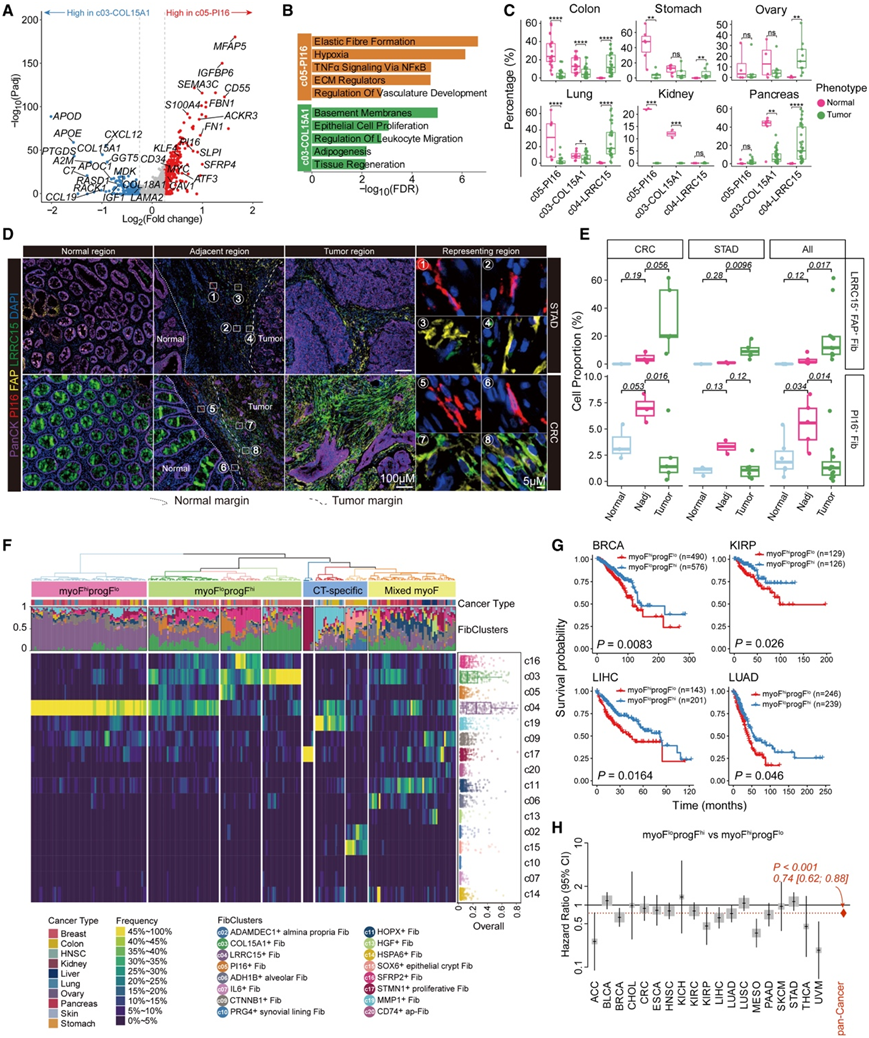
图4. 成纤维细胞祖细胞的特征及其与患者生存的关系。
(A) 火山图显示 c05 和 c03 之间的差异表达基因。(B) 条形图显示两个成纤维细胞聚类的富集通路。(C) 箱线图比较六种癌症类型的相邻正常和肿瘤样本中成纤维细胞亚群的比例。(D) 代表性组织切片中的 mIHC 染色。(E) 箱线图显示两种癌症类型中相同大小的不同组织区域中PI16 +成纤维细胞和 FAP + LRRC15 +成纤维细胞的比例。(F)热图显示肿瘤样本(列)中成纤维细胞聚类(行)的频率。(G) 生存曲线分析。(H) 森林图描绘了两组基于成纤维细胞的患者对总体生存率的影响。
05
PI16 +成纤维细胞和 LRRC15 +成纤维细胞参与不同癌症类型的空间上不同的多细胞模块
由于 CAF 可以对 TIME 产生关键影响,他们对肿瘤患者进行了细胞类型共现分析,以检查 FC 与 TIME 之间的相互作用。除成纤维细胞外,他们纳入了所有T细胞和髓系细胞亚型,从而鉴定出9个共变的多细胞模块(CM)(图5A)。
在这些 CM 中,他们观察到 c05-PI16 和 c04-LRRC15 明显分离到不同的模块(分别是 CM1 和 CM6)(图 5 A)。具体而言,c05 与 CM1 内的 c16、CD8 + CX3CR1 + Temra 细胞、CD14 +单核细胞和 LYVE1 + 巨噬细胞同时出现。值得注意的是,后两种细胞类型富集在血管周围,暗示CM1靠近血管的可能性。有趣的是,CM1 高患者表现出增强的“效应细胞”和“抗肿瘤免疫”特征(图5 B),强调了 CM1 在促进有效的抗肿瘤免疫反应中的潜在作用。相反,c04 与 CM6 内的几种成纤维细胞亚型和 SPP1+巨噬细胞同时出现。值得注意的是,在纳入的免疫细胞类型中,SPP1 +巨噬细胞与 c04 表现出最强的相关性,强调了它们之间的密切关系。CM6内“基质重塑”、“M2”和“促肿瘤细胞因子”特征升高,再加上 T 细胞和 B 细胞特征降低(图 5 B-C),揭示了 CM6 的免疫排斥特性。
基于空间转录组数据评估细胞类型丰度进一步揭示了 CM 相关细胞的空间共现,其中不同 CM 中的不同成纤维细胞亚群和免疫细胞共定位(图5D-F)。

图5. 成纤维细胞亚群在不同癌症类型的空间背景下参与不同的多细胞群落。
(A) 热图显示不同癌症类型的肿瘤样本中细胞类型比例的pearson相关性。(B) 点图显示归类为 TME 亚型的样本的 TME 相关特征评分的表达水平。(C) 点图显示分类为 TME 亚型的样本的特定标记基因的表达。(D-F) 空间转录组学分析。
06
细胞间相互作用分析
通过对肺癌标本进行 mIHC 染色进一步验证了c04(FAP + LRRC15 +)和 SPP1 +巨噬细胞的空间共定位(图 6 A)。 FAP + LRRC15 +成纤维细胞在空间上比 FAP + LRRC15-细胞更靠近 SPP1 +巨噬细胞(图6A )。他们进一步根据 CellPhoneDB 分析探索了每个 CM 内潜在的细胞间相互作用(图 6 B)。他们在空间转录组分析(ST)数据中的CM1高表达区域(图6C-D)验证了多个配体-受体的共表达,以及抗肿瘤免疫特征的增加,表明这些相互作用在维持CM1发挥了关键作用。相反,CM6中c04和SPP1+巨噬细胞之间的相互作用包含大量与组织重塑和基质沉积相关的配体受体对,包括COL1A1-ITGA5、FN1-SDC2、ADAM12-ITGB1、ADAM12-SDC4、SPP1-ITGAV /ITGB1和COMP-CD36(图6B)。此外,c04可通过与CSF1-CSF3R、GAS6-MERTK、MIF-CD44、APOE-SDC2和RARRES2-CMKLR1等相互作用促进巨噬细胞极化和存活。通过在 CM6-high 区域中的共表达分析进一步在空间上验证了这些相互作用,强调了它们在塑造 CM6 的促肿瘤微环境中的作用(图6C-E)。通过体外刺激试验进一步研究了 SPP1 在促进肌成纤维细胞转化方面的潜力,揭示了其在结肠和肺癌中诱导肌成纤维细胞表型的能力(图 6 F)。
除了前面提到的成纤维细胞外,细胞共现分析发现 c19-MMP1 成纤维细胞是 CM7 的核心成分,同时还发现各种免疫细胞类型,包括 FOXP3 +调节性 T 细胞、LAMP3 +树突状细胞 (DC)、浆细胞样树突状细胞 (pDC)、INHBA +和 NLRP3 +巨噬细胞(图 5 A)。其中,FOXP3+ Treg和 LAMP3 + DC与免疫抑制密切相关,同时伴有“髓系细胞免疫抑制”和“Treg 和 Th2 流量”特征增加(图5 B-C),共同表明 CM7 表现出免疫抑制和促肿瘤特性。他们进一步使用 TCGA 和空间转录组数据验证了 c19 与不同癌症类型中这些免疫细胞的相关性(图 5 F)。
CM7中成纤维细胞和免疫细胞之间的细胞相互作用表明,c19可能通过趋化因子-受体相互作用促进白细胞运输,例如通过CCL2-CCR4、CXCL16-CXCR6和ICAM1-IL2RA/IL2RG募集Treg(图6B)。与对照组相比,荧光激活细胞分选(FACS)分选的MMP1+成纤维细胞与CD4+CD25+FOXP3+ Treg细胞共培养显著增强了Treg细胞的迁移(图6G)。外源性添加这些配体显著增强了Treg细胞的迁移,强调了它们在促进招募中的潜在作用(图6H)。
与免疫抑制 CM7 相反,富含 c20 的 CM4 表现出强的抗原呈递活性,表明具有强大的免疫激活作用(图 5B-C)。结肠癌中 CM4 细胞的空间映射显示它们位于三级淋巴结构 (TLS) 中,这通过 TLS 相关特征和配体-受体对的高表达得到进一步证实(图6C-D)。c03 与几种幼稚和记忆性 T 细胞亚群以及 CM2 中的 cDC2 细胞同时出现(图 5A),可能与有效的抗肿瘤免疫有关。
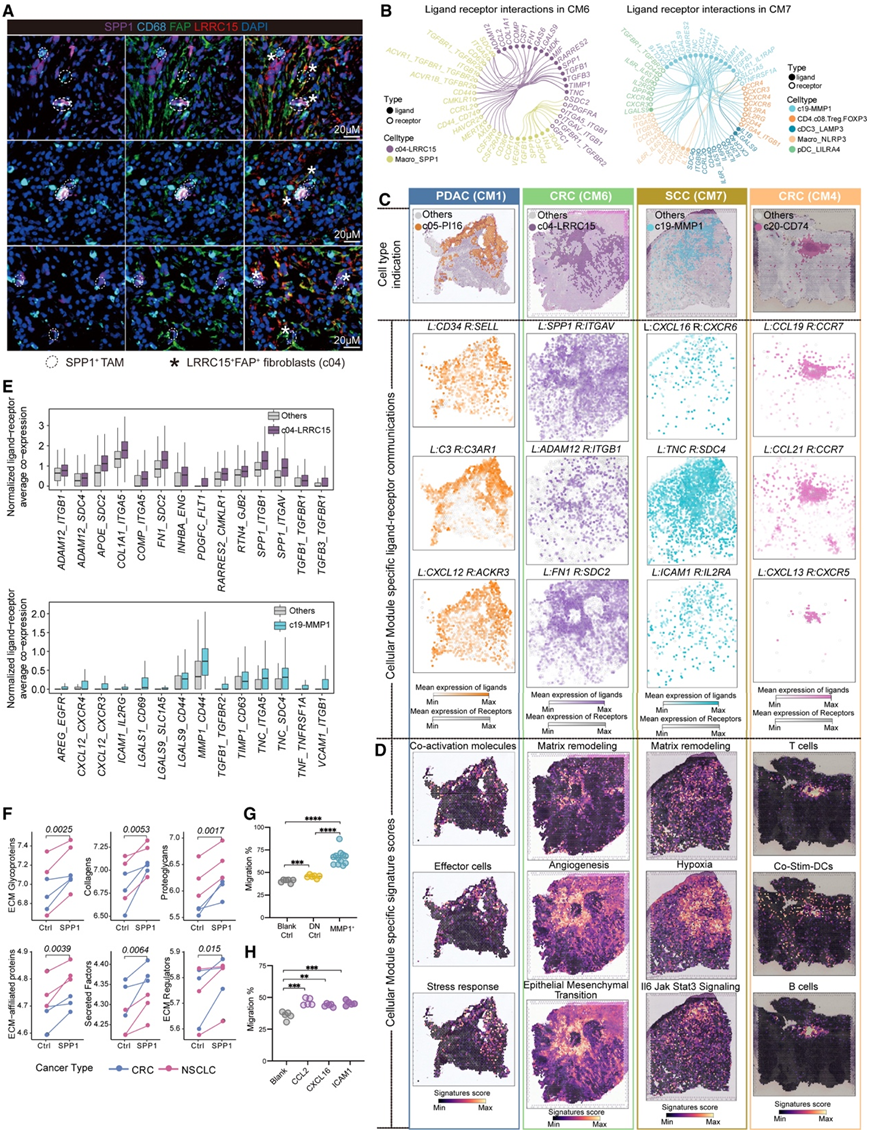
图6. 纤维细胞和免疫细胞亚群之间的细胞间相互作用。
(A) 代表性肺肿瘤标本中的 mIHC 染色。 (B) 配体-受体相互作用分析。(C) 空间特征图描绘了成纤维细胞亚群高区域和每个空间转录组载玻片中配体-受体对的基因表达。(D) 空间特征图。(E) 配体-受体对的共表达水平。(F) 点图比较了暴露于 SPP1 刺激的样本与对照条件下的样本的功能特征得分。(G-H) 细胞的迁移分析。
+ + + + + + + + + + +
结 论
本项研究对来自 517 个人类样本的成纤维细胞进行了全面的scRNA-seq,涵盖 11 种组织类型和不同的病理状态,确定了具有普遍和组织特异性特征的不同成纤维细胞亚群。病理状况导致成纤维细胞组成发生重大变化,包括炎症期间免疫调节成纤维细胞的扩增和癌症中组织重塑成纤维细胞。在成纤维细胞类别中,确定了四个转录上不同的亚群,它们来自不同的发育起源,其中 LRRC15 +成纤维细胞表现出终末分化特征。LRRC15+和 MMP1+成纤维细胞都表现出促肿瘤潜力,有助于免疫排斥和免疫抑制肿瘤微环境 (TME),而 PI16+成纤维细胞在相邻的非癌性区域中显示出潜在的抗肿瘤功能,成纤维细胞亚型组成定义了具有不同临床结果的患者亚型。
+ + + + +



 English
English


