文献解读|Nat Commun(16.6):葡萄膜黑色素瘤免疫基因组学预测免疫治疗耐药性和敏感性
✦ +
+
论文ID
原名:Uveal melanoma immunogenomics predict immunotherapy resistance and susceptibility
译名:葡萄膜黑色素瘤免疫基因组学预测免疫治疗耐药性和敏感性
期刊:Nature Communications
影响因子:16.6
发表时间:2024.04.16
DOI号:10.1038/s41467-024-46906-4
背 景
免疫检查点抑制已在治疗转移性皮肤黑色素瘤(CM)方面取得了成功,但对转移性葡萄膜黑色素瘤(UM)的疗效有限,目前缺乏对该类疗法的完整性分析。
实验设计

结 果
01
转移性葡萄膜黑色素瘤的临床基因组景观
2013年至2022年期间,美国国家癌症研究所和匹兹堡大学医学中心(NCT01814046和NCT03467516)通过手术从84名UM患者中获得了100个转移瘤,作为肿瘤浸润性淋巴细胞(TIL) 过继性细胞治疗(ACT)临床试验资格筛选的一部分。切除的转移灶起源于11个独特的解剖部位(图1a),肝脏是主要的获取部位(56%)(图1b)。患者有广泛的转移性疾病负担,95%有肝脏受累,75%有乳酸盐脱氢酶(LDH)水平升高,71%有M1B或M1C分期。治疗处治患者(24%)和治疗难治性患者(76%)均有转移灶(图1c)。值得注意的是,46例患者既往接受过免疫检查点抑制(ICI)治疗,9例患者接受过tebentafusp治疗。转移瘤的体细胞突变分析证实了低TMB(中位数=每兆碱基0.64个突变),普遍存在且相互排斥的已建立的UM驱动突变(GNAQ, GNA11, CYSLTR2或PLCB4)和BAP1(62%)和SF3B1(42%)的频繁继发性改变(图S1a-e)。体细胞拷贝数改变包括3号染色体丢失(46%)和8q增益(85%)(图1c)。未发现TMB与队列人口统计学之间存在关联(图S1f)。
总之,临床基因组学分析建立了这个患者队列,广泛代表了晚期UM和获得转移的典型UM驱动改变和低TMB。
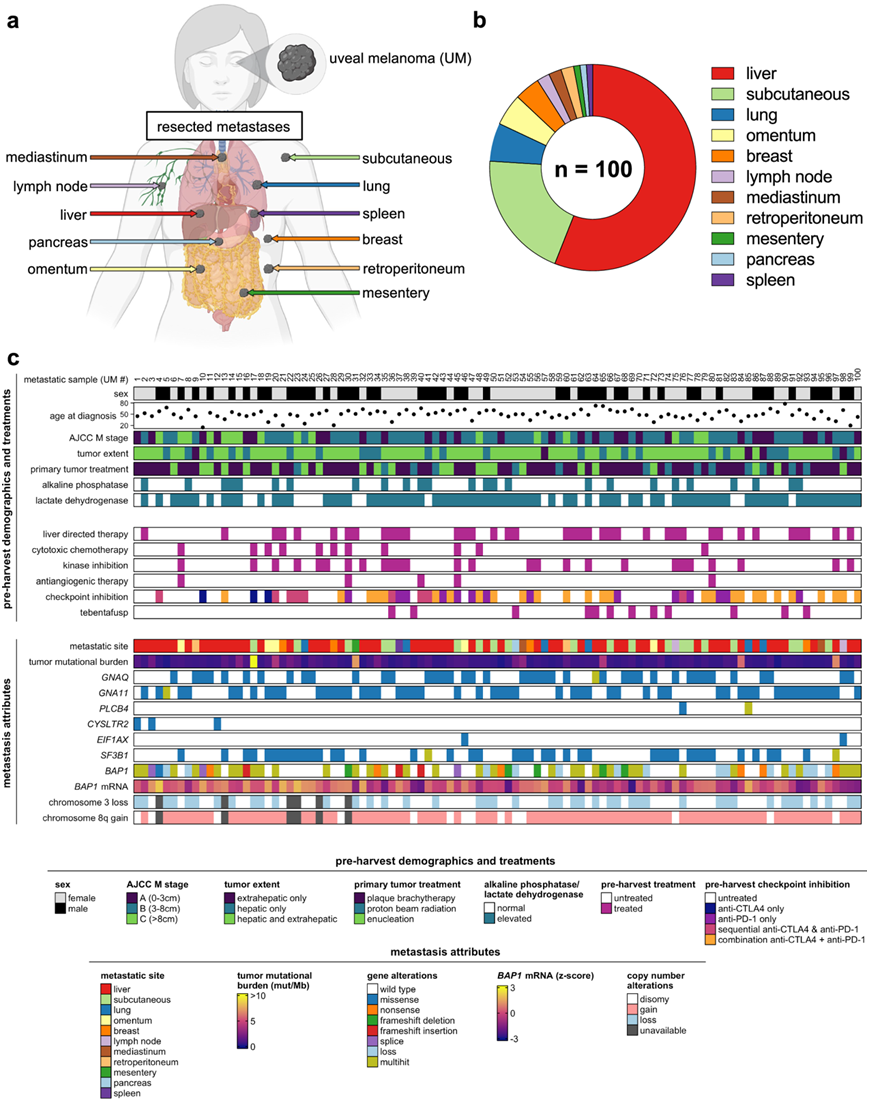
图1. 转移性葡萄膜黑色素瘤的临床基因组景观。
(a) 切除的转移瘤来源组织的多样性。(b) 切除的转移瘤来源组织的分布。(c) 个体转移的临床基因组注释。

图S1. 转移性葡萄膜黑色素瘤的详细基因组图谱。
(a) 转移瘤中检测到的变异类型。(b) 在转移瘤中检测到特异性变异。(c) 队列中十个最常发生突变的基因。(d) 10种最常突变基因的体细胞相互作用分析。(e) 基因组突变对致癌信号通路的影响评估。(f) TMB与切除转移灶源组织的比较。
02
转录组学揭示T细胞炎症葡萄膜黑色素瘤转移
接下来,他们进行了转录组分析(RNA-seq)。主成分分析 (PCA) 显示转移灶之间的大部分转录方差仅限于 PC 1、2 和 3(方差贡献:分别为 19%、13%、12%),而其余 PC(4-100)各自贡献~5% 或更少的方差(图2a)。PC-基因集相关性(Spearman 's rho)的无监督聚类(欧氏距离)确定了具有独特生物基序的4个离散聚类(A, B, C和D)。A类包括细胞代谢途径(MYC TARGETS V1, MTORC1信号传导,氧化磷酸化),B类包括免疫和炎症信号传导途径(干扰素α反应、干扰素γ反应、同种异体移植排斥反应、il -2-STAT5信号传导),C类包括肝脏主要生理途径(胆酸代谢、凝血、胆固醇稳态),D类包括细胞信号传导和分裂(WNT β - CATENIN信号传导、MYC TARGETS V2、G2M检查点)。单个转移性样本通过其每个标志基因集聚类的相对表达进一步聚类,以揭示整个肿瘤队列的惊人变异性(图2b)。在确定了转移瘤之间的转录组差异后,他们下一步试图确定三种pc是否与基因集聚类的表达独立相关。每个基因集聚类富集分数(A、B、C和D)的平均Spearman等级相关系数(rho)映射到pc(1、2和3)上(图2c)。他们观察到,聚类A(细胞代谢)与PC3密切相关,但与PC1的负相关也很弱。聚类B(免疫和炎症信号)与PC2的阴性方面完全相关。聚类C和D没有与三个pc中的任何一个独立相关。鉴于PC2与聚类B免疫途径的独立关联,他们假设PC2的坐标位置主要由这些转移瘤的内在免疫和炎症基因表达驱动。当T细胞活化基因集的富集分数映射到转移瘤的三维PCA图时,他们观察到每个基因集与PC2轴呈显著的负相关(图2d)。总的来说,无偏倚的计算分析显示PC2坐标定位是分离具有T细胞炎症转录组属性的UM转移瘤的有效初始方法。

图2. 无偏见的肿瘤转录组学揭示了 T 细胞发炎的葡萄膜黑色素瘤转移。
(a) Spearman 等级相关系数的无监督聚类。(b) 热图显示了 UM 转移瘤标志特征富集的异质性。(c) 每个聚类-PC 组合的平均 Spearman 等级相关系数矩阵。(d) 三维 PCA 图显示聚类 B 中确定的选择性标志免疫相关途径的富集分数。
03
葡萄膜黑色素瘤免疫基因组评分(UMIS)的发展
接下来,他们试图将基本的PC2变量细化为更具体和临床适用的UM转移免疫指标。首先,确定了2394个与免疫和炎症标志基因集富集正相关的基因。此外,为了实现单样本前瞻性分析,他们采用了一种基于队列的基于序列的基因集评分方法,根据转录本丰度计算个体活检的富集分数(每百万的转录本:TPM)。使用这种方法,他们为每个转移生成了一个单一的连续变量,称为葡萄膜黑色素瘤免疫基因组评分(UMIS),它反映了样本转录组中2394个基因列表的一致性和排序(图3a)。队列独立的UMIS与使用已建立的方法(GSVA)计算的相应队列依赖评分密切相关,证明本项研究方案可用于肿瘤活检的前瞻性评估(图3b)。在构成UMIS的2394个基因中,1527个是蛋白质编码基因,其余867个是非编码、未分类和伪基因的混合物(图3c)。UMIS编码基因的功能注释证实了与免疫和炎症反应相关的途径(图3d)。在100个转移瘤中,UMIS值为0.114 - 0.347,中位评分为0.237,这是定义UMIS高和低组进行分类比较的截止值(图3e)。高和低UMIS转移的基因集富集分析表明,最显著富集的途径存在于高UMIS组,并涉及T细胞活化(图3f)。UMIS水平与转移部位、TMB、体细胞突变和拷贝数改变以及I类人白细胞抗原(HLA)等位基因无关(图3g-h)。因此,UMIS代表了一种独特的单样本基因表达评分,该评分来自编码、非编码和未注释转录本的无偏混合,可以根据免疫和炎症基因的表达水平对UM转移进行排序。

图3. 葡萄膜黑色素瘤免疫基因组评分 (UMIS) 的发展。
(a) UMIS 开发的工作流程。(b) 通过队列独立方法计算的 UMIS 分数与通过队列依赖方法计算的 UMIS 分数的相关性。(c) 使用人类基因组组织 (HUGO) 基因命名委员会 (HGNC) 对 UMIS 基因进行注释。(d) 使用注释、可视化和集成发现数据库 (DAVID) 和人类分子特征数据库基因本体生物过程基因集集合对 UMIS 内的蛋白质编码基因进行功能注释。(e) 100 个转移瘤队列中 UMIS 评分的分布。(f) 高UMIS和低UMIS转移瘤差异表达基因的基因集富集分析。(g) 切除转移灶来源组织的 UMIS 比较。(h) UMIS 与 TMB 的相关性。
04
UMIS揭示了体内T细胞募集和排斥的驱动因素
他们通过两个步骤的过程,首先将细胞分类为肿瘤、免疫和基质,然后将特定的细胞和谱系特征(髓样与淋巴样)分配给免疫细胞分数,从而建立了一个独特的转移性UM单细胞图谱(图4a-b)。他们对低UMIS肿瘤的单细胞分析预期免疫细胞数量较少。然而,为了保持特定细胞类型的真实比例景观并避免操作诱导的转录组变化,他们在没有额外富集步骤的情况下对肿瘤消化进行了分析。观察到,与低UMIS转移相比,高UMIS转移的淋巴样细胞更多,肿瘤细胞更少(图4b)。此外,这些淋巴组织的组成不同,高UMIS转移灶由CD8+ T细胞富集,而低UMIS转移灶由CD4+ T细胞和T辅助/Th17 T细胞富集(图4c)。淋巴样细胞的颗粒分析显示,CD8+耗竭T细胞和CD8+细胞毒性T细胞富集了高UMIS转移灶(图4d)。有趣的是,他们观察到9%的CD8+耗竭和20%的CD8+细胞毒性TIL保留了TCF7的转录组表达,这表明可能具有祖细胞能力。淋巴细胞的差异表达基因显示,UMIS高转移的T细胞活化(TNFRSF9、TNFRSF4)、T细胞耗损(PDCD1、CTLA4、LAG3、HAVCR2、VSIR)、淋巴细胞活化(STAT1)、干扰素反应(HLA-A、HLA-B、HLA-C、B2M、IFNGR1、IRF1、IFI27、IFI6、IFITM1、IFITM2、IFITM3)、T细胞记忆(IL7R)、淋巴细胞转运(CXCL13、CCR7、SELL、CXCR3)和T细胞祖细胞能力(TCF7)等基因上调(图4e)。这些数据表明,在UMIS高转移灶中发现的TIL经历了激活和效应分化,这与体内适应性抗肿瘤反应一致,并表明T细胞炎症微环境。
接下来,他们研究了在高UMIS和低UMIS转移中发现的骨髓细胞(图4f)。虽然在两组中均没有特异性骨髓细胞类型(巨噬细胞、树突状细胞、肥大细胞)的富集,但差异表达基因显示,高UMIS的骨髓细胞表达上调的基因涉及CD8+ T细胞募集(CXCL10、CXCL9)、肿瘤吞噬(SLAMF7)、抗原加工(TAP1、TAP2)、抗原呈递(HLA-A、HLA-B、HLA-C、B2M、HLA-DPB1、HLA-DQB1、HLA-DRB1)和干扰素应答(IRF1、IRF8、IFI27、IFI6)(图4g)。
差异表达基因显示,高UMIS肿瘤细胞中几种干扰素诱导的转录因子和元件(IRF1、IFI27、IFI6、IFITM1、IFITM2、IFITM3)以及各主要组织相容性复合体(MHC) I类分子异源二聚体组分(HLA-A、HLA-B、HLA-C、B2M)的表达显著增加(图4h-i)。这些发现表明,高UMIS转移是由IFN-γ引发的肿瘤细胞组成的,这些肿瘤细胞在肿瘤特异性CD8+ T细胞慢性分泌IFN-γ时,MHC I类表达上调。相比之下,低UMIS肿瘤细胞编码β -连环蛋白的CTNNB1的表达高1.44倍(图4h-l)。Wnt/β -连环蛋白通路的激活与T细胞排斥有关,并可能解释低UMIS转移中CD8+ T细胞浸润的缺乏。在整个转移队列中,UMIS与先前报道的免疫抵抗程序的表达之间存在显著的负相关关系。有趣的是,在低UMIS肿瘤细胞中上调最多的基因是长链非编码RNA SNHG7,它在低UMIS肿瘤细胞中上调了3.48倍,并且在一些癌症中报道为CTNNB1表达的正调节因子(图4h-i)。他们的研究结果证实了在UM转移瘤中SNHG7和CTNNB1表达水平之间的强相关性(图4l),这种相关性与通过黑色素瘤特异性基因表达(S100A1、SOX10、MITF)和总RNA量(ACTB、GAPDH)测量的肿瘤细胞丰度无关(图4l-m)。

图4. UMIS 揭示了 T 细胞招募和排除的体内驱动因素。
(a) 对 6 个 UM 转移瘤进行分析的所有细胞的均匀流形近似和投影 (UMAP) 图。(b) UMIS 组内总体细胞类型的比例。富集倍数是指比例(高 UMIS/低 UMIS)。(c) UMIS 组内淋巴广泛细胞类型的比例。(d) UMIS 组内淋巴颗粒细胞类型的火山图。(e) 从高 UMIS 与低 UMIS 淋巴细胞的差异表达基因分析中选择的基因。(f) UMIS 组内骨髓广泛细胞类型的比例。(g) 从高 UMIS 与低 UMIS 骨髓细胞的差异表达基因分析中选择的基因。(h) 高 UMIS 和低 UMIS 肿瘤细胞之间差异表达基因的热图。(i) 从高 UMIS 与低 UMIS 肿瘤细胞的差异表达基因分析中选择的基因。(j) UM转移瘤中UMIS与免疫耐药方案评分的相关性。(k) 按 UM 转移中的 UMIS 水平比较免疫抵抗计划评分。(l) UM 转移中 SNHG7 与 CTNNB1 转录本表达的相关性。 (m) UM 转移中 SNHG7 与典型黑色素瘤标记转录本(S100A1、SOX10、MITF)的相关性分析。
05
UMIS 预测离体扩增 TIL 的抗肿瘤效力
为了验证转录组学证明 T 细胞炎症基因表达,他们探索了每个 UM 转移灶的内源性 TIL 的特异性抗肿瘤效力,将源自每个来源转移的单次随机活检的 UMIS 值与传统离体扩增后发现的 TIL 抗肿瘤反应性水平进行了比较(图 5a)。通过与自体肿瘤消化物(与正常组织对照)共培养,然后检测到 CD3+ 细胞上的 4-1BB 上调(流式细胞分析)和 IFN-γ 释放(ELISA),测试各个 TIL 片段培养物的肿瘤特异性,结果发现强相关(图 5b-c)。
来自每个转移的具有肿瘤特异性反应性的TIL培养物的百分比用作标准化反应性度量,用于比较跨肿瘤的抗肿瘤TIL反应水平(图 5d)。肿瘤反应性 TIL 培养物的频率在整个队列中存在显著差异,其中 55 个转移瘤具有可测量的抗肿瘤反应性,其余 45 个转移瘤未检测到反应性(图 5e)。当将每个来源转移的 UMIS 与几周后生成的肿瘤反应性 TIL 培养物的百分比进行比较时,他们发现了很强的正相关性(图5f)。
为了进一步表征UMIS在100例UM转移患者中的结果,他们对其预测共培养抗肿瘤反应性的能力进行了基准测试,包括TMB、浸润CD8+ T细胞的百分比和几种已发表的T细胞炎症基因表达谱(图5g-h)。他们发现UMIS作为预测离体TIL反应性的相关指标和分类指标(AUC = 0.85)都表现最好(图5g-h)。UMIS水平可以在单个UM患者的同步转移中识别出肿瘤反应性TIL产量最高的转移灶(图5i)。在转移性肿瘤活检的前瞻性和独立验证队列中,他们证实了UMIS对体外TIL反应性的预测能力(图5j)。

图5. UMIS 预测离体扩增 TIL 的抗肿瘤效力。
(a) 用于并行分析源肿瘤转录组和扩展 TIL 抗肿瘤反应性的工作流程。(b) 从源肿瘤 UM #100 中筛选 TIL 培养物抗肿瘤反应性的示例。(c) 过夜肿瘤共培养后,来自 UM #100 的 24 个片段培养物中 %4-1BB + CD3+ 细胞与 IFN-γ 释放之间的相关性。(d) 通过源肿瘤 UM #100 的 4-1BB 上调和 IFN-γ 释放评估单个 TIL 片段培养物抗肿瘤反应性。(e) 100 个转移瘤队列中肿瘤反应性 TIL 培养物百分比的分布。(f) UMIS 与肿瘤反应性 TIL 培养物百分比的相关性。(g) UMIS 与已发表的基因表达谱和肿瘤生物标志物的相关基准测试。(h) UMIS 针对已发表的基因表达谱和肿瘤生物标志物的预测基准。(i) UM 患者 #1 中同步肝转移的 UMIS 和 TIL 培养反应性不同。(j) 在独立的转移性活检队列中验证 UMIS 预测离体 TIL 反应性的能力。
06
UMIS 鉴定出对 ICI 和 tebentafusp 具有抗性但对离体扩增和过继转移敏感的静态 TIL
他们发现 TCR β(TRB)和 TCR α(TRA)链的原位多样性在整个转移队列中存在显著差异(图6a)。研究发现UMIS与TRB多样性和TRA多样性密切相关,这表明UMIS高转移灶有更多的多克隆T细胞浸润(图6a)。相比之下,TRB和TRA克隆性(相对TIL克隆扩增的体内替代指标)在样品中较低且变异最小(图6a)。单细胞TCR库分析进一步证实了这些TIL的体内静止性,显示出低克隆性和单细胞转录组学,发现在高和低UMIS转移中增殖T细胞的百分比同样低(图4c,图6b)。有趣的是,与未治疗的样本相比,ICI治疗对TCR多样性没有影响(图6a-c)。相比之下,先前的tebentafusp治疗与更大的TCR多样性相关,这与这种双特异性T细胞接触器招募T细胞到这些转移灶的能力一致(图6a-c)。然而,先前的ICI和tebentafusp治疗均未与TCR克隆性增加相关,这表明这些免疫疗法无法诱导内源性TIL的体内增殖。
为了确定肿瘤内T细胞的增殖不足是由于T细胞耗竭还是其他内在的增殖缺陷,他们进行了临床规模的体外快速扩增(REP),从UM转移灶中分离出TIL,这些TIL要么对ICI和tebentafusp不敏感,要么对ICI、tebentafusp或两种疗法都具有耐药性(图6d-e)。他们观察到,每个转移灶的TIL都表现出大约5倍的扩增(图6d-e)。此外,与高度特异性靶向TCR测序相比,这些扩增的TIL显示TCR多样性显著降低,TCR克隆性显著增加(图6d-e)。
由于UMIS可以预测静息内源性TIL的体外效力,他们假设UMIS也可以预测这些TIL在体外释放和扩增后过继转移的临床疗效(图6f)。在分析的100例转移性UM中,有19例已用于生成TIL,用于先前报道的转移性UM患者的ACT试验(NCT01814046)。在该治疗队列中,包括6名应答者和13名无应答者,他们观察到源肿瘤UMIS与rep后TIL输注产品的体外抗肿瘤反应性之间存在很强的相关性(图6g)。此外,他们发现UMIS作为一个连续变量与转移性UM患者(包括ICI难治性患者)过继转移后临床肿瘤消退的程度密切相关(图6h)。
为了帮助定义一个 UMIS 阈值,该阈值可能在预测 RECIST 客观反应(减少≥30%)方面具有未来的临床实用性,他们利用无反应组的中位 UMIS 值作为反应阈值(图 6i)。与低于阈值的患者相比,源转移高于该阈值的患者在 TIL ACT 后显著改善了无进展生存期和总生存期(图 6j)。总之,这些发现表明,在治疗前转移性活检中进行的 UMIS 与 TIL 过继转移后的临床结果相关,并且可以作为 ACT 治疗转移性 UM 的未来预测生物标志物。

图6. UMIS 鉴定出对 ICI 和 tebentafusp 具有抗性但对离体扩增和过继转移敏感的静态 TIL。
(a) 对 UM 转移瘤的bulk RNA-seq进行 T 细胞受体 β (TRB) 谱分析。(b) 按单细胞图谱计算的 UMIS 组中增殖性 T 细胞的比例。(c) 未治疗的 ICI 或 tebentafusp 与已治疗的转移瘤中 TRB 多样性和克隆性的比较。(d) 来自未接受治疗和难治性患者的体外 TIL 扩增。(e) 离体 TIL 扩增的 TRB 动力学示例。(f) 在 NCT01814046(转移性 UM 的 TIL ACT)背景下评估 UMIS 的示意图。(g) 源转移 UMIS 与 TIL 输注产品反应性的相关性。 (h) TIL ACT 后源转移 UMIS 与肿瘤大小相对于基线 (RECIST v1.1) 的最大百分比变化的相关性。 (i) TIL ACT应答者和无应答者之间 UMIS 的比较。 (j) 按 UMIS 反应阈值计算的 ACT 后生存时间-事件曲线。
+ + + + + + + + + + +
结 论
本项研究使用临床基因组学、转录组学和肿瘤浸润淋巴细胞效力评估来全面分析 100 个人类葡萄膜黑色素瘤转移瘤。虽然突变负荷低且对先前的免疫疗法具有抵抗力,但超过一半的转移瘤含有具有强自体肿瘤特异性的肿瘤浸润淋巴细胞。即使在先前的免疫治疗之后,肿瘤微环境中的肿瘤内 T 细胞受体克隆性也非常低。为了利用这些静止的肿瘤浸润淋巴细胞,本项研究开发了一种转录组生物标志物,能够进行体内识别和离体释放,以对抗它们的生长抑制。当其他免疫疗法无效时,这些转录组选择的肿瘤浸润淋巴细胞的过继转移可以促进转移性葡萄膜黑色素瘤患者的肿瘤免疫。
+ + + + +



 English
English


