文献解读|Microbiome(15.5):肠道菌群失调通过补体 C3 介导的小胶质细胞异常突触修剪诱导抑郁样行为的发生
✦ +
+
论文ID
原名:Gut dysbiosis induces the development of depression-like behavior through abnormal synapse pruning in microglia-mediated by complement C3
译名:肠道菌群失调通过补体 C3 介导的小胶质细胞异常突触修剪诱导抑郁样行为的发生
期刊:Microbiome
影响因子:15.5
发表时间:2024.02.20
DOI号:10.1186/s40168-024-01756-6
背 景
重塑肠道微环境的优生可能有助于预防抑郁症的发生和发展。越来越多的实验证据表明,补体 C3 信号传导与抑郁症的发病机制有关,肠道微生物群的破坏可能是补体系统激活的根本原因。然而,补体 C3 参与抑郁症发病机制中肠脑串扰的机制仍不清楚。
实验设计
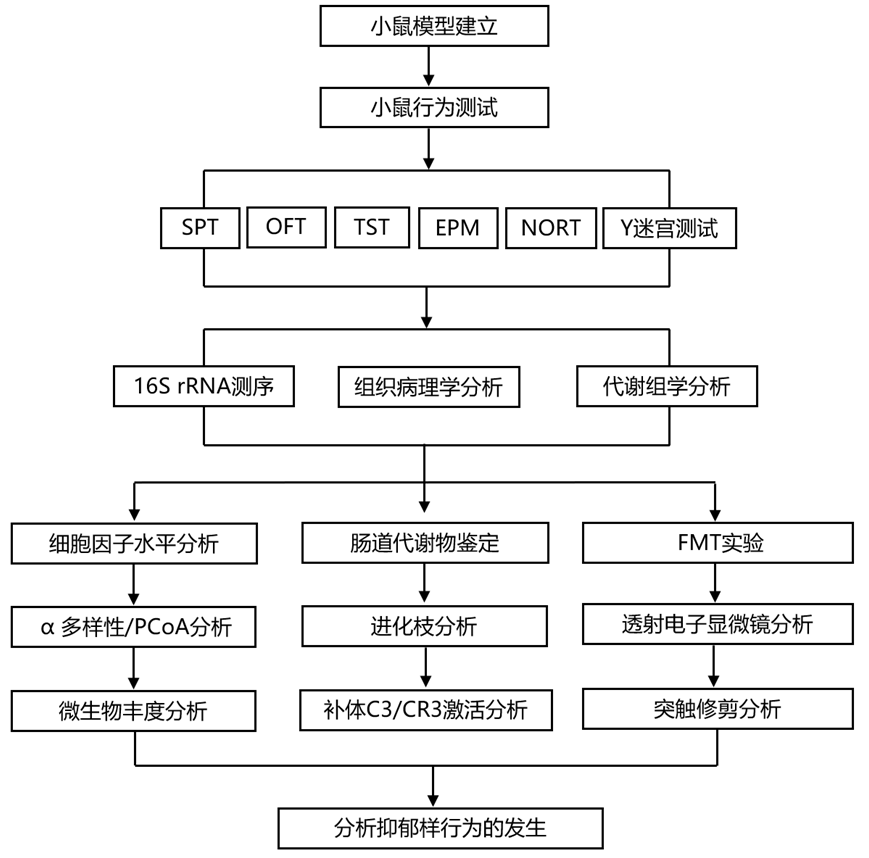
结 果
01
XYS 作为潜在的抗抑郁药,以肠道微生物依赖性方式减轻 CUMS 诱导的抑郁/焦虑样行为和认知障碍
逍遥散(XYS)是一种由多种中药组成的药物,其在亚洲国家(包括中国、日本和韩国)作为情绪障碍的传统治疗方法有着悠久的历史,并且在欧洲国家(包括英国、荷兰)也作为保健食品或草药传统应用。研究团队设计了实验,以评估抑郁症发展过程中肠道微生物群、补体系统和突触修剪的变化,以及 XYS 作为潜在抗抑郁药的药效作用(图 1a)。适应1周后,将小鼠随机分为四组(实验1):对照组、慢性不可预测的轻度应激组 (CUMS)、CUMS+XYS和CUMS+氟西汀(FLX)。除对照组外,其他三组均连续八周承受各种压力源。治疗方法如下:(1)对照组:不给予应激刺激,作为阴性对照。(2)CUMS组:CUMS持续8周,随后每天口服磷酸盐缓冲盐水(PBS),持续4周; (3)CUMS+XYS组:CUMS连续8周,随后每天口服XYS(0.658g/kg/天,连续4周; (4)CUMS+FLX组:CUMS持续8周,随后每天口服FLX。收集海马、下丘脑和前额皮质组织以供将来分析。收集 CUMS 和 CUMS + XYS 组的新鲜粪便(含有或不含代谢物的肠道微生物群)用于后续粪便微生物群移植(FMT)(图 1 A)。评估了抗生素干扰 XYS 抗抑郁作用的能力(图 1 B)。通过使用由氨苄青霉素(1.5 g/mL;A9518;Sigma Aldrich)、万古霉素(500 mg/L;V820413;Macklin)组成的抗生素混合物预先破坏肠道微生物来评估抗生素诱导的微生物群破坏对 XYS 功效的影响。
使用 6 至 8 周大的无特定病(SPF)和无菌(GF) 雄性 C57BL/6 小鼠评估了粪便微生物群对抑郁症的治疗效果(图 1C)。适应1周后,将SPF小鼠随机分为四组:(1)对照组:不接受应激刺激,作为阴性对照; (2)对照组+FMT(CUMS)组:无应激刺激8周,随后每日FMT(实验1中CUMS组的粪便),持续4周; (3)CUMS组:CUMS持续8周,随后每天口服PBS,持续4周; (4)CUMS+FMT(XYS)组:CUMS持续8周,随后每日FMT(实验1中CUMS+XYS组的粪便),持续4周。适应1周后,将GF小鼠随机分为两组,如下:(1)GF组:不接受应激刺激,作为阴性对照;(2)GF+FMT(CUMS)组:8周无应激刺激,随后每日FMT(实验1中CUMS组的粪便),持续4周。
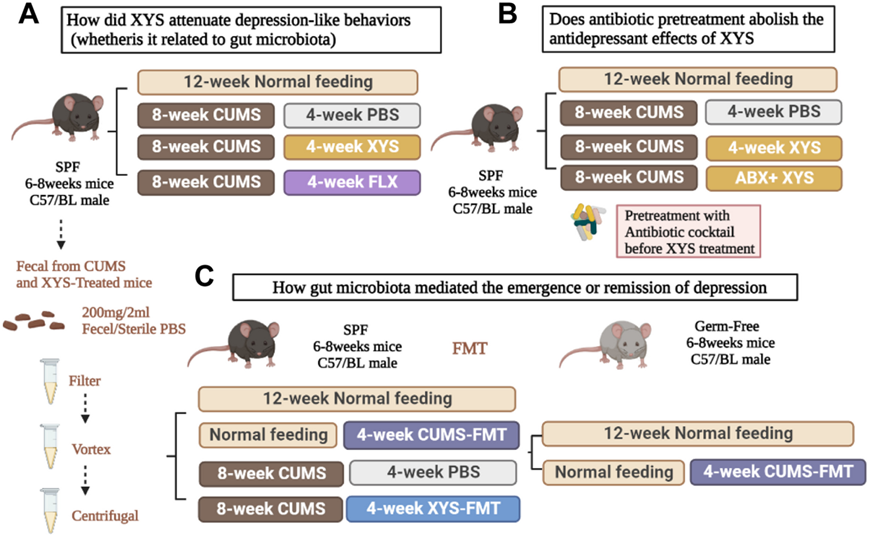
图1. 整个实验的研究设计。
通过给予小鼠 8 周的 CUMS,然后每天口服 XYS 4 周,诱导小鼠抑郁样行为,评估 XYS 对 CUMS 诱导的抑郁样行为的潜在抗抑郁活性(图 2 A)。在接受 8 周 CUMS 干预的小鼠中观察到显著的抑郁样行为。成功建立 CUMS 小鼠模型后,检查了 XYS 干预对小鼠行为的影响。与 CUMS 组相比,XYS 干预显著减轻了 CUMS 诱发的抑郁样行为,表现为体重减轻明显减少、蔗糖偏好测试(SPT)显示对蔗糖偏好增加、旷场测试(OFT)总距离和进入频率增加以及尾部悬挂测试(TST)静止时间减少(图2B-F)。XYS 治疗还显著改善了 CUMS 诱导的抑郁样行为小鼠的焦虑样行为和认知障碍。接受 XYS 干预的小鼠显示高架十字迷宫测试 (EPM) 中开臂进入的频率增加(图 2 G),并且新物体识别测试(NORT)(图 2 H)和 Y 迷宫测试(图 2 I)中对新区域的探索增加(图2J)。这些结果表明XYS具有显著的抗抑郁作用,可以作为潜在的抗抑郁药进行进一步研究。
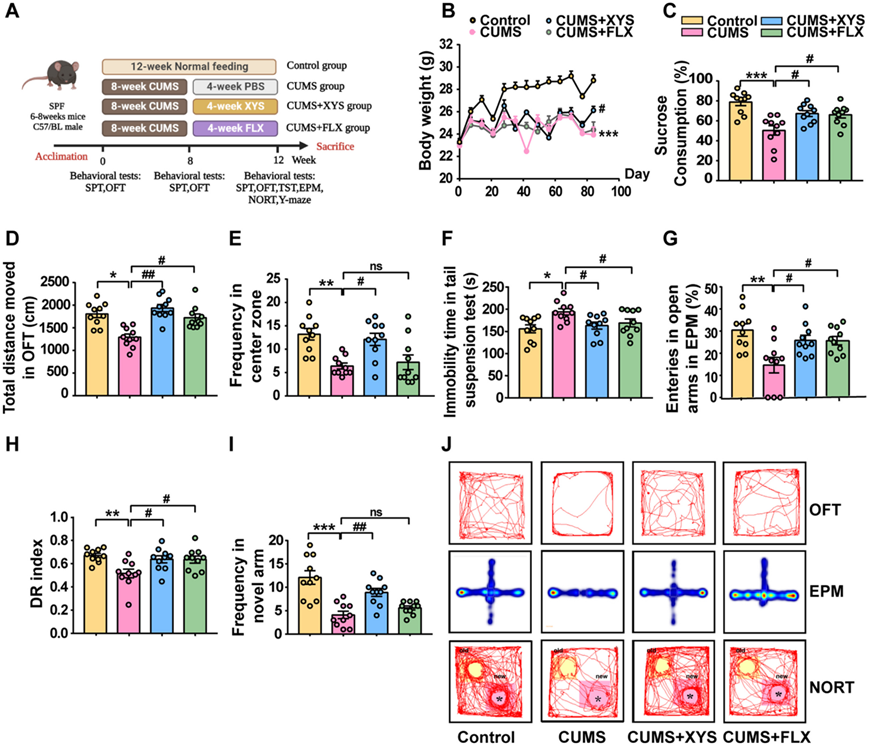
图2. XYS 作为潜在的抗抑郁药,可以减轻 CUMS 引起的抑郁/焦虑样行为和认知障碍。
(A) 适应1周后,将小鼠随机分为如下四组:对照、CUMS、CUMS+XYS和CUMS+FLX。(B) 在整个研究期间每日体重变化。(C) 蔗糖偏好测试(SPT)。(D) 旷场测试(OFT)(移动总距离)。(E) OFT(中心区频率)。(F) 尾部悬挂测试(TST)。(G) 高架十字迷宫 (EPM)。(H) 新物体识别测试(NORT)。(I) Y型迷宫。(J) OFT、EPM 和 NORT 中小鼠的运动轨迹。
02
抑郁样行为伴随着肠道菌群失调
为了了解抑郁症发展过程中结肠病理、屏障功能和全身炎症的变化,他们评估了组织学分析、结肠超微结构形态和血清中炎症细胞因子的水平。与对照小鼠相比,具有抑郁样行为的小鼠表现出明显的结肠炎症,并且病理评分显著升高(图 3A-B)。透射电子显微镜显示,具有抑郁样行为的小鼠的微绒毛大小和数量减少,肠道屏障外观异常(图 3 C)。结肠炎症的加重和屏障功能的破坏会影响外周炎症因子的水平。 CUMS模型中IL-10的表达受到抑制,并且在具有抑郁样行为的CUMS小鼠的血清中观察到IL-1β、IL-6和TNF-α水平升高(图 3D -G)。服用抗抑郁药可以改善结肠屏障功能和炎症病理学。服用XYS后,肠道炎症得到改善,结肠微绒毛的大小和数量增加,异常排列得到逆转(图 3A -C)。此外,XYS还降低了具有抑郁样行为的小鼠血清中IL-1β、IL-6和TNF-α的水平,并增加了IL-10的水平(图 3D-G)。
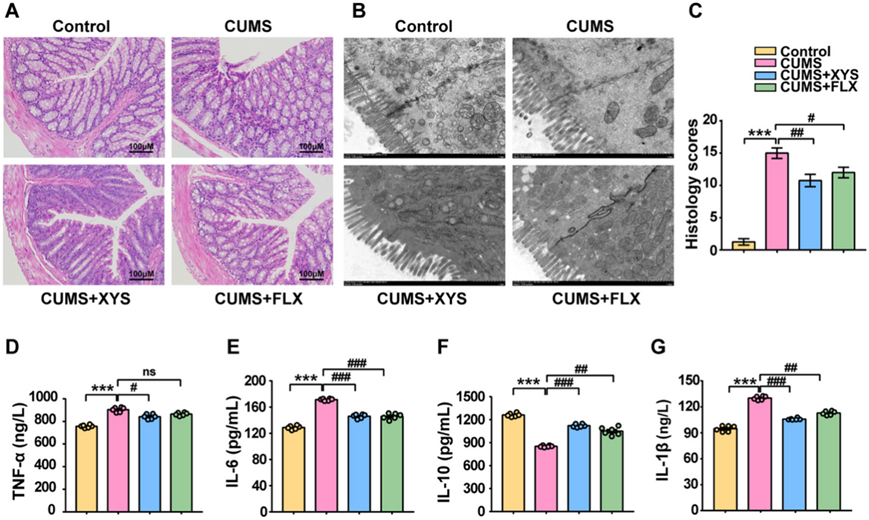
图3. XYS 抑制 CUMS 诱导的结肠炎症反应,改善屏障功能。
(A) H&E染色结肠切片(× 200)。(B) 透射电镜分析(× 10000, 1um) 。(C) 结肠的组织学分数。(D-G) IL-1β、TNF-α、IL-6 、IL-10 水平。
通过 16S rRNA 基因测序和 UHPLC-QTOF-MS/MS 分析评估抑郁症模型中肠道微生物群和肠道代谢物的变化以及抗抑郁药物的反应。香农指数显示的 α 多样性结果表明,具有抑郁样行为的小鼠肠道微生物多样性降低,并且可以通过口服抗抑郁药(XYS 或 FLX)恢复(图 4 A)。基于 Bray-Curtis 距离的主坐标分析 (PCoA) 揭示了对照小鼠和具有抑郁样行为的小鼠之间肠道微生物群结构的差异(图 4 B)。CUMS + XYS 组和 CUMS 组之间肠道菌群结构存在显著差异,表明口服 XYS 显著影响表现出抑郁样行为的小鼠的粪便微生物群结构。
本研究共鉴定出 37 个门。厚壁菌门、拟杆菌门和变形菌门是小鼠粪便微生物群中的优势门。变形菌门是具有抑郁样行为的小鼠粪便微生物群中的优势门。与未经治疗的 CUMS 小鼠相比,XYS 干预显著降低了变形菌的丰度(图 4 C-D)。通过对微生物组数据进行 LEfSe 分析生成的进化枝图(图 4 E-F)显示,CUMS 组和 XYS 组的科水平上分别有 9 个和 5 个差异富集的进化枝。在属水平上(图4G-I),与对照组相比,CUMS组Bacteroides和Klebsiella的丰度显著增加,而口服XYS显著降低了Bacteroides和Klebsiella的相对丰度。XYS给药显著增加了CUMS小鼠中乳酸杆菌的相对丰度。
为了进一步探讨肠道代谢物的变化是否参与抑郁样行为的形成和抗抑郁药物的调节,使用 UHPLC-QTOF-MS/MS 在正负模式下分析小鼠的结肠内容物。应用 PLS-DA 方法研究对照组、CUMS、CUMS + XYS 和 CUMS + FLX 组的分离。在四组之间观察到了分离,表明抑郁样行为的发展或抗抑郁药物的摄入发生了代谢变化(图 4 J)。为了进一步阐明这些具体变化,使用监督多元正交偏最小二乘判别分析(OPLS-DA)模型来区分不同变量。CUMS 组与对照组和 CUMS + XYS 组分开。他们对结肠内容物样本中的微生物组和代谢物进行了Spearman相关性分析。肠道微生物群的变化与LPS生物底物的关系最为显著(图4K)。
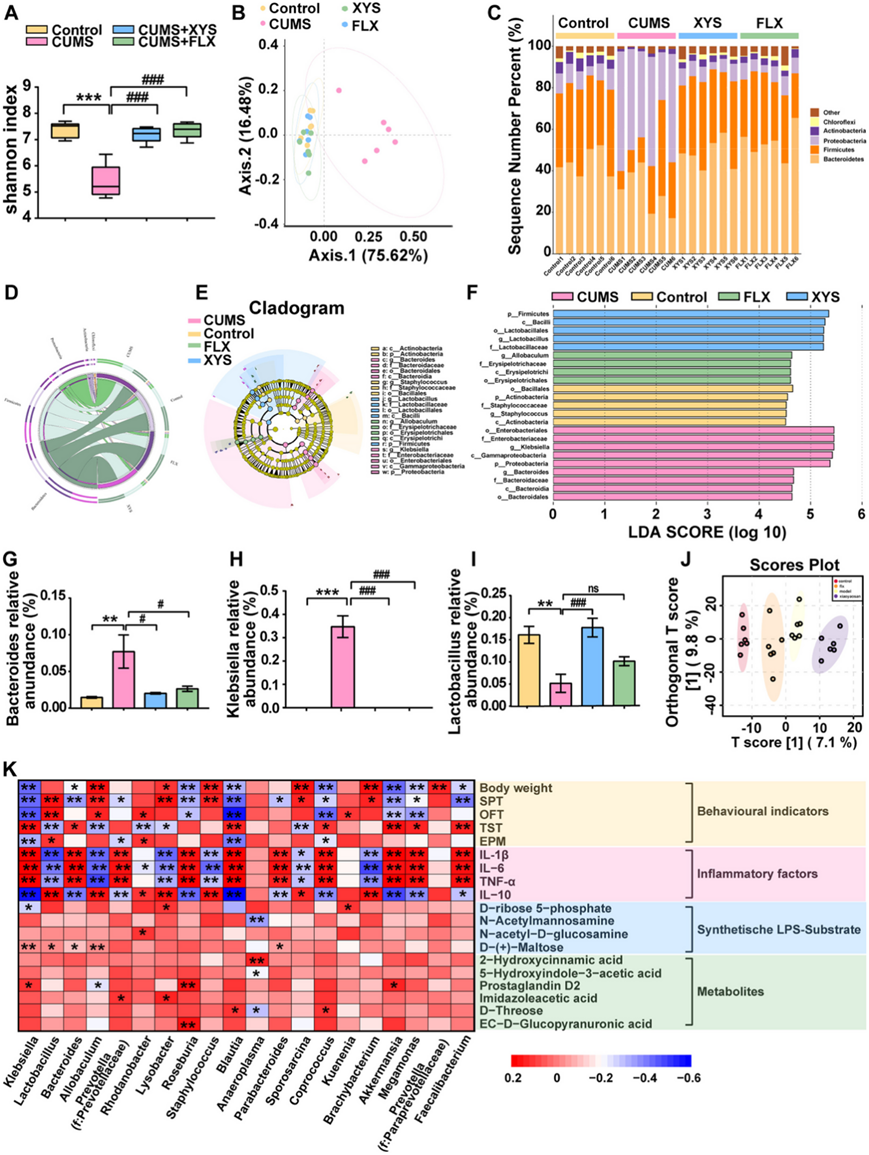
图4. 抑郁样行为伴随着肠道稳态的失调,而抗抑郁药可以恢复肠道稳态。
(A) Alpha 多样性。(B) PCoA分析。(C) 门水平的肠道微生物群变化。(D) 肠道微生物群在门水平发生变化。(E-F) 分支图显示科水平的肠道微生物群变化。(G-J) 拟杆菌属、克雷伯菌属、乳酸杆菌属相对丰度。(K) Spearman 微生物组和代谢组的相关性分析。
03
补体C3/CR3激活和补体参与的小胶质细胞介导的异常突触修剪
为了验证代谢检测的可靠性,他们评估了血清中的LPS含量。具有抑郁样行为的小鼠血清中LPS浓度较对照小鼠显著升高(图 5A)。然而,XYS 给药降低了脂多糖(LPS) 水平,这与代谢组学分析中观察到的测序结果一致。作为补体系统激活的重要通路,LPS 在具有抑郁样行为的小鼠血清中表现出高表达(图 5 A)。他们探索了外周和中枢补体系统以及突触修剪的可能变化,在血清样本中观察到补体 C3 水平显著升高(图 5 B)。另外,检测了CNS中C3的表达。评估海马、下丘脑和前额皮质中补体 C3 的蛋白表达水平。前额皮质中补体 C3 的表达显著增加(图 5 C)。补体系统参与大脑中小胶质细胞突触修剪的调节。补体 C3 通过引导趋化性小胶质细胞的生长并与小胶质细胞上的补体受体结合,诱导小胶质细胞吞噬标记的突触。
利用免疫荧光观察PFC中补体C3受体CR3的表达和定位。 CUMS 诱导 PFC 中 CR3 表达增加。这表明在抑郁症的发展过程中,C3/CR3 信号传导的激活与细胞质中的小胶质细胞共定位(图 5 D-F)。突触蛋白SYN和PSD95是反映突触生长和维持的重要指标。接受 CUMS 的小鼠前额皮质中 SYN 和 PSD95 的蛋白表达显著降低,表明抑郁期间突触功能受损(图5G-H)。同时,XYS给药降低了外周和前额叶皮质中补体C3的表达,抑制了C3/CR3通路的激活,并增加了突触蛋白SYN和PSD95的表达水平,表明抗抑郁药抑制了补体相关的小胶质细胞介导的异常。
总的来说,这些结果表明补体 C3/CR3 激活和小胶质细胞介导的异常突触修剪是抑郁症的重要病理表现。同时,抗抑郁药抑制 CUMS 诱导的补体 C3/CR3 激活和补体相关的小胶质细胞介导的异常突触修剪,从而维持突触神经元的正常生长。
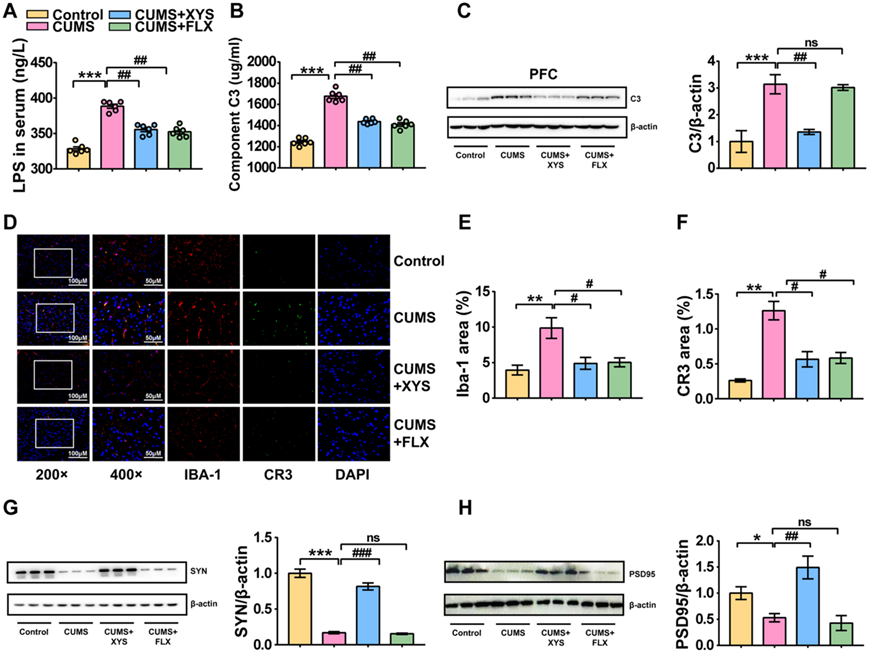
图5. 补体C3/CR3激活和补体相关的小胶质细胞介导的突触异常修剪是抑郁症的重要病理表现。
(A) 血清中的LPS。(B) 血清中的C3 。(C) PFC中 C3 的蛋白表达水平。(D) 小胶质细胞和 CR3 的免疫荧光分析。(E) PFC中IBA-1蛋白的表达。(F) PFC中CR3蛋白的表达。(G-H) PFC中SYN和PSD95的蛋白表达水平。
04
移植失调的肠道微生物群会导致抑郁样行为的发生
肠道微生物群与抑郁症发病之间的联系得到了验证。通过移植来自 CUMS 诱导小鼠的粪便微生物群来确定 CUMS 介导的微生物群对 SPF 和 GF 小鼠的影响(图 6 A)。FMT 后 SPF 和 GF 小鼠均表现出明显的抑郁样和焦虑样行为,并伴有认知记忆障碍。与对照小鼠相比,接受 CUMS 诱导小鼠粪便微生物群的 SPF 小鼠表现出体重减轻、蔗糖偏好降低、OFT 总距离缩短以及 NORT 和 Y 迷宫中对新奇事物的渴望降低;这与 8 周 CUMS 刺激后的小鼠相似(图 6 B-H)。在 GF 小鼠中也观察到类似的结果。接受 CUMS 小鼠粪便微生物群的 GF 小鼠表现出 OFT 中的总运动距离显著减少,TST 中的不动时间增加(图 6 I-K),以及 NORT 和 Y 迷宫中的认知障碍(图 6L-N)。这些结果表明,在与压力无关的条件下,接受具有抑郁样行为和认知障碍的 CUMS 宿主的 FMT 可能会导致行为异常,包括抑郁样行为。
此外,通过将来自施用 XYS 的小鼠的粪便微生物群移植到 CUMS 诱导的小鼠中,评估了抗抑郁药介导的微生物群对抑郁症的影响。与未经治疗的 CUMS 诱导小鼠相比,接受 XYS 治疗小鼠粪便微生物群的 CUMS 小鼠体重增加和蔗糖偏好显著改善(图 6 B-E)。然而,在接受 XYS 治疗小鼠粪便微生物群的小鼠中,并未观察到焦虑样行为和认知障碍的改善(图 6 F-G),相关的行为变化表明有缓解趋势,但没有统计学意义。
这些结果表明,CUMS-FMT 有助于抑郁样行为、焦虑样行为和认知障碍,而 XYS-FMT 有助于缓解抑郁,但不能缓解焦虑样行为和认知障碍。这表明肠道菌群失调会诱发抑郁样行为的发生,而抗抑郁药物治疗的 FMT 对抑郁样行为具有抑制作用。
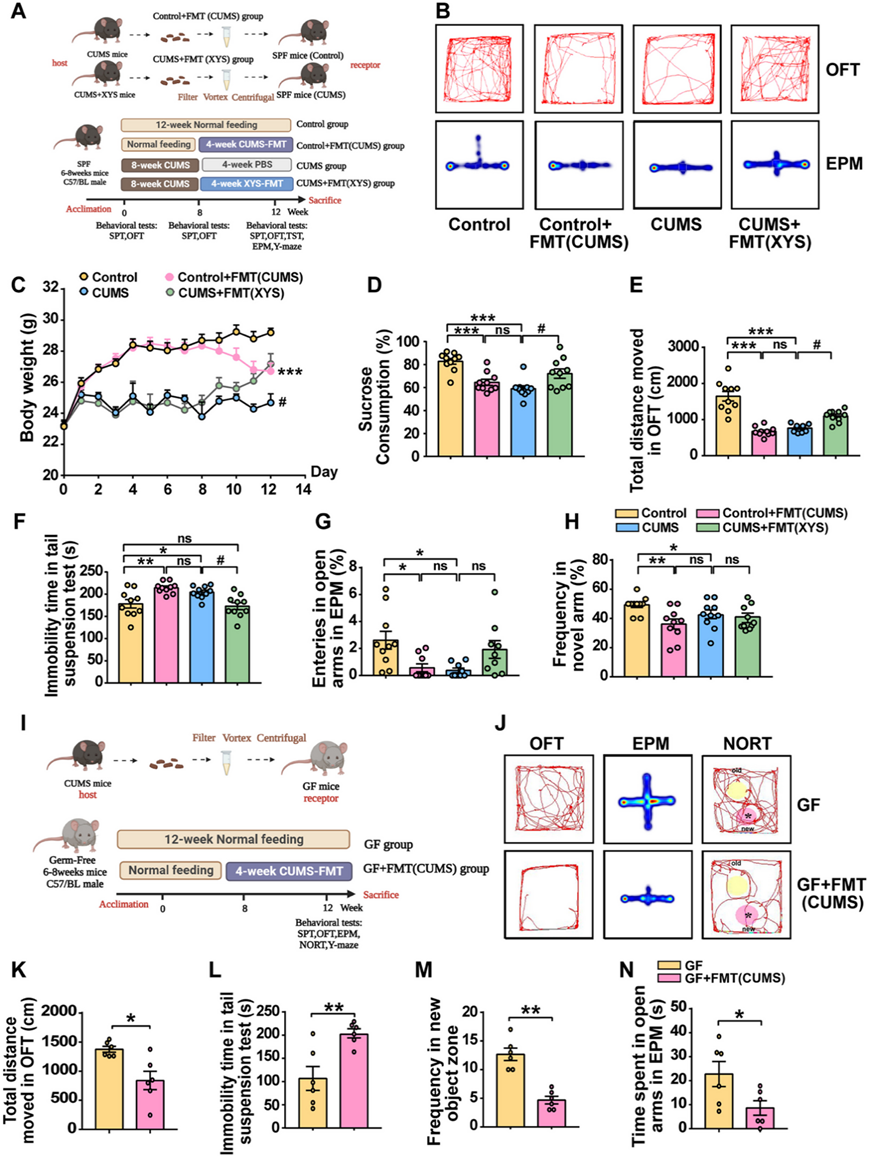
图6. 失调的肠道微生物群的移植直接诱导抑郁样行为的发展。
(A) 适应1周后,将小鼠随机分为四组:对照、对照+FMT(CUMS)、CUMS和CUMS+FMT(XYS)。(B) OFT(移动总距离)(SPF 小鼠)。(C)小鼠体重。(D)蔗糖消耗。(E) OFT。(F) TST(SPF 小鼠)。(G) EPM(SPF 小鼠)。(H)Y迷宫测试。(I) GF小鼠的研究设计。(J) 小鼠在OFT, EPM中的运动轨迹。(K) OFT。(L) TST。(M) NORT。(N) EPM。
05
肠道微生物群失调介导结肠炎症和屏障破坏
对 CUMS 组小鼠和 XYS + CUMS 组小鼠进行 FMT实验,以研究CUMS-FMT和XYS-FMT对结肠炎症和肠道屏障功能的生物活性。检测HE染色、结肠超微结构形态以及血清IL-1β、IL-6、TNF-α和IL-10水平。与对照小鼠相比,接受 CUMS 诱导小鼠粪便微生物群的 GF 和 SPF 小鼠均表现出明显的结肠炎症综合征(图 7A)。透射电子显微镜显示微绒毛的尺寸和数量减少,并且表现出异常的外观(图 7B)。在接受 CUMS 诱导小鼠粪便微生物群的 SPF 和 GF 小鼠中,还观察到 IL-10 浓度降低,IL-1β、IL-6 和 TNF-α 水平升高(图 7 C-H) 。
通过将来自施用 XYS 的小鼠的粪便微生物群移植到 CUMS 诱导的小鼠中,验证了抗抑郁药介导的微生物群对抑郁症的影响。在SPF小鼠中,XYS-FMT逆转了CUMS诱导的结肠炎症(图 7A)。透射电镜显示CUMS组微绒毛的大小和数量减少,并且表现出异常的外观。 XYS-FMT 使微绒毛的大小和数量增加,异常排列得以逆转(图 7 B)。与CUMS组相比,XYS-FMT增加了IL-10的水平并抑制了IL-1β、IL-6和TNF-α的表达(图 7C -F)。
这些结果表明 CUMS-FMT 有助于结肠炎症反应和肠道屏障损伤。此外,XYS-FMT 还可抑制 CUMS 诱导的结肠炎症反应并改善屏障功能。这表明肠道菌群失调会介导结肠炎症和屏障破坏,而抗抑郁药物的 FMT 治疗对结肠炎症和屏障破坏具有抑制作用。
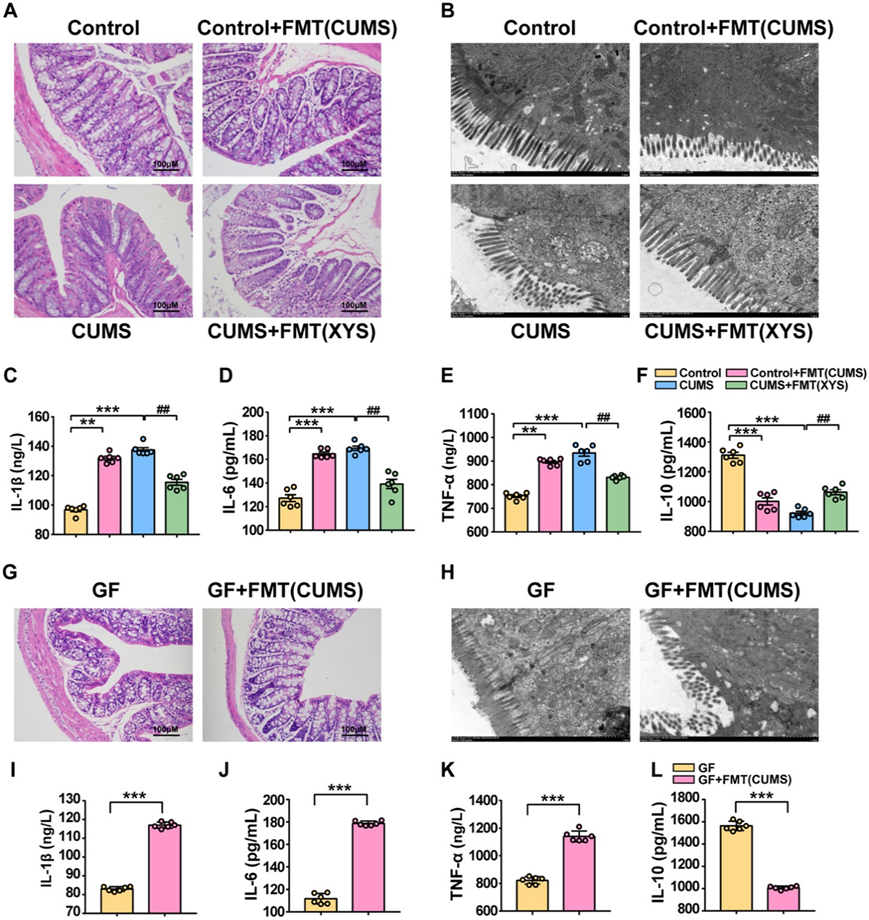
图7.CUMS-FMT导致结肠炎症反应、肠道屏障损伤。
(A) H&E染色。 (B) 透射电子显微镜(SPF 小鼠)。(C) IL-1β水平。(D) IL-6 水平。(E) TNF-α水平。(F) IL-10 水平。(G) H&E染色。(H) 透射电子显微镜(SPF 小鼠)。(I) IL-1β水平。(J) IL-6 水平。(K) TNF-α水平。(L) IL-10 水平。
06
CUMS-FMT 介导肠道菌群紊乱,XYS-FMT 恢复肠道平衡
使用 16S rRNA 基因测序进一步探讨 CUMS-FMT 和 XYS-FMT 对小鼠肠道微生物群组成的影响。Shannon 指数显示的 α 多样性受到 FMT 的影响(图 8 A)。基于 Bray-Curtis 距离的 PCoA 显示,有或没有 CUMS-FMT 的对照小鼠肠道微生物群结构存在分离(图 8 B)。在 CUMS 组和 CUMS + FMT (XYS) 组之间还观察到肠道微生物群结构的分离,这表明抑郁症小鼠的肠道微生物结构受到 XYS-FMT 的影响(图 8 C)。与对照组相比,接受CUMS的小鼠变形菌门水平的丰度有所增加,表明相同应激条件下微生物群变化的一致性。此外,还观察到疣微菌门的丰度增加。通过微生物组数据的 LEfSe 分析生成进化枝图(图 8 F-G),显示 CUMS 组中属水平上有两个差异丰富的进化枝,对照组中有两个差异富集的进化枝。
接受 CUMS-FMT 的 SPF 小鼠表现出明显的抑郁样行为。相应地,接受 CUMS-FMT 的 SPF 小鼠也表现出肠道微生物结构和组成的改变。在门水平上,与对照组相比,接受CUMS-FMT的小鼠中拟杆菌门的丰度显著增加,而变形菌门的丰度没有显著差异(图 8D-E)。然而,在属水平上,FMT 产生了显著的效果。通过微生物组数据的 LEfSe 分析生成了进化枝图(图 8 H-I),显示 CUMS-FMT 组中有 11 个属水平差异富集的进化枝,对照组有 1 个属水平差异富集的进化枝。
在 CUMS 小鼠中评估了 XYS-FMT 的效果。先前的实验表明,XYS 给药和 XYS-FMT 可以调节 CUMS 小鼠的抑郁样行为。相应地,接受 XYS-FMT 的 CUMS 小鼠也表现出肠道微生物结构和组成的改变。在门水平上,与 CUMS 组相比,接受 XYS-FMT 的小鼠变形菌丰度显著降低,这与摄入 XYS 后的变化一致(图 8 D-E)。通过微生物组数据的 LEfSe 分析生成分支图(图 8 J-K),并显示 XYS-FMT 组中属水平上的三个差异富集的分支,以及 CUMS 组中属水平上的三个差异富集的分支。
此外,还观察到接受 CUMS-FMT 的 GF 小鼠的微生物群发生变化。GF小鼠的肠道中不存在任何已知的微生物;因此,它们的微生物群变化比 SPF 小鼠更为明显。在门水平上,变形菌门是 CUMS-FMT 小鼠的优势门之一,与 CUMS 小鼠的微生物群相似。一致地,在属水平上,拟杆菌的丰度与暴露于压力的小鼠的微生物群相对应(图 8L)。
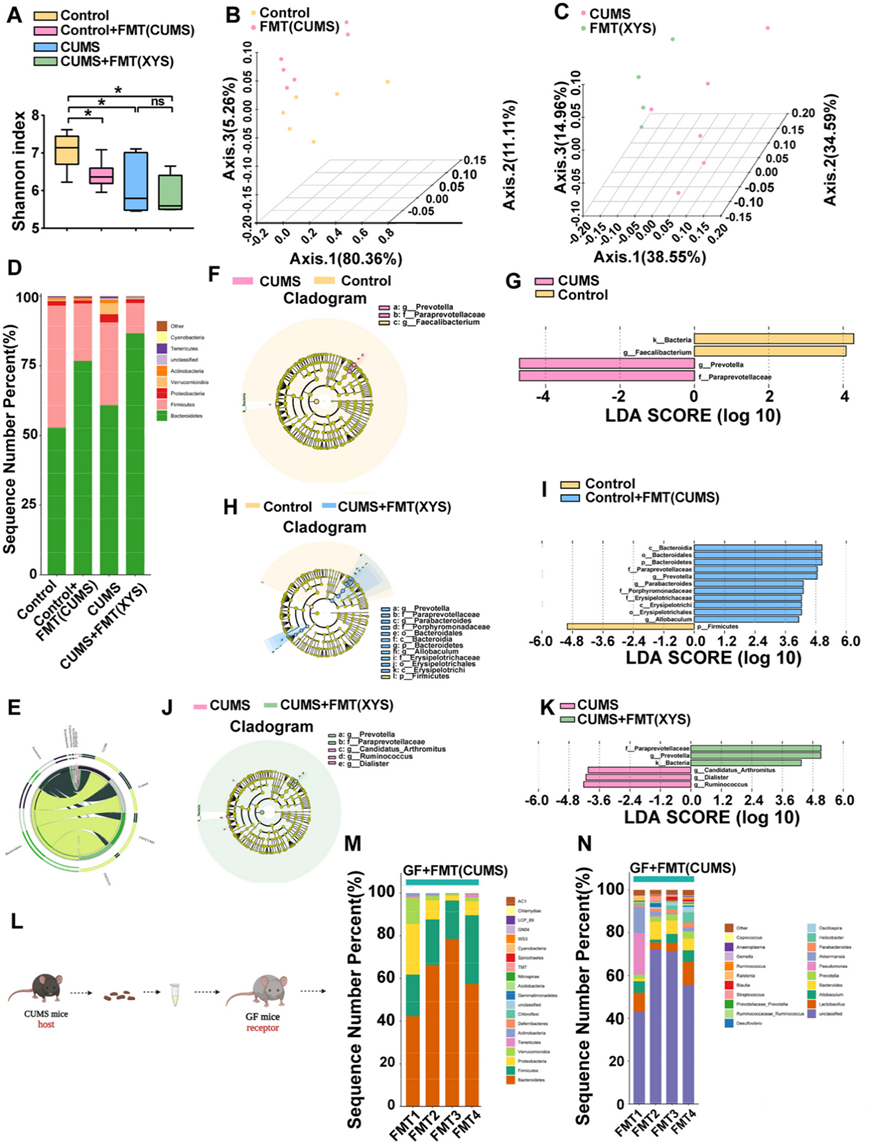
图8. CUMS-FMT 介导小鼠肠道微生物群的紊乱; XYS-FMT 调节肠道微生物群的组成。
(A) Alpha 多样性。(B-C) PCoA 分析。(D) 门水平的肠道微生物群变化。(E) 肠道微生物群在门水平发生变化。(F-G) 分支图。(H-K) 进化分枝图。(L-N) FMT后GF门和属水平的肠道菌群变化。
07
肠道微生物群失调诱导补体 C3 激活和小胶质细胞介导的异常突触修剪
与对照SPF小鼠相比,接受CUMS诱导小鼠的粪便微生物群后,小鼠血清中的LPS和C3水平显著增加(图 9A-D)。此外,与CUMS诱导一致,在接受CUMS诱导的小鼠的粪便微生物群后,在SPF和GF小鼠的PFC组织中观察到补体C3的蛋白表达显著增加(图 9E)。此外,基于CR3和IBA-1的免疫荧光结果表明,CUMS-FMT诱导PFC中小胶质细胞的激活并增加CR3的表达,表明CUMS-FMT可以直接诱导C3/CR3通路的激活(图 9F-L)。LPS 诱导的 CD68 和 IBA-1 表达水平的变化也与 CUMS 诱导的应激一致,观察到SYN和PSD95表达水平降低,这也表明异常突触修剪引起的神经元损伤(图 9 M-P)。
XYS 给药可以调节 CUMS 小鼠中 C3 介导的异常突触修剪。相应地,XYS-FMT显著降低了CUMS小鼠血清中LPS和C3的水平,抑制了PFC中小胶质细胞和C3/CR3通路的激活,并增加了SYN和PSD95的表达水平。这些结果表明,XYS 干预肠道微生物群对其抗抑郁作用具有重要意义(图 9 A-P)。
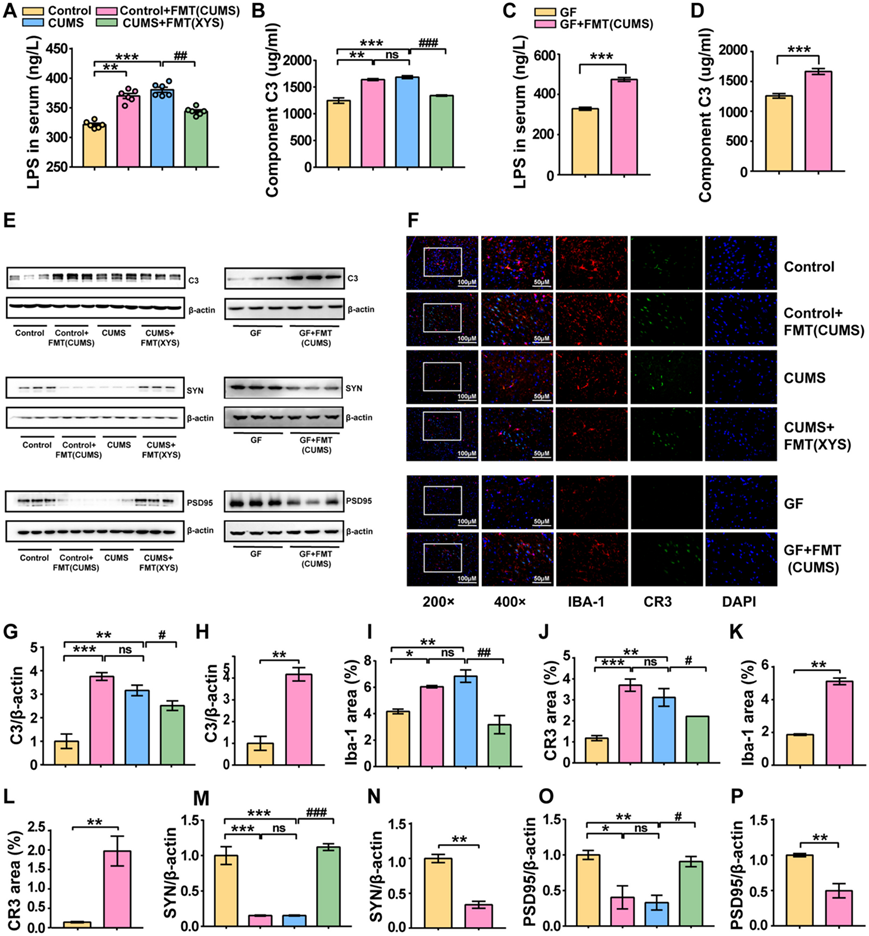
图9. 失调的肠道微生物群诱导补体 C3 激活和小胶质细胞介导的异常突触修剪。
(A) 血清中的LPS。(B) 血清中的C3。(C) 血清中的 LPS 。(D) 血清中的C3。(E)免疫印迹分析。(F)免疫荧光分析。(G-H) C3蛋白的表达。(I) IBA-1蛋白的表达。(J) C3蛋白的表达。(K) IBA-1蛋白的表达。(L) C3蛋白的表达。(M-N) SYN蛋白表达水平。(O-P) PSD95蛋白的表达水平。
+ + + + + + + + + + +
结 论
本研究发现CUMS诱导的小鼠表现出明显的抑郁样行为以及认知障碍,这与显著的肠道菌群失调有关,特别是变形菌的富集和微生物群衍生的脂多糖的升高。此外,还观察到小胶质细胞中外周和中枢补体 C3 激活以及中枢 C3/CR3 介导的异常突触修剪。将 CUMS 诱导的抑郁症模型小鼠的肠道微生物群移植到特定的无病原体和GF小鼠体内,可诱导受体小鼠出现抑郁样行为并伴随认知障碍,同时前额皮质中补体 C3/CR3 通路的激活增加以及小胶质细胞介导的突触修剪异常。相反,抗抑郁药物和来自接受抗抑郁药物治疗的供体的粪便微生物群移植改善了抑郁小鼠的抑郁样行为并恢复了肠道微生物组紊乱。同时,还观察到补体 C3/CR3 通路的抑制、小胶质细胞介导的异常突触修剪的改善以及突触蛋白和突触后密度蛋白表达的增加。
+ + + + +



 English
English


