文献解读|Cell Rep Med(14.3):母体 SARS-CoV-2 感染后,性腺生态位保护人类胎儿生殖细胞发育
✦ +
+
论文ID
原名:The gonadal niche safeguards human fetal germline cell development following maternal SARS-CoV-2 infection
译名:母体 SARS-CoV-2 感染后,性腺生态位保护人类胎儿生殖细胞发育
期刊:Cell Reports Medicine
影响因子:14.3
发表时间:2024.04.16
DOI号:10.1016/j.xcrm.2024.101515
背 景
在怀孕期间,种系发育对于维持物种的延续至关重要。最近的研究表明,COVID-19 患者在围产期的妊娠风险增加。然而,感染对发育中胎儿生殖质量的潜在影响仍不清楚。
实验设计
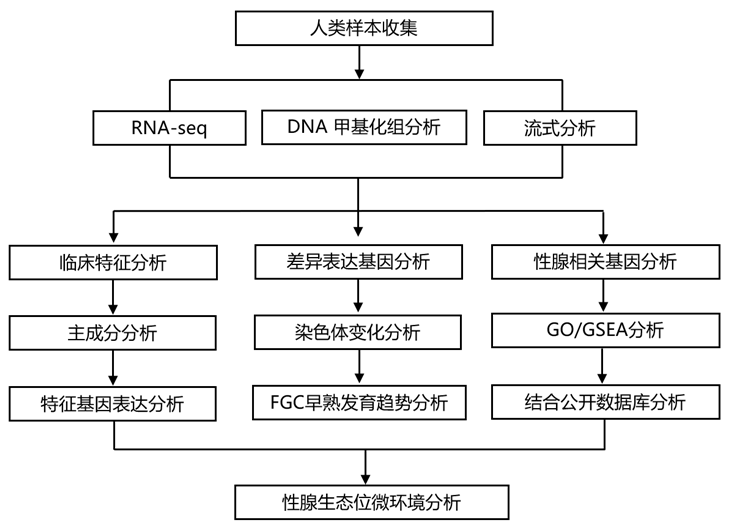
结 果
01
研究队列的临床特征
研究团队共纳入 29 名接受选择性终止妊娠的女性,所有这些孕妇都完成了 COVID-19 感染调查问卷(图1A,表1)。急性呼吸综合征冠状病毒 2 (SARS-CoV-2) 呈阳性时的中位孕龄不到 4 周。在这些个体中没有检测到明显的妊娠相关并发症,包括妊娠糖尿病、妊娠期高血压疾病或前置胎盘。入院时收集妊娠后 10-17 周的胚胎样本,系统研究母体 SARS-CoV-2 感染对人类胎儿生殖细胞(FGC)发育的潜在影响以及 FGC 与其邻近生态位细胞之间的调节关系。感染组(7 个女性胚胎和 11 个男性胚胎)来自在妊娠前三个月检测出 COVID-19 呈阳性但在终止妊娠时恢复的孕妇。同时,将未感染孕妇的未感染组(6个女性和5个男性胚胎)设为对照。
然后他们检测了人类 FGC 的转录组和 DNA 甲基化组,这些 FGC 是从感染和未感染受试者的个体性腺中分离出来的。这是通过使用荧光激活细胞分选 (FACS) 和表面受体 c-KIT 来实现的。同时,还收集了 c-KIT 阴性体细胞,以揭示妊娠期间 SARS-CoV-2 感染引发的 FGC 与其微环境之间潜在的相互作用改变(图1B,图S1A-C)。
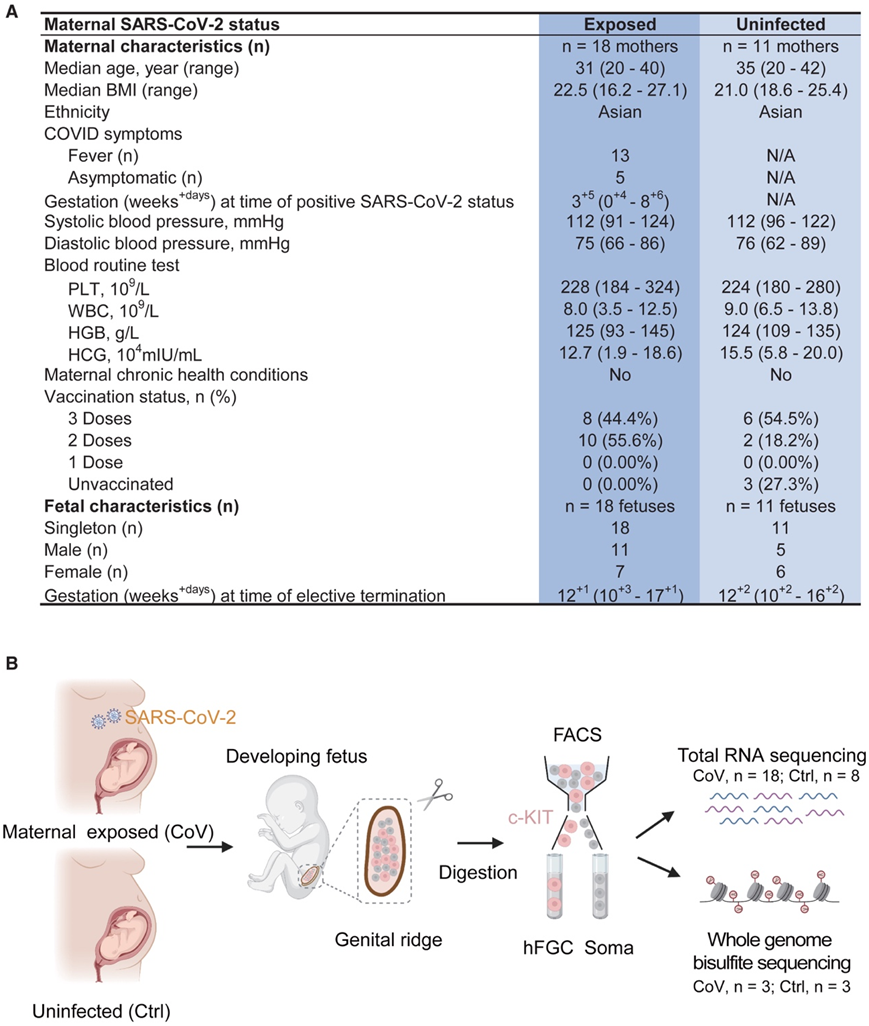
图1. COVID-19 大流行背景下人类性腺发育的研究概述。
(A) 收集样本的母体和胎儿临床特征。(B) 母体感染 SARS-CoV-2 或未感染时,发育中胎儿的胎儿生殖细胞 (FGC) 和性腺体细胞 (soma) 的转录组学和表观基因组学数据的生成示意图。
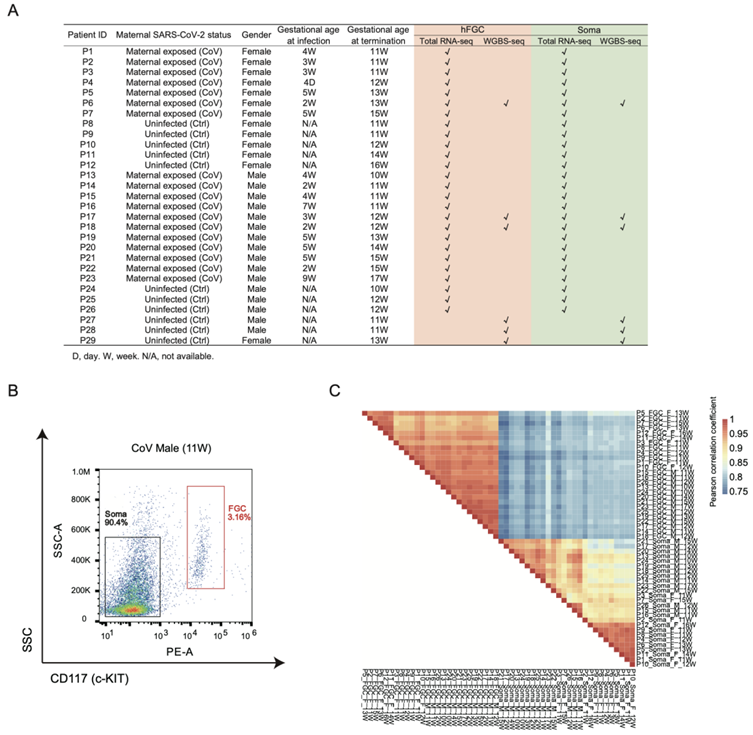
图S1. 用流式细胞分离母体感染SARS-CoV-2后的人FGC和性腺体细胞。
(A)用于全转录组测序(RNA-seq)和全基因组甲基化测序(WGBS-seq)的发育中胎儿样本的详细信息。(B)男性生殖腺在母体感染后的代表性FACS图像。(C)显示所有转录组Pearson相关系数的热图。
02
母体 SARS-CoV-2 感染后对 FGC 发育的影响微乎其微
他们首先证实了FGC及其邻近龛细胞中SARS-CoV-2和冠状病毒相关受体和因子(SCARF)的表达(图2A),这些生态位细胞提供了SARS-CoV-2感染的途径。母体SARS-CoV-2感染后,FGC中SCARF基因的表达没有显著差异,体细胞中的SCARF基因表达也没有显著差异,除了两个基因外。然而,母体感染后体细胞中存在SCARF基因表达升高的趋势(图2A),这表明 SARS-CoV-2 感染可能会增加性腺体细胞中的 SCARF 基因表达,但不会增加 FGC 中的 SCARF 基因表达。因此,体细胞变得更容易受到 SARS-CoV-2 的影响。
为了评估 SARS-CoV-2 感染对胚胎性腺的总体影响,他们对转录组数据进行了主成分分析 (PCA),并获得了两个完全独立的组:生殖细胞和体细胞。此外,FGC 中也可以区分性别差异(图 2 B)。值得注意的是,男性和女性体细胞表现出不同的基因表达模式(图 2 B)。虽然SARS-CoV-2 RNA可能与逆转录转座子相同的转录本融合,尤其是长散在核元件(LINE)和短散在核元件(SINE),但在感染组和未感染组之间,他们未检测到FGC中可转座元件(TE)的表达有显著变化(图2C)。同时,他们在母体感染SARS-CoV-2后,分别在男性和女性FGC中鉴定出43个和30个显著差异表达基因(DEG)(图2D-E)。感染状态对生殖细胞发育结果的影响很小,特别是在细胞类型的性别特异性和功能意义方面的主要差异。
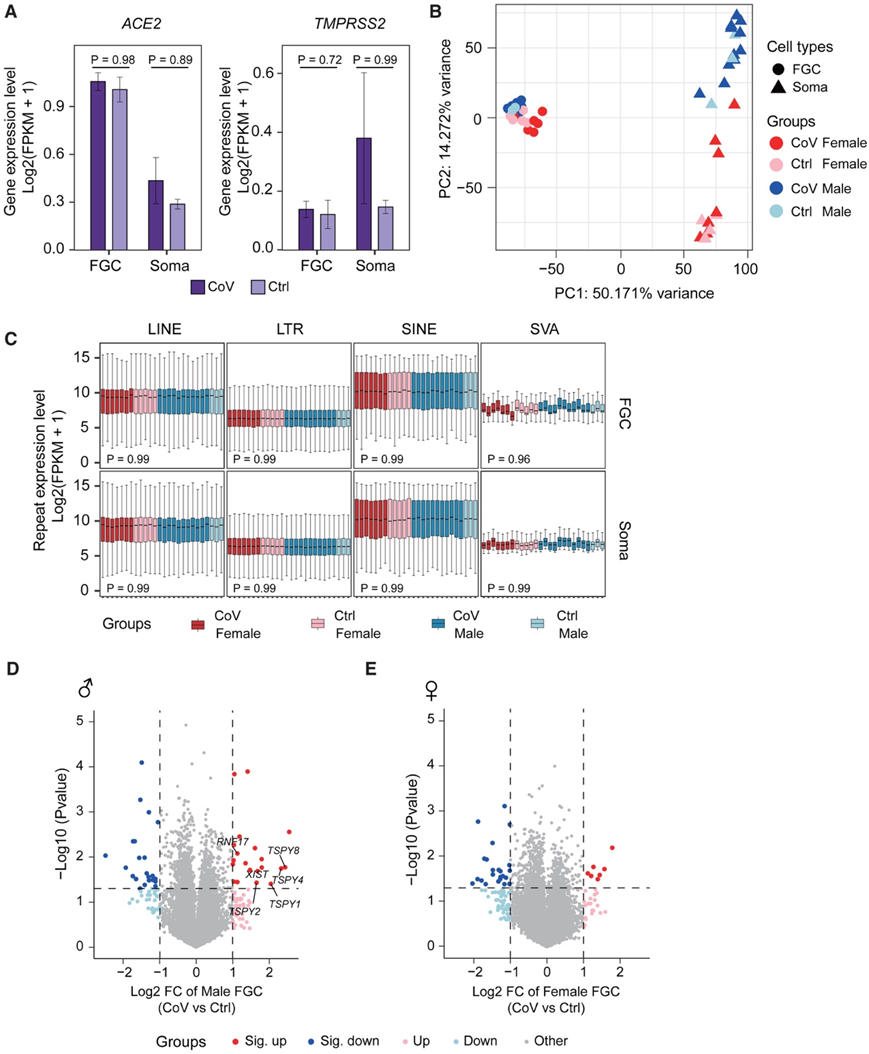
图2.转录组显示母体 SARS-CoV-2 感染后对人类 FGC 发育的影响有限。
(A) FGC 和性腺体细胞中选定的 SCARF(SARS-CoV-2 和冠状病毒相关受体和因子)的表达水平。(B) CoV 和 Ctrl 组 FGC 和性腺体细胞转录组的主成分分析 (PCA)。(C) FGC 和性腺体细胞中主要人类重复元件类别的表达水平。(D-E) 男性或女性 FGC 中 CoV 组与 Ctrl 组鉴定的差异表达基因 (DEG) 的火山图。
03
母体感染SARS-CoV-2后FGC的早熟倾向
FGC的正常发育是由一组协调的、高度动态的生物过程调节的。他们按妊娠阶段(≤12周和≥13周)对样本进行分组,并检测早期或晚期种系标记基因的表达水平。结果显示,两组未感染样本中早期种系标记基因的表达均显著升高。晚期种系标记基因的表达模式相反(图3A-B)。随后,他们根据妊娠阶段(11-12周、13-14周和15-16周)将样本分为三组,并比较这些种系标记基因的表达水平。这些结果表明,未感染组的女性FGC准确表达了有序的发育阶段特异性基因(图3C-D)。然而,这种高度稳定且精确有序的生殖细胞表达模式在母体感染SARS-CoV-2后发生了改变。具体来说,在接触组中超过一半的受试者中,女性原始生殖细胞FGC中早期生殖系特异性标记基因的表达低于未感染组,这表明她们从多能性状态向生殖细胞特化的过程加速了(图3C-D)。巧合的是,与未感染组相比,感染组的女性FGC中晚期种系特异性标记基因的表达更高(图3C-D)。值得注意的是,这些晚期种系特异性标记基因主要参与了女性FGC发育的关键生物学阶段,如有丝分裂、类视黄酸(RA)信号反应、减数分裂和卵发生。这些结果表明了一种趋势,即SARS-CoV-2感染可能导致早熟的发育结果,特别是在女性性腺中。
性别分化出现在第9周,是人类FGC生命周期中最具决定性的事件。他们首先分析了FGC中的X染色体再激活特征,并发现在母亲SARS-CoV-2感染后,女性FGC中有一致的X再激活模式,从而实现正确的人类生殖细胞系重编程(图3E-F)。然后,他们探索了Y染色体(chr .Y)上的转录活性,以更好地了解母亲感染对性别决定的影响。引人注目的是,感染组有更活跃的转录活性,伴随更大程度的DNA去甲基化的chry .Y。这进一步暗示感染状态可能有助于促进女性生殖器发育结果的提前成熟。
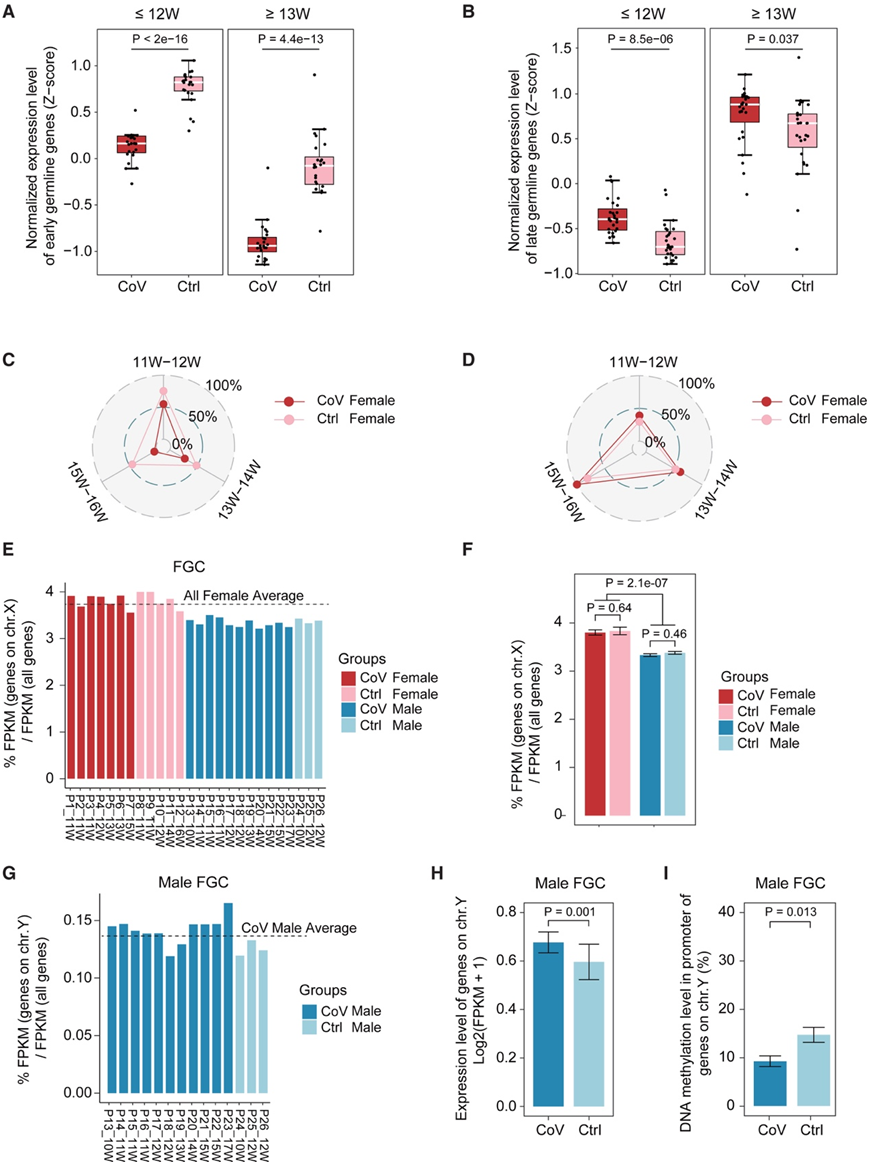
图3. 母体感染SARS-CoV-2后人类FGC的早熟发育趋势。
(A-B)箱形图显示了女性FGC和女性FGC中早期和晚期生殖细胞系标记基因的统一标准化表达水平。(C-D)雷达图显示女性FGC种系特异性标记基因的平均表达水平。(E-F) CoV组和Ctrl组FGC中X染色体上所有检测到的基因的表达水平与总基因的百分比。(G) CoV组和Ctrl组男性FGC中Y染色体上所有检测到的基因的表达量与总基因的表达量的百分比。(H) 男性 FGC 中 Y 染色体上检测到的基因的表达水平。(I) (H) 基因启动子中的 DNA 甲基化水平。
04
COVID-19诱导性腺生态位免疫反应升高
体细胞是性腺中 FGC 的相邻生态位,这对于提供适当的微环境来指导 FGC 的特化、迁移、定位到生殖脊和性别分化至关重要。虽然感染组和未感染组之间的FGC变化有限(图2D-E),但他们发现SARS-CoV-2感染特异性地导致邻近生态位细胞的基因表达发生了更广泛的变化(图4A-B)。值得注意的是,感染组的生态位细胞中表达上调的基因较多,且两性间重叠程度较高,说明两性生态位细胞对母体感染SARS-CoV-2表现出相似的应答(图4C-D)。男性和女性微环境细胞中76个共同上调基因富集的通路包括免疫系统过程、对其他生物体的防御反应以及对环境应激/刺激的反应(图4E)。虽然COVID-19侵入发育中的胎儿的概率相对较低,但感染组的性腺生态位细胞仍表现出广泛的反应,以抵御母体SARS-CoV-2感染的潜在威胁。当他们将这些基因映射到疾病数据库时,与新冠肺炎感染相关的症状得到了富集,这表明周围体细胞的靶向反应是由母亲接触SARS-CoV-2引发的(图4F)。此外,还富集了“冠状病毒传染病”和“寄生虫传染病”等症状,进一步提示发育中的胎儿可能存在针对病毒或寄生虫等外部病原体入侵的潜在威胁的保守应对机制(图4F)。
他们通过基因集富集分析 (GSEA) 将分析范围扩大到整个转录组改变及其功能富集。感染组的男性和女性体细胞中的免疫相关通路也高度富集,包括先天免疫和适应性免疫(图4G)。大多数免疫反应在 SARS-CoV-2 感染后经常观察到。例如,I 型干扰素和信号传导的诱导是感染 SARS-CoV-2 后导致先天免疫反应的第一个反应(图4G)。同时,发现细胞因子的表达显著增加,包括白细胞介素家族、趋化因子家族等,这有助于诱导有效的免疫反应(图4G-H)。此外,异体吞噬过程也得到了富集,这表明相邻的生态位细胞采用了多种策略来防御潜在的威胁(图4G)。然而,这样的防御会迫使感染组的性腺生态位对额外的压力做出更高的反应(图4E-G)。因此,一些生态位细胞可能因自噬或凋亡而“牺牲”(图4G)。两性之间的综合反应相似,这表明母体 SARS-CoV-2 注射后发育中的胎儿存在保守的防御机制(图 4G-H)。此外,感染后的这些复杂反应仅发生在相邻的微环境中,而不是在 FGC 中(图4G-I)。
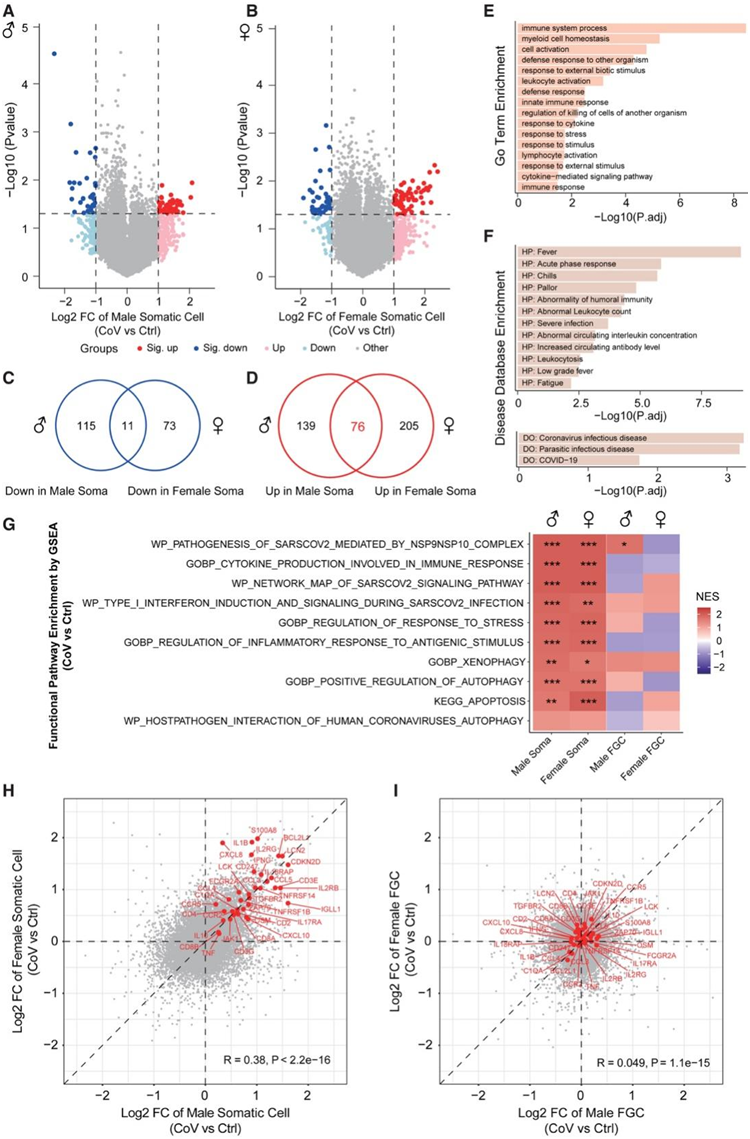
图4. 母体 SARS-CoV-2 感染后,胚胎性腺微环境中的广泛免疫反应保持了 FGC 发育的完整性。
(A-B) 在男性 (A) 或女性 (B) 性腺体细胞中,由 CoV 组与 Ctrl 组鉴定的 DEG 的火山图。 (C-D) 维恩图显示男性和女性性腺体细胞之间下调或上调基因的重叠。(E-F) GO分析和人类疾病本体(DO)数据库分析。(G) 基于分子特征数据库 (MSigDB),对男性和女性性腺体细胞和 FGC 中 CoV 组与 Ctrl 组计算的整个基因表达的 log2 FC 进行基因集富集分析 (GSEA)。(H-I) 散点图显示分别在男性和女性性腺体细胞和 FGC中由 CoV 组与 Ctrl 组计算的所有基因的基因表达变化。
鉴于FGC在SARS-CoV-2感染后发生的有限转录和表观遗传变化,他们发现,在母亲感染SARS-CoV-2的情况下,性腺微环境仅在体细胞中触发免疫应答,从而保护人FGC的内环境稳态(图4G-I,图S5A-C)。
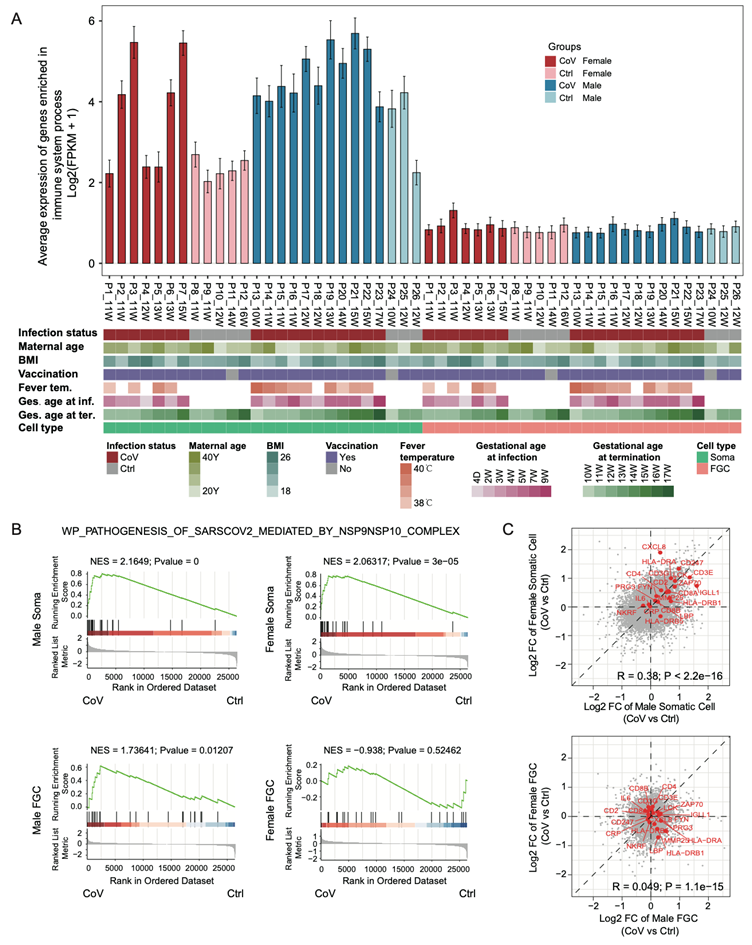
图S5. 生殖腺生态位保护FGCs免受母体SARS-CoV-2感染的广泛免疫反应。
(A)共上调基因在男性和女性性腺体细胞和FGC中的平均表达水平。(B) GSEA分析。(C) CoV组与Ctrl组在男性和女性性腺体细胞和FGC中所有基因表达变化的散点图。
+ + + + + + + + + + +
结 论
本项研究分析了母体感染SARS-CoV-2后胎儿种系的转录组和 DNA 甲基化组。孕早期(人类原始生殖细胞特化和表观遗传重编程的关键时期)的感染对FGC的发育影响甚微。此外,FGC 生态位的通讯不会因母体感染而受到损害。性腺微环境细胞中的一般免疫通路和 SARS-CoV-2 特异性免疫通路都极大地发生激活,以保护 FGC 免受母体感染。母体感染后FGC出现“提前”发育的趋势。本项研究深入了解了母体 SARS-CoV-2 感染对胎儿种系发育的影响,并为未来大流行提供了潜在的临床指导。
+ + + + +



 English
English


