文献解读|Cell Metab(29.0):综合多组学分析揭示骨因子参与整体调控
✦ +
+
论文ID
原名:An integrated multi-omics analysis reveals osteokines involved in global regulation
译名:综合多组学分析揭示骨因子参与整体调控
期刊:Cell Metabolism
影响因子:29.0
发表时间:2024.04.03
DOI号:10.1016/j.cmet.2024.03.006
背 景
骨骼是一种高度动态且代谢活跃的组织,在整个生命过程中不断进行重塑,以保持其稳健的结构和功能。骨分泌蛋白(称为骨因子)调节骨代谢和全身稳态。然而,关于真正的骨因子及其细胞来源是什么以及它们如何调节的基本问题仍不清楚。
实验设计
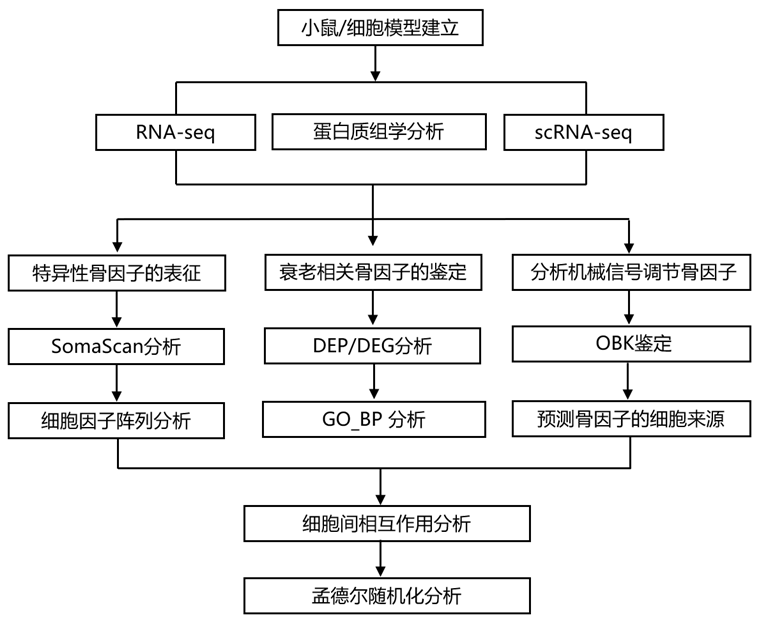
结 果
01
成年小鼠 BOK 的表征
研究团队对从成年 C57BL/6 小鼠获得的 21 种不同组织进行了转录组分析(RNA-seq),这产生了78个RNA-seq文库的综合数据集。分析的组织包括各种骨区域(干骺端、骨干、颅骨、脊柱和肋软骨)、骨髓和骨骼外器官/组织(图1A-B)。通过比较骨骼与骨骼外组织,他们鉴定了 252 个骨骼特异性基因 (BSG)。其中,52%或37%在骨中的表达分别比在骨外组织中高5倍或10倍。这些基因包括众所周知的骨细胞(Sost和Dmp1)、成骨细胞(ob)(Bglap2和Sp7)、破骨细胞(Ctsk和Acp5)、软骨细胞(Col2a1和Acan)和骨髓间充质干细胞(Cxcl12)的标记。
为了研究分泌到骨细胞外液(骨髓和血清)中的蛋白质,他们分别通过 LC-MS/MS、SomaScan 和细胞因子阵列分析了骨髓上清液 (BMS)、小鼠血清和人血清(图S1A)。SomaScan 是一种基于适配体的检测方法,能够同时测量血清中数千种蛋白质,与传统 LC-MS/MS 技术相比,检测低丰度激素和细胞因子的灵敏度明显更高(图 S1 B)。通过将 BSG 与通过这些蛋白质组学方法在细胞外液中检测到的蛋白质重叠,他们获得了这些 BSG 编码的 132 种潜在的分泌蛋白(图 1 C)。分泌蛋白传统上通过内质网-高尔基体通路转运,随后分泌到细胞外空间(定义为经典分泌)。此外,虽然一些分泌蛋白释放到血清中系统地调节远端器官,但其中一些限制在分泌细胞本身的细胞外基质(ECM)中。因此,他们结合GO Cellular Component注释“胞外位置”、UniProt注释“分泌”、SignalP、TMHMM和SecretomeP预测算法,对这些潜在BSG进行了综合分泌预测(ISP)分析。该预测分析鉴定出107个潜在的ob分泌骨因子(OBK),包括通过经典、非经典或两者同时分泌的BOK。通过将它们与Vesiclepedia和ExoCarta数据库中列出的蛋白质重叠,他们发现一些BOK可能通过大泡或外泌体分泌(图1C)。他们鉴定了几种已知的骨因子,包括Bglap、Fgf23、Cxcl12、Tnfsf11、Tnfrsf11b、Dkk1、Spp1、Sost、Mmp13、Ctsk、Acp5、Ccn4、Rspo3、Dlk1和Clec11a,证明了本项研究方法的稳健性。其中,骨钙素(Bglap)是在葡萄糖代谢和脑健康中研究最广泛的骨因子。骨源性CXCL12通过作用于肝脏来调节免疫和造血。骨外基质中的有机成分由I型胶原蛋白和各种非胶原蛋白组成。最近,Phylobone项目在30种脊椎动物中鉴定出255种ECM蛋白。根据该项目,大约36%的BOK属于骨ECM蛋白,突出了它们在骨化和骨稳态中的关键作用(图S1C)。
Bglap和Sost这两种著名的BOK主要在骨中表达,证实了该方法的有效性(图1E)。有趣的是,许多以前未识别的骨因子,如Angpt4、Angptl7、Cst3、Clec3a、Dlk1、Fgf4、Fbln7、Il17b、Prg2、Rspo4、Stc2、Tnc和Tnfrsf19都鉴定出来(图1D)。此外,Angpt4、Tnc和Comp表现出类似的表达模式(图1E)。GO生物通路(GO_BP)富集分析显示,BOKs不仅调节骨代谢,还在维持机体稳态中发挥作用(图1F)。
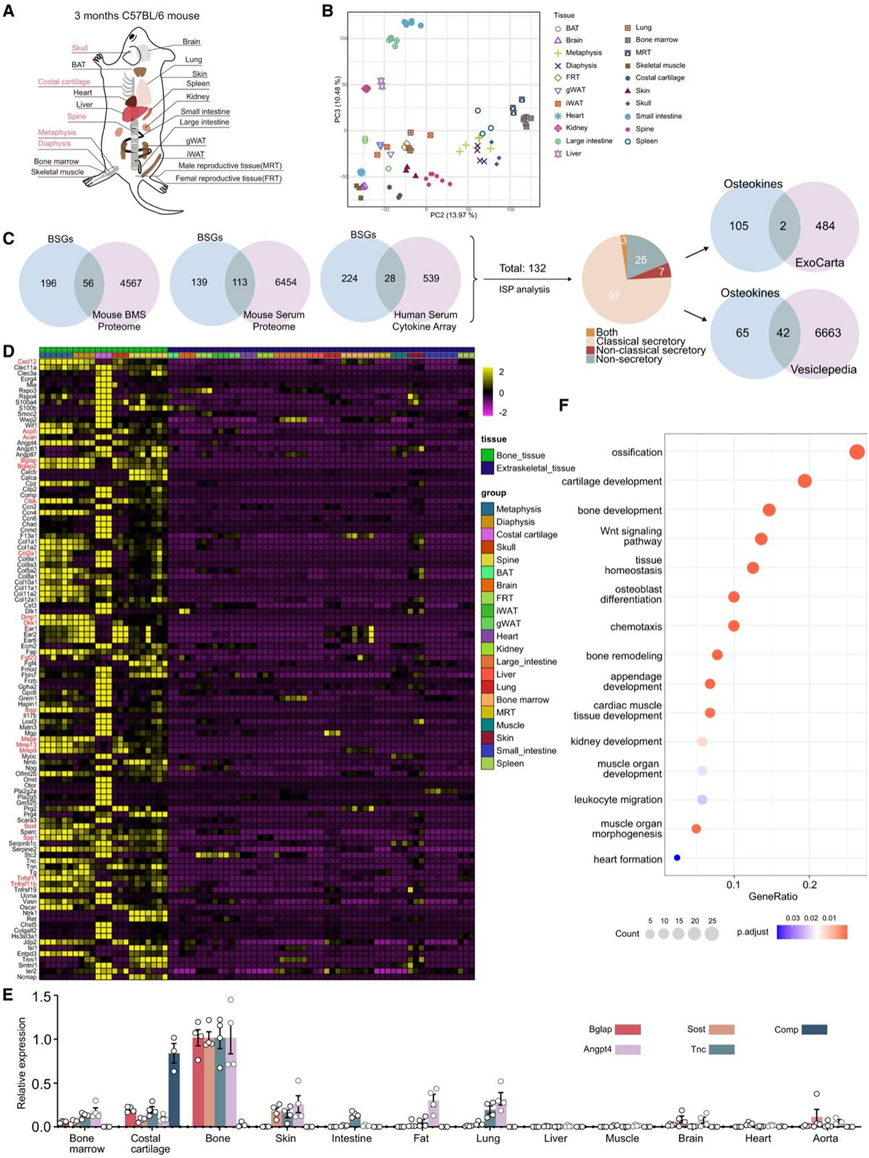
图1. 成年小鼠骨特异性骨因子的表征。
(A) 样本描述。(B) RNA-seq 数据的主成分分析 (PCA)。 (C) 比较细胞外液(血清和骨髓上清液 [BMS])中检测到的骨特异性基因 (BSG) 和蛋白质并预测分泌。(D) 热图显示骨特异性骨因子 (BOK) 的表达。(E) 通过 qPCR 验证 Bglap、Sost、Angpt4、Tnc 和 Comp 的表达。(F) BOK 的基因本体生物过程 (GO_BP) 注释。
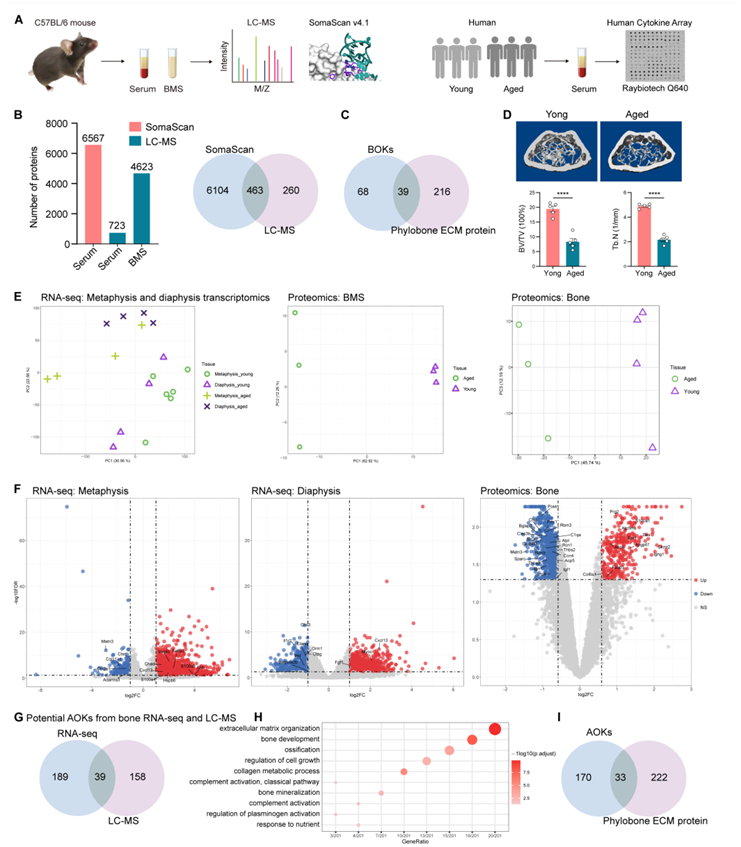
图S1. 对年轻和年老老鼠的样本进行分析。
(A)实验流程。(B) SomaScan和LC-MS检测范围的比较。(C)骨特异性骨因子(BOK)和Phylobone鉴定的ECM蛋白重叠。(D)具有代表性的显微ct图像和组织形态学分析。(E) PCA。(F)火山图显示干骺端和干骺端deg和dep。(G)骨RNA-seq数据和LC-MS蛋白质组学数据中AOK的比较。(H)Go分析。(I) AOK和Phylobone项目ECM蛋白的重叠。
02
衰老相关骨因子(AOK)的识别
衰老会导致骨量损失,导致骨脆性和骨折风险增加。衰老骨细胞退化以获得衰老相关的分泌表型,其中涉及促炎细胞因子、趋化因子和 ECM 降解蛋白的产生。这些物质对局部和全身都有有害影响。为了全面鉴定这些骨因子,他们进行了多组学分析,包括RNA-seq、骨组织的蛋白质组学分析以及年轻和老年小鼠的 BMS 和血清样本的蛋白质组学分析(图 2 A)。微型计算机断层扫描 (micro-CT) 证实老年小鼠的骨量减少(图 S1 D)。通过差异表达分析,鉴定与衰老相关的基因和蛋白。结果显示,小鼠干骺端有2211个差异表达基因(DEG),干骺端有1185个DEG,骨组织中有976个差异表达蛋白(DEP),BMS中有560个DEP,血清中有1285个DEP(图2B-F,图S1E-F)。通过将骨中的deg和dep分别与BMS和血清中的deg和dep重叠,他们获得了386个潜在的aok。有趣的是,从deg或dep中获得的aok差异很大(图2B,图S1G)。
GO_BP 分析显示“ECM”是 AOK 中改变最显著的通路(图 S1 H)。根据 Phylobone 项目的数据,大约 16% (33) 的 AOK 是 ECM 蛋白(图 S1 I)。这些蛋白质,包括 Alpl、Sparc 和 Thbs3,在老年小鼠的骨组织和 BMS 中表现出表达减少(图 2 E)。与衰老相关的 ECM 蛋白下调可能导致骨量和质量下降,最终增加骨脆性和骨折的风险。他们还发现了与补体激活和免疫反应相关的骨因子的变化,例如 Cxcl13、Fgf1、C1qa、Ctsg、Elane 和 Il1r2(图 2 E)。Il1r2 是 Il1a、Il1b 和 Il1rn 的非信号受体,随着年龄的增长而上调并抑制其配体的活性。Elane 属于丝氨酸蛋白酶亚家族,在衰老的骨骼、毛囊干细胞、和卵巢中减少,并在退行性和炎症性疾病中发挥作用。
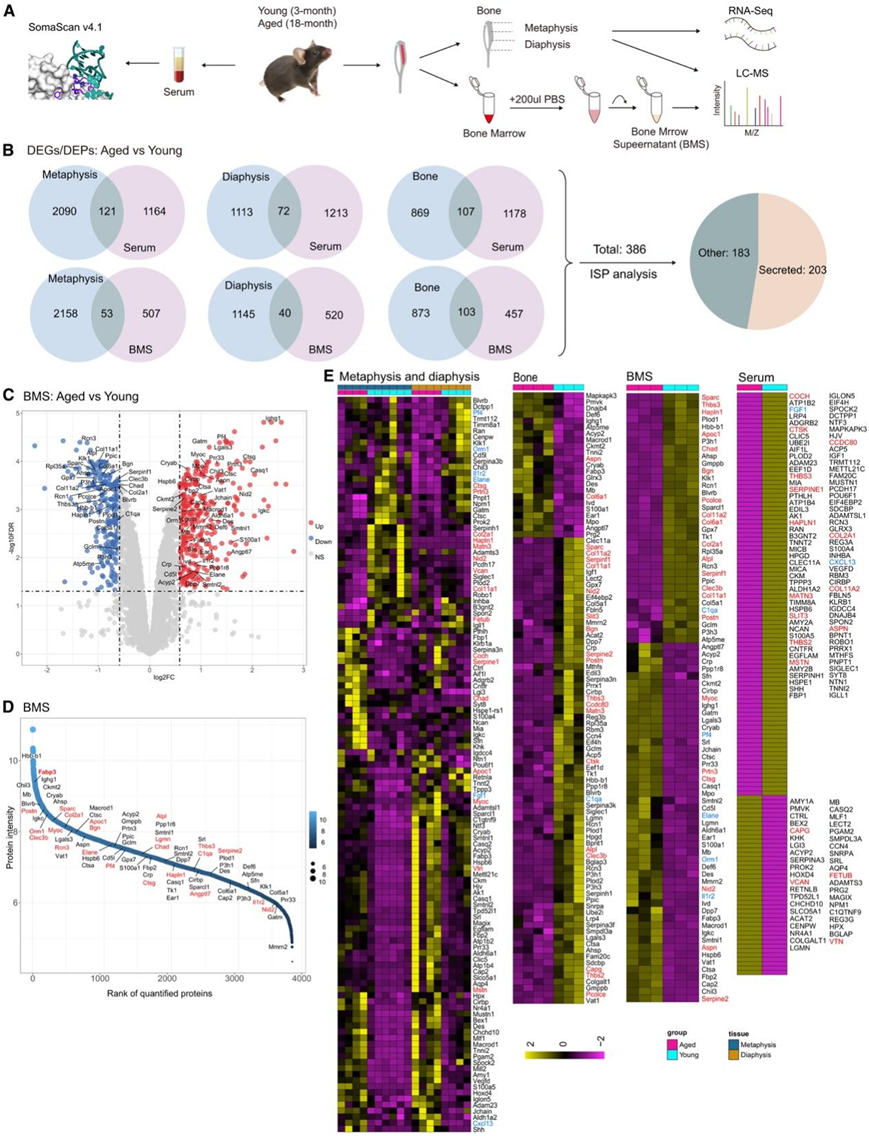
图2. 衰老相关骨因子的鉴定。
(A) 年轻和老年小鼠骨组织的转录组学和蛋白质组学以及 BMS 和血清的蛋白质组学的工作流程。(B) 骨中差异表达基因 (DEG) 和差异表达蛋白 (DEP) 与细胞外液(血清和 BMS) 中 DEP 的比较以及分泌物的预测。(C) 火山图显示 BMS 中的蛋白质,其中蛋白质随年龄增加(红色)和减少(蓝色)。(D)对 BMS 蛋白进行排序。 (E) 热图显示干骺端、骨干、骨、BMS 和血清中的 AOK 表达。
03
机械信号调节的骨因子的鉴定
机械负荷是一种有效的合成代谢刺激,可诱导骨形成和适应。相反,这个过程中的失误会导致骨质流失和骨骼脆弱性增加,这称为沃尔夫定律。为了研究机械反应性骨因子(MOK),他们分析了这些小鼠骨组织的转录组和蛋白质组,以及 BMS 和血清的蛋白质组(图 3 A)。干骺端中有615个DEG,骨干中有722个DEG,骨组织中有491个DEP,BMS中有781个DEP,血清中有290个DEP(图3B-E)。通过将骨的DEG和DEP与细胞外液(BMS和血清)的DEG和DEP重叠,他们获得了158个潜在的MOK。经过ISP分析去除污染蛋白后,预计有100个蛋白分泌,因此是候选MOK(图3B-E)。正如预期的那样,MOK在的ECM组织、骨化和骨发育通路富集,这与wolf定律的原则一致。几个MOK与Phylobone project重叠,因此可能代表ECM蛋白,包括Acan、Bmp1和Tgfbi(图3E)。其中,Bmp1促进成熟胶原蛋白的生成。相反,它的突变或缺失会导致成骨不完全。Rbp4与2型糖尿病患者的骨密度呈正相关。Tgfbi的缺失会导致体型、骨量和骨大小的减小。相反,来自间充质细胞的Tgfbi可缓解骨关节炎的进展。另一方面,破骨细胞分泌更多的消化蛋白,如Mmp9和Acp5,以促进骨吸收。
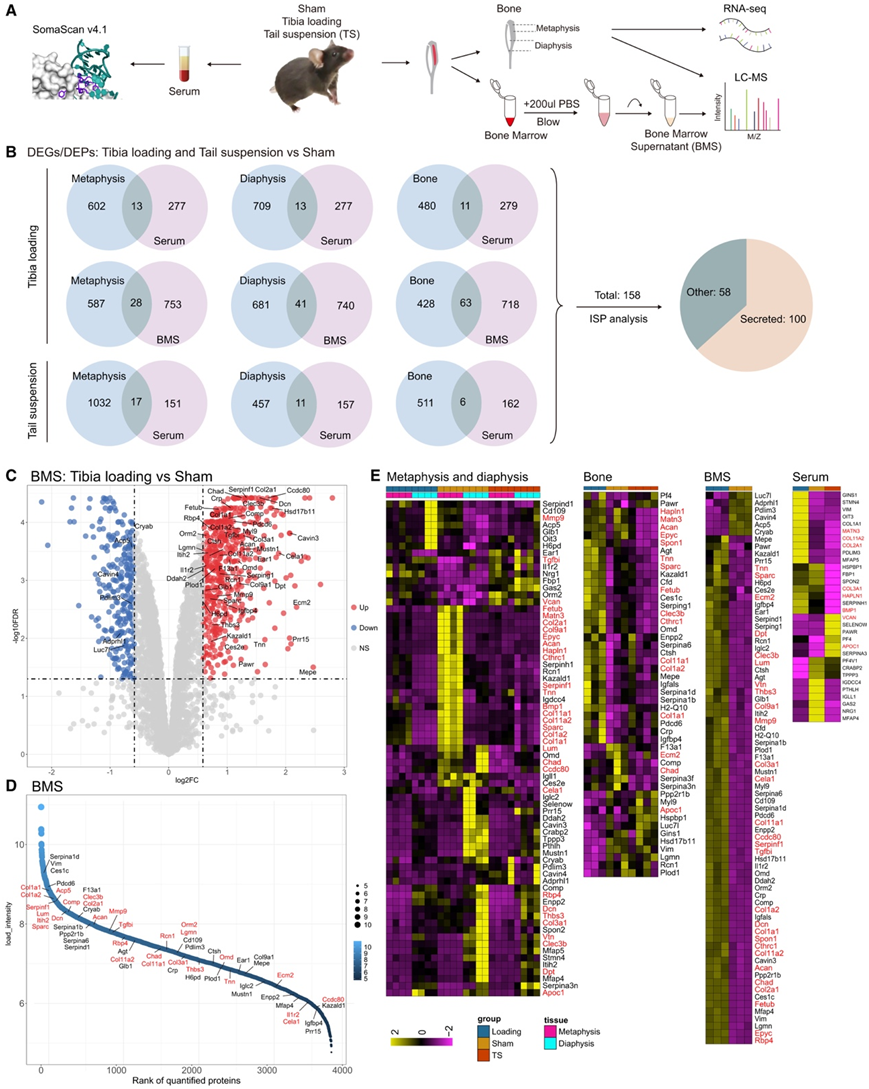
图3. 机械信号调节的骨因子的鉴定。
(A) 骨组织的转录组学和蛋白质组学以及假手术小鼠、胫骨负载小鼠和尾悬吊小鼠的 BMS 和血清的蛋白质组学工作流程。(B) 骨中的 DEG 和 DEP 与细胞外液(血清和 BMS)中的 DEP 的比较以及分泌的预测。(C) 火山图以 BMS 中的蛋白质为特征。(D) 根据 MS 信号对 BMS 蛋白进行排序。(E) 热图显示干骺端、骨干、骨、BMS 和血清中的 MOK 表达。
04
通过将 OB 分泌组与骨的 scRNA-seq 数据整合来鉴定 OBK
接下来,他们通过将OB分泌组与公开的单细胞转录组分析 (scRNA-seq)数据集整合,确定了潜在的obk,包括健康小鼠骨骼和骨髓细胞群的GSE128423,健康小鼠OB和骨细胞的GSE154719,以及体外破骨细胞发生的小鼠细胞的GSE147174。从scRNA-seq数据中共获得了7726个单细胞转录。t-SNE可视化显示了六个主要的聚类,分别对应于OB、软骨细胞、骨髓间质细胞(BMSC)、破骨细胞、骨细胞和未选择的标记基因表达细胞(图4A-B)。为了研究调节OB分化或衰老的蛋白质,他们通过连续传代对OB诱导成骨分化或衰老的条件培养基的蛋白质组进行了分析(图4C)。随后,他们分别鉴定出1217个和1000个与OB分化和衰老相关的dep。通过与obk特异性基因重叠,他们发现了86个蛋白,其中50个预测为分泌蛋白并归类为obk(图4D-F)。
本研究确定了几个在OB增殖和分化中起关键作用的obk。这些包括Adamts2、Bgn、Gnas、Ltbp3、Mmp13、Slit3、Spp1和Tgfbi(图4F)。其中Bgn是富含亮氨酸的小蛋白聚糖家族成员,通过调节BMP信号传导促进OB分化和基质矿化。
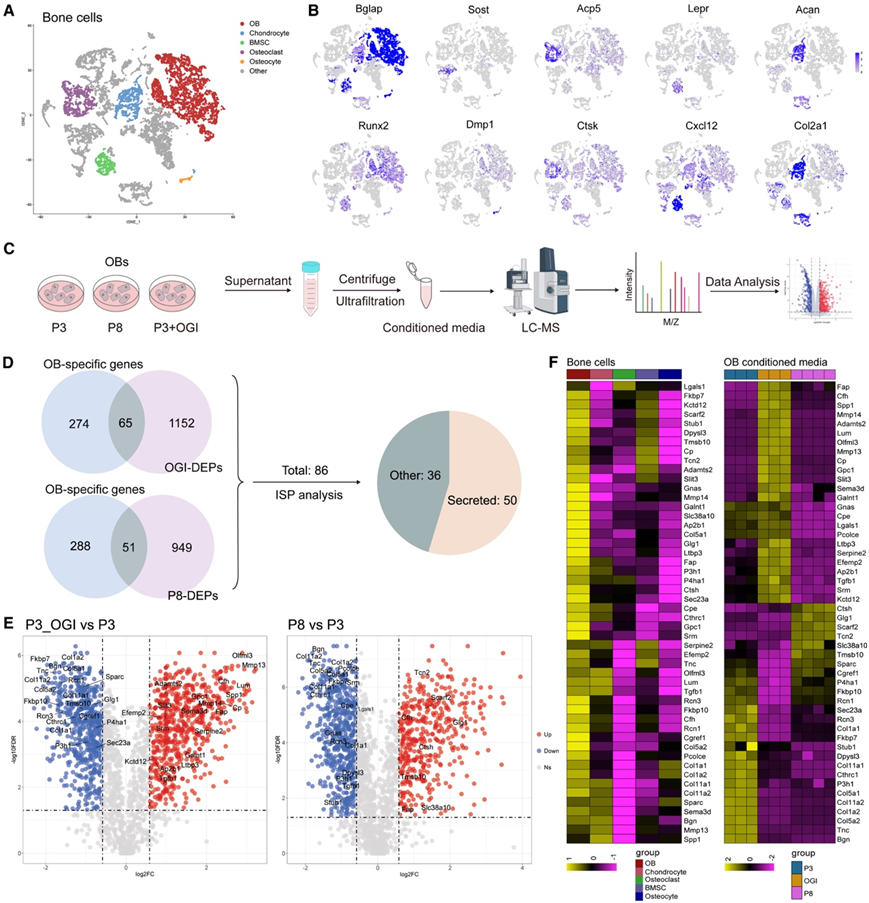
图4. 通过将 OB 分泌组与骨的 scRNA-seq 数据整合来描述 OB 分泌的骨因子。
(A) 骨细胞的 t-SNE 可视化。(B) t-SNE 图显示 OB (Bglap/Runx2)、骨细胞 (Sost/Dmp1)、破骨细胞 (Acp5/Ctsk)、BMSC (Lepr/Cxcl12) 和软骨细胞 (Acan/Col2a1) 中标记基因的标准化表达水平。(C) 连续传代 (P3-P8) 中具有成骨诱导 (OGI) 的 OB 条件培养基的蛋白质组学工作流程。(D) OB 特异性基因与具有 OGI 的 OB 条件培养基中的 DEP 的比较以及分泌的连续传代和预测。(E) 火山图显示 OB 分泌的骨因子 (OBK),红色/蓝色表示 OGI 和传代导致的增加/减少。(F) 热图显示骨 scRNA-seq 数据和 OB 分泌组中 OBK 的表达。
05
利用骨的 scRNA-seq 数据预测骨因子的细胞来源
通过上述四种不同的模型——正常成年小鼠、老年小鼠、机械刺激小鼠和体外原发性OB—他们总共鉴定出了375种候选骨因子。具体来说,他们确定了 107 个 BOK、203 个 AOK、100 个 MOK 和 50 个 OBK。他们重新分析了公开的 scRNA-seq 数据集,通过排列检验确定骨因子的定位。通过将 375 种骨因子映射到scRNA-seq数据,他们获得了其中 345 种的细胞定位(图 5 A)。
确定了几种众所周知的骨因子的细胞来源,证实了该研究预测的准确性(图 5 B)。骨钙素和骨桥蛋白是两种 OB 标志物,在位于骨表面的 OB 中特异性表达。破骨细胞标记基因 Acp5 和 Ctsk 分配给破骨细胞。通过TRAP染色可以在骨表面观察到多核破骨细胞。嵌入骨基质中的骨细胞表达标记物Sost。软骨细胞标记物 Acan 和 Chad 仅在软骨细胞中表达。免疫组织化学 (IHC) 测定证实了 Acan 在关节软骨中的表达模式。新鉴定的骨因子,例如 Fabp3 和 Comp,显示细胞来源与预测结果一致(图 5 B)。
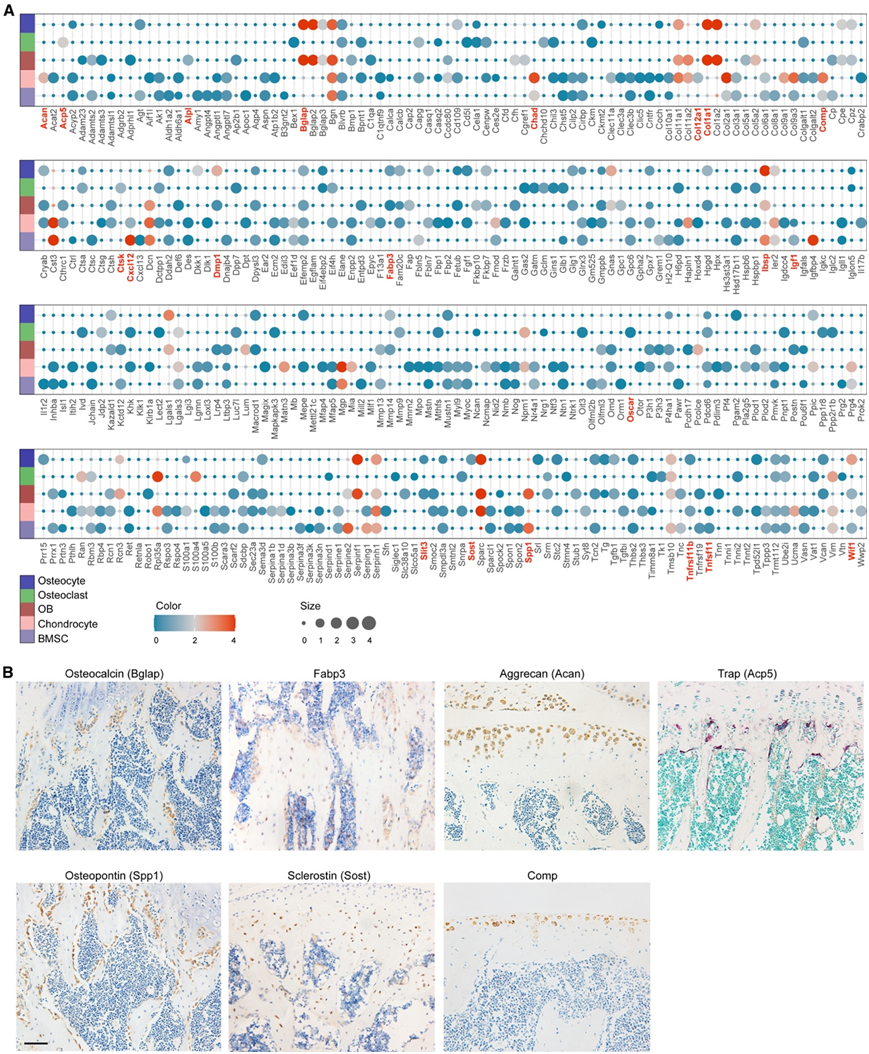
图5. 利用骨的 scRNA-seq 数据预测骨因子的细胞来源。
(A) 使用 scRNA-seq 数据预测细胞来源。(B) 正常成年小鼠股骨中某些骨因子的免疫组织化学染色的代表性图像。
06
骨因子介导的器官间通讯
他们对来自肝脏(GSE109774)、大脑(GSE129788)、主动脉(GSE152583)和骨骼四个不同组织的scRNA-seq数据进行了整合和再分析。他们鉴定出15438个细胞,这些细胞根据其细胞标志物进一步分为OB、破骨细胞、软骨细胞、骨细胞、骨髓间充质干细胞、脑小胶质细胞和神经细胞、肝细胞和血管平滑肌细胞(VSMC)(图6A-B)。CellChat分析显示,在各种细胞类型和组织中,涉及475对配体-受体对的20630种显著相互作用(图6C-D)。通过将骨因子映射到鉴定的配体-受体对,他们确定了骨因子介导的骨与其他器官之间的相互作用(图6E)。虽然OB、软骨细胞和BMSC中表达的Spp1作用于VSMCs的整合素受体,但软骨细胞和BMSC通过Comp-Sdc4与肝细胞和VSMCs相互作用。此外,Tnc 在软骨细胞、OB 和 BMSC 中表达,并作用于肝细胞的 Sdc1 和 Sdc2。他们发现下游通路主要涉及脂质和动脉粥样硬化、乙型肝炎、丝裂原活化蛋白激酶(MAPK)信号、神经退行性变、细胞衰老和凋亡(图6F)。这些结果揭示了骨组织细胞在调节其他器官中的丰富作用,特别是与动脉粥样硬化相关的 VSMC。
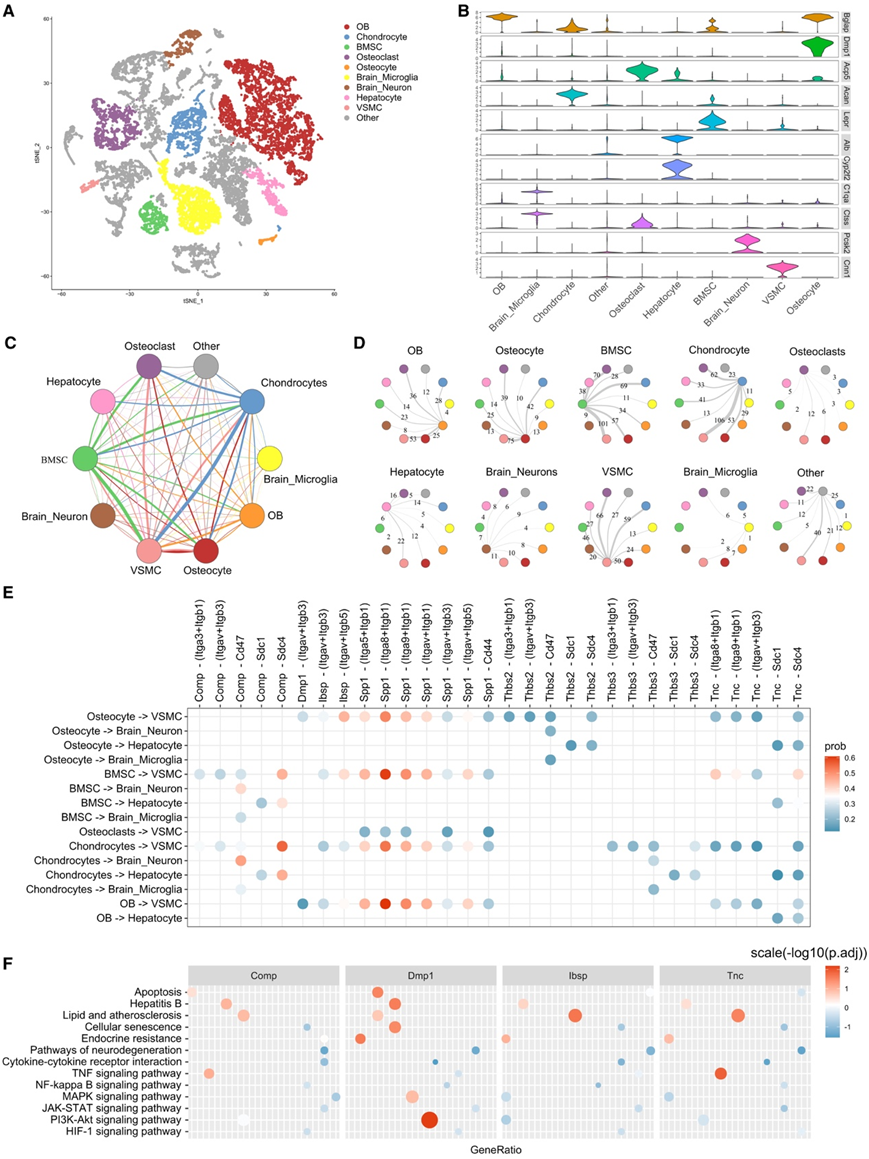
图6. 通过 scRNA-seq 数据分析骨因子介导的细胞间通讯。
(A) 来自骨、肝、脑和主动脉的细胞的 t-SNE 可视化。(B) 类型特异性标记基因表达值的小提琴图。(C) 连接图以彩色圆圈显示一种细胞类型与另一种细胞类型之间相互作用的强度。(D) 圆形图显示细胞相互作用;黑色数字代表配体-受体对计数;箭头粗细表示相互作用强度。(E) 气泡图呈现跨细胞类型的配体-受体对。(F)配体-受体激活下游基因的KEGG通路分析。
07
衰老的 OB 通过 FABP3 将衰老传播到 VSMC
他们根据 IEU OpenGWAS 项目的骨矿物质密度 (BMD) 和动脉粥样硬化性心血管疾病 (ASCVD) 参与者的全基因组关联研究 (GWAS) 汇总统计数据进行了两个样本孟德尔随机化分析(MR)。MR 分析提供的证据表明,低 BMD 是 ASCVD 的一个因果危险因素,包括硬性心血管疾病、心力衰竭和缺血性中风(图 7 A)。
他们假设 AOK可能在促进骨质疏松症患者动脉粥样硬化的进展中发挥至关重要的作用。根据图2所示的BMS蛋白质组学数据,FABP3是一个高丰度的AOK。它是一种 15 kDa 的蛋白质,参与长链脂肪酸的摄取和运输。虽然它抑制骨髓间充质干细胞的成骨,但它会加速血管纤维化,表明它可能作为连接骨质流失和心血管疾病的纽带。与 AOK 在年龄相关疾病中的关键作用一致,男性个体中血清 FABP3 水平与年龄呈正相关,但与股骨颈 BMD 呈负相关(图 7 B)。
为了研究 FABP3 在动脉粥样硬化中的作用,他们使用重组 FABP3 蛋白处理参与动脉粥样硬化进展的细胞,包括内皮细胞、成纤维细胞和 VSMC。然后他们检测衰老标志物,包括SA-β-gal、p16、p21、p27、p53、p-H2AX和层粘连蛋白B1。结果表明,重组FABP3可以促进VSMC的衰老,伴随着p21、p27和p53水平升高(图7C)。在评估VSMCs中衰老标志物的蛋白水平和SA-β-gal染色时,得到了一致的结果(图7D-E)。与 FABP3 耗尽的 OB 的条件培养基共培养的 VSMC 表现出较低水平的衰老,而用 FABP3 过表达的对应物处理的 VSMC 则显示出相反的趋势(图 7F-I)。GO_BP分析显示FABP3不仅与已知的增殖、凋亡和氧化应激等过程相关,而且还与脂质代谢、钙离子转运、激素分泌和其他过程相关(图7J)。然而,这些过程如何参与 VSMS 衰老还需要进一步研究。总之,这项结果表明衰老的 OB 衍生的 FABP3 与 VSMC 的衰老之间存在潜在关联(图 7 K)。这为骨质疏松症和动脉粥样硬化之间的因果关系提供了合理的解释。
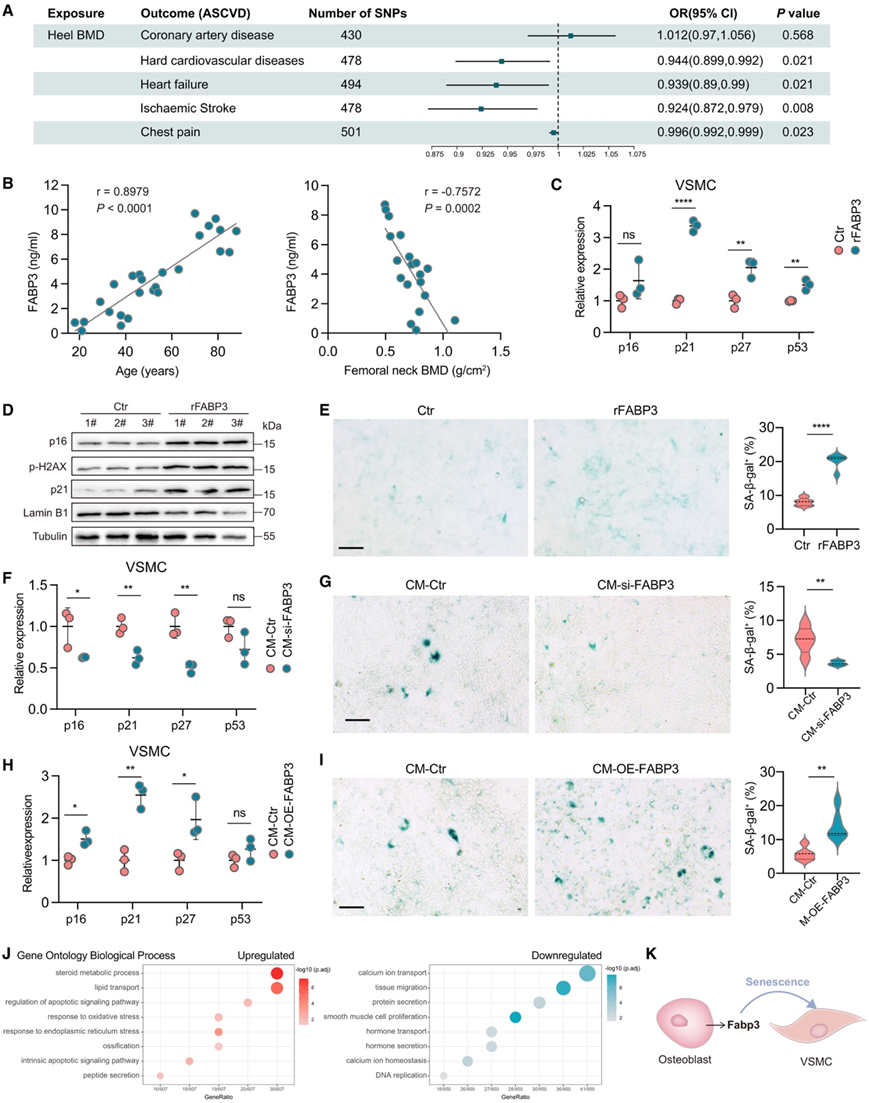
图7. 衰老的 OB 通过 FABP3 将衰老传播到 VSMC 。
(A) 采用逆方差加权法对足跟骨矿物质密度 (BMD) 和动脉粥样硬化性心血管疾病 (ASCVD) 进行孟德尔随机化分析。(B) Pearson 相关系数显示 18-88 岁男性血清 FABP3 水平、年龄和股骨颈 BMD之间的个体相关性。 (C-E) 用鼠重组 FABP3 培养原代小鼠 VSMC。(F–I) 用来自 FABP3 耗尽或过表达的 OB 的条件培养基培养原代小鼠 VSMC。(J) 用鼠重组 FABP3 处理的 VSMC 中 DEG 的 GO_BP 注释。(K) 衰老 OB 通过 FABP3 将衰老传播到 VSMC 的模型。
+ + + + + + + + + + +
结 论
本项研究分析了骨和骨外组织、OB条件培养基、BMS和血清,以了解基础骨因子以及对衰老和机械加载/卸载有反应的因子。通过整合 RNA-seq、scRNA-seq 和蛋白质组学方法的数据,鉴定了 375 种候选骨因子及其响应衰老和机械动力学的变化。此外,分析了它们在骨骼中的细胞来源以及它们促进的器官间通讯(骨脑、肝脏和主动脉)。值得注意的是,衰老的 OB 会分泌FABP3,从而向VSMC传播衰老。总而言之,本项研究确定了以前未知的候选骨因子,并在它们之间建立了动态调节网络,从而为进一步研究它们的系统作用提供了新的理论依据。
+ + + + +



 English
English


