文献解读|Gut(23.0):综合宏基因组学和代谢组学分析揭示了颅内动脉瘤中不同阶段特异性肠道微生物衍生代谢物
✦ +
+
论文ID
原名:Integrated metagenomic and metabolomic analysis reveals distinctive stage-specific gut-microbiome- derived metabolites in intracranial aneurysms
译名:综合宏基因组学和代谢组学分析揭示了颅内动脉瘤中不同阶段特异性肠道微生物衍生代谢物
期刊:Gut
影响因子:23.0
发表时间:2024.07.13
DOI号:10.1136/gutjnl-2024-332245
背 景
颅内动脉瘤(IA)是一种严重的神经血管疾病,影响了全球3%-5%的成年人。从未破裂IA (UIA)到破裂IA (RIA)的转变可导致蛛网膜下腔出血(SAH),与高发病率和死亡率相关。肠道微生物群已成为影响宿主代谢和免疫反应的关键环境因素,其生态失调通过微生物-肠-脑轴与各种脑血管疾病有关。马酚和牛磺酸等代谢物对IA的保护作用已有研究报道,但目前缺乏全面的大规模多组学研究RIA中的肠道菌群和代谢物表型。
实验设计
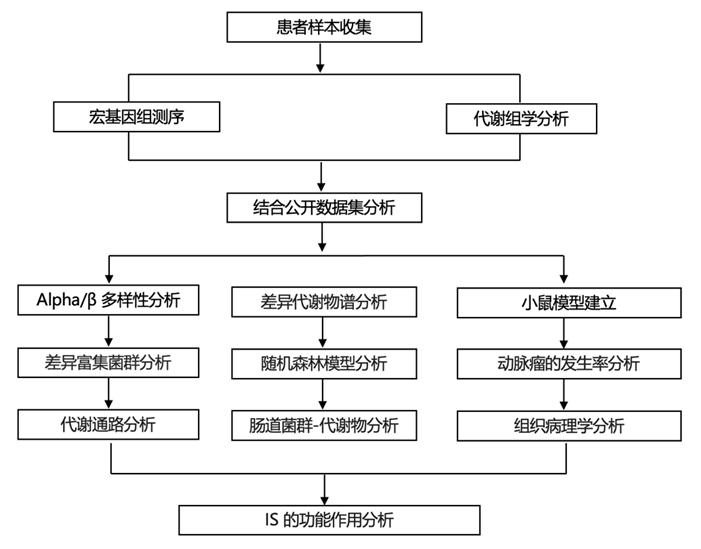
结 果
01
宏基因组数据显示了RIA组和UIA组肠道微生物群的分类特征
首先,研究团队在珠江医院采集了50例RIA和59例UIA患者的109份粪便样本进行宏基因组测序,以分析动脉瘤破裂后肠道菌群的变化。随后,他们对30例UIA患者和30例RIA患者的血浆进行了代谢组学研究,观察组间是否存在肠道菌群衍生代谢物的破坏(图1)。
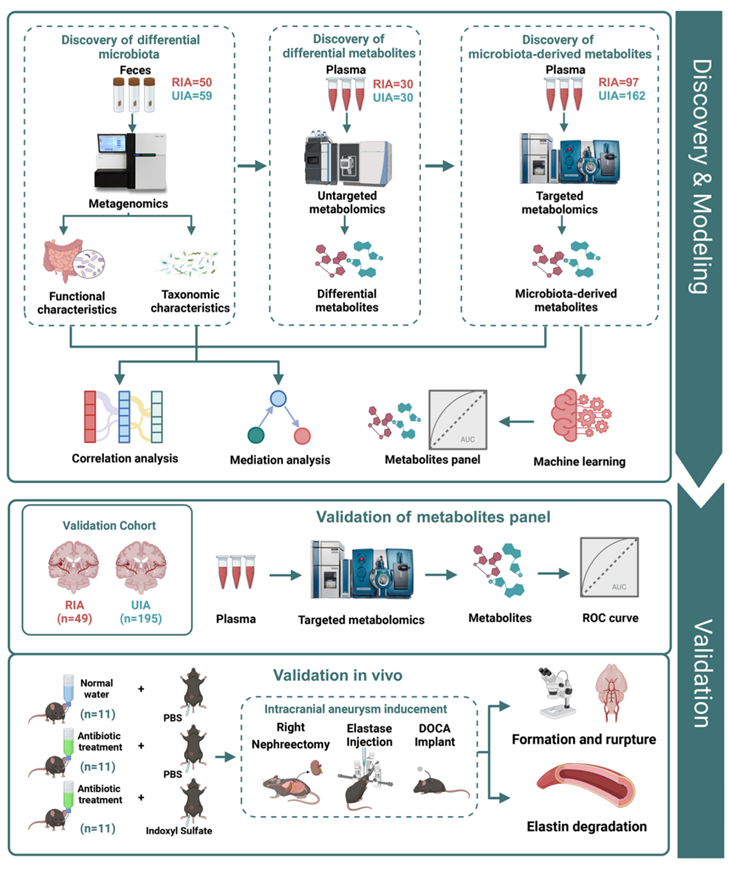
图1. 研究设计和实验流程。
他们从宏基因组数据中总共获得了1490种分类微生物,并检测了它们在两组之间的变化。alpha多样性指数中,微生物群落的物种丰富度和均匀度无显著差异(图2A)。对于β多样性,在Bray-Curtis距离上观察到肠道菌群的显著不同分布(图2B)。
与UIA组相比,他们发现RIA阶段的微生物组发生了变化。采用线性判别分析效应量(LEfSe)算法评估RIA和UIA中差异富集的菌群特征。根据线性判别分析(LDA)评分>2.0和p<0.05,共有52种鉴定为差异丰度细菌种(图2C)。此外,在RIA患者的粪便样本中,肺炎克雷伯菌和Ruminococcus gnavus的水平显著升高,而某些物种,包括短双歧杆菌、Bifidobacterium pseudocatenulatum和Fusicatenibacter saccharivorans的丰度则显著降低。这些结果表明,RIA和UIA组存在独特的肠道菌群,这可能与IA特征和发展的差异有关。

图2. 粪便宏基因组学分析。
(A) 箱线图显示了UIA组和RIA组之间的alpha多样性比较。(B) 基于PCoA的β多样性分析,表明组间分布不同。(C) 柱状图显示了UIA组和RIA组之间差异富集特征计算的LDA得分。
02
RIA组和UIA组具有代表性的KEGG通路和KO基因代谢酶反应
为了进一步确定RIA患者发生的微生物代谢过程,他们在KEGG orthology (KO)数据库中对宏基因组分析的微生物基因进行注释,以重建和比较RIA和UIA样本中的代谢通路。色氨酸代谢的功能模块(基因色氨酸酶)在RIA样本中显著富集(图3A-B)。同时,与磷酸戊糖通路相关的基因在UIA相关的微生物组中显著富集,可能反映了其他作用机制。他们列出了涉及代谢物和酶基因的的代表性“反应公式”(formula),硫酸吲哚酚(IS)是具有重要作用的下游代谢物。他们使用HUMAnN3技术分析发现,在具有色氨酸酶基因的菌株中,肺炎克雷伯菌的贡献最大(图3D)。
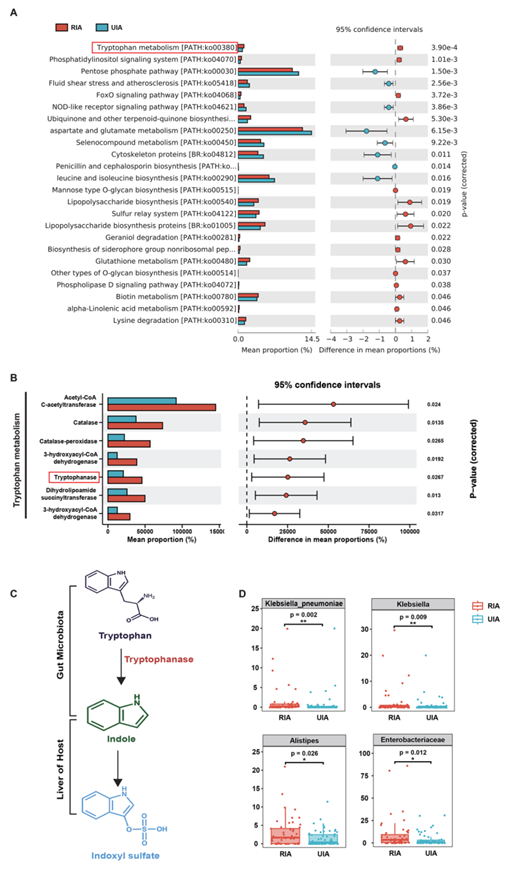
图3. RIA组和UIA组具有代表性KEGG通路和KO基因的代谢-酶反应。
(A) UIA和RIA代谢通路的差异。(B) RIA富集了色氨酸代谢通路基因。(C) 色氨酸-吲哚代谢通路。(D) 对色氨酸含量有贡献的微生物群。
03
来自发现队列的RIA组和UIA组之间的微生物组相关代谢物发生了变化
鉴于微生物代谢基因功能的改变可引起宿主循环代谢物水平的变化,他们对珠江医院30例RIA患者和30例UIA患者的血浆样本进行非靶向代谢组学研究,初步构建不同阶段IA患者的差异代谢物谱(图1)。采用正交偏最小二乘判别分析(OPLS-DA)模型对RIA和UIA患者血浆样本的代谢差异进行初步评价。结果表明,在正离子和负离子模式下,RIA组和UIA组血浆代谢物均有明显分离(图4A-B)。OPLS-DA排列检验也显示出对分类变量的高解释和预测能力。因此,他们在RIA患者和UIA患者的血浆中鉴定出52种差异表达的代谢物。热图显示了RIA患者中差异表达的33种代谢物,主要包括氨基酸和吲哚化合物。此外,UIA患者的19种代谢物水平显著升高,其中以胆汁酸为主(图4C-D)。
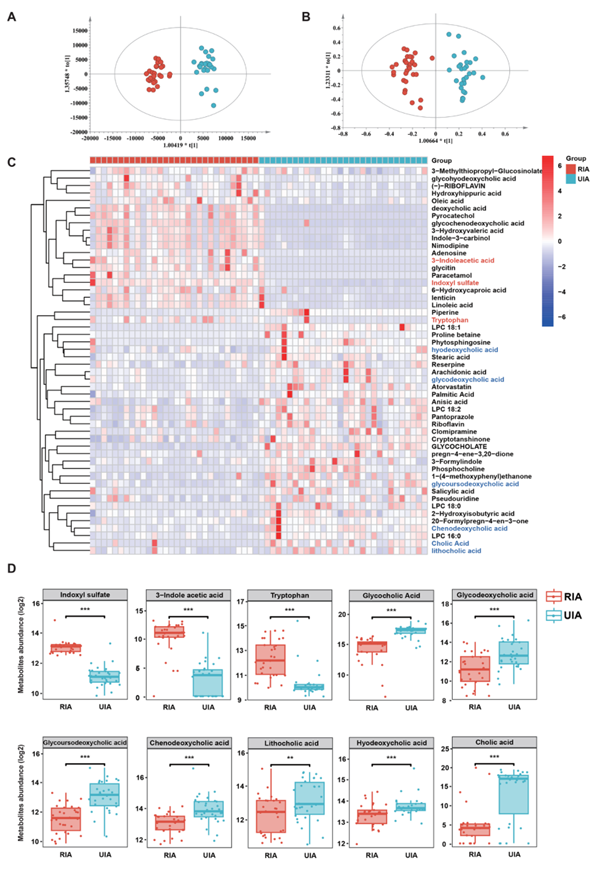
图4. 非靶向代谢组学分析。
(A-B)血浆代谢物分析。(C) 热图显示了基于非目标代谢组学分析的参与者的特定代谢特征。(D) 箱线图显示了组间选定的10种差异代谢物的比较。
04
随机森林分析发现了IA分层的潜在代谢生物标志物
在研究IA患者的代谢组学特征后,他们建立了一个随机森林模型,探索一个可以区分RIA患者和UIA患者的代谢物,以用于探索IA进展的病因,甚至预测动脉瘤的破裂(图5A)。平均下降Gini评分代表了RIA和UIA患者血浆中代谢物的显著表达(图5B)。与RIA相关的代谢物包括IS、5-羟色氨酸和犬尿氨酸,其在测试集的合并曲线下面积(AUC)为0.974,在外部验证集的合并AUC为0.972(图5C-D)。色氨酸代谢标志物水平在两个队列中表现出一致的差异(图5E)。
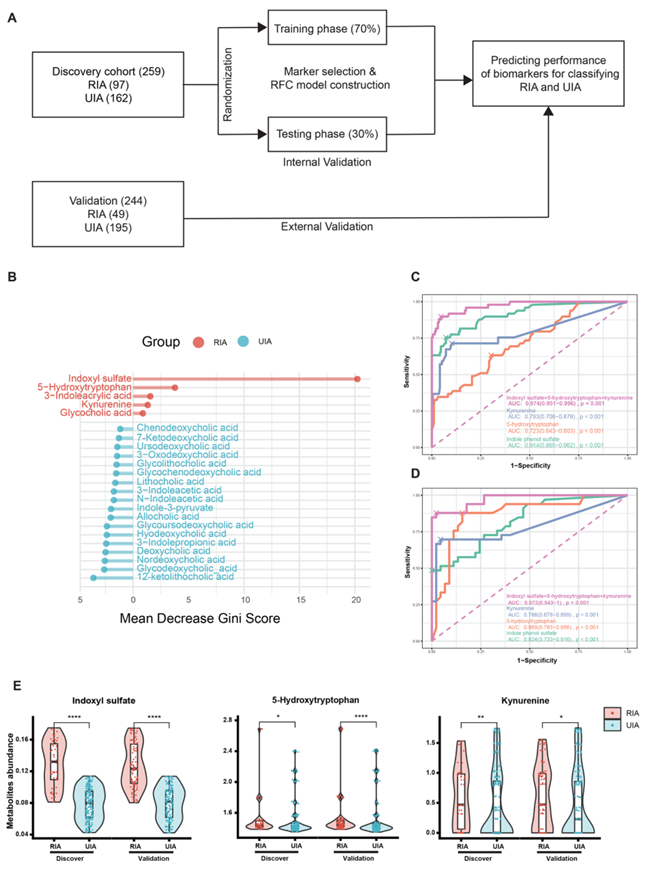
图5. 随机森林模型对RIA和UIA代谢标志物的研究。
(A) 随机森林模型的研究设计和流程图。(B) 分类UIA和RIA的候选代谢物。(C) 测试集的ROC曲线。(D) 验证集的ROC曲线。(E) 两个队列中代谢标志物含量的箱线图。
05
RIA相关的肠道微生物群和循环代谢物之间的关联
为了进一步探索肠道菌群与IA进展相关代谢物之间的关系,他们对显著改变的分类特征、KEGG通路模块和关键代谢物进行了Spearman相关分析和中介分析,以揭示RIA和UIA的多组学特征(图6A-D)。结果表明,IS水平的升高与色氨酸代谢通路和肺炎克雷伯菌密切相关(图6C)。这些数据表明,微生物KEGG通路和代谢物的改变与IA阶段微生物群的变化有关。
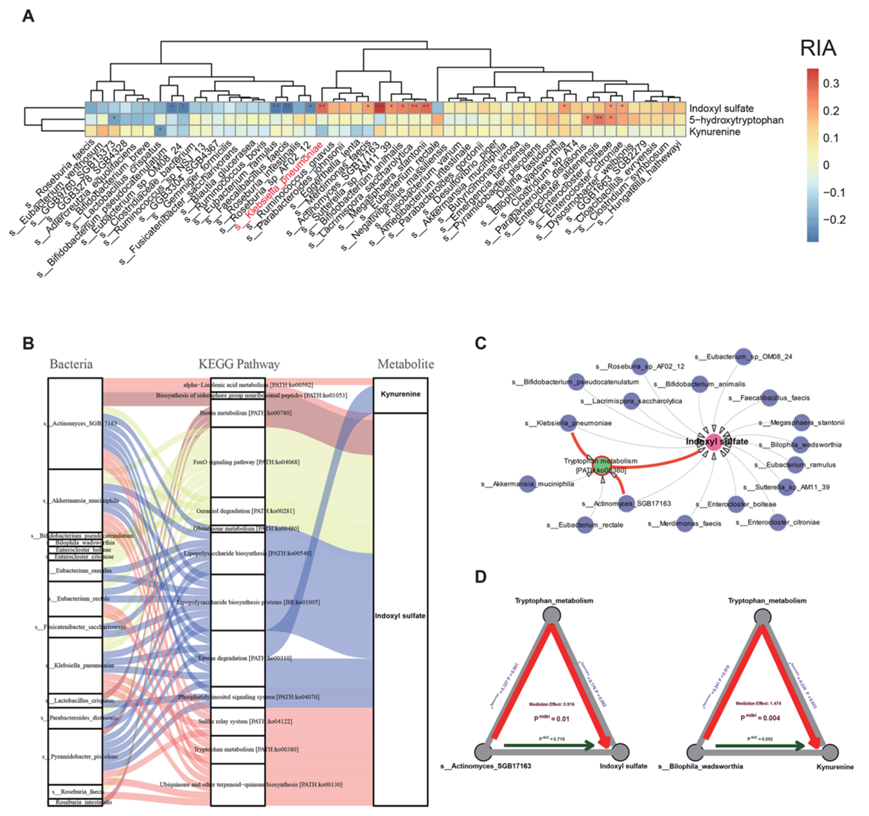
图6. 整合宏基因组和代谢组分析揭示了RIA患者的分类群和代谢物之间的关联。
(A) 该热图详细描述了RIA与UIA中不同代谢物与微生物类群之间的相关性。 (B) 桑基图可视化了细菌物种之间的联系。(C) 网络图描绘了微生物群、硫酸吲哚酚和参与色氨酸代谢的通路之间复杂的相互作用。 (D) 定量评估特定细菌类群对中枢代谢物水平的贡献。
06
肠道菌群的消耗降低了小鼠血浆IS和IA的进展
为了验证改变的肠道菌群和血浆IS的相关性,他们在右肾切除术前2周开始了抗生素鸡尾酒(ABX)处理的IA小鼠模型中IS的靶向代谢组学分析(图7A)。通过抗生素去除肠道菌群能够有效降低小鼠血浆中IS的浓度(图7E)。同时,与无ABX的IA小鼠相比,ABX处理显著减少了动脉瘤的形成和动脉瘤的破裂(图7B-C)。Log- rank检验进一步显示ABX+IA组的累积无症状率显著高于IA组(图7D)。
与ABX+IA组相比,补充IS使ABX治疗的IA小鼠的血浆IS水平正常化(图7E),并有效地增加了IA的发生率和动脉瘤的破裂(图7B-C)。同时,累积无症状率显著下降(图7D)。在此基础上,他们接下来重点关注IA进展过程中IS的特定病理改变。IA的形成和破裂与脑动脉内细胞外基质的破坏密切相关。既往研究表明,ABX处理可以有效改善IA的炎症,减少炎症细胞的浸润(图7F)。肠源性尿毒症毒素IS参与心血管疾病的炎症反应。据报道,与炎症反应相关的基质金属蛋白酶9 (MMP9)可促进IA病灶中弹性蛋白的降解。在本项研究中,ABX处理后,脑动脉中弹性蛋白的降解减少(图7F)。肠道菌群缺失可下调IA小鼠脑动脉壁MMP9的表达(图7G)。然而,在ABX处理的IA小鼠中补充IS上调了MMP9的表达(图7G),并增强了弹性蛋白的降解。
这些结果表明,宿主血浆中的IS水平受肠道菌群的调节。此外,血浆IS水平的升高增加了IA的发生率和破裂率,这可能与脑动脉MMP9表达上调和弹性蛋白降解有关。
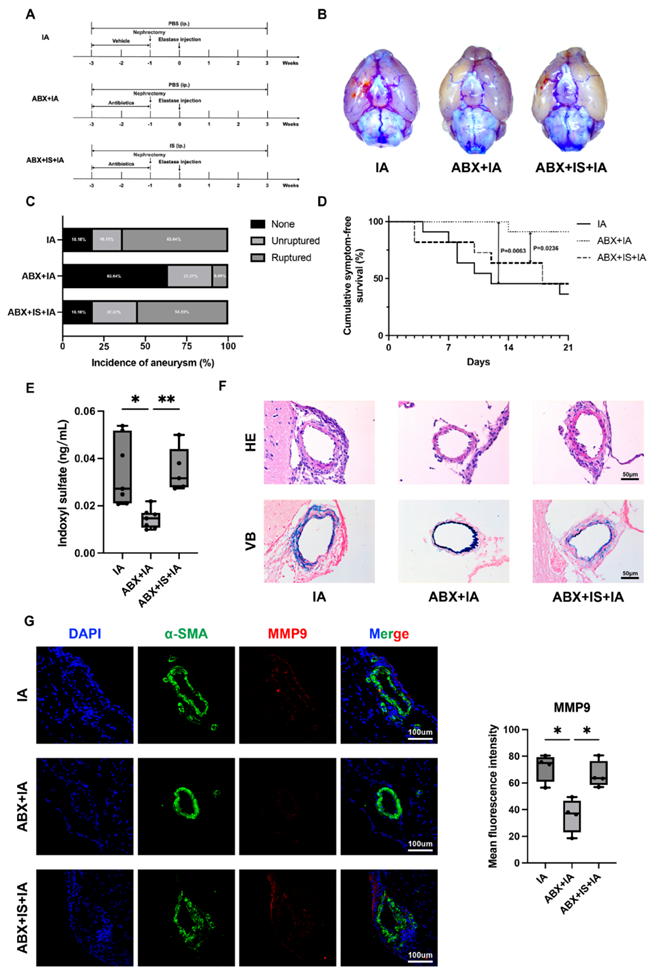
图7. IS增加了ABX治疗小鼠IA的形成和破裂。
(A) 实验流程。(B) 各组小鼠大脑底部脑血管代表性图像。(C) 诱导后21天动脉瘤的发生率。(D) 小鼠的累积无症状曲线显示各组症状出现的时间进程。(E) LC-MS/MS法检测小鼠血浆IS水平。(F)H&E染色和脑动脉VB染色。(G) 免疫荧光染色和定量。
+ + + + + + + + + + +
结 论
本项研究结合宏基因组学和代谢组学数据,发现了肠道微生物组衍生的色氨酸代谢物作为区分 RIA 和 UIA 患者的生物标志物的潜力。肠道微生物衍生的 IS 在导致 IA 破裂的 IA 壁弹性蛋白降解中发挥了新的致病作用。
+ + + + +



 English
English


